MDBK细胞bpiv3活性的检测
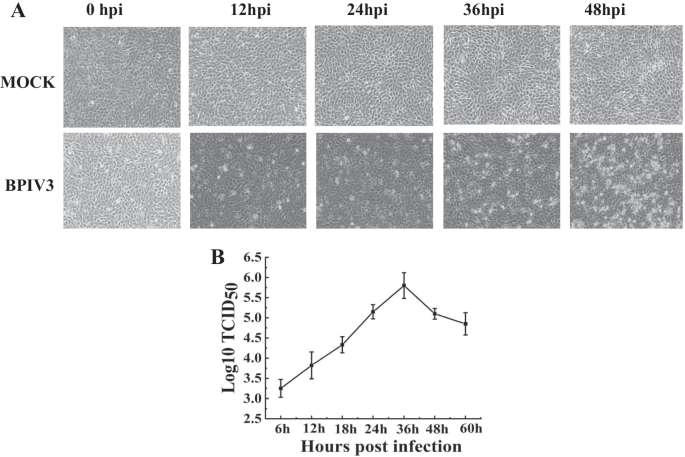
为了确定BPIV3感染后进行蛋白质组学分析的最佳采样时间点,我们将MDBK细胞单层培养并接种BPIV3。在接种后0、6、12、18、24、36、48 h的不同时间点,收获细胞-病毒悬液,观察CPE(图2)。1A) TCID50测量。根据TCID结果绘制BPIV3的生长曲线50结果显示,BPIV3在感染后24至36小时内迅速增殖,表明病毒在细胞内复制活跃(图2)。1B)。
以1个感染倍数(MOI = 1)的剂量接种MDBK细胞,在感染后不同时间点观察CPE。结果显示,BPIV3感染细胞后12 h,病变开始明显,随着时间的推移,病变加重(图2)。1A).病毒滴度在36 h时达到约5.7的峰值,随后逐渐持续下降(图。1B).一般来说,进行蛋白质组学分析的最佳时间是病毒复制仍然很高,但没有观察到明显的宿主细胞细胞骨架或膜重排[20.].根据感染后细胞病变情况结合病毒增殖情况,以24 h感染的细胞为时间点进行蛋白质组学分析。
蛋白质分析和iTRAQ定量
收集bpiv3感染和模拟感染的MDBK细胞的蛋白质样本,用iTRAQ试剂标记3个生物重复。通过整合模拟感染组(对照组)和bpiv3感染组(感染)3个生物重复体的肽段信息,获得两个实验组比例(比[感染/对照])的定量信息。
对两组蛋白表达水平的变化进行统计学分析。LC-MS /MS共检测蛋白2804个。116种蛋白质发生了显著变化P< 0.05(图2),蛋白质变化比≥1.5。在这些蛋白中,有74个蛋白表达显著上调,42个蛋白表达显著下调。2).在DEPs中,上调最显著的蛋白是与自噬相关的囊泡相关膜蛋白。最显著的下调蛋白是整合素补体蛋白,这是一种病毒感染的受体蛋白(表。2).
dep的GO注释
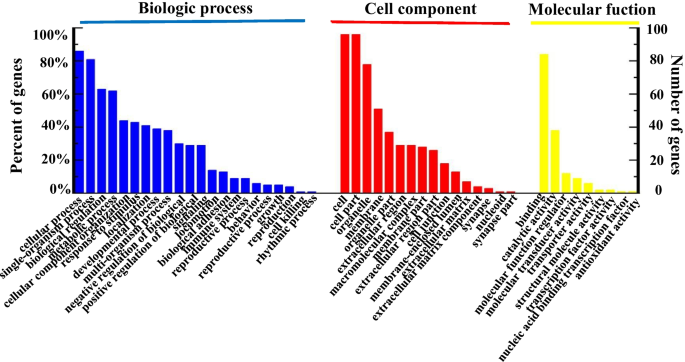
dep的GO注释。这些蛋白被分为三大类:生物过程(BP)、细胞成分(CC)和分子功能(MF)(图。3.).GO在生物过程中的富集分析表明,DEPs在单生物过程、对刺激的响应、代谢过程、细胞过程和生物调控5个过程中富集显著。参与生物调节过程的蛋白质最多,其次是参与刺激反应过程的蛋白质。在本研究中,刺激反应过程中的蛋白质主要包括酪氨酸磷酸酶、信号转导蛋白1、Rab5 GDP/GTP转换因子1、白细胞介素-13 (IL-13)、丝裂原活化蛋白激酶7 (MAPK7)、FOX转录抑制因子3 (Foxp3)、磷酸钙、蛋白酪氨酸磷酸酶蛋白受体、MAP3K10、人端粒酶逆转录酶、SSNA1。IL-13是引起气道炎症最重要的炎症因子。它在慢性气道炎症疾病的发生中起关键作用,引起粘液的大量分泌。Foxp3是Fox转录因子家族的一员,在维持机体免疫功能方面起着重要作用[21].bpiv3感染的MDBK细胞中的DEPs可能引起初始细胞应激反应。这些dep在BPIV3感染过程中的确切作用还有待进一步研究。
京都基因和基因组百科(KEGG)对DEPs的途径分析
KEGG通路数据库是一个基于分子相互作用通路和细胞反应网络的集合图。这些dep被识别并映射到6种KEGG通路,包括代谢、细胞过程、有机体系统、环境信息过程、遗传信息过程和疾病途径。有机体系统和疾病途径为富集途径,分别有37个和43个途径组。
在代谢途径中,DEPs参与了13个与葡萄糖、脂质、氨基酸和核苷酸代谢相关的通路(图。4A).这些途径影响细胞中三种主要营养物质的代谢。细胞过程涉及10个通路(图2)。4B),包括Focal adhesion pathway和Phagosome pathway,这两种途径都参与了病毒感染过程。整合素蛋白是这两种途径的关键蛋白。溶酶体途径、吞噬体途径和自噬途径都参与了病毒感染的自噬过程。环境信息涉及11条通路,主要集中在病毒感染的通路和信号分子的相互作用(图;4C)。其中pI3K-Akt信号通路、MAPK信号通路、Ras信号通路和TNF信号通路已被证实与病毒感染有关。基因信息处理类的注释蛋白在细胞的合成、转运、蛋白水解、剪接体等方面发挥作用(图。4D).在有机体系统类别中标注的蛋白与抗原加工和递呈、nod样受体信号转导、toll样受体信号转导、补体和凝血级联以及Th1和Th2细胞分化通路组相关。这些途径与宿主对病毒感染的免疫反应相关(图。4E).疾病类别标注的dep见图。4F.传染病中有十种途径聚集,其中五种与病毒感染有关。
通过对DEPs的分析,发现与MAPK信号通路相匹配的蛋白较多,包括FGF13、ERK5和MKK3。KEGG通路分析显示MKK3参与了14条通路,表明MKK3是BPIV3感染MDBK细胞过程中的关键调控蛋白(表2)。2).
通过实时定量PCR (qRT-PCR)对所选蛋白质进行验证
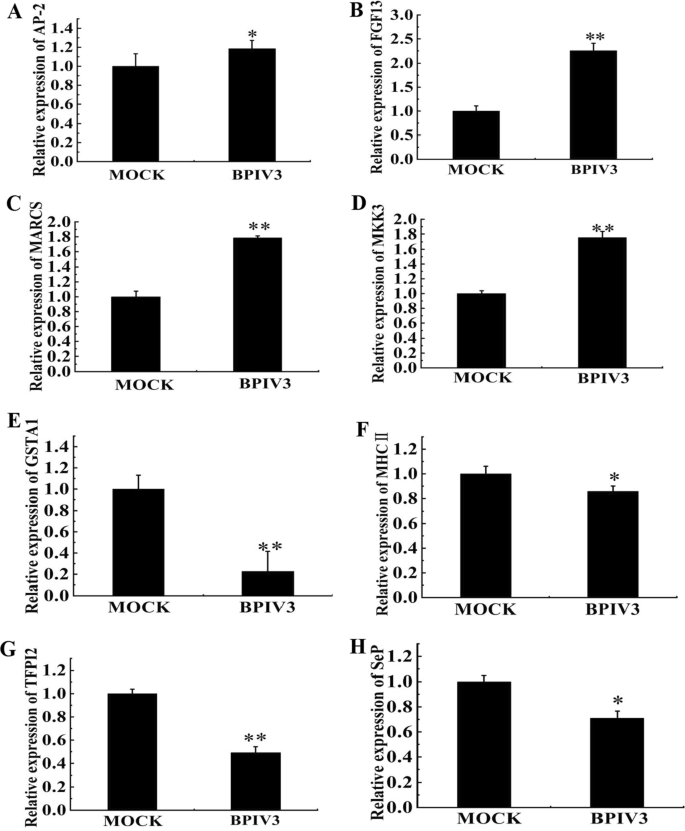
为了验证iTRAQ鉴定的DEPs,采用qRT-PCR检测了8个蛋白的转录水平。本研究随机选取8种蛋白进行qRT-PCR。其中上调的4个蛋白包括AP-2复合亚基β蛋白(AP-2)、FGF13、肉豆蔻酰化富丙氨酸c激酶底物(MARCS)和MKK3蛋白。其他4种下调蛋白包括MHCII类(MHCII)、谷胱甘肽s -转移酶(GSTA1)、硒蛋白P (SepP)和组织因子途径抑制剂(TFPI)。如图所示。5,这些基因的表达水平与iTRAQ结果一致。qRT-PCR结果进一步验证了iTRAQ实验的可靠性。
p38 MAPK通路对BPIV3复制的影响
BPIV3感染激活p38 MAPK通路
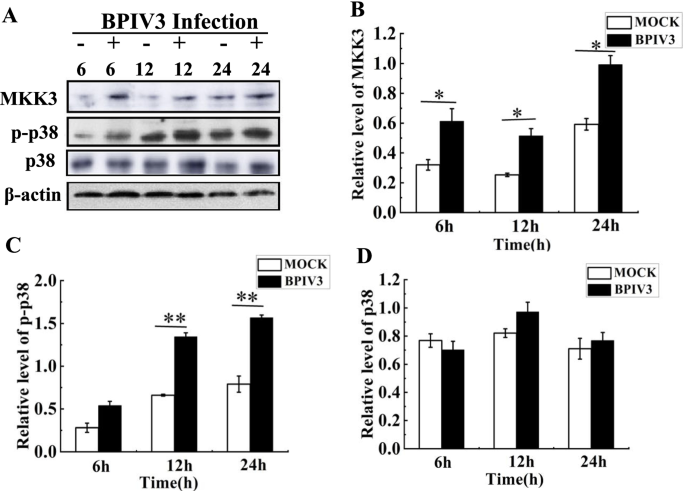
MAPK通路在细胞内信号网络中起着多种作用。MKK3和MKK6被认为是p38的上游激酶。蛋白组学分析结果显示,BPIV3感染后MKK3水平明显上调(表2。2).病毒感染被认为是一种细胞外刺激物,可激活p38 MAPK通路[22,23].应该研究BPIV3感染是否在MKK3激活后激活p38 MAPK通路。
western blotting法检测bpiv3感染细胞中MKK3、p38和phospho-p38的表达。在BPIV3感染后6、12和24小时采集细胞样本。与mock组相比,感染组在不同感染时间点MKK3表达水平升高。BPIV3感染后12 h和24 h,感染组p38蛋白表达水平未见变化,而磷酸化p38蛋白表达水平明显高于模拟组(图。6).因此,BPIV3感染诱导MKK3激活和p38磷酸化。MKK3的表达水平与之前的蛋白质组学结果一致,进一步验证了蛋白质组学分析的可靠性。
抑制p38 MAPK激活对BPIV3复制的影响
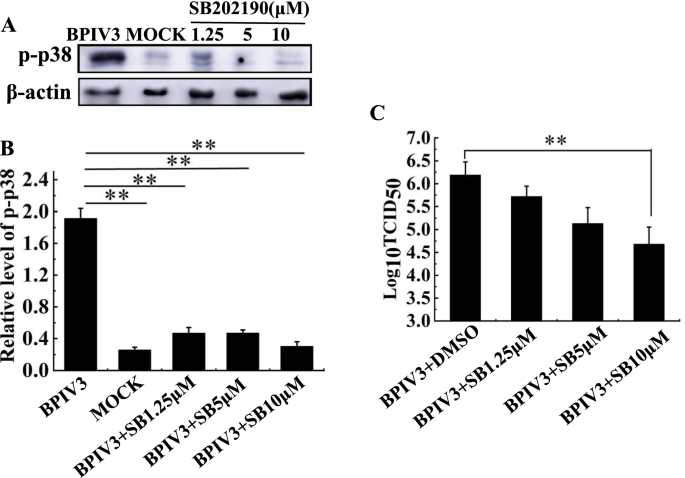
为了研究p38 MAPK通路的激活是否促进BPIV3的增殖,在感染前1小时用p38 MAPK通路抑制剂SB202190处理细胞。分别用浓度为1.25、5和10 μM的SB202190处理MDBK细胞。在感染后24 h采集细胞样本(MOI = 1)。
结果如图所示。7.BPIV3感染诱导p38磷酸化。抑制剂SB202190处理后,p38的表达水平呈剂量依赖性显著降低,说明SB202190抑制了p38的磷酸化(图202190)。7A和B)。BPIV3病毒滴度降低1.8 logTCID50结果表明,p38 MAPK通路参与了BPIV3蛋白的复制(图2)。7C).结果显示SB202190能抑制BPIV3的增殖。因此,BPIV3激活了参与其复制的p38 MAPK信号通路。