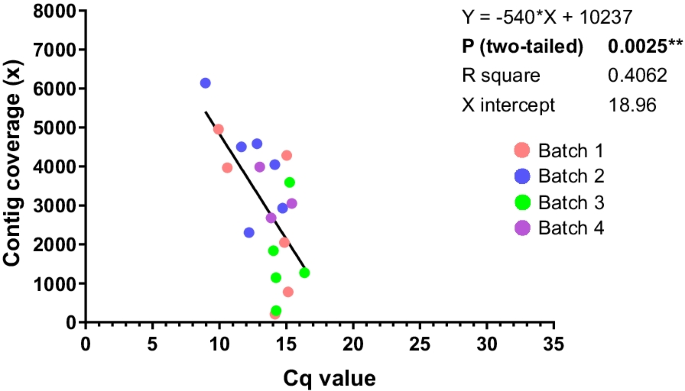
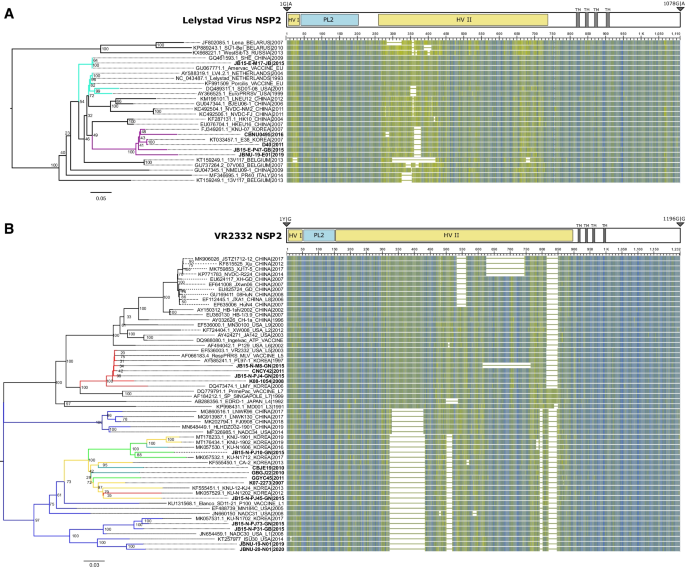
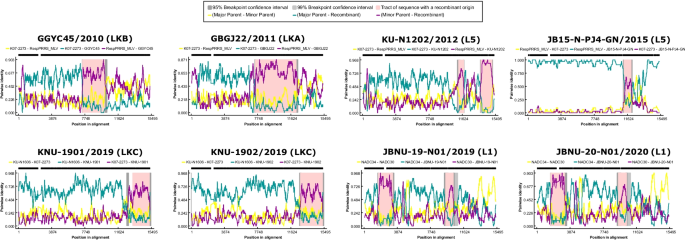
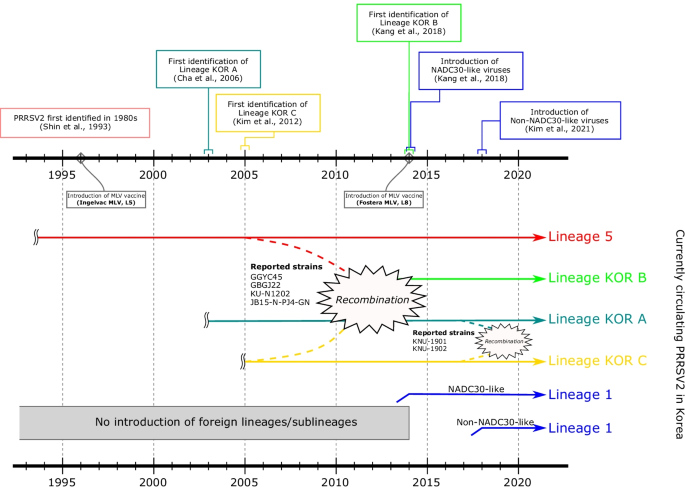
原因不明的生殖失败。美国养猪协会,1989;1:1-9。
谷歌学者
Holtkamp DJ, Kliebenstein JB, Neumann E, Zimmerman JJ, Rotto H, Yoder TK, Wang C, Yeske P, Mowrer CL, Haley CA.猪繁殖与呼吸综合征病毒对美国猪肉生产商经济影响的评估。《猪卫生促进会》2013;21:72。
谷歌学者
Neumann EJ, Kliebenstein JB, Johnson CD, Mabry JW, Bush EJ, Seitzinger AH, Green AL, Zimmerman JJ。评估猪繁殖和呼吸综合征对美国养猪生产的经济影响。美国兽医学会2005;227:385-92。
文章PubMed谷歌学者
Murtaugh议员,Stadejek T, Abrahante JE, Lam TT。梁fc - c:不断扩大的猪繁殖与呼吸综合征病毒多样性。病毒决议2010;154:18-30。
文章中科院PubMed谷歌学者
Johnson CR, Griggs TF, Gnanandarajah J, Murtaugh MP。猪繁殖和呼吸综合征病毒中由所有动脉病毒中存在的另一种ORF5编码的新结构蛋白。中国病毒学杂志,2011;92:1107。
文章中科院PubMed公共医学中心谷歌学者
Adams MJ, Lefkowitz EJ, King AM, Harrach B, Harrison RL, Knowles NJ, Kropinski AM, Krupovic M, Kuhn JH, Mushegian AR.国际病毒分类学委员会(2017)批准的分类学变化和国际病毒分类和命名规则。Adv Virol, 2017; 162:2505-38。
中科院谷歌学者
Nelsen CJ, Murtaugh MP, Faaberg KS。猪繁殖与呼吸综合征病毒比较:两大洲的不同进化。中华病毒学杂志1999;73:270-80。
文章中科院PubMed公共医学中心谷歌学者
猪繁殖与呼吸综合征病毒亚型的分化时间。中国生物医学杂志2005;22:2131-4。
文章中科院PubMed谷歌学者
猪繁殖与呼吸综合征病毒的起源和进化。中国生物医学杂志,2005;22:1024-31。
文章中科院PubMed谷歌学者
猪繁殖与呼吸综合征病毒主要包膜GP5糖蛋白的基因组和抗原变异。Can J Vet res 1998;62:170。
中科院PubMed公共医学中心谷歌学者
Wissink E, Kroese M, Van Wijk H, Rijsewijk F, Meulenberg J, Rottier P.猪繁殖与呼吸综合征病毒感染性病毒粒组装的包膜蛋白需求。中国病毒学杂志,2005;49:12495 - 506。
文章中科院PubMed公共医学中心谷歌学者
Delisle B, Gagnon CA, Lambert M-È, D 'Allaire S.加拿大东部猪群繁殖与呼吸综合征病毒多样性在大序列数据集中显示了正选择下的两个高变量区域。《传染病》2012;12:1111-9。
文章PubMed谷歌学者
高建超,熊建勇,叶超,常晓波,郭建超,蒋成刚,张国辉,田志军,蔡学辉,童国忠。1996-2016年中国大陆猪繁殖与呼吸综合征病毒的基因型和地理分布兽医微生物学杂志,2017;208:164-72。
文章PubMed谷歌学者
康H,于我,胫骨J-E Kang, Kim w i C李,李J,曹is,无疑是,Cha - H。2013年至2016年在韩国养猪场流行的猪繁殖和呼吸综合征病毒的地理分布和分子分析BMC Vet Res. 2018;14:160。
文章PubMed公共医学中心中科院谷歌学者
施敏、林泰勇、许荣华议员、Faaberg KS、Wennblom T、Murtaugh MP、Stadejek T、梁fc - c。PRRSV的分子流行病学:系统发育的视角。病毒决议2010;154:7-17。
文章中科院PubMed谷歌学者
施敏、林泰勇、郑志刚议员、Murtaugh MP、Davies PR、许荣辉、李俊、王丽伟、叶志伟、蒋建文。北美2型猪繁殖和呼吸综合征病毒的进化、人口和地理解剖中国病毒学杂志,2010;
文章中科院PubMed公共医学中心谷歌学者
Shin J, Kang Y, Kim Y, Yeom S, Kweon C, Lee W, Jean Y, Hwang E, Rhee J, An S.韩国猪繁殖与呼吸综合征的血清流行病学研究-(1)-间接荧光抗体的检测。RDA J农业科学(韩国)。1993; 35:572-6。
谷歌学者
金建勇,李世勇,苏建辉,刘玉生。在韩国分离的猪繁殖与呼吸综合征病毒欧洲株的血清学和遗传特征。韩国J兽医Res. 2006; 46:363-70。
谷歌学者
南娥,朴C-K,金S-H, Joo Y-S, Yeo S-G, Lee C.欧洲1型猪繁殖与呼吸综合征病毒在韩国分离物的完整基因组特征。Adv Virol, 2009; 154:629-38。
中科院谷歌学者
金世赫,卢宜善,崔仁杰,李c,李c - h,李k - h,李k - k,宋永奎,李o - s,朴c - k。欧洲猪繁殖与呼吸综合征病毒在韩国分离的分子分析。兽医微生物,2010;143:394-400。
文章中科院PubMed谷歌学者
权涛,刘世杰,朴景伟,姜sc,朴c k,吕玉生。含韩国田间株和vr -2332样株基因的天然重组猪繁殖与呼吸综合征病毒2的基因组特征及致病性病毒学。2019;530:89 - 98。
文章中科院PubMed谷歌学者
Slatko BE, Gardner AF, Ausubel FM。下一代测序技术概述。中国生物医学杂志,2018;
文章PubMed公共医学中心谷歌学者
Tan S, Dvorak CM, Murtaugh MP。快速,无偏PRRSV菌株检测使用MinION直接RNA测序和生物信息学工具。病毒。2019;11:1132。
文章中科院公共医学中心谷歌学者
陈志伟,陈志伟,陈志伟,陈志伟,陈志伟。猪繁殖与呼吸综合征病毒高重组率的田间观察。病毒决议2014;194:159-66。
文章中科院PubMed公共医学中心谷歌学者
赵凯,叶超,常晓波,蒋春光,王世杰,蔡晓华,童国忠,田志军,史敏,安天强。高致病性猪繁殖与呼吸综合征病毒在中国最新出现的原因是输入和重组。中国病毒学杂志,2015;89:10712-6。
文章中科院PubMed公共医学中心谷歌学者
边涛,孙勇,郝敏,周玲,葛霞,郭霞,韩娟,杨慧。一种介于nadc30样和mlv样之间的重组2型猪繁殖与呼吸综合征病毒:仔猪的遗传特征和致病性。感染Genet Evol, 2017; 54:279-86。
文章中科院PubMed谷歌学者
王,陈问,王L, Madson D,哈蒙K,收税官P,张军,李g之间的重组疫苗和猪繁殖与呼吸综合征病毒株。新兴感染病2019;25:2335。
文章中科院PubMed公共医学中心谷歌学者
周玲,康瑞,余娟,谢斌,陈超,李鑫,谢娟,叶勇,肖玲,张娟。重组猪繁殖与呼吸综合征病毒2在nadc30样、jxa1样和mlv样毒株中的遗传特性及致病性。病毒。2018;10:551。
文章公共医学中心中科院谷歌学者
Eclercy J, Renson P, Lebret A, Hirchaud E, Normand V, Andraud M, Paboeuf F, Blanchard Y, Rose N, Bourry O.来自两种1型猪繁殖与呼吸综合征病毒(PRRSV-1)修饰活疫苗的现场重组菌株显示在SPF级猪中病毒血症和传播增加。病毒。2019;11:296。
文章中科院公共医学中心谷歌学者
刘东,周睿,张娟,周玲,蒋强,郭旭,葛霞,杨慧。猪繁殖与呼吸综合征病毒两株体内重组分析。病毒决议2011;155:473-86。
文章中科院PubMed谷歌学者
Yuan S, Nelsen CJ, Murtaugh MP, Schmitt BJ, Faaberg KS。猪繁殖与呼吸综合征病毒北美毒株的重组。病毒决议1999;61:87-98。
文章中科院PubMed公共医学中心谷歌学者
刘J,周X,翟J,李B, C,戴,杨X,罗m .出现的一种新型高致病性猪繁殖与呼吸综合征病毒在中国。跨界新兴Dis。2017;64:2059-74。
文章中科院PubMed谷歌学者
方勇,金D-Y,罗普S, Steen P,克里斯托弗-亨宁斯J,纳尔逊EA,罗兰RR。美国分离的欧洲样猪繁殖与呼吸综合征病毒Nsp2的异质性病毒决议2004;100:229-35。
文章中科院PubMed谷歌学者
Brockmeier SL, Loving CL, Vorwald AC, Kehrli ME Jr, Baker RB, Nicholson TL, Lager KM, Miller LC, Faaberg KS。4株2型猪繁殖与呼吸综合征病毒的基因组序列及毒力比较病毒决议2012;169:212-21。
文章中科院PubMed谷歌学者
van Geelen AG, Anderson TK, Lager KM, Das PB, Otis NJ, Montiel NA, Miller LC, Kulshreshtha V, Buckley AC, Brockmeier SL.猪繁殖与呼吸疾病病毒:进化和重组产生具有个体致病性的不同ORF5 rflp1-7-4病毒。病毒学。2018;513:168 - 79。
文章PubMed中科院谷歌学者
童国志,周永杰,郝晓峰,田志军,安天清,邱海军。高致病性猪繁殖与呼吸综合征,中国。新兴感染病。2007;13:1434。
文章PubMed公共医学中心谷歌学者
新一代测序技术。Nat Rev Genet. 2010; 11:31-46。
文章中科院PubMed谷歌学者
郑张J, Y,夏X-Q,陈Q,吩咐SA Yoon K-J,哈蒙公里,测量者电脑,主要RG,李·g·高通量基因组测序的猪生殖与呼吸综合征病毒从细胞培养材料使用新一代测序技术和临床标本。中华医学杂志。2017;29:41-50。
文章PubMed中科院谷歌学者
Kvisgaard LK, Hjulsager CK, Fahnøe U, Breum SØ, Ait-Ali T, Larsen LE。猪繁殖与呼吸综合征病毒(PRRSV) 1型和2型全基因组测序的快速和可靠方法。中国病毒学杂志。2013;193:697-705
文章中科院PubMed谷歌学者
Djikeng A, Halpin R, Kuzmickas R, DePasse J, Feldblyum J, Sengamalay N, Afonso C, Zhang X, Anderson NG, Ghedin E.随机启动病毒基因组测序。BMC基因组学,2008;9:1-9。
文章中科院谷歌学者
Reyes GR, Kim JP。序列无关,单引物扩增(SISPA)的复杂DNA群体。分子细胞探针,1991;5:473-81。
文章中科院PubMed谷歌学者
Blomström a - l, Widén F, Hammer a -S, Belák S, Berg M.利用病毒宏基因组学检测抖貂综合征水貂脑组织中一种新型星状病毒。中华微生物学杂志,2010;
文章PubMed公共医学中心中科院谷歌学者
Chrzastek K, Lee D, Smith D, Sharma P, Suarez DL, Pantin-Jackwood M, Kapczynski DR.利用序列无关的单引物扩增(SISPA)快速检测、鉴定和鉴定禽RNA病毒。病毒学。2017;509:159 - 66。
文章中科院PubMed谷歌学者
李丽娟,李丽娟,李丽娟,李丽娟,李丽娟,李丽娟。急性弛缓性麻痹患儿粪便病毒宏基因组分析。中国病毒学杂志,2009;83:4642-51。
文章中科院PubMed公共医学中心谷歌学者
Worobey M, Watts TD, McKay RA, Suchard MA, Granade T, Teuwen DE, Koblin BA, Heneine W, Lemey P, Jaffe HW。20世纪70年代和“0号病人”HIV-1基因组揭示了北美早期HIV/艾滋病的历史。大自然。2016;539:98 - 101。
文章中科院PubMed公共医学中心谷歌学者
于峰,闫燕,史敏,刘海忠,张海林,杨永波,黄晓宇,Gauger PC,张杰,张永华。2014-2018年中美猪繁殖与呼吸综合征病毒的系统发育、基因组重组和NSP2多态性模式中国病毒学杂志,2020;44:e01813-e1819。
文章中科院PubMed公共医学中心谷歌学者
朴俊,崔松,田俊华,李国伟,李昌军。猪繁殖与呼吸综合征病毒新谱系1的重组:基因组序列和细胞因子产生谱。Adv Virol, 2020; 165:2259-77。
中科院谷歌学者
金世谦,郑昌贵,朴g - s,朴志勇,郑海燕,申圭娥,高敏奎,金世宏,李k - k,金w - i。2014-2019年韩国猪繁殖与呼吸综合征病毒ORF5基因的时间谱系动态病毒学报。2021;166:2803-15。
文章中科院PubMed谷歌学者
胡健,倪勇,Dryman BA,孟X,张晨。超滤-肝素亲和层析分离纯化猪繁殖与呼吸综合征病毒。中国生物医学工程学报(英文版);2010;
文章中科院PubMed谷歌学者
Van Dijk EL, Jaszczyszyn Y, Thermes C.下一代测序文库制备方法:降低偏差。Exp Cell res 2014; 322:12-20。
文章PubMed中科院谷歌学者
陈松,黄涛,周勇,韩勇,徐敏,顾娟。AfterQC: fastq数据的自动滤波、裁剪、纠错和质量控制。BMC bioinfo . 2017; 18:91-100。
文章中科院谷歌学者
Minimap2:核苷酸序列的成对比对。生物信息学。2018;34:3094 - 100。
文章中科院PubMed公共医学中心谷歌学者
K Okonechnikov K, Conesa A, García-Alcalde F. Qualimap 2:高通量测序数据的先进多样本质量控制。生物信息学。2016;32:292-4。
中科院PubMed谷歌学者
李华,Handsaker B, Wysoker A, Fennell T, ruj, Homer N, Marth G, Abecasis G, Durbin R.序列比对/映射格式与SAMtools。生物信息学。2009;25:2078-9。
文章PubMed公共医学中心中科院谷歌学者
班克维奇A,努尔克S,安提波夫D,古列维奇AA,德沃金M,库利科夫AS,列辛VM, Nikolenko SI, Pham S, Prjibelski AD。SPAdes:一种新的基因组组装算法及其在单细胞测序中的应用。中国生物工程学报。2012;19:455-77。
文章中科院PubMed公共医学中心谷歌学者
郭晓明,王晓明,王晓明,王晓明,等。qast:基因组组装质量评估工具。生物信息学。2013;29:1072-5。
文章中科院PubMed公共医学中心谷歌学者
Sievers F, Wilm A, Dineen D, Gibson TJ, Karplus K, Li W, Lopez R, McWilliam H, Remmert M, Söding J.使用Clustal Omega快速,可扩展生成高质量蛋白质多序列校准。生物化学学报,2011;7:539。
文章PubMed公共医学中心谷歌学者
Kozlov AM, Darriba D, Flouri T, Morel B, Stamatakis a . RAxML-NG:一种快速,可扩展和用户友好的最大似然系统发育推断工具。生物信息学。2019;35:4453-5。
文章中科院PubMed公共医学中心谷歌学者
兰姆波特A,德拉蒙德A: FigTree 1.4版。0.2012.
Suyama M, Torrents D, Bork P. PAL2NAL:蛋白质序列对齐到相应密码子对齐的鲁棒转换。核酸研究,2006;34:W609-12。
文章中科院PubMed公共医学中心谷歌学者
权涛,柳世杰,善宇,李德愚,尚海杰,朴俊伟,朴c k,吕玉生。韩国结构蛋白抗原区遗传异质性的猪繁殖与呼吸综合征病毒2的独立进化Adv Virol. 2019; 164:213-24。
中科院谷歌学者
Kim H, Nguyen V, Kim I, Park J, Park S, Rho S, Han J, Park B.作为PRRSV根除候选地区的济州岛传统养猪场猪繁殖和呼吸综合征病毒的流行病学和系统发育特征跨界新兴Dis 2012; 59:62-71。
文章中科院PubMed谷歌学者
Lole KS, Bollinger RC, Paranjape RS, Gadkari D, Kulkarni SS, Novak NG, Ingersoll R, Sheppard HW, Ray SC.来自印度c亚型感染血清转换者的人类免疫缺陷病毒1型全长基因组,有亚型间重组的证据。中国病毒学杂志,1999;73:152-60。
文章中科院PubMed公共医学中心谷歌学者
Martin D, Murrell B, Golden M, Khoosal A, Muhire B. RDP4:病毒基因组重组模式的检测与分析。病毒进化。2015;1:vev003。
文章PubMed公共医学中心谷歌学者
Lee C, Kim H, Kang B, Yeom M, Han S, Moon H, Park S, Kim H, Song D, Park B. 2007 - 2008年韩国分离的I型猪繁殖与呼吸综合征病毒流行及系统发育分析病毒基因。2010;40:225-30。
文章中科院PubMed谷歌学者
权涛,柳世杰,李德宇,善宇善,尚海杰,朴继伟,金敏海,朴c k,吕玉生。猪繁殖与呼吸综合征病毒1型抗原区在疫苗引入前后的差异进化病毒res 2019; 260:12-9。
文章中科院PubMed谷歌学者
Kim Y, Van Bonn W, Aw TG, Rose JB。水族病毒:人类管理的水生系统的病毒。前沿微生物,2017;8:1231。
文章PubMed公共医学中心谷歌学者
Beaulaurier J, Luo E, Eppley JM, Den Uyl P, Dai X, Burger A, Turner DJ, Pendelton M, Juul S, Harrington E。基因组Res. 2020; 30:437-46。
文章中科院PubMed公共医学中心谷歌学者
Colman RE, Mace A, Seifert M, Hetzel J, Mshaiel H, Suresh A, Lemmer D, Engelthaler DM, Catanzaro DG, Young AG。isisq100和MiSeq上耐药结核分枝杆菌的全基因组和靶向测序:性能、易用性和成本评估公共科学图书馆·医学2019;16:e1002794。
文章中科院PubMed公共医学中心谷歌学者
张海林,张文林,向丽茹,冷春林,田志军,唐玉东,蔡晓辉。新型猪繁殖与呼吸综合征病毒(ORF5 rflp1-7-4病毒)在中国的出现兽医微生物,2018;222:105-8。
文章中科院PubMed谷歌学者
徐华,宋松,赵娟,冷春,付娟,李超,唐勇,向林,彭娟,王强。一种中国潜在的流行毒株:nadc34样猪繁殖与呼吸综合征病毒。跨界新兴Dis 2020; 67:1730-8。
文章中科院PubMed谷歌学者
陈楠,于旭,王玲,吴娟,周震,倪娟,李霞,翟霞,田凯。两种不同致病性的天然重组猪繁殖与呼吸综合征病毒。病毒基因,2013;46:473-8。
文章中科院PubMed谷歌学者
李斌,方林,徐震,刘松,高洁,姜勇,陈宏,肖生。猪繁殖与呼吸综合征病毒疫苗与流行株的重组。新兴感染病。2009;15:2032。
文章PubMed公共医学中心谷歌学者
卢文华,屯敏敏,孙宝林,莫军,周庆峰,邓玉玉,谢庆明,毕玉珍。梁fc - c, Ma jyy:猪呼吸与生殖综合征病毒(谱系3)的重现和与疫苗变体基因组重组后的致病性增加。兽医学报。2015;175:332-40。
文章中科院PubMed谷歌学者
车世辉,崔e俊,朴建辉,尹世荣,宋建勇,权建辉,宋海杰,尹k - j。最近韩国猪繁殖与呼吸综合征(PRRS)病毒的分子特征及其与其他亚洲PRRS病毒的比较。兽医微生物学,2006;117:248-57。
文章中科院PubMed谷歌学者
周玲,王忠,丁勇,葛霞,郭霞,杨华。猪繁殖与呼吸综合征病毒nadc30样株,中国。新兴感染杂志2015;21:2256。
文章中科院PubMed公共医学中心谷歌学者
周玲,杨旭,田勇,尹松,耿刚,葛旭,郭霞,杨慧。中国近年来出现的猪繁殖与呼吸综合征基因型2型病毒遗传多样性分析。BioMed Res Int 2014;2014:1 - 13。
谷歌学者
周玲,康锐,季刚,田勇,葛敏,谢波,杨霞,王慧。2012-2016年西南地区猪繁殖与呼吸综合征病毒分子特征及重组分析病毒基因,2018;54:98-110。
文章中科院PubMed谷歌学者
赵红,韩强,张龙,张震,吴勇,沈宏,姜平。中国不同省份猪繁殖与呼吸综合征病毒流行优势株与JXA1-R疫苗相关的花叶重组株的出现。病毒学报,2017;14:1-10。
文章中科院谷歌学者
张震,曲霞,张宏,唐霞,边涛,孙勇,周明,任峰,吴平。中国猪繁殖与呼吸综合征分离株的进化与重组分析。病毒基因2020;56:354-60。
文章中科院PubMed谷歌学者