Takeuchi O, Akira S.模式识别受体与炎症。细胞。2010;140(6):805 - 20。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2Ba谷歌学者gydF4y2Ba
Schneider W, Chevillotte M, Rice C.干扰素刺激基因:宿主防御的复杂网络。中华免疫杂志2014;32:513-45。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2Ba谷歌学者gydF4y2Ba
孙玲,吴娟,杜峰,陈鑫,陈哲。环状GMP-AMP合成酶是一种激活I型干扰素通路的细胞质DNA传感器。科学(纽约,纽约州)。2013, 339(6121): 786 - 91。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2Ba谷歌学者gydF4y2Ba
加藤K,大村H,石谷R, Nureki O.环GMP-AMP在先天性免疫信号通路中的内源性第二信使。生物化学,2017;86:541-66。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2Ba谷歌学者gydF4y2Ba
在疱疹病毒感染过程中,病毒DNA传感器IFI16和环GMP-AMP合酶在调节病毒基因表达、免疫防御和凋亡反应方面具有不同的功能。gydF4y2BamBiogydF4y2Ba2016年,7(6)。gydF4y2Ba
高勇,赖敏,于晨。登革热病毒如何绕过先天免疫系统。前沿免疫。2018;9:2860。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2Ba谷歌学者gydF4y2Ba
高东,吴娟,吴勇,杜峰,阿罗春,闫楠,孙玲,陈铮。环GMP-AMP合成酶是HIV和其他逆转录病毒的先天性免疫传感器。科学(纽约,纽约州)。2013, 341(6148): 903 - 6。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2Ba谷歌学者gydF4y2Ba
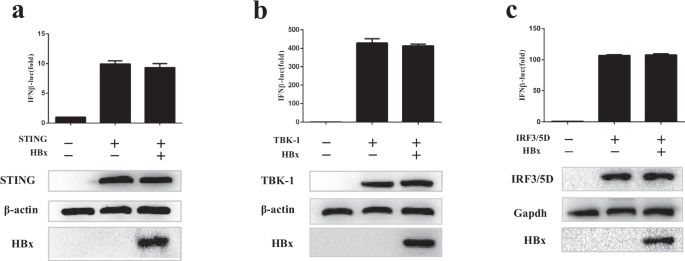
Dansako H, Ueda Y, Okumura N, Satoh S, Sugiyama M, Mizokami M, Ikeda M, Kato N.环GMP-AMP合成- sting信号通路在对抗HBV的先天免疫应答和抑制HBV组装中都是必需的。中华医学杂志,2016;29(1):344 - 344。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2Ba谷歌学者gydF4y2Ba
何娟,郝瑞,刘东,刘霞,吴松,郭松,王勇,田萍,郭东。激活cGAS-STING途径抑制乙肝病毒复制。中国病毒学杂志,2016;44(12):3368-78。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2Ba谷歌学者gydF4y2Ba
郭峰,唐磊,舒舒,Sehgal M, Sheraz M,刘波,赵强,程杰,赵霞,周涛等。肝细胞干扰素基因刺激因子的激活抑制乙肝病毒的复制。中国生物医学工程学报,2017,29(10)。gydF4y2Ba
张东,苏晨,郑晨。单纯疱疹病毒1丝氨酸蛋白酶VP24通过取消干扰素调节因子3的激活阻断dna传感信号通路。中国病毒学杂志,2016;90(12):5824-9。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2Ba谷歌学者gydF4y2Ba
单纯性疱疹病毒1型通过病毒粒子宿主关闭蛋白UL41取消cGAS/ sting介导的胞质dna感应通路。中华病毒学杂志,2017,91(6)。gydF4y2Ba
徐红,苏晨,Pearson A, Mody C,郑晨。单纯疱疹病毒1ul24通过抑制NF-κB激活来消除DNA传感信号通路。中国病毒学杂志,2017,91(7)。gydF4y2Ba
尤红,郑松,黄志,林艳,沈强,郑晨。单纯疱疹病毒1被膜蛋白UL46抑制tank结合激酶1介导的信号通路。生物工程学报,2019,10(3)。gydF4y2Ba
叶瑞,苏晨,徐红,郑晨:单纯疱疹病毒1型泛素特异性蛋白酶UL36抑制NF-κB在DNA敏感信号通路中的激活。中国病毒学杂志,2017;91(5)。gydF4y2Ba
游红,林燕,林峰,杨敏,李娟,张锐,黄铮,沈强,唐锐,郑超:β-Catenin是cGAS/STING信号通路的必需蛋白,但被单纯疱疹病毒1us3蛋白拮抗。中华病毒学杂志,2020,94(5)。gydF4y2Ba
黄娟,尤红,苏超,李艳,陈松,郑晨。单纯疱疹病毒1型被膜蛋白VP22取消cGAS/ sting介导的抗病毒先天免疫。中国病毒学杂志,2018,92(15)。gydF4y2Ba
吴娟,李伟,邵毅,Avey D,付波,Gillen J, Hand T,马森,刘x, Miley W,等。疱疹病毒病毒粒蛋白对cGAS DNA感应的抑制作用细胞宿主微生物。2015;18(3):333-44。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2Ba谷歌学者gydF4y2Ba
张光,陈B, Samarina N, Abere B, Weidner-Glunde M, Buch A, Pich A, Brinkmann M, Schulz T.卡波西肉瘤疱疹病毒LANA的细胞质异型招募并拮抗先天免疫DNA传感器cGAS。美国国家科学研究院。2016, 113 (8): e1034 - 1043。gydF4y2Ba
中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
Verrier E, Yim S, Heydmann L, El Saghire H, Bach C, Turon-Lagot V, Mailly L, Durand S, Lucifora J, Durantel D,等。人肝细胞中环状单磷酸鸟苷-单磷酸腺苷合酶检测对乙型肝炎病毒的逃避作用肝病学(巴尔的摩,医学博士)。2018, 68(5): 1695 - 709。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2Ba谷歌学者gydF4y2Ba
Lok A, McMahon B.慢性乙型肝炎。2007; 45(2): 507 - 39。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2Ba谷歌学者gydF4y2Ba
李松,车娥,林俊,权山,金东,赵海华,韩凯。乙型肝炎病毒本质展开mini-HBX蛋白的结构特征。中国生物医学工程学报。2012;34(2):165-9。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2Ba谷歌学者gydF4y2Ba
姜军,唐慧。乙型肝炎病毒X蛋白抑制I型干扰素诱导的机制。中国生物医学工程学报。2010;1(12):1106-17。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2Ba谷歌学者gydF4y2Ba
陶娟,张鑫,金娟,杜霞,连涛,杨娟,周霞,蒋志,苏鑫:cGAS N端非特异性DNA结合促进cGAS活化。J Immunol。(巴尔的摩,马里兰州:1950)2017,198(9):3627-36。gydF4y2Ba
王霞,李艳,毛安,李艳,田平。乙型肝炎病毒X蛋白通过破坏签证相关复合物抑制病毒触发的IRF3激活和ifn - β诱导。细胞Mol免疫,2010;7(5):341-8。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2Ba谷歌学者gydF4y2Ba
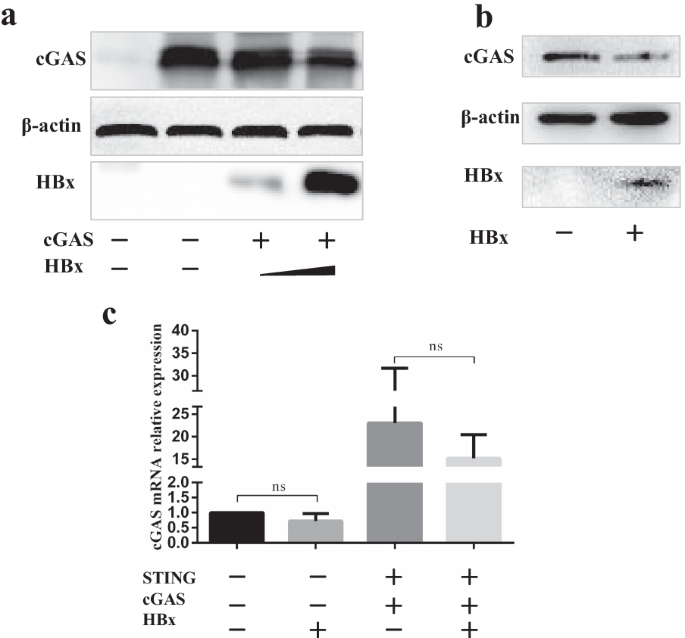
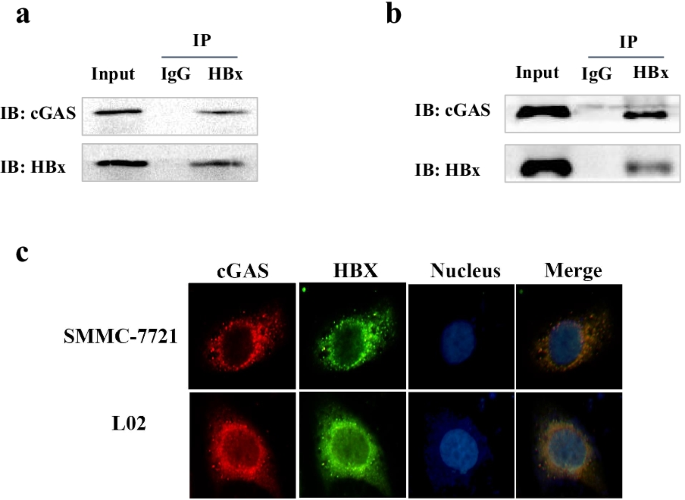
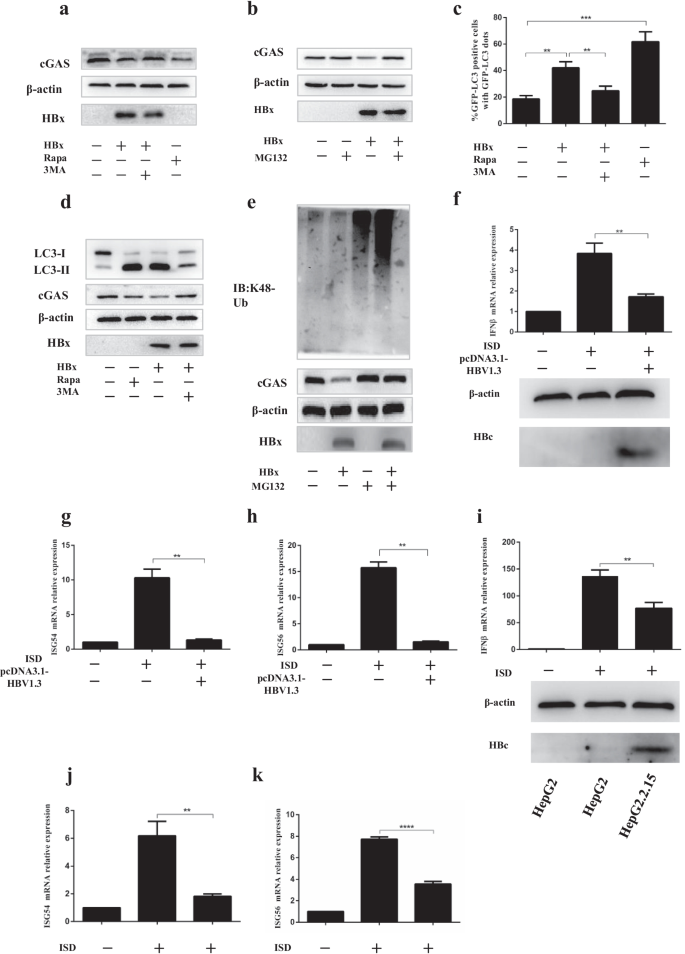
陈敏,孟强,秦勇,梁鹏,谭鹏,何玲,周勇,陈勇,黄娟,王锐,等。TRIM14抑制选择性自噬受体p62介导的cGAS降解,促进先天免疫应答。中国生物医学工程学报,2016;36(1):344 - 344。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2Ba谷歌学者gydF4y2Ba
Park S, Rehermann B.对HCV和其他肝炎病毒的免疫应答。免疫力。2014;40(1):24里面。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2Ba谷歌学者gydF4y2Ba
熊敏,王松,王勇,冉勇。cGAS的调控。中国病毒学杂志,2018;33(2):117-24。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2Ba谷歌学者gydF4y2Ba
Murphy CM, Xu Y, Li F, Nio K, Reszka-Blanco N, Li X, Wu Y, Yu Y, Xiong Y, Su L.乙型肝炎病毒X蛋白促进SMC5/6的降解,增强HBV复制。Cell Rep. 2016;16(11): 2846-54。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2Ba谷歌学者gydF4y2Ba
张海涛,陈广根,胡广朋,张志智,恽太平,何明明,赖保。乙型肝炎病毒x蛋白通过激活死亡相关蛋白激酶诱导自噬。病毒性肝炎杂志。2014;21(9):642-9。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2Ba谷歌学者gydF4y2Ba
高鹏,Ascano M,吴Y, Barchet W, Gaffney B, Zillinger T, Serganov A,刘y, Jones R, Hartmann G,等。Cyclic [G(2 ',5 ')pA(3 ',5 ')p]是由dna激活的环状GMP-AMP合成酶产生的后生动物第二信使。细胞。2013;153(5):1094 - 107。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2Ba谷歌学者gydF4y2Ba
赵波,徐鹏,罗莱特C,景涛,辛德O,雷Y, West A,刘伟,李鹏。cGAS紧密核系留与失活的分子基础。大自然。2020;587(7835):673 - 7。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2Ba谷歌学者gydF4y2Ba
陈红,陈红,张娟,王艳,Simoneau A,杨红,Levine A,邹玲,陈志,兰玲。cGAS作为复制叉的减速器抑制基因组不稳定性。科学通报2020,6(42)。gydF4y2Ba