rAAV病毒粒子来源
15种不同血清型的单一自我互补rAAV-EGFP质粒载体[28]是在马萨诸塞大学医学院Horae基因治疗中心通过衣壳蛋白的差异表达产生的。亲本rAAV-EGFP质粒载体编码由混合CMV增强子/鸡β-肌动蛋白启动子驱动的细胞质增强绿色荧光蛋白(EGFP) [27].转导后,EGFP荧光可以通过显微镜(共聚焦显微镜,流式细胞仪)直接在细胞中可见,蛋白表达可以通过特异性抗体检测(见下文)。15种rAAV血清型中的每一种(表1)在修饰的人HEK293细胞中合成,提取、纯化、分离、分析基因组含量并按所述方法滴定[25].15种血清型的生产细节可通过Horae基因治疗中心获得。
细胞来源
本研究中使用的b细胞系见表2连同他们的来源。原代b细胞根据NEOB机构审查委员会和马萨诸塞大学医学院的政策,从从新英格兰器官库获得的人类脾脏样本中分离出来。原代B细胞分离采用STEMCELL技术公司EasySep直接人类B细胞分离试剂盒(STEMCELL Technologies),根据制造商说明书进行负选择。使用单克隆抗体:APC-conjugated anti-CD20 (BioLegend)和FITC-conjugated anti-CD19 (BioLegend),流式细胞术验证b细胞群纯度大于90%。所有b细胞保存在rmi -1640 (Sigma-Aldrich)中,添加10%热灭活胎牛血清(HyClone)、100 U/ml青霉素和100 μg/ml链霉素(Cellgro), 37℃,5% CO2孵化器。
转导程序和共聚焦显微镜
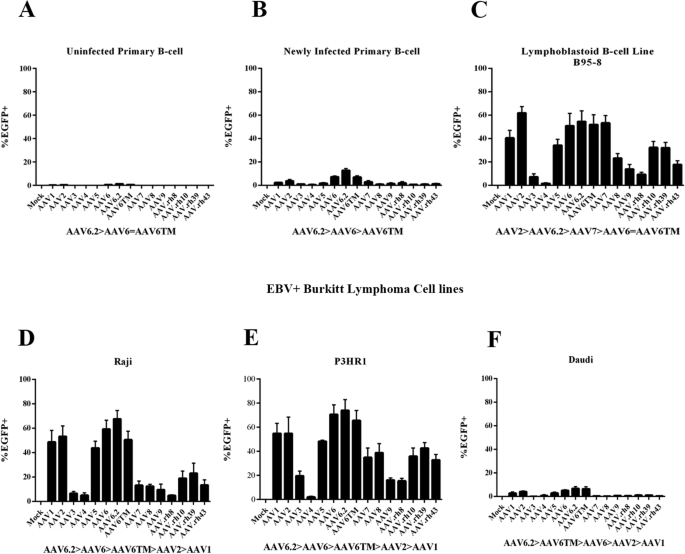
为了比较每种人类b细胞系中15种rAAV血清型的转导效率,以2 × 10的密度将生长到中对数期的细胞种在24孔板中5每孔细胞。24小时后,细胞以MOI为10的rAAV血清型转导5.感染48小时后,ZEISS LSM 700共聚焦显微镜捕捉EGFP表达介导的荧光。
转导程序和流式细胞术
b细胞来自所描述的每个来源(表2)生长到中对数相,然后镀(3 × 105细胞/孔)在24孔板。然后以MOI为10的15种rAAV血清型中的每一种转导细胞5在重复三次的独立实验中,n = 3。感染48小时后,收集细胞,PBS清洗,2%多聚甲醛固定,并在LSRII流式细胞仪上进行流式细胞术分析(BD Biosciences)。BD FACSDiva™软件(BD Biosciences)用于量化荧光(egfp表达)细胞的百分比。
编码HSV1-TK的rAAV6.2的合成与生产
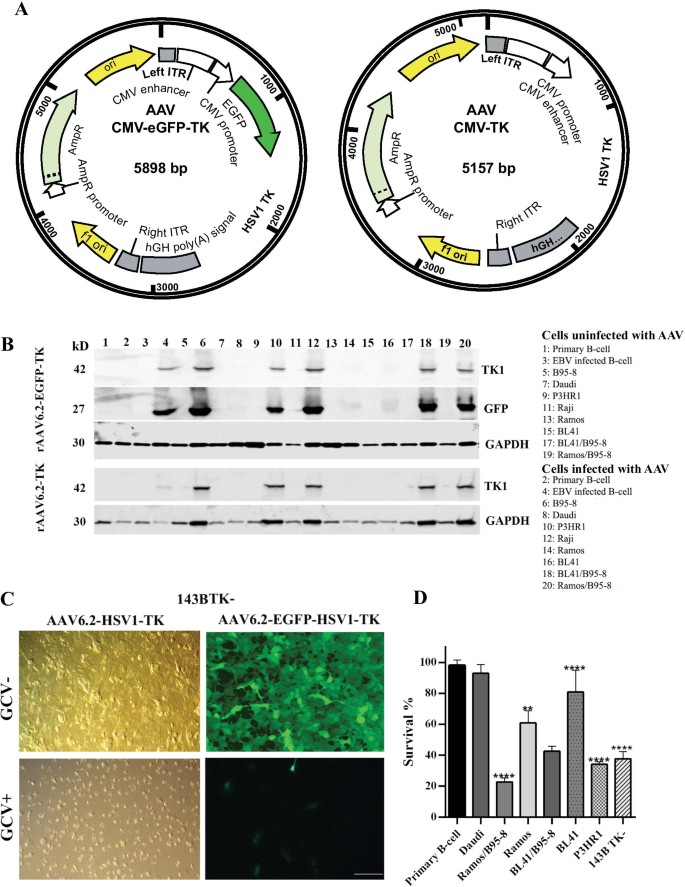
基于raav的编码EGFP-HSV1-TK和单独编码HSV1-TK的质粒由Gene Universal (Newark, Delaware)合成。各基因组如图所示。4a.插入物(EGFP-HSV1-TK和HSV1-TK)的来源已在前面描述过[6].每个基因组被封装以产生rAAV6.2血清型,并如上所述在Horae基因治疗中心进行转导实验。
143BTK-人横纹肌肉瘤细胞系,缺乏人TK-1表达(ATCC),被预先选择为溴脱氧尿苷耐药。细胞保存在DMEM (Corning)中,添加10%热灭活胎牛血清(HyClone)、100 U/ml青霉素和100 μg/ml链霉素(Cellgro), 37℃,5% CO2孵化器。143BTK细胞经上述rAAV6.2- egfp -HSV1-TK或rAAV6.2 HSV1-TK共聚焦分析b细胞系。
免疫印迹检测转导细胞中HSV1-TK蛋白的表达
选择生长到中对数期的b细胞株,以2 × 10的密度在24孔板中播种5每孔细胞。24小时后,细胞以MOI为10的rAAV6.2血清型编码HSV1-TK转导5.转导48小时后,收集细胞,在RIPA缓冲液中裂解,并用Bradford法定量。用NuPAGE Bis-Tris(4-12%)聚丙烯酰胺凝胶电泳(Thermo Fisher Scientific)在MOPS缓冲液中还原条件下分离总细胞蛋白(20µg / lane)。将蛋白质转移到硝化纤维膜上,在TBST中用5%脱脂牛奶阻断1小时,然后进行抗体孵育,清洗5次膜,最后使用ECL化学发光检测试剂盒Clarity Max Western ECL Substrate (Bio-Rad)进行检测。
一抗兔多克隆抗- hsv1 - tk由耶鲁大学William Summers博士慷慨提供。最终检测采用hrp标记山羊抗兔二抗(Santa Cruz Biotechnology)。
一抗小鼠抗egfp和小鼠抗gapdh来自Santa Cruz Biotechnology公司,酶标山羊抗小鼠IgG二抗用于化学发光检测。
HSV1‐TK‐转导细胞对GCV的敏感性
用ZEISS LSM 700共聚焦显微镜采集143BTK-细胞经rAAV6.2 HSV1-TK或EGFP-HSV1-TK转导后的共聚焦图像。使用ZEN lite软件分析图片。所有图片均在相同的放大倍率(比例尺= 50 μm)下拍摄。用10 μM更昔洛韦孵育前和孵育后72 h分别采集图像。更昔洛韦显示的浓度是在先前的实验中通过剂量-反应曲线确定的。
更昔洛韦孵育rAAV6.2 HSV1-TK转导b细胞的MTT活力分析
选择b细胞株(2 × 105细胞/ml)在96孔微孔板中37℃培养24 h。用rAAV6.2-HSV1-TK转染细胞48 h,用10 μM GCV或安慰剂(无GCV)孵育细胞3 d。显微镜观察后,将20微升MTT(3-(4,5-二甲基噻唑-2-基)-2,5-二苯基溴化四唑)溶液(5mg /ml)加入每孔,与细胞一起孵育4小时。加40 μl DMSO使积累的甲马赞产物增溶。在570 nm处测定了反应产物的光学吸收。通过测量处理细胞的平均吸光度比未处理细胞的平均吸光度来计算存活细胞的百分比。未经处理的细胞100%存活。结果用平均值±标准差表示(n = 3)。
统计分析
使用GraphPad Prism 8软件(GraphPad, San Diego, CA)对流式细胞术产生的荧光数据进行统计分析。因为条件内的变化很小,我们假设所有数据都服从正态分布。来自独立实验的数值报告为平均值±标准差。
伦理批准
本研究是根据NEOB机构审查委员会和马萨诸塞大学医学院(irb# H00004283)的政策进行的。