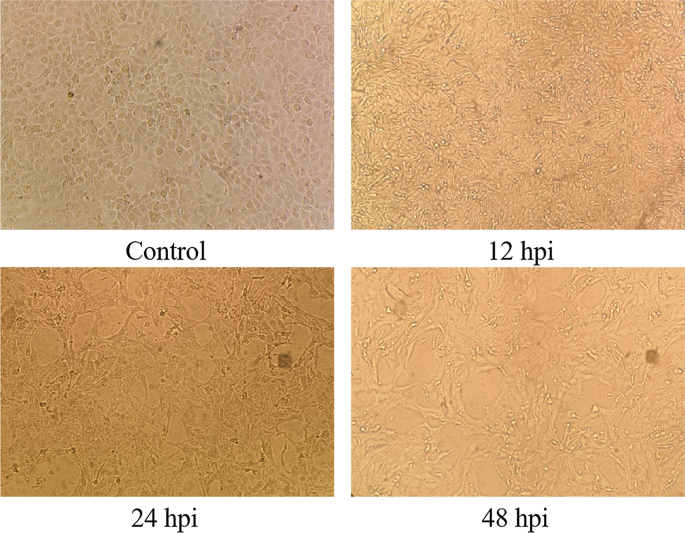
MDBK细胞目前广泛应用于BVDV的研究,很少有研究人员对BVDV感染MDBK细胞的蛋白质组学进行研究。BVDV的研究和开发处于相对滞后的状态。通过研究BVDV感染MDBK细胞的差异表达蛋白,我们可以系统地了解病毒与宿主细胞之间的相互作用,寻找BVDV感染的宿主细胞免疫调节相关蛋白。此外,本研究也可为BVDV的防治提供新的思路,并为其它猪瘟病毒属病毒的研究提供参考。迄今为止,通过世界各地的研究,BVDV有许多不同的亚型[13].由于所有这些类型的研究都比较困难,我们选择了中国畜牧业常用的BVDV-1 NADL [14].
目前,各种蛋白质组学方法已被广泛用于研究病毒与宿主细胞之间的相互作用[8,15].等压相对和绝对定量标签(iTRAQ)是美国应用生物系统公司ABI开发的一种肽体外标记技术。iTRAQ作为一种新的蛋白质组定量技术,可以比传统的蛋白质定性技术进行更准确有效的高通量蛋白质组分析。近年来,基于itraq的蛋白质组学技术已多次应用于病毒学研究。
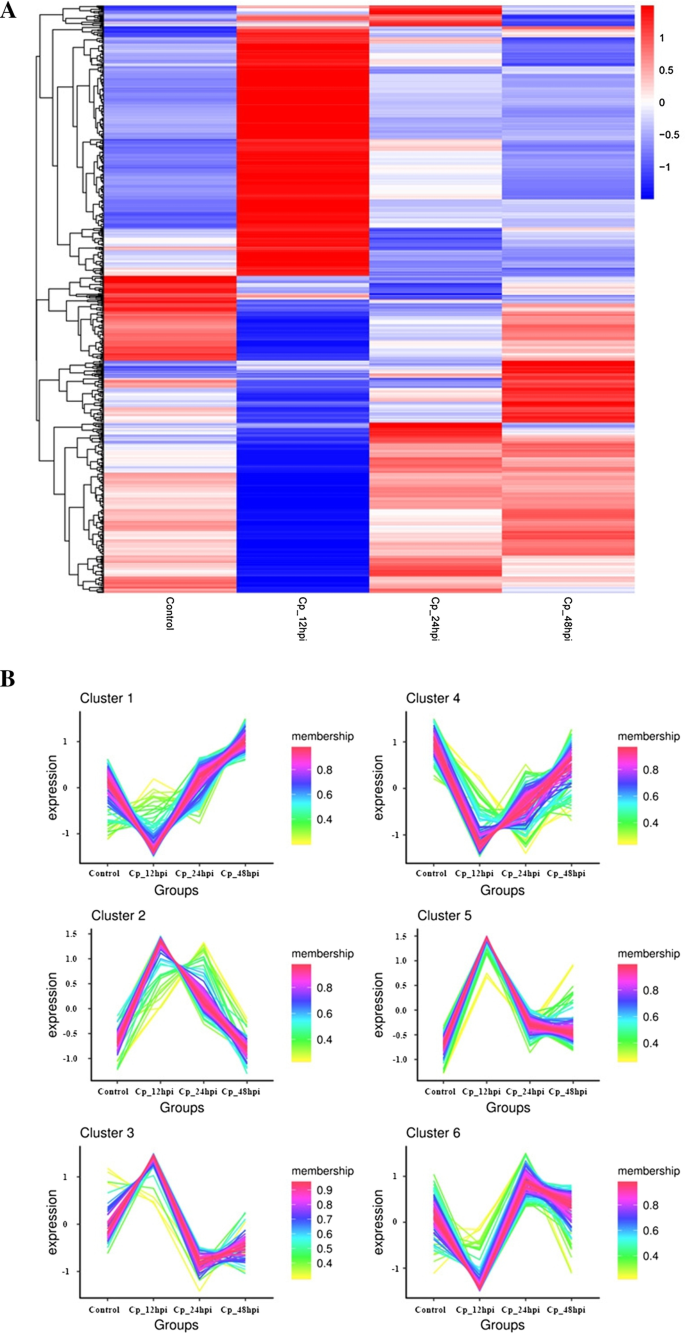
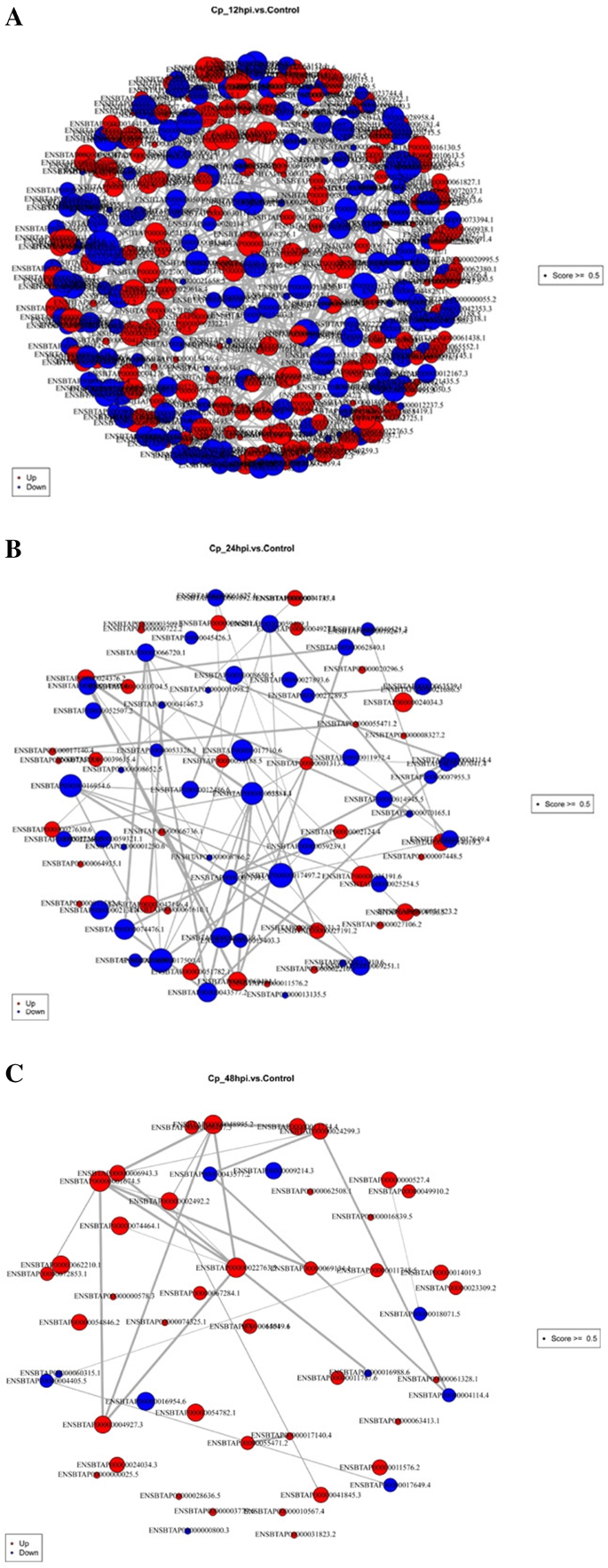
病毒与宿主细胞的相互作用是一个非常复杂的过程,涉及大量的蛋白质表达变化和信号转导[16].本研究采用iTRAQ结合串联质谱(LC-MS /MS)技术,分析了BVDV NADL感染3个不同时间点MDBK细胞的蛋白表达谱。在本研究中,基于折叠变化> 1.5或< 0.67和p值< 0.05,在12、24和48 hpi共鉴定出357、101和66个dep。从我们的结果来看,宿主细胞中的蛋白质存在显著差异。这表明DEPs在BVDV nadl感染的MDBK细胞中起着重要的调节作用。大量蛋白质在每个时期都有上调。同时,上调蛋白的表达量远高于下调蛋白,这在48 hpi时表现得尤为明显。这表明宿主在不同时间点对BVDV NADL感染具有抵抗作用。进一步分析这些蛋白的功能有助于了解MDBK细胞与BVDV NADL之间的关系。为宿主细胞对BVDV NADL感染的反应及疫苗的研制提供了理论依据。
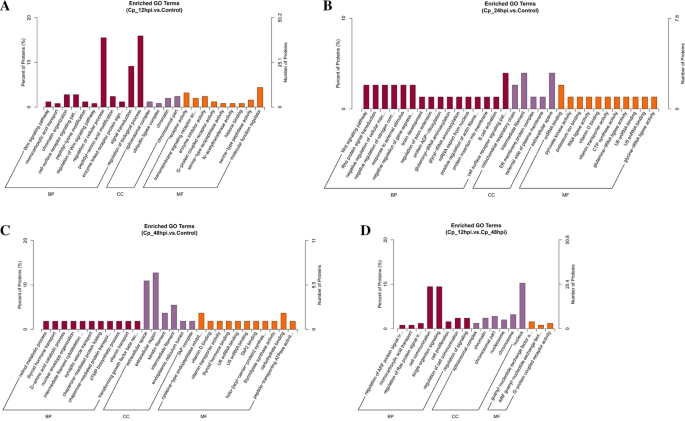
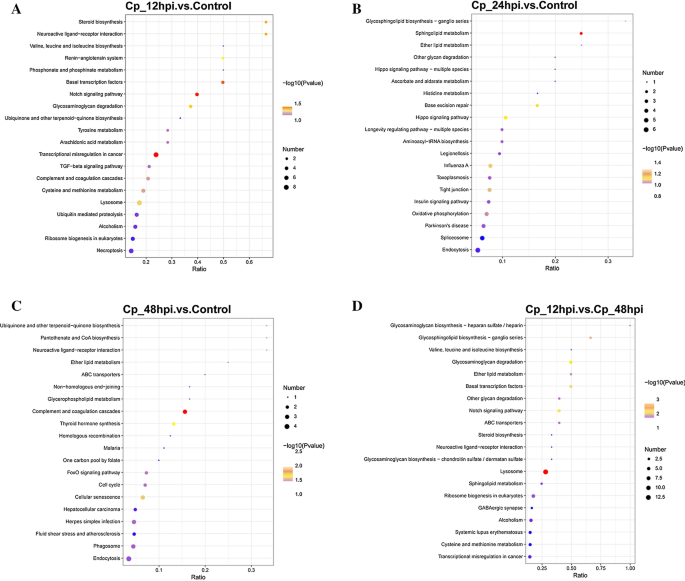
基于GO注释对这些失调蛋白进行功能分析,GO项在12 hpi、24 hpi和48hpi的顺序完全不同。研究还表明,在BVDV NADL感染的不同时间点,感染细胞的反应也不同。实际上,大量的差异表达蛋白集中在生物过程(BP)和细胞过程的调控以及12 hpi的信号转导中。在24 hpi时,氧化石墨烯含量最高的是细胞表面受体信号通路、中间纤维和细胞外间隙。但在感染后期,生物学过程中差异表达蛋白没有明显富集。GO注释和通路分析表明,这些蛋白处于多种细胞生物学过程中,包含代谢通路、蛋白在内质网的加工、ECM受体相互作用、肌动蛋白细胞骨架规则等。通过蛋白相互作用网络分析,我们推测MAPK信号通路可能在BVDV nadl感染细胞中发挥作用。本研究结果为进一步研究BVDV的发病机制和抗病毒靶点的选择奠定了基础。
- 1.
参与免疫系统的差异表达蛋白
非特异性免疫系统是指人体固有的正常生理防御功能,能对各种病毒的感染做出相应的免疫反应。模式识别受体(Pattern recognition receptor, PRRs)是先天免疫中免疫受体的代表,可识别细胞质中的病毒RNA [17].它实际上在抗病毒自然免疫中起着重要作用[18].在本研究中,大量DEPs参与toll样受体(TLR)、核苷酸结合寡聚结构域(NOD)样受体(NLR)和MAPK信号通路,包括无名指蛋白31 (RNF31)、ANTXR细胞粘附分子2 (ANTXR2)、肿瘤蛋白p53结合蛋白1 (TP53BP1)、caspase 8 (CASP8)和胰岛素受体(INSR)。MAPK家族在细胞生长、分化和炎症等生理和病理过程中发挥调节作用。许多研究表明,RLR(视黄酸诱导基因-Ι(RIG-I)样受体)、TLR和NLR信号通路在黄病毒感染细胞中起着重要的调控作用[19,20.].
我们发现,在BVDV NADL感染后,一些参与免疫反应的蛋白质的表达发生了改变,如干扰素调节因子(IRFs)。IRFs是一种多功能转录因子,可特异性结合干扰素(IFN)基因启动子和干扰素刺激反应基因(ISG)中的干扰素刺激反应元件(ISRE)。因此,IRFs在人体抗病毒感染和调节细胞生长方面具有重要意义。从我们的研究数据来看,干扰素调节因子2 (IRF2)的表达明显上调。IRF2是乳腺癌侵袭转移的重要调控因子;但其在抗病毒过程和免疫调节中的作用还有待进一步研究。
- 2.
参与细胞骨架和ecm受体相互作用的差异表达蛋白
细胞形态、细胞运动和细胞间粘附是由细胞骨架蛋白维持的。此外,细胞骨架在细胞器定位和囊泡运输中也起着关键作用。值得一提的是,细胞骨架网络在病毒感染过程中也起着促进作用。宿主细胞被病毒感染后,其细胞骨架会断裂甚至解体[21].在调节肌动蛋白细胞骨架的8个DEPs中,整合素亚基β 5 (ITGB5)、ENAH肌动蛋白调节因子(ENAH)和Rho鸟嘌呤核苷酸交换因子7 (ARHGEF7)显著上调。
在本研究中,整合素亚基β5 (ITGβ5)、IV型胶原α 1链(COL4A1)和syndecan 1 (SDC1)显著上调。整合素作为细胞外基质细胞与细胞内肌动蛋白骨架之间的跨膜接头,将细胞外基质与细胞内骨架网络连接成一个整体。一系列相关研究表明,ITGβ5的异常表达与各种疾病的病理过程密切相关。ITGβ5在多种疾病中可促进血管的形成。它还能与内皮生长因子受体2 (VEGF2)相互作用,抑制细胞凋亡。胶原蛋白是哺乳动物中数量最多、分布最广的功能性蛋白,在细胞运动、血管生成、组织形成或修复等方面发挥着重要作用。胶原蛋白也是ECM的主要成分,ECM与许多其他疾病有关,包括Ehlers-Danlos综合征、Kniest发育不良、Alport综合征和某些动脉瘤[22].不同类型的胶原蛋白在BVDV NADL感染中是否具有多种不同的功能,目前尚不清楚。在BVDV nadl感染后,我们发现病毒滴度为48 hpi的细胞发生了很多明显的病理变化。然而,实验结果并未表明MDBK细胞中与细胞骨架和ecm受体相互作用相关的蛋白能够促进BVDV NADL的增殖和释放。
- 3.
参与内质网蛋白加工的差异表达蛋白
内质网是蛋白质合成和成熟的重要组成部分。内质网存在于许多分子伴侣中,帮助蛋白质折叠和组装[23].大量研究表明,病毒感染不仅会改变内质网,还会激活未折叠蛋白反应(UPR),从而促进病毒复制[24,25].在我们的研究中,有14个DEPs参与了内质网蛋白的加工。其中,内质网凝集素1 (ERLEC1)和凝集素与甘露糖结合1 (LMAN1)均在48 hpi上调。此外,泛素偶联酶E2J1 (UBE2J1)在12 hpi上调。结果表明,DnaJ热休克蛋白家族(Hsp40)成员A2 (DNAJA2)、热休克蛋白家族A (Hsp70)成员8 (HSPA8)和热休克蛋白家族A (Hsp70)成员1A (HSPA1A)在24 hpi时表达下调,而DnaJ热休克蛋白家族(Hsp40)成员B4 (DNAJB4)在12hpi时表达显著上调。热休克蛋白(Heat shock protein, HSP)是一类高度保守的蛋白家族,其表达在正常情况下受到机体或细胞的抑制,在不良环境因素的刺激下受到抑制[26].它具有多种生物学功能,包括细胞蛋白自稳定、抗凋亡、抗氧化、协同免疫等。例如,HSP70在各种DNA病毒和RNA病毒感染中高表达,并抑制病毒复制[27,28].热休克蛋白活性降低会导致遗传性外周运动神经病变、阿尔茨海默病等疾病的发生[29].本研究发现BVDV NADL感染后24 h HSPA8和HSPA1A明显下调,可能导致宿主出现异常的神经症状。由于热休克蛋白参与蛋白质折叠,内质网应激反应中UPR信号的激活可能在特定的病毒功能中发挥作用。因此,内质网应激蛋白可能对许多病毒的复制也很重要[25].病毒进入靶细胞是病毒繁殖最重要的步骤之一,因此需要进一步研究这些差异蛋白在BVDV NADL感染后的具体作用。
- 4.
参与翻译的差异表达蛋白
大多数翻译相关蛋白在BVDV NADL感染过程中表达上调。在核糖体蛋白中,糖浆核糖体生物发生因子1(TCOF1)、核转运因子2类出口因子2(NXT2)、核糖体蛋白L37(RPL37)、核糖体蛋白L29 (RPL29)、线粒体核糖体蛋白S18A(MRPS18A)在感染早期均上调。真核翻译起始因子4E结合蛋白1 (EIF4EBP1)、真核翻译起始因子4E (EIF4E)和真核翻译起始因子3亚基F (EIF3F)作为翻译起始因子在BVDV nadl感染过程中上调。我们假设BVDV NADL会利用MDBK细胞的蛋白质合成系统产生大量的病毒蛋白。
- 5.
参与代谢过程的差异表达蛋白
研究表明,病毒感染可显著改变宿主细胞的细胞代谢[30.,31].在我们的研究中,我们发现许多参与代谢过程的蛋白质在BVDV nadl感染的MDBK细胞中表达不同。59个差异表达蛋白(9.14%)被分类为代谢途径。这些蛋白主要参与糖酵解、丙酮酸代谢和柠檬酸循环(TCA循环)。在这些代谢途径中的蛋白质中,丙酮酸脱氢酶E1 β亚基(PDHB)、乙醛脱氢酶7家族成员A1 (ALDH7A1)、乙醛脱氢酶3家族成员A2 (ALDH3A2)和丙酮酸激酶M1/2 (PKM)同时参与糖酵解和丙酮酸代谢。乙醛脱氢酶7家族成员A1 (ALDH7A1)和丙酮酸激酶M1/2 (PKM)在24 hpi时下调。丙酮酸脱氢酶E1 beta亚基(PDHB)、柠檬酸合成酶(CS)、ATP柠檬酸裂解酶(ACLY)和异柠檬酸脱氢酶(NAD(+)) 3非催化亚基γ (IDH3G)参与了柠檬酸循环(TCA循环)。目前,病毒-宿主代谢的相互作用机制有待进一步研究。特别是代谢途径的关键基因如何调节病毒易感性值得考虑。这一过程为本研究提供了新的方向。 Antiviral drugs can be studied by studying how protein expression in metabolic pathways inhibits virus generation.