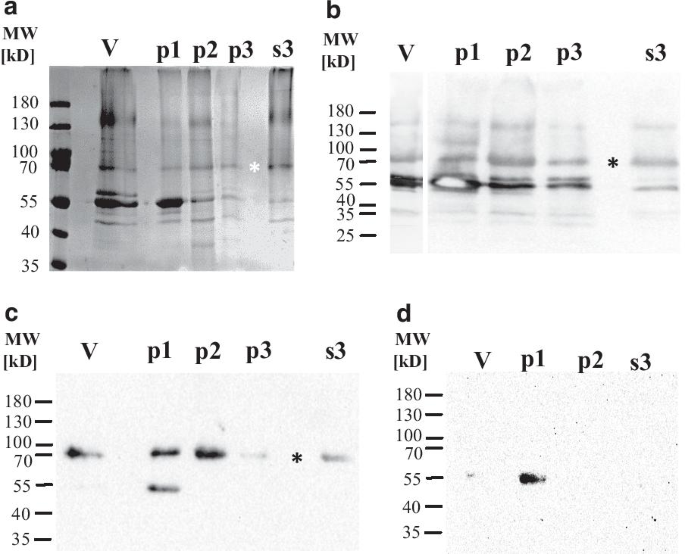
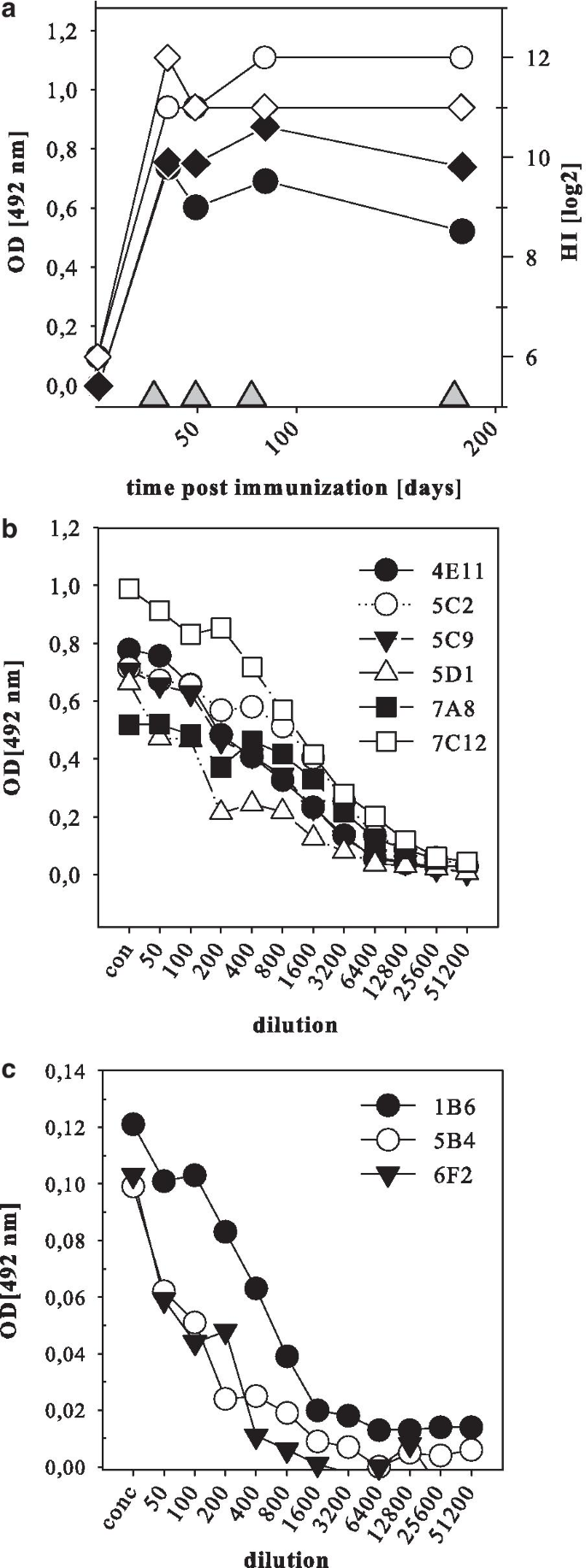
Rima B, Balkema-Buschmann A, Dundon WG, Duprex P, Easton A, Fouchier R, Kurath G, Lamb R, Lee B, Rota P, Wang L, Ictv报告C. Ictv病毒分类简介:副粘病毒科。中国病毒学杂志,2019;100:1593-4。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
Czegledi A, Ujvari D, Somogyi E, Wehmann E, Werner O, Lomniczi B.禽副粘病毒血清型(新城疫病毒)的第三基因组大小类别及其进化意义。病毒决议2006;120:36-48。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
张志刚,张志刚,张志刚。新城疫病毒互补dna的分子克隆及大蛋白与血凝素神经氨酸酶基因连接的核苷酸序列分析。中华病毒学杂志,1986;67:475-86。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
王志刚,王志刚,王志刚,等。新城疫病毒感染细胞中四种多顺反子转录物序列的鉴定。病毒决议1986;5:77-95。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
黄志刚,王晓明,王志刚,王志刚。新城疫病毒融合蛋白裂解位点的研究进展。Microb Pathog. 2004; 36:1-10。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
Lamb RA, Paterson RG, Jardetzky TS.副粘病毒膜融合:F和HN原子结构的经验教训。病毒学。2006;344:30-7。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
Morgan RW, Gelb J, Jr., Pope, c.r., Sondermeijer, p.j.。含新城疫病毒融合基因的火鸡疱疹病毒重组疫苗对鸡的免疫效果:母源抗体的起效和保护作用。鸟类疾病,1993;37:1032-40。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
赵帅,权海杰,金泰,金志华,刘hs,朴焕明,朴永华,金世杰。重组新城疫病毒疫苗株的鉴定。临床免疫。2008;15:1572-9。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2Ba谷歌学者gydF4y2Ba
顾敏,刘伟,徐磊,曹勇,姚超,胡松,刘霞。新城疫病毒血凝素-神经氨酸酶基因的阳性选择及其对疫苗效力的影响。病毒J. 2011;8:150。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
Mebatsion T, Verstegen S, De Vaan LT, Romer-Oberdorfer A, Schrier CC.一种低表达V蛋白的重组新城疫病毒对鸡胚具有免疫原性和致病性。中国病毒学杂志2001;75:420-8。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
Karsunke J, Heiden S, Murr M, Karger A, Franzke K, Mettenleiter TC, Romer-Oberdorfer A. W蛋白在新城疫病毒中的表达。病毒决议2019;263:207-16。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
Goldhaft TM。新城疫病病毒LaSota毒株起源的历史记录。鸟类疾病,1980;24:297-301。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
Miller PJ, Estevez C, Yu Q, Suarez DL, King DJ。用野生型和重组病毒配制的新城疫灭活疫苗接种后病毒脱落的比较鸟类疾病,2009;53:39-49。gydF4y2Ba
文章gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
胡松,马红,吴勇,刘伟,王旭,刘勇,刘霞。反向遗传学制备新城疫病毒减毒基因型7型候选疫苗。疫苗。2009;27:904-10。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
刘敏敏,程建林,于晓华,秦志明,田福林,张广志。基于中国流行的高毒力毒株的新城疫病毒减毒疫苗的反向遗传生成。生物技术,2015;37:1287-96。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
季米特洛夫公里,Abolnik C,阿方索CL,阿宾娜E,巴尔J, Berg M, Briand外汇,布朗IH崔KS, Chvala我,一昼夜的DG,·杜尔PA,费雷拉霍奇金淋巴瘤,Fusaro,吉尔P, Goujgoulova问,浅滩C,希克斯JT, Joannis TM, Torchetti可,Kolosov年代,Lambrecht B,刘易斯NS,刘H, H,麦卡洛,米勒PJ, Monne我,穆勒CP,姆尼尔M, Reischak D,拉M, Samal SK, Servan de Almeida R,随着我,Snoeck CJ,苏亚雷斯DL,范还是婚后,王Z,黄西FYK。更新了统一的系统发育分类系统,修订了新城疫病毒的命名法。感染Genet Evol. 2019;74:103917。gydF4y2Ba
文章gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
杜晓东,刘志刚,刘志刚,刘志刚。禽副粘病毒1(新城疫病毒)的时间、地理和宿主分布。《感染Genet Evol》2016;39:22-34。gydF4y2Ba
文章gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
Diel DG, da Silva LH, Liu H, Wang Z, Miller PJ, Afonso CL。禽副粘病毒1型的遗传多样性:新城疫病病毒基因型统一命名和分类体系的建议。《感染Genet Evol》2012;12:1770-9。gydF4y2Ba
文章gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
Xiao S, Nayak B, Samuel A, Paldurai A, Kanabagattebasavarajappa M, Prajitno TY, Bharoto EE, Collins PL, Samal SK。基于目前流行的高毒力印度尼西亚毒株,通过反向遗传生成有效、稳定、减毒新城疫病毒活疫苗。PLoS ONE。2012; 7: e52751。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
Alexender DJ。纽卡斯尔疾病。在:赛义夫YM,巴恩斯HJ,格里森JR,法德利AM,麦克道戈尔LR,斯威恩DE,编辑。家禽疾病。第11版。作者:爱荷华州立大学出版社;2003.p . 64 - 87。gydF4y2Ba
谷歌学者gydF4y2Ba
Miller PJ, Koch G.新城疫。在:Swayne DE, Glisson JR, McDougald LR, Nolan LK, Suarez DL, Nair V,编辑。家禽疾病。第13版。霍博肯:Wiley-Blackwell;2013.p . 89 - 138。gydF4y2Ba
谷歌学者gydF4y2Ba
Grund C, Steglich C, Huthmann E, Beer M, Mettenleiter TC, Romer-Oberdorfer A.禽副乳病毒-8免疫可减少同源APMV-8攻击后的病毒脱落,但不能预防新城疫。病毒学报,2014;11:179。gydF4y2Ba
文章gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
其他禽副粘病毒。在:Swayne DE, Boulianne M, Logue CM, McDougald L, Nair V, Suarez DL,等,编辑。家禽疾病。14版。纽约:Wiley-Blackwell, Inc;2020.ISBN: 9781119371168(精装本)。gydF4y2Ba
Lana DP, Snyder DB, King DJ, Marquardt WW。新城疫病毒和鸽副粘病毒1株分化单克隆抗体的研究鸟类疾病,1988;32:273-81。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
罗素PH,亚历山大DJ。新城疫病毒单克隆抗体检测的抗原性变异。阿奇·维罗尔,1983;75:243-53。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
王志强,王志强,王志强,等。新城疫病毒F蛋白单克隆抗体的抗原定位及功能分析。《病毒学杂志》1986;90:97-110。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
Alexander DJ, Manvell RJ, Kemp PA, Parsons G, Collins MS, Brockman S, Russell PH, Lister SA。单克隆抗体用于鉴定提交给国际参考实验室的禽副粘病毒1型(新城疫病毒)分离物。《鸟类病原学》1987;16:553-65。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
Iorio RM, Borgman JB, Glickman RL, Bratt MA。新城疫病毒血凝素-神经氨酸酶糖蛋白中和域内的遗传变异。中华病毒学杂志,1986;36 (p7): 1393-403。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
Iorio RM, Bratt MA。新城疫病毒单克隆抗体:HN糖蛋白4个表位的定位。《病毒学杂志》1983;48:44 - 50。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
Iorio RM, Glickman RL。新城疫病毒融合突变体与血凝素-神经氨酸酶单克隆抗体选择。中国病毒学杂志。1992;66:6626-33。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
Iorio RM, Glickman RL, Riel AM, Sheehan JP, Bratt MA。新城疫病毒HN糖蛋白7个重叠抗原位点的功能和中和谱:对某些位点的单克隆抗体可防止病毒附着。病毒决议1989;13:245-61。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
Iorio RM, Glickman RL, Sheehan JP。新城疫病毒血凝素-神经氨酸酶糖蛋白单克隆抗体的中和抑制融合。中华病毒学杂志,1992;43 (Pt 5): 366 - 366。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
Iorio RM, Syddall RJ, Sheehan JP, Bratt MA, Glickman RL, Riel AM。新城疫病毒血凝素-神经氨酸酶糖蛋白的中和图:由阻止受体识别的单克隆抗体识别的域。中国病毒学杂志,1991;gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
Gotoh B, Sakaguchi T, Nishikawa K, Inocencio NM, Hamaguchi M, Toyoda T, Nagai Y.新城疫病病毒血凝素-神经氨酸酶蛋白上三个抗原位点各自独特的结构特征。病毒学。1988;163:174 - 82。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
Srinivasappa GB, Snyder DB, Marquardt WW, King DJ。新城疫病毒常用疫苗株特异性单克隆抗体的分离。鸟类疾病,1986;30:562-7。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
李军,李志刚,李志刚。该单克隆抗体通常用于鉴定新城疫病毒的无毒毒株,该单克隆抗体与血凝素-神经氨酸酶蛋白羧基末端的表位结合,并识别单个中源和快速源毒株。中华微生物学杂志,2005;43:429 - 33。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
Moharam I, Razik AAE, Sultan H, Ghezlan M, Meseko C, Franzke K, Harder T, Beer M, Grund C.对埃及新城疫疑似疫情的调查发现,在小规模饲养场中,新城疫病毒快速生长负担高,且存在多种病原体。禽病原学,2019;48:406-15。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
Schroer D, Veits J, Grund C, Dauber M, Keil G, Granzow H, Mettenleiter TC, Romer-Oberdorfer A.新城疫病毒载体疫苗接种能保护鸡免疫高致病性H7禽流感病毒。鸟类传染病,2009;53:190-7。gydF4y2Ba
文章gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
EU/92/66/EEC,介绍共同体控制新城疫的措施。欧洲共同体正式公报1992年,1-20。gydF4y2Ba
肖邦作家。新城疫病毒包膜蛋白的分离纯化。中华病毒学杂志,1973;11:263-71。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
Fischer K, Diederich S, Smith G, Reiche S, Pinho Dos Reis V, Stroh E, Groschup MH, Weingartl HM, Balkema-Buschmann A.基于亨德拉和尼帕病毒蛋白的间接ELISA法检测猪亨德拉和尼帕病毒特异性抗体PLoS ONE。2018; 13: e0194385。gydF4y2Ba
文章gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba中科院gydF4y2Ba谷歌学者gydF4y2Ba
Hammond SA, Cook SJ, Lichtenstein DL, Issel CJ, Montelaro RC。马传染性贫血病毒持续感染马的细胞和体液免疫反应成熟是一个复杂而漫长的过程。中国病毒学杂志,1997;71:3840-52。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
王志强,王志强,王志强,等。酶联免疫吸附法检测HIV-1包膜糖蛋白抗体的研究进展[J] .中华免疫杂志,1990;gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
Reed LJ, Muench H.估算50%终点的简单方法。阿姆J海格。1938;27:49 - 549。gydF4y2Ba
谷歌学者gydF4y2Ba
外源免疫血清不完全中和卵中甲型流感病毒后的持续抗原变异。中华检验医学杂志,2000;26(2):344 - 344。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
Collins MS, Alexander DJ, Brockman S, Kemp PA, Manvell RJ。评价针对引起当前鸽子大流行的变异禽副粘病毒1型分离物的小鼠单克隆抗体。阿奇·维罗尔,1989;104:53-61。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
龙龙,李志刚,李志刚,李志刚。新城疫病毒血清凝集素-神经氨酸酶单克隆抗体的研究进展。中华病毒学杂志,1986;57:1198-202。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
Cox RM, Plemper RK。副粘病毒颗粒的结构和组织。中国医学杂志,2017;24:105-14。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
Battisti AJ,孟G, Winkler DC, McGinnes LW, Plevka P, Steven AC, Morrison TG, rosssmann MG。副粘病毒基质蛋白的结构和组装。美国国家科学研究院。2012; 109:13996 - 4000。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
Nishikawa K, Isomura S, Suzuki S, Watanabe E, Hamaguchi M, Yoshida T, Nagai Y.新城疫病毒HN糖蛋白单克隆抗体。生物特性和用于菌株比较。病毒学。1983;130:318-30。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
Pantua HD, McGinnes LW, Peeples ME, Morrison TG。新城疫病毒样颗粒的组装和释放要求。中国病毒学杂志2006;80:11062-73。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
李志强,李志强,李志强,等。多功能副粘病毒血凝素-神经氨酸酶的晶体结构。生物工程学报,2000;7:1068-74。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
Ryan C, Zaitsev V, Tindal DJ, Dyason JC, Thomson RJ, Alymova I, Portner A, von Itzstein M, Taylor G.新城疫病病毒血凝素-神经氨酸酶复合物抑制剂的结构分析。植物学报,2006;23:135-41。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
袁P, Swanson KA, Leser GP, Paterson RG, Lamb RA, Jardetzky TS.新城疫病毒血凝素-神经氨酸酶(HN)外膜结构显示四螺旋束茎。中国科学院学报(自然科学版)2011;gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
Jitsukawa T, Nakajima S, Sugawara I, Watanabe H. ELISA包衣后抗原包衣效率提高,原始抗原结构保存。中华免疫杂志,1989;16:516 - 516。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
Brennand DM, Danson MJ, Hough DW。抗可溶性蛋白抗原单克隆抗体的ELISA筛选方法比较。中华免疫杂志1986;93:9-14。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
杜晓明,李志强,李志强,等。番茄花叶病毒单克隆抗体的结构特异性研究。阿奇·维罗尔,1987;94:191-203。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba