菌株
用于测定的标准菌株为HHV-6 (U1102 A型菌株和Z29 B型菌株)、HHV-7 (RK菌株)、HHV-8 (GK菌株)标准菌株;美国马里兰州)。利用这些标准菌株获得重组质粒,并检测引物和探针的特异性。
此外,从湖北省疾病预防控制中心(HBCDC,武汉,湖北,中国)获得的人类巨细胞病毒和单纯疱疹病毒1/2 (HSV-1/2)标准株作为阴性对照。
由于国内有少数研究机构关注HHV-6、7、8,我们从标准株中扩增出了HHV-6、-7、-8的特异性靶基因片段。我们在10处处理HHV-6、7和8质粒6浓度作为阳性对照。转染和转化过程已简单提到下面。利用这三种质粒检测多重实时PCR检测方法的重复性。
临床标本标本采集
2019年8月至12月,在湖北省中医院献血中心采集了74名献血者的血液样本。此外,本研究还收集了另外45份疑似感染PR的成年人的血液样本。根据纳入标准选择患者(躯干或四肢皮肤病变,可能是一个2±1厘米椭圆形鳞状斑块,中心区域为鲑鱼色或许多更小的区域[14],椭圆形,红斑,鳞片状,轻微瘙痒斑)。
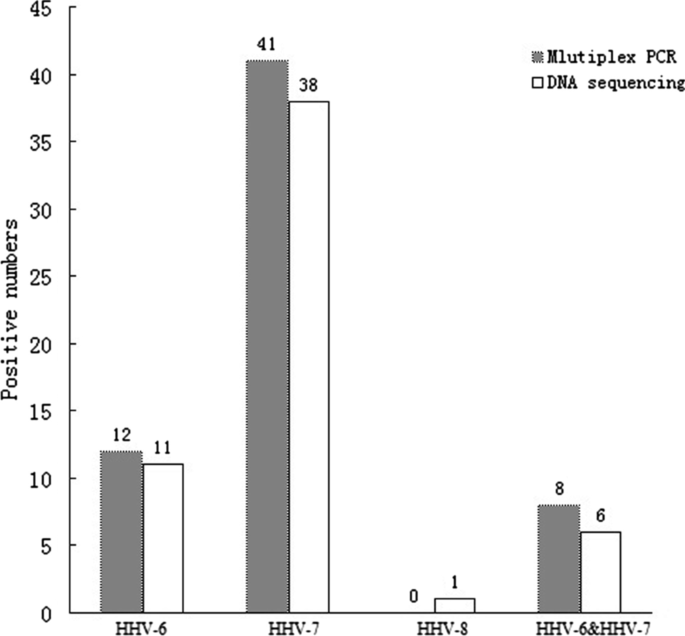
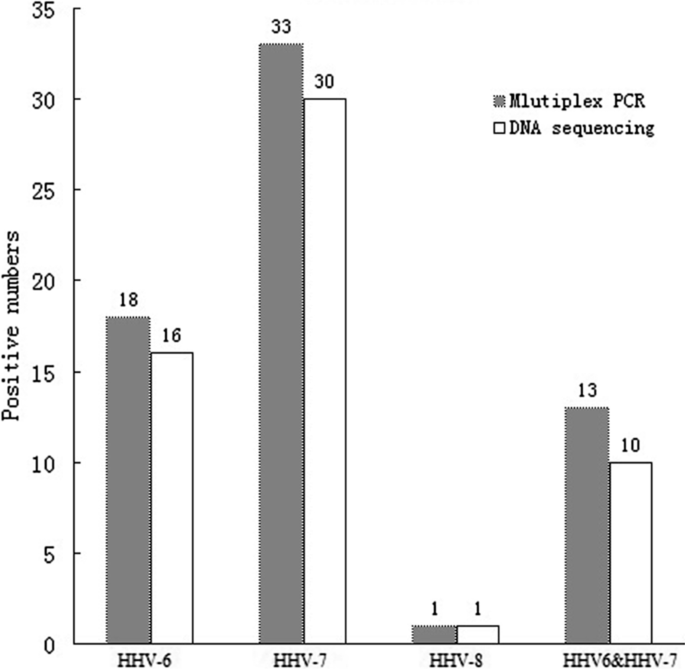
这项前瞻性研究总共对119份血液样本进行了研究(74份来自献血者,45份来自疑似PR感染的患者)。所有参与者都签署了研究知情同意书。所有的血液样本都储存在含有柠檬酸钠作为抗凝血剂的试管中。
为了避免溶血对DNA提取的影响,我们没有将全血低温保存。作为替代方法,DNA被立即提取,然后存储在−70°C。
DNA提取
为了避免样本间的污染,我们采取了特别的保护措施:DNA提取和处理使用了不同的房间和专用设备。此外,在PCR设置和分析中,所有移液管尖端都有气溶胶保护过滤器。
从每个全血样本中抽取一毫升来提取DNA模板。根据制造商的协议,使用QIAamp DNA血液迷迪试剂盒(QIAGEN,上海,中国)进行DNA提取。血液样本红细胞压积均在正常范围内(男性0.40 ~ 0.50,女性0.37 ~ 0.45)。使用QIAamp 96病毒试剂盒(QIAGEN, Shanghai, China)提取HHV-6、7和8标准株的病毒DNA。
提取后,用50 μl无菌水悬吊DNA。最后将DNA保存于-70℃,待PCR检测。
引物和探针
根据以往的研究[15,16]、U67、U36、ORF65分别作为HHV-6、7、8的靶基因。从NCBI GenBank序列数据库下载HHV-6A和HHV-6B的U67序列、HHV-7的U36序列和HHV-8的ORF65序列(http://www.ncbi.nlm.nih.gov)。
用于HHV-6、7和8的引物和TaqMan-LNA探针使用信标设计器(PREMIER Biosoft International, Palo Alto, CA)设计。虽然HHV-6、7和8是外源基因,但仍然选择人CCR5基因作为“管家”基因进行扩增,并作为内部控制来确保每个样本中提取的DNA的质量和PCR的适用性。根据布罗克罗的报告[17],正向引物5 ' -CAAAGCCAATTATCCAGAGCG-3 ',反向引物5 ' - cgctggttgaggatgcga -3',探针5 ' -6FAM-TACGCAACGC CAACAGACCTAGCGA-BHQ-3'。
HHV-6、7和8引物和TaqMan-LNA探针(表21)由上海生工生物技术有限公司(中国上海)合成。通过BLAST搜索数据库(http://blast.ncbi.nlm.nih.gov/)。没有发现显著的相似性。
重组质粒
从上海生工获得HHV-6、7、8质粒(分别含有76 bp U67扩增子、147 bp U36扩增子和108 bp ORF65扩增子)和CCR5质粒(含有133 bp CCR5扩增子)。
利用上述质粒构建HHV-6、7、8的单次实时PCR和多重实时PCR标准曲线。人CCR5基因的质粒在每次实验中都被扩增,表明在核酸扩增反应和HHV-6、7和8病毒载量的正常化过程中没有发生完全抑制。
单次实时PCR
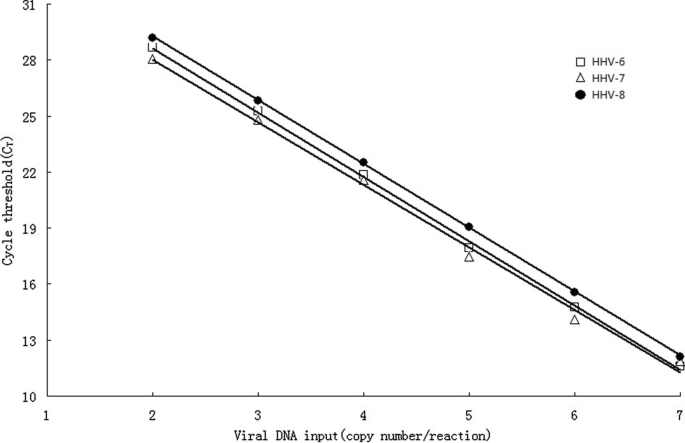
为了扩大和量化质粒,我们准备了称职的大肠杆菌DH5α,质粒在其中繁殖。使用QIAamp质粒Midi Kit纯化了4个质粒(HHV-6、7、8和CCR5),并使用紫外分光光度计测量光密度(OD)260进行定量(SHIMADZU, Tokyo, Japan)。用6.02 × 10计算提取质粒的拷贝数23(张/摩尔)×A260 (ng / ml)÷(DNA长度×660)=拷贝/毫升。质粒从1 × 10稀释10倍7到102以拷贝数/μl作为检测限,建立标准曲线。每个稀释剂(5 μl)也加入到单个实时PCR反应混合物中。
为排除PCR过程中污染的可能性,阳性对照(106HHV-6、7、8的拷贝/孔质粒)、阴性对照(从HSV-1、2、CMV和无菌水中提取的DNA)和1 × 10的标准DNA7到102在每个实验中扩增副本/反应。
为了优化PCR条件,每个试剂的浓度应归一化(表2)。优化反应条件后,在相应条件下对每种病毒进行PCR。将提取的DNA (5 μl)加入到反应混合物中,使最终反应体积为50 μl。每个样本都对每种病毒进行了重复分析。
退火温度分别为55、58、61、64℃,退火时间分别为25、30、35、40、45、50 s。最佳循环条件为94°C 10 min, 94°C 30 s, 58°C 40 s,循环40次。结果以每毫升全血的基因组当量拷贝数(EqCop)表示。
多重实时PCR
标准DNA为1 × 107到102每个反应混合副本,并用于构建标准曲线。同样,阴性对照(从HSV-1、2、HCMV和无菌水中提取的DNA)在每个实验中每5个样本进行扩增,包括除标准DNA样本外的所有试剂。
根据单次PCR优化结果,采用PCR (1 ×)缓冲液,4 mM MgCl,反应体积为50 μl,进行多重实时PCR2、0.48 mM脱氧核苷酸混合物、0.5 U Hotstart Taq DNA聚合酶、0.29 μM HHV-6引物、0.29 μM HHV-7引物、0.31 μM HHV-8引物、0.24 μM HHV-6探针、0.26 μM HHV-7探针、0.24 μM HHV-8探针和5 μl DNA模板。
为了最终计算DNA拷贝数,我们生成了已知数量的标准曲线(102到107从HHV-6(变异株A U1102和变异株B Z29)、7株(RK株)、8株(GK株)中分离并定量。每个点重复三次,并重复每个点的标准曲线。每个样本和病毒的DNA拷贝数的最终计算由ABI Prism 7500仪器提供的软件进行。
DNA测序
根据S.Yalcin的描述[18],采用巢式PCR扩增HHV-6 DNA,基本如前所述。设计PCR扩增HHV-6的IE (U90)区域。第一次PCR引物为5 ' -TTCTCCAGATGTGCCAGGGAAATCC-3 '和5 ' -CATCATTG TTATCGCTTTCACTCTC-3 '。第二次PCR引物为5 ' - AGTGACAGATCTGGGC GGCCCTGATAACTT-3 '和5 ' - aggtgctgagtgatcagtttcataaccaaa -3 '。PCR产物大小分别为506 bp(第一次)和363 bp(第二次)。每个样品(5 μl)加入45 μl含有32.5 μl无菌水、5 μl KOD缓冲液、0.2 mM脱氧核苷酸混合物、200 nM引物和1.25 U KOD DASH DNA聚合酶(Promega, Madison, WI)的反应混合物中。第一个PCR循环条件为94°C持续6 min,然后在94°C持续30 s, 62°C持续5 s, 72°C持续15 s进行30个循环扩增。条件与第一次PCR相同,只是使用了内部引物。
根据Yalcin的描述[18],采用巢式PCR扩增HHV-7 DNA。设计PCR扩增HHV-7主要衣壳蛋白基因。首次PCR引物为5 ' -AGTTCCAGCACTGCAATCG-3 '和5 ' -CACAAAAGCGT CGCTATCAA-3 '。第二次PCR引物为5 ' -CGCATACACCAACCCTACTG-3 '和5 ' - gactcattatggggatcgc -3 '。每个样品(5 μl)加入含有32.5 μl无菌水、5 μl KOD缓冲液、0.2 mM脱氧核苷酸混合物、200 nM引物和1.25 U KOD DASH的反应混合物45 μl中。第一个PCR循环条件为94℃6 min,然后在94℃30 s, 60℃5 s, 72℃16 s下扩增30个循环。用内引物进行第二轮40个循环。
根据Tisdale等人的描述[19],采用巢式PCR扩增HHV-8 DNA,基本如前所述。设计PCR扩增HHV-8的ORF 75区。首次PCR引物为5 ' - tattcgcggccttggcaac -3 '和5 ' - aagatgcgca CCGCGTTGTC-3 '。第二次PCR引物为5 ' - acgtacagcaggccgagatg -3 '和5 ' - GGAGCTGTCGCGATAGAGGT-3 '。每个样品(5 μl)加入含有32.5 μl无菌水、5 μl KOD缓冲液、0.2 mM脱氧核苷酸混合物、200 nM引物和1.25 U KOD DASH的反应混合物45 μl中。第一个PCR循环条件为94°C持续6 min,随后在94°C持续30 s, 66°C持续8 s, 72°C持续15 s进行40次扩增循环。第二个PCR循环条件为94°C, 6 min,然后在94°C, 30 s, 59°C,和72°C, 12 s,扩增40个循环。
用0±8%琼脂糖凝胶电泳和溴化乙锭染色对PCR产物进行分辨和目视检测。HHV-6、7和8的扩增产物长度分别为423、264和245 bp。HHV-6、7、8 DNA PCR产物及相应内正向引物由生工提供。单方向DNA测序。使用Mega 3.1软件(Mega software, Tempe, AZ, USA)对序列进行校准、检查并纠正分析仪可能的错误。在NCBI Blast项目中与GeneBank数据库中的参考菌株进行了比较。
统计分析
基于HHV-6、-7、-8质粒标准曲线跨度107到102拷贝数,计算病毒载量,以拷贝数/ml表示。使用ABI PRISM 7500提供的软件计算标准曲线的相关系数(R)值。使用SPSS 16.0统计软件包(SPSS Inc., Chicago, USA)计算该检测方法的临床敏感性、特异性、绝对一致性和kappa值、标准的变异系数以及多重和单一实时PCR检测病毒载量之间的相关性。所有测试均在5%显著性水平下进行。由于样本量有限,仅提供描述性统计。