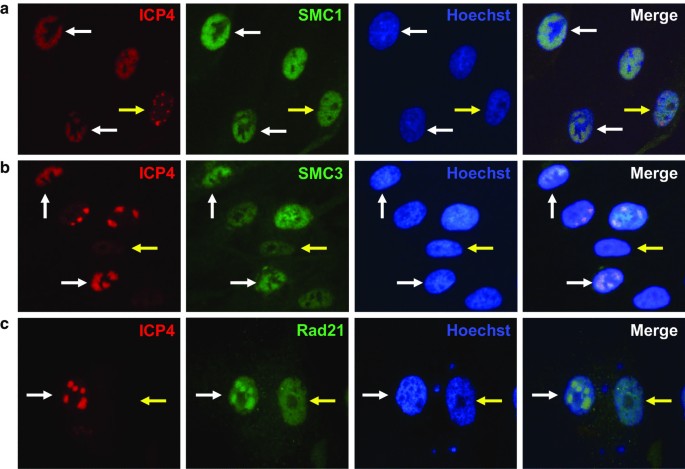
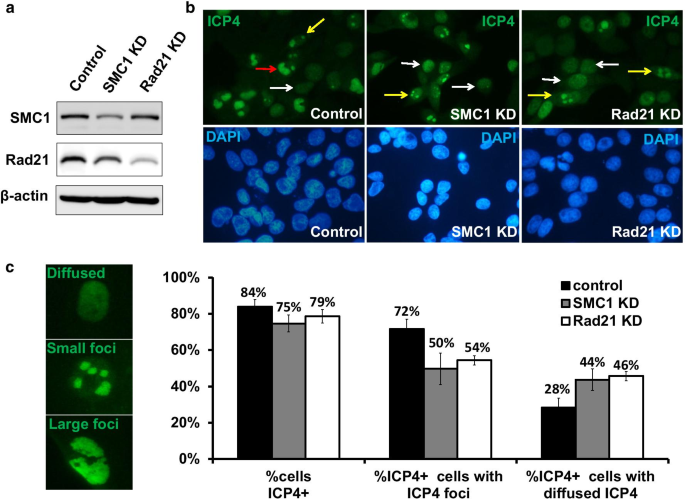
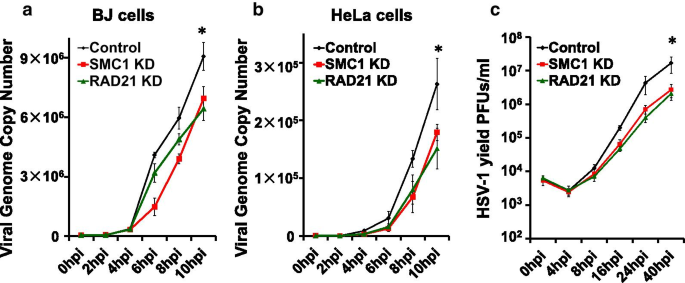
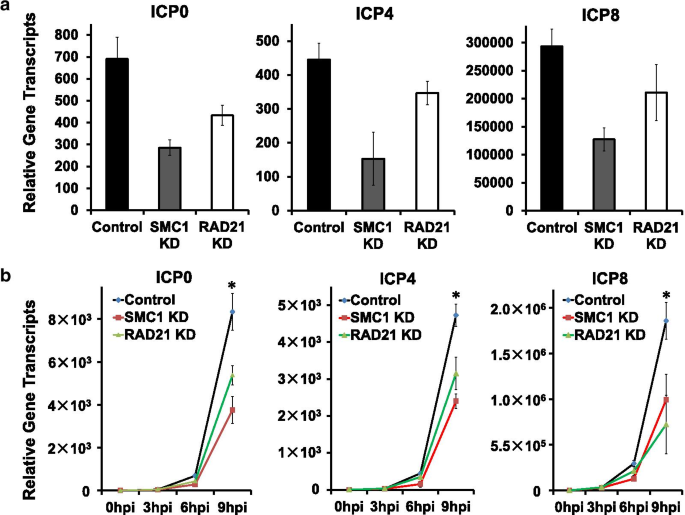
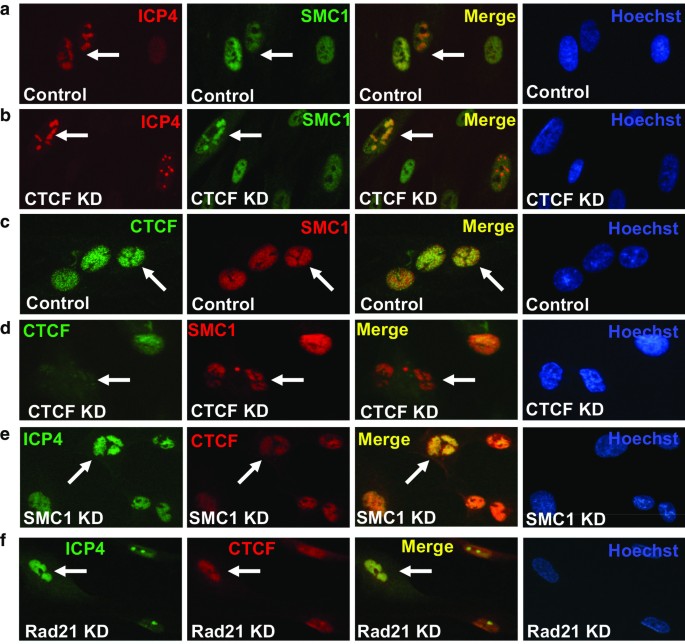
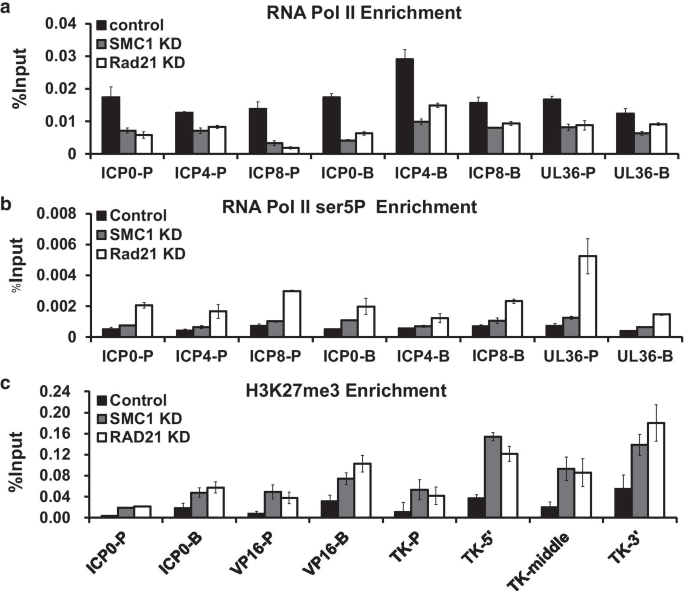
李丽娟,李丽娟,李丽娟。单纯疱疹病毒。临床感染杂志,1998;26:541-53gydF4y2Ba测试554 - 545gydF4y2Ba).gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
Fraser KA, Rice SA。单纯疱疹病毒即早蛋白ICP22触发丝氨酸2磷酸化RNA聚合酶II的丢失。中国病毒学杂志,2007;81:5091-101。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
巴斯蒂安TW,赖斯SA。单纯疱疹病毒1型ICP22中影响RNA聚合酶II修饰和病毒晚期基因表达的序列鉴定中国病毒学杂志,2009;83:128-39。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
Ou M, Sandri-Goldin RM。在单纯疱疹病毒1感染期间抑制cdk9阻碍病毒转录。PLoS ONE。2013; 8: e79007。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
Oh J, Ruskoski N, Fraser NW。单纯疱疹病毒1 DNA溶出感染早期染色质组装依赖于Asf1a。中国病毒学杂志,2012;86:12313-21。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
陈志伟,曾佩萍,陈志伟,陈志伟。单纯疱疹病毒1型裂解感染过程中组蛋白的表达与转录活性相关。中国病毒学杂志,2004;78:10178-86。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
黄娟,王志刚,王志刚,王志刚,王志刚。单纯疱疹病毒1型溶出感染中组蛋白H3.3基因表达的调控。中国病毒学杂志,2009;83:1416-21。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
单纯性疱疹病毒溶性和潜伏性感染的染色质控制。微生物学报。2008;6:21 - 21。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
李志刚,李志刚。单纯疱疹病毒1型溶解感染过程中染色质的动态变化。生物化学学报,2010;(4):344 - 344。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2Ba谷歌学者gydF4y2Ba
内聚物的作用与机制。2009; 43:525-58。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
Dorsett D, Merkenschlager M.活性基因的内聚蛋白:从模式生物到人类的内聚蛋白和基因表达的统一主题。中国生物医学工程学报。2013;25:27 - 33。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
梅塔K,古纳塞哈兰V, Satsuka A,莱明斯LA。人乳头瘤病毒通过与CTCF绝缘体结合,激活和招募SMC1内聚蛋白,进行分化依赖的生命周期。Plos Pathog. 2015;11:e1004763。gydF4y2Ba
文章gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
Li DJ, Verma D, Mosbruger T, Swaminathan S. CTCF和Rad21通过调节病毒基因转录,成为卡波西肉瘤相关疱疹病毒(KSHV)溶酶复制的宿主细胞限制因子。Plos Pathog. 2014;10:e1003880。gydF4y2Ba
文章gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
Arvey A, Tempera I, Tsai K, Chen HS, Tikhmyanova N, Klichinsky M, Leslie C, Lieberman PM。爱泼斯坦-巴尔病毒转录组和表观基因组的图谱揭示了宿主-病毒调控相互作用。细胞宿主微生物。2012;12:233-45。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
De Leo A, Chen HS, Hu CC, Lieberman PM。er应激和caspase依赖的rad21裂解对KSHV潜伏期构象的调控。公共科学图书馆,2017;13:e1006596。gydF4y2Ba
文章gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
陈hs, Wikramasinghe P, Showe L, Lieberman PM。内聚蛋白在潜伏期抑制卡波西肉瘤相关疱疹病毒的即时早期基因转录。中国病毒学杂志,2012;86:9454-64。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
陈海峰,陈海峰,陆飞,吕佩兰,穆勒JM, Lieberman PM, Tempera I. Epstein-Barr病毒LMP1/LMP2位点突变的表观遗传调控。中国生物防治杂志,2014;88:1703-13。gydF4y2Ba
文章gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
郎峰,李霞,郑伟,李忠,陆东,陈刚,龚东,杨玲,付军,石鹏,周娟。CTCF通过促进同源重组定向DNA双链断裂修复来防止基因组不稳定性。中国自然科学(英文版),2017;gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
Arzate-Mejia RG, Recillas-Targa F, Corces VG。三维发育:CTCF在细胞分化中的作用。发展。2018;145:dev137729。gydF4y2Ba
文章gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
陈强,林琳,周娟,黄娟,Berger SL,周娟。单纯疱疹病毒1型基因组中潜伏期相关转录本与ICP0启动子之间的ctcf依赖染色质边界元。中国病毒学杂志,2007;81:5192-201。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
Hansen AS, Pustova I, Cattoglio C, Tjian R, Darzacq x。Elife。2017;6:e25776。gydF4y2Ba
文章gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
Zuin J, Dixon JR, van der Reijden MI, Ye Z, Kolovos P, Brouwer RW, van de Corput MP, van de Werken HJ, Knoch TA, van IJcken WF,等。内聚蛋白和CTCF对人类细胞染色质结构和基因表达有不同的影响。中国科学院学报(自然科学版),2014;gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
Rao SSP, Huang SC, Glenn St Hilaire B, Engreitz JM, Perez EM, Kieffer-Kwon KR, Sanborn AL, Johnstone SE, Bascom GD, Bochkov ID,等。内聚蛋白的丢失消除了所有环域。细胞。2017;171:305-20。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
辛建平,曼利JL。RNA聚合酶II CTD协调转录和RNA加工。基因开发2012;26:2119-37。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
Michaelis C, Ciosk R, Nasmyth K.内聚蛋白:防止姐妹染色单体过早分离的染色体蛋白。细胞。1997;91:35-45。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
Kagey MH, Newman JJ, Bilodeau S, Zhan Y, Orlando DA, van Berkum NL, Ebmeier CC, Goossens J, Rahl PB, Levine SS,等。中介和内聚蛋白连接基因表达和染色质结构。大自然。2010;467:430-5。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
郭颖,Monahan K,吴hy, Gertz J, Varley KE, Li W, Myers RM, Maniatis T,吴强。CTCF/内聚物介导的DNA环是原钙粘蛋白α启动子选择的必要条件。自然科学进展(英文版)。2012;gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
Hadjur S, Williams LM, Ryan NK, Cobb BS, Sexton T, Fraser P, Fisher AG, Merkenschlager M.内聚蛋白在发育调控IFNG位点形成染色体顺式相互作用。大自然。2009;460:410-3。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
Parelho V, Hadjur S, Spivakov M, Leleu M, Sauer S, Gregson HC, Jarmuz A, Canzonetta C, Webster Z, Nesterova T,等。内聚蛋白在哺乳动物染色体臂上与CTCF功能相关。细胞。2008;132:422-33。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
Wendt KS, Yoshida K, Itoh T, Bando M, Koch B, Schirghuber E, Tsutsumi S, Nagae G, Ishihara K, Mishiro T,等。内聚蛋白通过cctc结合因子介导转录隔离。大自然。2008;451:796 - 801。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba谷歌学者gydF4y2Ba
Schwarzer W, Abdennur N, Goloborodko A, Pekowska A, Fudenberg G, Loe-Mie Y, Fonseca NA, Huber W. C HH, Mirny L, Spitz F:内聚蛋白去除揭示的两种独立染色质组织模式。大自然。2017;551:51-6。gydF4y2Ba
文章gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
Stedman W, Kang H, Lin S, Kissil JL, Bartolomei MS, Lieberman PM。内聚蛋白与CTCF一起定位于KSHV潜伏期控制区和细胞c-myc和H19/Igf2绝缘体。Embo j . 2008; 27:654-66。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
姜H, Wiedmer A,袁Y, Robertson E, Lieberman PM。ctcf -内聚蛋白介导的KSHV潜伏基因和溶出基因调控的协调。公共科学图书馆,2011;7:e1002140。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
郎方富,李霞,Vladimirova O,胡宝霞,陈国杰,肖燕,辛格V,卢东峰,李汉华,韩海波,等。CTCF与可溶性HSV-1基因组相互作用促进病毒转录。科学通报2017;7:1-15。gydF4y2Ba
文章gydF4y2Ba谷歌学者gydF4y2Ba
郎方富,李旭,Vladmirova O,李志荣,陈国军,肖燕,李汉林,卢东峰,韩海波,周建民。HSV-1复制中心选择性招募宿主因子。东武学言九。2015;36:142-51。gydF4y2Ba
中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
阿梅里奥AL,麦克纳尼PK,布鲁姆DC。单纯疱疹病毒1型潜伏期相关转录区域中的染色质绝缘体样元件与ccctc结合因子结合,并显示增强子阻断和沉默活性。中国病毒学杂志2006;80:2358-68。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
Washington SD, Musarrat F, Ertel MK, Backes GL, Neumann DM.单纯疱疹病毒1基因组中的CTCF结合位点显示了位点特异性的CTCF占据、蛋白募集和绝缘体功能。中国病毒学杂志,2018;92:e00156。gydF4y2Ba
文章gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
李志军,李志军,潘德龙,陈志军,陈志军。ccctc结合因子在单纯疱疹病毒潜伏染色质上的异染色质屏障作用及其与稳定潜伏感染的关系。Mbio。2018;9:e02372。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
Dembowski JA, DeLuca NA。核因子的选择性招募以有效复制单纯疱疹病毒基因组。公共科学图书馆,2015;11:e1004939。gydF4y2Ba
文章gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
多塞特D,斯特罗姆L.内聚蛋白在基因表达和DNA修复中的古老和不断发展的作用。生物学报。2012;22:R240-250。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
Schaaf CA, Kwak H, Koenig A, Misulovin Z, Gohara DW, Watson A, Zhou YJ, Lis JT, Dorsett D.内聚蛋白对RNA聚合酶II活性的全基因组调控。PLoS Genet, 2013;9:e1003382。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
王珊珊,王凯,林荣,郑春。单纯疱疹病毒1丝氨酸/苏氨酸激酶US3过度磷酸化IRF3并抑制β -干扰素的产生。中国病毒学杂志,2013;gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
Showalter SD, Zweig M, Hampar B.抗单纯疱疹病毒1型蛋白,包括即早蛋白ICP 4的单克隆抗体。《感染Immun》1981;34:684-92。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
Everett RD, Sourvinos G, Leiper C, Clements JB, Orr A.单纯疱疹病毒1型调控蛋白ICP4在感染早期核灶的形成:ICP27的定位、动态、募集,以及nd10样复合物重新诱导的证据。中国病毒学杂志,2004;78:1903-17。gydF4y2Ba
文章gydF4y2Ba中科院gydF4y2BaPubMedgydF4y2Ba公共医学中心gydF4y2Ba谷歌学者gydF4y2Ba
Hartig SM。ImageJ的基本图像分析和操作。中国生物医学工程学报,2013;gydF4y2Ba
文章gydF4y2Ba谷歌学者gydF4y2Ba