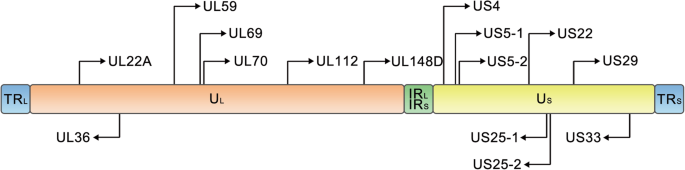
人巨细胞病毒基因产物的功能注释:最新进展。前沿微生物。2014;5:218。
PubMed公共医学中心谷歌学者
Fattuoni C, Palmas F, Noto A, Barberini L, Mussap M, Grapov D, Dessi A, Casu M, Casanova A, Furione M,等。从经典数据到代谢组学的孕期原发性HCMV感染:一项探索性分析临床化学学报2016;460:23-32。
文章中科院PubMed谷歌学者
格里菲思P,巴拉尼亚克I,李维斯M.人类巨细胞病毒的发病机制。中华病理学杂志,2015;
文章中科院PubMed谷歌学者
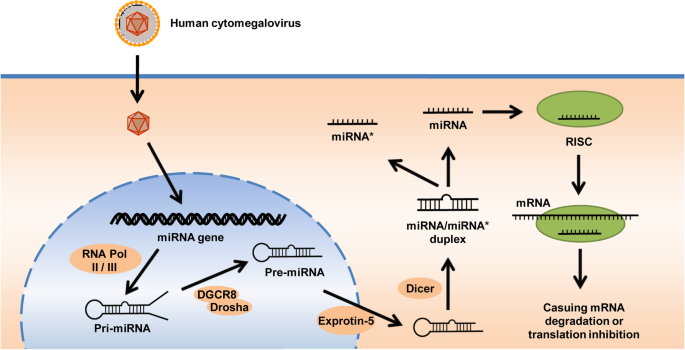
李,范鲍姆,安伯龙。秀丽隐杆线虫异长基因lin-4编码与lin-14反义互补的小rna。细胞。1993;75:843-54。
文章中科院PubMed谷歌学者
Kozomara A, Birgaoanu M. griffith - jones S: miRBase:从microRNA序列到功能。核酸研究,2019;47:D155-62。
文章中科院PubMed谷歌学者
卡伦BR。病毒microRNAs的病毒和细胞信使RNA靶标。大自然。2009;457:421-5。
文章中科院PubMed公共医学中心谷歌学者
李志强,李志强,李志强,等。小表达rna编码基因的研究进展。科学。2001;294:853-8。
文章中科院PubMed谷歌学者
许俊华,李志强,李志强。MicroRNA臂转换的研究进展。EMBO代表2011;12:172-7。
文章中科院PubMed公共医学中心谷歌学者
Pfeffer S, A, Lagos-Quintana M, Sheridan R, Sander C, Grasser FA, van Dyk LF, Ho CK, Shuman S, Chien M,等。疱疹病毒家族microrna的鉴定。自然科学学报。2005;2:269-76。
文章中科院PubMed谷歌学者
李志强,李志强,李志强,等。HCMV和HIV-1 MicroRNAs在病毒感染中的作用。前沿微生物,2017;8:689。
文章PubMed公共医学中心谷歌学者
Pfeffer S, Zavolan M, Grasser FA, Chien M, Russo JJ, Ju J, John B, Enright AJ, Marks D, Sander C, Tuschl T.病毒编码microrna的鉴定。科学。2004;304:734-6。
文章中科院PubMed谷歌学者
格兰霍夫A,沙利文CS。病毒编码小分子核糖核酸。病毒学。2011;411:325-43。
文章中科院PubMed谷歌学者
卡伦BR。疱疹病毒microrna:表型和功能。《中国医学杂志》2011;1:21 - 5。
文章中科院PubMed公共医学中心谷歌学者
Stern-Ginossar N, Saleh N, Goldberg MD, Prichard M, Wolf DG, Mandelboim O.感染期间人类巨细胞病毒编码的microRNA活性分析。中国病毒学杂志,2009;83:10684-93。
文章中科院PubMed公共医学中心谷歌学者
Lee SH, Kalejta RF, Kerry J, Semmes OJ, O'Connor CM, Khan Z, Garcia BA, Shenk T, Murphy E. BclAF1限制因子在人巨细胞病毒感染过程中被蛋白酶体降解和microRNA抑制中和。自然科学进展(英文版)。2012;
文章中科院PubMed公共医学中心谷歌学者
Nachmani D, Stern-Ginossar N, Sarid R, Mandelboim O.多种疱疹病毒microrna靶向应激诱导的免疫配体MICB以逃避自然杀伤细胞的识别。细胞宿主微生物。2009;5:376-85。
文章中科院PubMed谷歌学者
Stern-Ginossar N, Elefant N, Zimmermann A, Wolf DG, Saleh N, Biton M, Horwitz E, Prokocimer Z, Prichard M, Hahn G,等。宿主免疫系统基因靶向病毒miRNA。科学。2007;317:376 - 81。
文章中科院PubMed公共医学中心谷歌学者
Grey F, Meyers H, White EA, Spector DH, Nelson J.人巨细胞病毒编码的microRNA调节参与复制的多种病毒基因的表达。PLoS Pathog. 2007;3:e163。
文章PubMed公共医学中心中科院谷歌学者
黄勇,齐勇,阮强,马勇,何瑞,季勇,孙哲。一种快速筛选已知microRNA的mRNA靶点的方法。杨晓明,2011;8:8。
文章中科院PubMed公共医学中心谷歌学者
李松,朱军,张伟,陈勇,张凯,Popescu LM,马晓霞,刘伟文,荣荣,余旭,等。原发性高血压的特征microRNA表达谱及其与人类巨细胞病毒感染的新联系循环。2011;124:175 - 84。
文章中科院PubMed谷歌学者
Hook LM, Grey F, Grabski R, Tirabassi R, Doyle T, Hancock M, Landais I,郑s, McWeeney S, Britt W, Nelson JA。巨细胞病毒miRNAs靶向分泌途径基因,促进病毒粒子组装室的形成,减少细胞因子的分泌。细胞宿主微生物。2014;15:363-73。
文章中科院PubMed公共医学中心谷歌学者
金淑娟,李淑娟,张海红,张海白,金维宁,李松,安坤。人巨细胞病毒感染过程中microrna介导的宿主-病毒相互对话的时间格局。细胞宿主微生物,2015;17:838-51。
文章中科院PubMed谷歌学者
汉考克MH,胡克LM,米切尔J,纳尔逊JA。人巨细胞病毒MicroRNAs miR-US5-1和miR-UL112-3p通过直接下调IKKalpha和IKKbeta来阻断促炎细胞因子的产生,以响应nf - kapab激活因子。mBio。2017年,8。
黄艳,齐颖,马艳,何瑞,纪勇,孙志,阮强。hcmv-miR-UL36下调人巨细胞病毒UL138的基因表达。生物科学进展。2013;38:479-85。
文章中科院PubMed谷歌学者
Landais I, Pelton C, Streblow D, DeFilippis V, McWeeney S, Nelson JA。人巨细胞病毒miR-UL112-3p靶向TLR2并调节TLR2/IRAK1/NFkappaB信号通路。公共科学图书馆,2015;11:e1004881。
文章PubMed公共医学中心中科院谷歌学者
罗马尼亚P, Cifaldi L, Pignoloni B, Starc N, D'Alicandro V, Melaiu O, Li Pira G, Giorda E, Carrozzo R, Bergvall M,等。ERAP1氨基肽酶的遗传变异可阻止人巨细胞病毒mir - ul112 -5p介导的免疫逃避。Cell rep 2017; 20:846-53。
文章中科院PubMed谷歌学者
金艳,李珊珊,金珊,安志华,安坤。人巨细胞病毒临床株特异性microRNA miR-UL148D在感染过程中靶向人趋化因子RANTES。公共科学图书馆,2012;8:e1002577。
文章中科院PubMed公共医学中心谷歌学者
王亚萍,齐颖,黄玉军,齐明兰,马一萍,何锐,纪永华,孙志荣,阮强。直接早期基因X-1作为hcmv-mir-UL148D细胞靶基因的鉴定。中华药理学杂志,2013;31(2):359 - 366。
文章中科院PubMed谷歌学者
杨晓明,陈晓明,陈晓明,陈晓明,等。HCMV miR-UL70-3p和miR-UL148D在抑制细胞凋亡中的作用。生物化学学报,2014;
文章中科院PubMed谷歌学者
刘斌,李志刚,李志刚,李志刚。人巨细胞病毒MicroRNA MiR-UL148D在原发性髓细胞潜伏感染中的表达抑制激活素a引发的IL-6分泌。科学代表2016;6:31205。
文章中科院PubMed公共医学中心谷歌学者
Hancock MH, Crawford LB, Pham AH, Mitchell J, Struthers HM, Yurochko AD, Caposio P, Nelson JA。人巨细胞病毒miRNAs调节tgf - β介导骨髓抑制,同时维持CD34(+)造血祖细胞的病毒潜伏期。细胞宿主微生物。2020;27:04 - 114.e104。
文章PubMed中科院谷歌学者
Lisboa LF, Egli A, O'Shea D, Asberg A, Hartmann A, Rollag H, Pang XL, Tyrrell DL, Kumar D, Humar A. Hcmv-miR-UL22A-5p:移植中的生物标志物,对宿主基因表达和潜在的免疫意义有广泛影响。中华外科杂志,2015;
文章中科院PubMed谷歌学者
裴楚利,李志强,李志强,等。人巨细胞病毒编码的高尔基体局部潜伏决定因子的研究。中国病毒学杂志,2009;83:5615-29。
文章中科院PubMed公共医学中心谷歌学者
郭旭,黄艳,齐颖,刘志,马艳,邵艳,姜松,孙志,阮强。人巨细胞病毒miR-UL36-5p通过下调腺嘌呤核苷酸易位子3抑制培养细胞凋亡。中国生物医学工程学报,2015;
文章中科院PubMed谷歌学者
丁敏,王霞,王超,刘霞,曾凯,王伟,张春春,张晨。口腔扁平苔藓患者血浆中HCMV编码mirna的独特表达谱。中华医学杂志,2017;15:133。
文章PubMed公共医学中心中科院谷歌学者
金松,李松,申杰,金勇,Evnouchidou I,金丹,金玉凯,金叶,安志华,Riddell SR,等。人巨细胞病毒microRNA miR-US4-1通过靶向氨基肽酶ERAP1抑制CD8(+) T细胞反应。中华免疫杂志,2011;12:984-91。
文章中科院PubMed公共医学中心谷歌学者
邵艳,齐颖,黄艳,刘震,马艳,郭旭,姜松,孙智,阮强。人巨细胞病毒miR-US4-5p通过下调p21活化激酶2促进培养细胞凋亡。Mol Med rep 2017; 16:4171-8。
文章中科院PubMed谷歌学者
Tirabassi R, Hook L, Landais I, Grey F, Meyers H, Hewitt H, Nelson J.人类巨细胞病毒US7由两种病毒编码的microrna和两种不同的机制协同调控。中国病毒学杂志,2011;85:11938-44。
文章中科院PubMed公共医学中心谷歌学者
姜松,黄勇,齐勇,何瑞,刘震,马勇,郭旭,邵勇,孙泽,阮强。人巨细胞病毒miR-US5-1通过靶向Geminin mRNA抑制病毒复制。中国生物医学杂志,2017;32:431-9。
文章中科院PubMed公共医学中心谷歌学者
斯塔克TJ,阿诺德JD,斯佩克特DH,杨GW。人巨细胞病毒感染期间病毒和宿主小rna的高分辨率分析。中国病毒学杂志,2012;86:226-35。
文章中科院PubMed公共医学中心谷歌学者
Mikell I, Crawford LB, Hancock MH, Mitchell J, Buehler J, Goodrum F, Nelson JA。HCMV miR-US22下调EGR-1调控CD34+造血祖细胞增殖和病毒再激活。公共科学图书馆,2019;15:e1007854。
文章PubMed公共医学中心中科院谷歌学者
格雷F,提拉巴西R,梅耶斯H,吴G,麦克维尼S,胡克L,尼尔森JA。病毒microRNA通过mRNA 5' utr下调多个细胞周期基因。科学通报。2010;6:e1000967。
文章PubMed公共医学中心中科院谷歌学者
齐敏,齐勇,马勇,何锐,季勇,孙智,阮强。人巨细胞病毒miR-US25-2-3p过表达下调eIF4A1并抑制HCMV复制。FEBS Lett. 2013; 587:2266-71。
文章中科院PubMed谷歌学者
沈泽泽,潘霞,苗丽芬,叶海峰,Chavanas S, Davrinche C, McVoy M,罗卫明。人巨细胞病毒裂解和静止感染时microRNA表达的综合分析。PLoS One. 2014;9:e88531。
文章PubMed公共医学中心中科院谷歌学者
郭旭,齐颖,黄艳,刘震,马勇,邵毅,姜松,孙志,阮强。人巨细胞病毒miR-US33-5p通过下调宿主Syntaxin3的表达抑制病毒DNA合成和病毒复制。FEBS Lett. 2015; 589:440-6。
文章中科院PubMed谷歌学者
孟德松,李志强,李志强,等。人巨细胞病毒在CD34+骨髓祖细胞中的表达。中华病毒学杂志,1996;32 (Pt 12): 389 - 397。
文章中科院PubMed谷歌学者
李光,嘉密太平绅士人巨细胞病毒嗜细胞性的病毒调控中国病毒学杂志,2016;90:626-9。
文章中科院PubMed谷歌学者
Meshesha MK, Bentwich Z, Solomon SA, Avni YS。人巨细胞病毒(HCMV) microRNAs在潜伏期的体内表达。基因。2016;575:101-7。
文章中科院PubMed谷歌学者
潘超,朱东,王艳,李玲,李东,刘峰,张春春,禅坤。人巨细胞病毒miR-UL148D通过靶向宿主细胞立即早期反应基因5促进潜伏病毒感染。PLoS Pathog. 2016;12:e1006007。
文章PubMed公共医学中心中科院谷歌学者
Slobedman B, Mocarski ES。人巨细胞潜伏病毒的定量分析。中国病毒学杂志,1999;73:4806-12。
文章中科院PubMed公共医学中心谷歌学者
Iwuchukwu OC, Harvey JR, Dordea M, Critchley AC, Drew PJ。肿瘤整形治疗性乳房成形术在乳腺癌手术中的作用——综述。外科医生,2012;21:133-41。
文章中科院PubMed谷歌学者
陈娟,夏松,杨霞,陈海华,李峰,刘峰,陈卓。人巨细胞病毒miR-US25-1-5p编码减弱CD147/ emmprinn介导的早期抗病毒反应。病毒。2017;9。
付敏,高勇,周强,张强,彭勇,田凯,王娟,郑霞。人巨细胞病毒潜伏感染改变细胞和病毒microRNA表达。基因。2014;536:272-8。
文章中科院PubMed谷歌学者
人类巨细胞病毒潜伏期:接近死结。《年度Rev Virol》2016;3:33 - 57。
文章中科院PubMed公共医学中心谷歌学者
邓伟,唐鹏,钟强,杨娥,范贝尔C,刘峰。人巨细胞病毒在生产性病毒感染过程中表达新型microrna。细胞微生物学,2005;7:1684-95。
文章中科院PubMed谷歌学者
Meshesha MK, Veksler-Lublinsky I, Isakov O, Reichenstein I, Shomron N, Kedem K, zev - ukelson M, Bentwich Z, Avni YS。人巨细胞病毒(HCMV)的microRNA转录组。Open Virol J. 2012; 6:38-48。
文章中科院PubMed公共医学中心谷歌学者
汉考克MH,提拉巴西RS,尼尔森JA。巨细胞恒河病毒编码17种microrna,这些microrna在体内和体外有差异表达。病毒学。2012;425:133-42。
文章中科院PubMed谷歌学者
Buck AH, santoyoo - lopez J, Robertson KA, Kumar DS, Reczko M, Ghazal P.小鼠巨细胞病毒中病毒编码微rna的离散簇与基因组互补链和7.2千碱基稳定内含子相关。中国病毒学杂志,2007;81:13761-70。
文章中科院PubMed公共医学中心谷歌学者
葛蕾F, Antoniewicz A, Allen E, Saugstad J, McShea A, Carrington JC, Nelson J.人巨细胞病毒编码的microrna的鉴定和表征。中国病毒学杂志,2005;49:12095 - 9。
文章中科院PubMed公共医学中心谷歌学者
Stern-Ginossar N, Gur C, Biton M, Horwitz E, Elboim M, Stanietsky N, Mandelboim M, Mandelboim O.人类microrna调节由受体NKG2D介导的应激诱导免疫反应。中华免疫杂志,2008;9:1065-73。
文章中科院PubMed谷歌学者
Nachmani D, Lankry D, Wolf DG, Mandelboim O.人巨细胞病毒microRNA miR-UL112与细胞microRNA协同作用以逃避免疫消除。中华免疫杂志2010;11:806-13。
文章中科院PubMed谷歌学者
于丽萍,史丽丽,张明敏,王淑云,蔡娟,高明敏,熊伟,杨晓春:[MicroRNA在原发性高血压中的表达谱及发病机制初步研究]。中华新医学,2011;39:488-93。
中科院PubMed谷歌学者
黄艳,陈东,何娟,蔡娟,沈凯,刘霞,杨霞,徐玲。Hcmv-miR-UL112通过抑制I型干扰素分泌降低NK细胞活性。免疫杂志2015;163:151-6。
文章中科院PubMed谷歌学者
沈凯,徐磊,陈东,唐伟,黄艳。人巨细胞病毒编码的miR-UL112通过诱导血管内皮细胞功能障碍参与hcmv介导的血管疾病。病毒基因,2018;54:172-81。
文章中科院PubMed谷歌学者
墨菲E,范尼切克J,罗宾斯H,申克T,莱文AJ。疱疹病毒编码的microrna抑制即时早期病毒基因表达:对潜伏期的影响。中国科学院学报(自然科学版),2008;
文章中科院PubMed公共医学中心谷歌学者
Lau B, Poole E, Van Damme E, Bunkens L, Sowash M, King H, Murphy E, Wills M, Van lock M, Sinclair J.人巨细胞病毒miR-UL112-1在潜伏期期间促进病毒直接早期基因表达下调,以防止t细胞识别潜伏感染细胞。J Gen Virol, 2016; 97:2387-98。
文章中科院PubMed公共医学中心谷歌学者
Donlon TA, Krensky AM, Wallace MR, Collins FS, Lovett M, Clayberger C.人t细胞特异性基因RANTES (D17S136E)在染色体17q11.2-q12上的定位。基因组学。1990;6:548-53。
文章中科院PubMed谷歌学者
Maghazachi AA, Al-Aoukaty A, Schall TJ。CC趋化因子诱导CD56+细胞生成杀伤细胞。中华免疫杂志1996;26:315-9。
文章中科院PubMed谷歌学者
Goodrum F, Reeves M, Sinclair J, High K, Shenk T.在潜伏感染个体中表达的人巨细胞病毒序列促进体外潜伏感染。血。2007;110:937-45。
文章中科院PubMed公共医学中心谷歌学者
Naqvi AR, shano J, Seal A, Shukla D, Nares S.病毒miRNA改变宿主细胞miRNA谱并调节先天免疫反应。前沿免疫。2018;9:433。
文章PubMed公共医学中心中科院谷歌学者
Mohammad AA, Costa H, Landazuri N, Lui WO, Hultenby K, Rahbar A, Yaiw KC, Soderberg-Naucler C.人类巨细胞病毒microrna由病毒粒子和密集体携带并传递到靶细胞。中国病毒学杂志,2017;98:1058-72。
文章中科院PubMed公共医学中心谷歌学者
邵勇,齐勇,黄勇,刘震,马勇,郭鑫,姜松,孙智,阮强。人巨细胞病毒编码的miR-US4-1通过靶向QARS促进细胞凋亡并有利于感染性病毒颗粒的释放。中国生物工程学报,2016;
文章中科院PubMed谷歌学者
Caputo TM, Cummaro A, Lettera V, Mazzarotta A, Battista E, Netti PA, Causa F.一步可扩展荧光微凝胶生物检测内源性病毒miR-US4-5p的超灵敏检测分析师。2019;144:1369 - 78。
文章中科院PubMed谷歌学者
凋亡过程中caspase介导的PAK2激活:蛋白水解激酶激活是凋亡信号转导的一般机制?细胞死亡差异。1998;5:637-45。
文章中科院PubMed谷歌学者
Yurochko广告。人巨细胞病毒MicroRNAs否定感染的促炎反应的新机制mBio。2017年,8。
刘颖,潘杰,刘玲,李伟,陶瑞,陈勇,李红,尚山。HCMV感染对THP-1细胞自噬的影响。医学(巴尔的摩)。2017; 96: e8298。
文章中科院谷歌学者
Buehler J, Carpenter E, Zeltzer S, Igarashi S, Rak M, Mikell I, Nelson JA, Goodrum F.宿主信号和EGR1转录控制人类巨细胞病毒复制和潜伏期。公共科学图书馆,2019;15:e1008037。
文章PubMed公共医学中心中科院谷歌学者
Landgraf P, Rusu M, Sheridan R, A, Iovino N, Aravin A, Pfeffer S, Rice A, Kamphorst AO, Landthaler M,等。基于小RNA文库测序的哺乳动物microRNA表达图谱。细胞。2007;129:1401-14。
文章中科院PubMed公共医学中心谷歌学者
范军,张伟,刘强。人巨细胞病毒编码的miR-US25-1加重氧化低密度脂蛋白诱导的内皮细胞凋亡。Biomed Res Int. 2014;2014:531979。
PubMed公共医学中心谷歌学者
张震,康勇,张震,张宏,段鑫,刘娟,李霞,廖伟。人脂肪干细胞软骨形成过程中microrna的表达。骨关节炎。2012;20:1638-46。
文章中科院PubMed谷歌学者
Krutzfeldt J, Rajewsky N, Braich R, Rajeev KG, Tuschl T, Manoharan M, Stoffel M.体内用“antiagomirs”沉默microrna。大自然。2005;438:685-9。
文章PubMed中科院谷歌学者