摘要
背景
水禽bornavirus 1 (ABBV-1)与野生水禽的神经系统疾病有关。在加拿大,通过RT-qPCR和免疫组化技术,在有神经系统疾病史和中枢及周围神经组织炎症史的水禽组织中发现了ABBV-1,但发病机理实验尚未证实其因果关系。迄今为止,ABBV-1的体外表征仅限于原代鸭胚成纤维细胞的分离。本研究的目的是描述ABBV-1在原代鸭胚胎成纤维细胞(DEF)中的分离,并表征在DEF和三种永生化禽成纤维细胞细胞系(鸭CCL-141、鹌鹑QT-35、鸡DF-1)中的复制,以评估细胞的允许度并确定适合常规病毒繁殖的细胞系。
方法
对病毒进行了测序,并对N基因编码区的一段进行了系统发育分析。使用免疫荧光、RT-qPCR、western blotting和组织培养剂量50% (TCID)评估病毒在细胞培养中的传播、病毒RNA和蛋白质的产生以及不同传代的滴度50)测定。
结果
分离得到的ABBV-1与欧洲ABBV-1分离物AF-168和北美ABBV-1分离物062-CQ和CG-N1489的同源性分别为97%和99%,并能在DEF、CCL-141、QT-35和DF-1培养物中感染和复制。在四种培养物中均检测到病毒RNA, DEF和CCL-141中检测到最高水平,QT-35中检测到中等水平,DF-1中检测到最低水平。N蛋白在感染DEF、CCL-141和QT-35的western blot中检测到中、高水平,而在感染DF-1的western blot中检测到低水平。DEF的感染滴度最高(约105到106Ffu / 106细胞)。对于永生化细胞系,CCL-141显示出最高滴度,约104到105Ffu / 106细胞。DF-1产生最小的感染滴度。
结论
本研究证实了加拿大水禽中存在ABBV-1病毒,并报道了该病毒在不同禽细胞系中的体外鉴定。ABBV-1在DEF中复制滴度最高,其次是CCL-141和QT-35,在DF-1中复制滴度较低。我们的研究结果表明,CCL-141可以代替DEF用于常规的ABBV-1生产,如果低滴度是可以接受的,可以简单地使用永生化细胞系进行原代培养。
背景
禽波恩病毒一词包括该属内的一组不同的病毒Orthobornavirus和家人Bornaviridae.现已确认的禽波恩病毒有五种:passerform 1正冰毒,passerform 2正冰毒,鹦鹉形1正冰毒,鹦鹉形2型正冰毒而且水鸟1正片病毒[1,2].的水鸟1正片病毒该物种含有两种病毒,水鸟bornavirus 1和2 (ABBV-1和ABBV-2)。ABBV-1最初是在对加拿大安大略省南部患有神经疾病的加拿大鹅和小号天鹅进行回顾性死后评估时发现的,使用的是存档组织的RT-PCR和免疫组化(IHC) [3.].从那时起,该病毒已在大雁和哑天鹅中被检测到[4,5],以及出现神经系统疾病的鸸鹋和海鸥[6,7].
ABBV-1是一种包膜负意义单链RNA病毒,基因组约9kb,包含6个基因编码5种结构蛋白和1种非结构蛋白,按3 '到5 '顺序排列:核衣壳(N)、非结构X蛋白、磷蛋白(P)、基质(M)、糖蛋白(G)和RNA依赖性RNA聚合酶(L) [8].在整个感染周期中,博尔纳病毒仍然与细胞高度相关,感染是持久和持久的,而不是引起细胞裂解[9,10,11,12,13].博尔纳病毒通过将病毒核糖核蛋白(RNP)与细胞核中的核心组蛋白和染色体结合而实现持久性[14],允许病毒物质在子细胞之间分离,而不释放在细胞外空间,缺乏明显的细胞病变效应(CPE)。因此,在体外观察bornvirus感染依赖于间接方法——通常是免疫荧光——在没有CPE的情况下检测病毒抗原[15].
在细胞培养中分离病毒被认为是病毒鉴定的"金标准" [16],病毒在细胞培养中的繁殖有助于描述病毒的生命周期和宿主对感染的固有反应。原代细胞培养被推荐用于多种禽类病毒,包括禽类bornvirus的初步分离[17],继续使用原代培养物进行常规病毒生产存在多种缺点。最重要的是,原代培养物通常是异质的,并且可能存在表型变异,例如由于每次培养时使用不同的动物,批次内和批次之间在衰老前寿命的变异[18,19].此外,初级培养需要随时可用的生产者动物或鸟蛋,这可能导致准备时间和成本的增加,对于野生鸟类,鸟蛋的可用性可能受到季节性限制。鸡蛋也可能自然受到病毒污染。例如,在一只加拿大鹅的卵黄中检测到禽波恩病毒RNA [20.]和鹦鹉的蛋[21,22,23].此外,Payne et al.(2012)在一篇综述文章中报道,从商业北京鸭蛋胚胎制备的鸭胚成纤维细胞(DEF)中检测到ABBV-1 RNA [24].当病毒在宿主群体中高度流行时,这一问题可能会加剧,根据血清学评估,在某些水禽种群中,根据地点的不同,ABBV-1病毒的流行率可高达50% [25].因此,使用永生化细胞系进行ABBV-1的常规繁殖减少了对原发DEF的需求,并减轻了相关的缺陷。
目前的禽波恩病毒体外培养,其定义为已知支持禽波恩病毒复制的细胞培养物的集合[26],在表中列出1.总的来说,使用原代胚胎培养物或永生化细胞系分离出了几种禽bornvirus毒株,所有物种都含有至少一种可以在细胞培养物中复制的病毒(例如,原代或永生化)。除了金丝雀bornavirus-2 (CnBV-2)和雌雀bornavirus-1 (EsBV-1)外,这些病毒都没有在哺乳动物细胞系中复制(表2)1),尽管在受感染的培养物中感染率很低(< 1%)。虽然ABBV-1和ABBV-2都在DEF中被分离出来[4,27],迄今为止,还没有关于ABBV-1或ABBV-2在永生化细胞系中繁殖的报道。
这项研究有两个目标。首先描述了来自加拿大安大略省自然感染的加拿大鹅脑的感染性ABBV-1在DEF中的分离和系统发育特征。第二项是研究ABBV-1在永生化禽细胞系中的复制特性,以确定常规繁殖该病毒的合适细胞系。
材料与方法
细胞
使用了四种细胞培养系统,一种原代细胞和三种永生细胞系。原代培养为北京鸭胚胎成纤维细胞(DEF) (阿拉斯platyrhynchos家)。这三种永生化细胞系是:鸭胚胎成纤维细胞(CCL-141) [36]和鸡胚胎成纤维细胞(DF-1, CRL-12203) [37]和鹌鹑纤维肉瘤细胞系(QT-35) [38].
对于常规繁殖,DEF、CCL-141、QT-35和DF-1在维持培养基中生长(Dulbecco 's Modified Eagle Medium [DMEM;添加10%胎牛血清[FBS;Hyclone]和1%青霉素-链霉素-两性霉素B [PSA;Hyclone])。传代时,用磷酸盐缓冲盐水(PBS;Hyclone),并与PBS中稀释至0.125%的胰蛋白酶- edta (Hyclone)或TryPLE (Gibco)分离。DEF每2 ~ 3天传代一次,永生细胞系每5 ~ 8天传代一次,分裂比例为1:2或1:3。所有培养物均在37°C、10% CO的气氛中培养2.对于持续感染ABBV-1的细胞,细胞繁殖的方法也相同(见下文)。
ABBV-1在DEF中的分离与表征
ABBV-1是从一只受感染的加拿大鹅(Branta黄花),这是安大略兽医学院Dr. Dale Smith的亲切礼物。按先前所述进行病毒分离[17],只做了一些小修改。简单地说,将鹅脑均质,用20 μL直接感染12孔板(Nunc)中的DEF(传代2,约75%汇合),最终在含1% PSA的DMEM中达到1:10稀释,不含血清。接种物一直保存到DEF准备好在维持培养基中常规传代为止。模拟感染DEF与DMEM单独孵育。动物卫生实验室(圭尔夫大学)通过对细胞颗粒进行RT-qPCR,初步确认了DEF持续感染的建立(106),根据已发表的ABBV-1 M基因检测方案[39].持续感染的DEF按上述方法常规培养。无细胞病毒原液(节从感染细胞培养物中提取和滴定ABBV-1)从DEF中提取,用于感染CCL-141细胞。除非另有说明,下面描述的所有实验都是使用来自CCL-141细胞的原液进行的。
为了更好地描述ABBV-1在DEF中的复制,细胞在15厘米的培养皿中与大约103.26FFU在10% FBS/DMEM中。培养后每5 ~ 8天传代一次,共传代13次。在规定的传代间隔,收集一些细胞进行RNA提取和RT-qPCR(传代1-7),病毒滴定(传代6-8和10-12),蛋白质提取和western blotting(传代1 - 3,6 - 8,11 - 13)。
ABBV-1基因序列测定及系统发育分析
ABBV-1测序和系统发育分析的综合材料和方法在附加文件1:材料和方法部分提供。简要描述如下。ABBV-1使用Sanger测序(圭尔夫大学基因组学高级分析中心)进行测序,并使用geneous 8.0版本进行组装。利用来自代表性禽波恩病毒毒株的29个N基因核苷酸序列,采用Neighbor-Joining方法进行系统发育分析[40]在MEGA7软件中[41,42,43].
永生细胞系与ABBV-1的感染和比较作为生产细胞系
在永生细胞系中进行了两个独立的感染实验,以表征ABBV-1通过细胞培养的生长和传播,以及在感染后建立持续感染的细胞群。实验大纲的图形总结报告在附加文件中1:图S1。
简单地说,ABBV-1在10% FBS/DMEM中10时感染未感染的CCL-141、QT-35和DF-13.49T25培养瓶中的FFU(实验1),或103.26FFU在15 cm培养皿中(实验2)。然后每5 ~ 8天传代一次,共13代。在规定的传代间隔,将部分细胞添加到12孔或24孔组织培养板(Nunc)中进行免疫荧光染色(传代1-3),收集细胞进行RNA提取和RT-qPCR(传代2-7),病毒滴定(传代6-8和10-12),蛋白质提取和western blotting(传代1 - 3,6 - 8,11 - 13)。
从感染细胞培养物中提取和滴定ABBV-1
使用冻融法从持续感染的细胞系(原代或永生化)中获取无细胞病毒。简单地说,细胞从含有胰蛋白酶的烧瓶中分离,在300 x g下离心5分钟。离心后,将细胞重悬于5 mL 2% FBS/DMEM中,并进行3个周期的冷冻(- 80°C)和解冻。再次以2000 x g离心5分钟,将混合物制成颗粒状细胞碎片。收集上清液并保存于−80°C。
无细胞病毒在同一(同源)细胞系或同一批次原代DEF(异源)上用IFA以96孔板格式滴定。用同源滴定法测定每个细胞系产生病毒的能力并报告滴度,用DEF异源滴定法规范不同细胞系产生病毒滴度的报告。用50%组织培养感染剂量(TCID) Karber法测定游离细胞病毒滴度50在96孔板中,根据实验使用四种细胞培养物(DEF, CCL-141, QT-35和DF-1)中的一种进行检测(见下文)。每孔加入10倍的2% FBS/DMEM病毒悬液(200 μL /孔)。感染后5 - 7天,免疫荧光(切片免疫荧光法(IFA)),并通过蔡司荧光显微镜(Axio Observer.A1)观察,对病毒存在的孔进行阳性或阴性评分。病毒滴度在TCID中表达50并通过乘以TCID转换为FFU50至0.69 [44];最终滴度为FFU / 106细胞,根据为制备病毒而收获的细胞数量计算。
对于从永生化细胞系中收集的ABBV-1传代之一,基于TCID的RT-qPCR变异50试验(TCID50-RT-qPCR) [45],其中在24孔板而不是96孔板上进行滴定,并使用RT-qPCR对每个孔的ABBV-1进行评分(sectionRT-qPCR检测病毒),代替免疫荧光染色。TCID50采用-RT-qPCR滴定法,较常规TCID提高检测灵敏度50ifa。
免疫荧光法(IFA)
采用免疫荧光法(IFA)检测感染细胞中ABBV-1的存在,单孔96孔板法检测TCID50.以1:1000浓度在兔体内培养抗ABBV-1 N蛋白332 - 354残基肽(Cys-KEAQLARYRRREVTRGEDGAHLS)的单特异性抗体。二抗为山羊抗兔IgG抗体,与AlexaFluor488 (Invitrogen)结合,1:1000稀释。简单地说,从平板/孔中去除上清液,用PBS冲洗两次细胞,并用50%乙醇:丙酮混合物在-20°C固定20分钟。然后用PBS清洗细胞两次,用PBS- t稀释的5%山羊血清(PBS含0.1%吐温-20)封闭1至3小时。阻断后,细胞用在阻断缓冲液中稀释的一抗在室温或4℃过夜孵育1 ~ 3小时。PBS-T清洗细胞3次,最后与荧光团偶联二抗在室温暗室中孵育1 ~ 3小时。孵育后,细胞清洗三次,用DAPI (1.43 mM稀释在PBS中)孵育约5分钟,并在荧光显微镜下观察。未感染的细胞作为阴性对照。
蛋白提取、定量及western blot分析
Western blot检测病毒N蛋白的相对含量。简单地说,用PBS清洗感染细胞,并在放射免疫沉淀试验(RIPA)缓冲液(50 mM Tris-HCl pH 8, 150 mM NaCl, 1% NP-40, 0.5%脱氧胆酸钠,0.1%十二烷基硫酸钠)中溶解。孵育30分钟后,细胞裂解物在10,000×g下4°C离心15分钟。收集上清液,并根据制造商的说明使用Pierce BCA蛋白检测试剂盒测定蛋白浓度。
为了使SDS-page和western blots变性,细胞裂解物在95°C的热板上孵育10分钟以使蛋白质变性。将蛋白质(1 μg)在120 V下用12% SDS-PAGE分离1.5 h,转移到带有1x Towbin缓冲液的PVDF膜上,在25 V下转移1 h(半干转移,BioRad)。然后用5%的脱脂牛奶在PBS-T中在4°C过夜阻塞膜。其余的程序按前面所述进行[46],所有洗涤步骤均采用PBS-T进行。一抗为稀释1:1000的兔抗n蛋白单特异性抗体或稀释1:1000的小鼠单克隆抗-肌动蛋白(ThermoFisher)。二抗为结合辣根过氧化物酶的山羊抗兔或山羊抗小鼠IgG二抗(ThermoFisher);使用BioRad ChemiDoc MP成像系统和BioRad Image Lab 6.0.1检测阳性信号。软件
RT-qPCR检测病毒
对感染ABBV-1的细胞培养物进行RT-qPCR,以定量感染后多次传代的病毒RNA水平。RNA从样品中提取用RNeasy Mini Kit (Qiagen)根据制造商的协议。使用Luna Universal Probe一步RT-qPCR试剂盒(NEB)对纯化的RNA进行逆转录和扩增,并使用针对abbv - 1n基因的引物和探针。引物序列为正向(5 ' -ATG CAC TTG CAC TCT TAG AC-3 '),反向(5 ' -TCC CCA TAA AAC CTC CCA AC-3 '),探针(5 ' -6-FAM-CCC TGC CCG CAG AGA GAA ATT CCA T-BHQ-3 ')。循环条件为:55℃逆转录10 min;95°C初始变性1 min, 95°C变性10 s, 60°C退火和拉伸相结合,循环40次。周期阈值(ct)小于35为阳性。
统计分析
统计分析比较在每个独立感染实验中持续感染的永生化细胞系之间的多传代平均产量滴度。由于在持续感染后,可以从持续感染的细胞系中获得任何甚至多个组合传代的无细胞病毒储备,因此比较不同细胞系之间多个传代(而不是仅一个特定传代)的平均产量滴度可以解释传代之间滴度的变动性,并更准确地确定支持更好的病毒生产的细胞系。这样做是为了比较持续感染的cc -141和QT-35,而不是DF-1。DF-1在除一段外的所有段落中都没有产生可测量的滴度。使用学生t检验对所有可测量的经期的滴度进行平均和平均值比较。分别对同源滴定和异源滴定结果进行检验。统计分析中只包括可测滴度,表中提供了每个细胞系所有传代的可测滴度2.
结果
鸭原代成纤维细胞中ABBV-1的分离与鉴定
为分离ABBV-1在DEF和永生化细胞系中繁殖和评价,将DEF与匀浆鹅脑接种。在感染后第8代和第10代,通过RT-qPCR检测M基因,确认ABBV-1存在,Ct值分别为19.57和17.17。未感染对照组DEF未检测到病毒遗传物质。Ct值从第8代到第10代的下降表明病毒在积极复制。从第8至第10段收集的感染滴度在10之间变化3.85到104.72Ffu / 106细胞。在细胞裂解液中检测到约40 kDa的蛋白条带,进一步证实了感染。1a)和IFA(图。1C)感染后第7代。abbv - 1n蛋白的免疫反应性存在于大多数细胞群中(提示持续感染的建立),主要特征是强烈的粗点状核和低水平的精细细胞质反应性(图2)。1c).分离出的病毒被命名为ABBV-1 UoG-CG。
western blot、IFA、RT-qPCR和病毒滴定法检测持续感染DEF患者的ABBV-1。为面板一个),b),c), DEF与来自ABBV-1阳性鹅的脑匀浆或对照培养基孵育,并使用western blot和IFA监测潜在的ABBV-1复制。一个Western blot显示在感染DEF的裂解物中检测到abbv - 1n蛋白,但在未感染的对照DEF培养物中没有检测到。在感染DEF和对照DEF培养基中均检测到β-肌动蛋白。b而且c分别用抗abbv - 1n蛋白的一抗(绿色)和用DAPI(蓝色)反染对照和感染DEF培养物的IFA。比例尺,100 μm。为面板d,e而且f用收获的ABBV-1细胞培养物感染DEF,并用RT-qPCR、western blot和病毒滴定法监测ABBV-1复制情况。D)前7代ABBV-1感染DEF的RT-qPCR。E) abbv -1感染的DEF在1- 3,6 - 8和11-13的Western blot检测。F) abbv -1感染的DEF在6-8和10-12传代进行病毒滴定
在未感染的DEF上进行第二次感染实验,使用新的细胞培养收获的病毒代替原始的鹅脑匀浆。这样做是为了在已知接种滴度(与组织匀浆无关)下更好地描述ABBV-1在DEF中的复制。RT-qPCR对前7代感染的监测显示,前5代Ct值稳步下降,第6代和第7代分别达到17.20和17.06 Ct,表明滴度开始稳定(平台期,图。1d).第1-3段样品Western blot未检测到N蛋白;但在第6-8和第11-13段可见到相应的波段。1e).对从传代6-8和传代10 - 12收集的细胞进行的病毒滴定在104.83和106.07Ffu / 106单元格(平均10个)5.65±0.44Ffu / 106细胞(图)。1f).综合RT-qPCR、滴定、western blot和IFA的数据表明,DEF支持ABBV-1的复制,并可持续性感染。未见细胞病变效应(CPE)。
分离株ABBV-1的鉴定及系统发育分析
ABBV-1 UoG-CG基因组测序并提交GenBank,登录号MK966418。基本局部比对搜索工具(BLAST)对9006 bp组装的基因组序列进行了搜索,结果显示其与欧洲ABBV-1分离物AF-168的同源性为97%和99% [47]和北美ABBV-1分离株062-CQ和CG-N1489 [8),分别。对包括其他28株禽bornavirus株的部分N基因序列的系统发育分析表明,ABBV-1 UoG-CG与其他ABBV-1分离株聚集在一起水鸟1正片病毒物种(附加文件)1:图S2)。
ABBV-1在永生化细胞系中复制的特性和比较
ABBV-1在DF-1、cc -141和QT-35中的复制在两个独立的感染实验中进行了定性和定量的监测和比较(附加文件)1:图S1)。定性上,用相位对比光显微镜观察早期传代的感染培养,以确定可能的CPE,并使用IFA确定病毒在培养中的传播。定量上,通过两种方法测量病毒在每个细胞系中的复制效率:靶向N基因的RT-qPCR以比较病毒RNA水平,以及TCID50比较感染滴度。通过N蛋白western blotting进一步证实了ABBV-1的复制。在所有传代中,在相衬光显微镜下观察到任何细胞系的感染和未感染细胞之间没有形态差异。其他结果将在下面的部分中描述。
ABBV-1在细胞培养中的扩散和定位
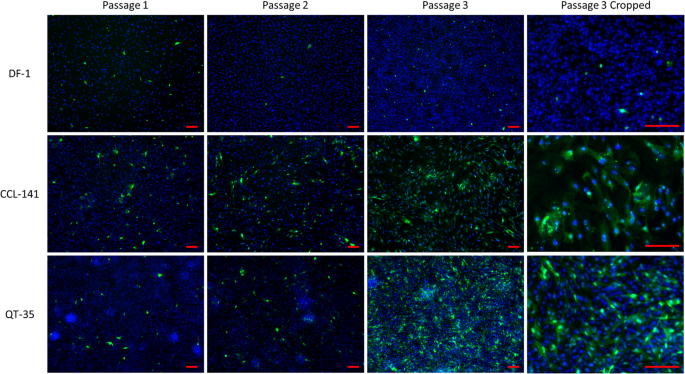
在实验感染1后1 - 3代,用IFA监测病毒在细胞群中的早期复制和传播。每次传代之间的时间为5 - 8天,所有三种培养都在同一天传代。在DF-1中,所有传代中只有罕见的abbv - 1n蛋白阳性细胞。相比之下,对于CCL-141和QT-35,感染细胞的数量在传代中增加,从传代2到3增加最大(图3)。2).与在感染DEF中看到的一样,abbv - 1n蛋白最强的反应性被视为核相关的斑点或点状信号(图2)。2).
abbv - 1n基因在细胞系中的转录
在两个独立的感染实验中,通过RT-qPCR监测细胞培养物中的病毒RNA转录,最多可达7传代。在未感染的对照细胞中均未检测到病毒RNA。
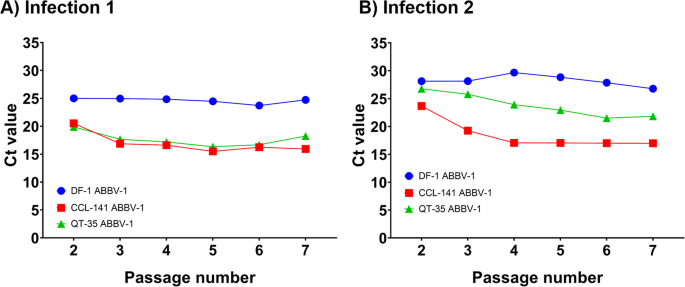
对于感染1的DF-1,在第2代时Ct值为25.00,并在5代中保持在23.71 - 25.00之间,直到第7代(图2)。3.a).在感染2中,Ct值在第2代时为28.12,在5代中保持在26.77 - 29.67之间,直到第7代(图2)。3.b).两种感染实验均表明DF-1能够维持稳定的低水平病毒RNA转录。
对于CCL-141,在感染1中,第2代Ct值为20.52,第3代Ct值为16.86,并继续下降,直到第7代(最后测量时间点)Ct值为15.92。3.a).感染2中,第2代Ct值为23.66,第3代Ct值为19.25,第7代Ct值为16.97,Ct值持续下降(图2)。3.b).在两个实验中,Ct值的最大降幅出现在段落2 - 3。
对于QT-35,感染1的Ct值从第2代的19.88下降到第5代的16.33;但在第6和第7段,Ct值略有增加(图。3.a).在感染2中,Ct值从第2代的26.76下降到第7代的21.83(图。3.b)。
abbv - 1n蛋白在细胞系中的表达
为了检测各细胞系中N蛋白的表达,分别对感染1后的11-13传代后期和第2次感染后的1 - 3、6-8和11-13传代进行western blot。在感染1中,感染的CCL-141和QT-35在11-13传代后期的裂解液中检测到显著的N蛋白条带(图2)。4a),但在相同的传代过程中,感染的DF-1只能检测到微弱的条带(图1)。4a).在感染2中,在感染的CCL-141的传代3中检测到N蛋白对应的条带,但在QT-35或DF-1中没有检测到(图2)。4b).传代6-8时,在感染的CCL-141中检测到强烈的蛋白条带,而在QT-35和DF-1中分别只检测到微弱或未检测到的蛋白条带(图6-8)。4b).在11-13传代后期,在CCL-141和QT-35中检测到清晰可见的蛋白条带,而在DF-1中仅可见微弱的蛋白条带(图11-13)。4b).综上所述,与其他永生化细胞系相比,DF-1中N蛋白的表达量似乎要低得多。与感染的cc -141相比,QT-35的N蛋白表达出现延迟。未感染的细胞未显示abbv - 1n蛋白条带。
永生细胞系中ABBV-1感染滴度的产生
在两个独立的感染实验中测量每个细胞系中感染性ABBV-1的产生滴度,同源和异源病毒滴度报告为FFU / 106细胞(见材料与方法部分)。
在感染1中,对于CCL-141,从传代8、12和13中收集的滴度在10之间3.92到105.11(同源滴定法)和104.48到104.86(异源滴定法)FFU / 106细胞(表2).对于QT-35,滴度在102.43到103.18(同源滴定法)和101.93到103.09(异源滴定法)FFU / 106细胞(表2).对于DF-1,根据同源和异源滴定的结果,未检测到可测量的感染滴度(表1)2).在同源滴定法中,持续感染的CCL-141与QT-35的平均产量滴度进行比较时,感染的CCL-141与104.34±0.67Ffu / 106与感染的QT-35细胞相比,QT-35细胞的滴度显著升高2.76±0.38Ffu / 106细胞(表2).感染CCL-141的平均产率滴度为10的异源滴定法也是如此4.67±0.19Ffu / 106细胞和QT-35在102.35±0.65Ffu / 106细胞(表2).
一种基于pcr的TCID变异50方法(TCID50-RT-qPCR),以提高滴定法的灵敏度。这是为了确认DF-1中滴度的缺失不是由于TCID可能的低敏感性50ifa。该方法是在感染后第8代DF-1和CCL-141和QT-35作为阳性对照完成的。对于DF-1,滴度再次检测不到,证实了常规TCID的滴度结果50.阳性对照CCL-141和QT-35的滴度为104.91和102.07Ffu / 106细胞,分别。
在感染2中,对于CCL-141,从传代6-8和传代10 - 12收集的滴度在10之间2.94到104.57(同源滴定法)和103.11到104.66(异源滴定法)FFU / 106细胞(表2).对于QT-35,滴度在10之间1.82到102.90(同源滴定法)和102.40到102.66(异源滴定法)FFU / 106细胞(表2);然而,第7代(同源滴定法)和第3-6代(异源滴定法)没有产生感染滴度。对于DF-1,同源滴定法在任何传代中均未检测到感染滴度,而异源滴定法在6个传代中仅在1个传代(第12个)中检测到滴度,滴度为102.06Ffu / 106细胞(表2).在同源滴定法中,持续感染的CCL-141与QT-35的平均产量滴度进行比较时,感染的CCL-141与103.89±0.69Ffu / 106与感染的QT-35相比,QT-35的滴度显著提高2.39±0.52Ffu / 106细胞)(表2).同样的情况也适用于异源滴定法,感染的CCL-141的平均产率滴度为103.87±0.75Ffu / 106细胞和QT-35在102.52±0.13Ffu / 106细胞(表2).
在两个感染实验中,当比较永生化细胞系时,CCL-141始终产生最高滴度范围,QT-35次之,而DF-1产生非常低的感染滴度,只有一个阳性传代。与从受感染的DEF中获得的无细胞病毒相比,来自不死细胞系的滴度范围较低(104.83到106.07Ffu / 106单元格,平均10个5.65±0.44Ffu / 106细胞,部分鸭原代成纤维细胞中ABBV-1的分离与鉴定).
讨论
一株来自加拿大安大略省的ABBV-1菌株(ABBV-1 UoG-CG)在DEF上分离,并在DEF和不朽的禽细胞系DF-1、CCL-141和QT-35中进行了鉴定。DEF最初用于隔离病毒,因为它以前被证明支持ABBV-1复制[4,48].ABBV-1 UoG-CG全基因组序列与来自美国德克萨斯州的2株菌株高度相似,>同源性99%,德国1株菌株>同源性97%。系统发育分析显示,ABBV-1 UoG-CG与北美而非欧洲的ABBV-1分离株聚集在一起,这表明安大略省分离株可能是北美加拿大鹅种群中的地方性毒株[47].
ABBV-1在原代DEF和永生化细胞系CCL-141和QT-35中复制,产生可检测的感染滴度。在DF-1中,病毒保持低水平的基因组物质和蛋白,分别通过RT-qPCR和western blot检测到,但通常不产生TCID检测到的传染性病毒颗粒50化验。在受感染细胞系传代过程中,任何时间点均未观察到CPE;免疫荧光检测显示胞浆和细胞核均有ABBV-1信号,且细胞核信号较强。核局部复制是两种鸟类[27,49,50]和哺乳动物bornvirus [51,52,53].
原代DEF能够被感染,支持复制并产生ABBV-1感染颗粒。这与文献中报道的一致(表1),大量的禽类bornavirus在DEF中繁殖。这些研究中使用的DEF中有一些(估计是大部分)[28,29,31]源自北京鸭(阿拉斯platyrhynchos家养的),就像我们的情况一样。DEF检测的ABBV-1滴度范围为104.83到106.07Ffu / 106我们研究中的细胞;由于DEF的ABBV-1滴度还没有具体报道,所以这个滴度与以前出版物中的滴度相比如何尚不清楚[4,8,48].对于其他禽波恩病毒,DEF中PaBV-2和PaBV-4的产量分别为6.5 × 105FFU/mL(或105.81洁净/毫升)[548.0 × 104FFU/mL(或104.90洁净/毫升)[30.,32].然而,这些滴度不能与我们的结果直接比较,因为PaBV-2和PaBV-4是在冷冻和解冻后进行超声检测的,而且滴度报告的是浓度而不是总FFU。这些病毒浓度的总量可能不同。总的来说,这些结果表明鸭胚胎细胞在体外对禽波恩病毒感染敏感.
在检测的三种永生细胞系中,CCL-141 [36同样来源于北京鸭的CCL-141产生了最高的ABBV-1感染滴度,尽管与来源于DEF的相比仍低1 - 2个对数。因此,如果希望在原代培养中简单地使用不死细胞系,CCL-141似乎是ABBV-1常规繁殖的有效替代。对于要求较高滴度的实验,DEF是更好的选择。据作者所知,这是第一份测试不死鸭细胞系支持任何禽波恩病毒株复制能力的报告。
QT-35鹌鹑细胞系支持ABBV-1复制,但感染滴度低于cc -141或DEF。ABBV-1在QT-35中复制能力较低的一个潜在原因可能包括细胞系的分化阶段。CCL-141和DEF源自鸭胚胎[36],而6至24日龄的QT-35 [38].类似地,其他禽波恩病毒株也在胚胎细胞系中更有效地复制。永生鹌鹑胚胎细胞系CEC-32 [55]与鹌鹑QM-7肌源细胞系相比,从受感染的组织中支持更好的鹦鹉bornavirus (PaBV)- 2,4,7和EsBV-1的滴定[29,31,33,56].同样,鸡胚胎细胞系DF-1 [37]支持从感染组织中获得的EsBV-1比来自20日龄鸡的LMH细胞系更好的滴定量[29,57].虽然这些差异可以简单地反映体细胞分化,但多能胚胎细胞通常缺乏IFN反应[11],这可能解释了为什么胚胎细胞似乎对禽波恩病毒复制更宽容。在培养基中添加外源性IFN-α可抑制CEC-32和QM-7细胞系中PaBV-2和PaBV-4的复制,这说明了良好的抗病毒反应对限制禽波恩病毒复制的重要性[58,59].
一个令人惊讶的发现是,相对于该细胞系在这些传代中产生的低滴度,在QT-35中观察到的abbv - 1n蛋白带的强度。在CCL-141中也检测到视觉上强烈的N蛋白条带,但滴度高于QT-35。相比之下,在DF-1中,微弱的N蛋白检测与缺乏病毒滴度相关,而在QT-35中则低于滴度。这一发现在两个独立的感染实验中是一致的。对于QT-35,相对于传染性病毒的产生,高水平的N蛋白可能通过改变其他病毒蛋白的最佳化学计量学相互作用或导致N蛋白聚集来影响病毒组装或基因组复制。虽然这些推测需要实验验证,改变N蛋白表达可以损害RNP的形成和降低病毒滴度,如哺乳动物1波恩病毒和其他负感单链RNA病毒所见[60,61,62,63].
DF-1始终支持低水平的ABBV-1基因和蛋白表达,但在检查的13个传代中没有检测到传染性病毒粒子,只有一个例外。文献中的数据表明,鸡细胞不像鸭或鹌鹑细胞那样支持禽波恩病毒的复制。例如,PaBV-1和PaBV-4在鸡胚成纤维细胞中没有复制,但在DEF中复制[30.].金丝雀bornavirus (CnBV)-1、-2、- 3、PaBV-2、- 4和- 7在DF-1或LMH培养物中或两者中的复制均低于鹌鹑细胞系,根据ifa阳性细胞的数量报告,但没有提及鸡细胞系产生的病毒滴度[28,31,33].这一趋势在DF-1报告中得到证实。然而,在多次传代中,病毒RNA和N蛋白水平维持在恒定的低量。这表明DF-1可以被ABBV-1感染;然而,产生的病毒RNA和蛋白质的数量不足以持续支持病毒粒子的组装。或者,产生的传染性病毒粒子的数量太少,无法在TCID中建立可检测的感染50可靠地测定。禽波恩病毒在鸡细胞中产生大量传染性病毒粒的普遍困难可能反映了宿主限制,并解释了缺乏关于鸡中自然禽波恩病毒感染的报告。
结论
总之,加拿大分离的ABBV-1(命名为ABBV-1 UoG-CG)首次在细胞培养中分离,与其他三种永生化禽细胞系(CCL-141, QT-35, DF-1)相比,在原代DEF中复制效果最好。在永生化细胞系中,CCL-141产生的滴度最高,因此可以用作原代胚胎成纤维细胞培养的替代品,用于产生ABBV-1,尽管病毒产量较低。DF-1可感染,但感染滴度最低。通过描述ABBV-1在这些细胞系中的感染和复制,本研究扩展了已知的细胞培养系统,可用于研究和繁殖ABBV-1。
数据和材料的可用性
不适用。
缩写
- ABBV-1 UoG-CG:
-
ABBV-1的安大略省分离物
- ABBV-1:
-
水鸟博尔纳病毒1
- ABBV-2:
-
水鸟bornavirus 2
- BCA蛋白测定:
-
双辛酸测定
- 爆炸:
-
基本本地对齐搜索工具
- ccl - 141:
-
鸭胚胎成纤维细胞
- CPE:
-
细胞病理效应
- Ct:
-
循环阈值
- DAPI:
-
4, 6-diamidino-2-phenylindole
- DEF:
-
鸭胚胎成纤维细胞
- DF-1:
-
鸡胚胎成纤维细胞
- DMEM:
-
杜尔贝科改良鹰中号
- EsBV-1:
-
雌雀博尔纳病毒
- 的边后卫:
-
胎牛血清
- 洁净工程:
-
焦点成形单元
- 玫瑰:
-
(4) - 2-hydroxyethyl 1-piperazineethanesulfonic酸
- IFA:
-
免疫荧光分析
- 包含IHC:
-
免疫组织化学
- PaBV:
-
鹦鹉bornavirus
- PBS:
-
磷酸盐缓冲盐水
- PBS-T:
-
0.1%吐温-20的PBS
- PSA值:
-
Penicillin-Streptomycin-Amphotericin B
- PVDF:
-
聚乙二烯二氟化物
- QT-35:
-
鹌鹑纤维肉瘤
- 里帕:
-
Radioimmunoprecipitation化验
- RNP:
-
病毒核糖核蛋白
- rt - pcr:
-
逆转录聚合酶链反应
- RT-qPCR:
-
逆转录实时聚合酶链反应
- sds - page:
-
十二烷基硫酸钠聚丙烯酰胺凝胶电泳
- TCID50:
-
组织培养感染剂量50%
参考文献
Amarasinghe GK, Bào Y, Basler CF, Bavari S, Beer M, Bejerman N,等。单胞病毒目分类:2017年更新。中国寄生虫学杂志,2017;26(4):344 - 344。
Maes P, Amarasinghe GK, Ayllón MA, Basler CF, Bavari S, Blasdell KR,等。单胞病毒目分类:2018年第二次更新。中国寄生虫病杂志,2019;44(4):433 - 444。
戴纳特,彭文杰,李志强,等。加拿大大雁和号手天鹅禽波恩病毒的新基因型。兽医杂志,2011;169(4):108。
Payne S, Covaleda L, Jianhua G, Swafford S, Baroch J, Ferro PJ,等。从健康加拿大鹅(Branta canadensis)中检测和鉴定一个不同的博尔纳病毒谱系。中国病毒学杂志,2011;85(22):12053-6。
Thomsen AF, Nielsen JB, Hjulsager CK, Chriél M, Smith DA, Bertelsen MF。丹麦大雁体内的博尔纳病毒1型水鸟。国际传染病杂志,2015;21(12):2201-3。
郭j, Tizard I, Baroch J, Shivaprasad HL, Payne SL.北美海鸥禽流感病毒的研究。中华动物医学杂志,2015;51(3):754-8。
尼尔森AMW, Ojkic D,达顿CJ,史密斯DA。圈养鸸鹋(Dromaius novaehollandiae)中的水鸟波恩病毒1型感染:假定由自由放养的野生水禽自然传播。禽病原学。2018;47(1):58-62。
郭娟,Baroch J, Randall A, Tizard I.禽博尔纳病毒全基因组序列分析(Branta黄花).基因工程学报。2013;1(5):e00839。
de la Torre JC。博尔纳病毒和大脑。中华流行病学杂志,2002;26(2):344 - 344。
博纳病病毒感染的分子和细胞生物学研究。微生物感染。2002;4(4):491-500。
Pare JM, Sullivan CS。多能细胞与分化细胞的不同抗病毒反应。Racaniello V,编辑。公共科学图书馆,2014;10(2):e1003865。
Ludwig H, Becht H, Groh L.博尔纳病(BD),一种慢病毒感染的生物特性病毒。中华医学微生物学杂志,2003;29(4):379 - 379。
鲍纳病兔中枢和周围神经系统的电镜研究。神经病理学报,1972;22(4):305-18。
松本Y,林Y,大森H,本田T,大东T,堀江文M,等。博尔纳病毒与宿主染色体紧密结合并分离,以确保持续的核内感染。细胞宿主微生物。2012;11(5):492-503。
马志刚,李志刚。Bornaviridae。在:芬纳的兽医病毒学。伦敦:学术出版社;2017.381 - 7页。
细胞培养在技术时代病毒检测中的作用。临床微生物学杂志,2007;20(1):49-78。
郭娟,Payne S, Zhang S, Turner D, Tizard I, Suchodolski P.禽波恩病毒:诊断、分离和基因分型。正确的做法:微生物学的现行规程。霍博肯:威利;2014.15 i.1.1-15i.1.33 p。。
杨晓东,杨晓东,张晓明,等。肌源性无性系表型复杂性的研究。自然科学进展,2004年4月1日;21(4):366 - 366。
鸡胚成纤维细胞克隆株的分离。科学通报,2007;21(2):417-28。
Delnatte P, Nagy É, Ojkic D, Crawshaw G, Smith DA。禽波恩病毒在散养加拿大鹅(Branta canadensis)垂直传播可能性的调查。禽病原学,2014;43(4):301-4。
莫娜娜E,霍普斯S,郭娟,提泽德I.鹦鹉蛋中禽类博尔纳病毒的检测。禽医学杂志,2012;26(3):144-8。
李志刚,李志刚,张晓明,杨晓明,Oberhäuser K,张志刚,李志刚。禽博尔纳病毒在海鹦鹉中的垂直传播研究。中国传染病杂志,2011;17(12):2390-1。
Kerski A, de Kloet AH, de Kloet SR.禽博尔纳病毒在鹦鹉形动物中的垂直传播:从受感染的太阳锥虫(Aratinga solstitialis)获得的卵、胚胎和孵化中的禽博尔纳病毒RNA和抗禽博尔纳病毒抗体。禽疫,2012;56(3):471-8。
Payne SL, Delnatte P, Guo J, Heatley JJ, Tizard I, Smith DA。鸟类和博尔纳病毒。动物卫生决议Rev. 2012; 13:145-56。
郭杰,Covaleda L, Heatley JJ, Baroch JA, Tizard I, Payne SL.美国东北部哑天鹅中广泛存在的禽类bornvirus感染。兽医(奥克兰,新西兰)。2012; 3:49-52。
波士NC, Pham PH, Dayeh VR, LEJ L. Invitromatics, invitromics和invitroomics:介绍体外生物学的三个新名词,并说明它们与虹鳟鱼细胞系的使用。中国生物医学工程杂志,2017;53:383-405。
郭娟,薛晓峰,李志刚,王晓峰,王志刚,王志刚。一种来自野鸭的禽bornvirus新基因型的鉴定。中国病毒学杂志,2014;11(1):197。
Rubbenstroth D, Rinder M, Stein M, Höper D, Kaspers B, Brosinski K,等。禽bornvirus广泛分布于金丝雀(Serinus canaria f. domestica)。中国兽医杂志,2013;26(3):344 - 344。
Rubbenstroth D, Schmidt V, Rinder M, Legler M, Corman VM, Staeheli P.在德国雌雀(Estrildidae)中发现一种新的禽类波恩病毒基因型。中国兽医杂志,2014;29(4):344 - 344。
Gray P, Hoppes S, Suchodolski P, Mirhosseini N, Payne S, Villanueva I,等。利用禽博尔纳病毒分离物诱发conres前脑室扩张病。中华流行病学杂志,2010;16(3):473-9。
鲁本斯特罗特,林德,李志强,等。从自然感染的鹦鹉中分离出禽bornavirus (ABV)的方法及一种新的ABV基因型的鉴定。中国兽医杂志,2012;29(1):37 - 38。
de Araujo JL, rodriguez - hoffmann A, Giaretta PR, Guo J, Heatley J, Tizard I,等。实验感染鹦鹉bornavir2的荷兰花鹦鹉(Nymphicus hollandicus)中枢神经系统病毒抗原分布及炎症病变。兽医病理学杂志,2019;56(1):106-17。
林德,李志刚,李志刚,李志刚,李志刚,李志刚,李志刚。禽bornvirus在禽前脑室扩张病中的作用。中国病毒学杂志,2009;83(11):5401-7。
堀江贵文,沙沙Y, Iki H, Ebisawa K,福志H,柳井T,等。利用日本鹌鹑QT6细胞从鹦鹉鸟中分离出禽bornvirus。中华兽医医学杂志,2016;32(2):357。
郭洁,Tizard I.鹦鹉bornvirus基因组序列研究。病毒基因。2015;51(3):430-3。
狼K,伯克CN, Quimby MC.鸭病毒性肠炎:鸭胚成纤维细胞系微量滴度板分离和中和试验。禽疫,1974;18(3):427-34。
Schaefer-Klein J, Givol I, Barsov EV, Whitcomb JM, VanBrocklin M, Foster DN,等。ev - o衍生细胞系DF-1支持禽白血病肉瘤病毒和载体的有效复制。病毒学。1998;248(2):305 - 11所示。
Moscovici C, Moscovici MG, Jimenez H, Lai MMC, Hayman MJ, Vogt PK.日本鹌鹑化学诱导肿瘤的连续组织培养细胞系。细胞。1977;11(1):95 - 103。
Delnatte P, Ojkic D, DeLay J, Campbell D, Crawshaw G, Smith DA。加拿大野生加拿大鹅(Branta canadensis)、号手天鹅(Cygnus buccinator)和哑天鹅(Cygnus olor)感染禽流感病毒的病理和诊断:一项回顾性研究。禽病原学杂志,2013;42(2):114-28。
齐田,李志刚,李志刚。邻接法:一种重建系统发育树的新方法。分子生物学杂志,1987;4(4):406-25。
Kumar S, Stecher G, Tamura K. MEGA7:更大数据集的分子进化遗传学分析版本7.0。分子生物学杂志,2016;33(7):1870-4。
系统发生的置信度限制:使用BOOTSTRAP的方法。进化(N Y). 1985;39(4): 783-91。
田村K, Nei M, Kumar S.用邻居连接方法推断非常大的系统发育的前景。自然科学进展,2004;29(3):344 - 344。
Luria SE, Darnell JE, Baltimore D, and Campell A(编辑),通用病毒学(第3版)。纽约;多伦多:威利;1978.p。578。
古stafsson RKL, Engdahl EE, fogdel - hahn a .基于Q-PCR的人疱疹病毒6型TCID50方法的开发和验证。中国病毒学杂志,2012;9(1):319。
Pham PH, Tong WWL, Misk E, Jones G, Lumsden JS,波士NC。来自心脏的大西洋鲑鱼内皮细胞比来自动脉大泡的成纤维细胞对四种RNA病毒更敏感,但通过dsRNA预处理可以保护两种病毒。鱼类贝类免疫,2017;70:214-27。
鲁本斯特罗斯D,施密特V, Rinder M,莱格勒M, Twietmeyer S, Schwemmer P,等。系统发育分析支持水平传播是禽博尔纳病毒传播的驱动力。Lierz M,编辑。公共科学学报,2016;11(8):e0160936。
穆雷,郭杰,李志强,李志强,等。美国东北部自由生活的加拿大鹅(Branta canadensis)中的水鸟博尔纳病毒相关疾病。中华动物医学杂志,2017;53(3):607-11。
欧阳N, Storts R, Tian Y, Wigle W, Villanueva I, Mirhosseini N,等。被诊断为心室扩张病的鸟类神经系统的组织病理学和禽类波恩病毒的检测。禽病原学杂志,2009;38(5):393-401。
张志强,张志强,张志强,等。禽博尔纳病毒存在于许多鹦鹉类鸟类的组织中,组织病理学证据表明,这是一种省级脑室扩张病。中华兽医杂志,2010;22(4):495-508。
Cubitt B, de la Torre JC。博尔纳病病毒(BDV)是一种非节段RNA病毒,在存在传染性BDV核糖核蛋白的受感染细胞的细胞核中复制。中国病毒学杂志,1994;68(3):1371-81。
布里泽T,德拉托雷JC,路易斯A,路德维希H,利普金WI。博尔纳病病毒是一种负链RNA病毒,在受感染细胞的细胞核中转录。中国科学:自然科学(英文版),2001;29(3):344 - 344。
Pyper JM, Clements JE, Zink MC.核仁是博尔纳病病毒RNA转录和复制的部位。中国病毒学杂志,1998;72(9):7697-702。
郭军,郭俊杰,李志刚,张志刚,张志刚。鹦鹉bornvirus病的免疫机制研究。病毒学。2018;515:81 - 91。
张志刚,张志刚,张志刚。鸡胚成纤维细胞克隆LSCC-H32的建立与鉴定。《体外实验》1982;18(10):827-34。
Antin PB, Ordahl CP。禽肌源性细胞系的分离与鉴定。中国生物医学工程学报。1991;43(1):457 - 457。
川口T,野村K,平山Y,北川T。鸡肝细胞癌细胞系LMH的建立和鉴定。癌症决议1987;47(16):4460-4。
路透社A, Ackermann A, Kothlow S, Rinder M, Kaspers B, Staeheli P.禽波恩病毒逃避先天免疫系统的识别。病毒。2010;2(4):927 - 38。
路透社A,贺建文,Höper D,欧尼姆斯,纳尔尔,林德,等。利巴韦林和干扰素-α对禽细胞中鹦鹉bornvirus的协同抗病毒活性。中国病毒学杂志,2016;97(9):2096-103。
许文乐,马志刚,李志强,李志强,李金伟。博尔纳病病毒P、N和X蛋白的相互作用及其功能意义中国生物医学工程学报,1998;29(3):344 - 344。
波尼施,魏乐,阿克曼,施耐德。博尔纳病病毒X蛋白在病毒增殖周期中起重要作用。中国病毒学杂志,2007;81(13):7297-9。
土涛,权洪杰,田文杰,佐藤红,米田美,陈凯。麻疹病毒通过病毒复制的自动调节诱导持续感染。科学通报2016;6(1):37163。
韦茨GM, Howard MB, Davis N, Patton J.负链RNA病毒从转录到复制的转换。清华大学学报(自然科学版)。1987;52:367-71。
确认
作者要感谢安大略兽医学院的Dale Smith博士提供鹅脑匀浆用于分离病毒。
资金
这项工作由安大略省农业、食品和农村事务部(OMAFRA) - G大学研究计划资助(UofG2016-2577)。
作者信息
作者及隶属关系
贡献
PP和LS设计了实验,并撰写了大部分手稿。PP和AL进行了实验,AL设计了许多初步分析。LD进行了病毒的初步分离和病毒测序。EN提供了病毒和原代细胞培养系统,并对手稿进行了严格的编辑。PP、LS、AL、EN参与数据分析。LS为这项研究提供了资金支持。所有作者都参与了手稿的写作或编辑,并认可了其内容。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:图S1。
多传代感染ABBV-1的细胞培养示意图(P)。在图中指定的传代上,使用四种不同的技术,免疫荧光、RT-qPCR、滴定和western blot,在13个传代上监测感染的CCL-141、QT-35和DF-1。图S2。ABBV-1 UoG-CG部分N基因序列的系统发育分析。ABBV-1 UoG-CG部分N基因序列(1036位段)与其他28个ABV部分N基因序列邻接系统发育分析在分支旁显示有1000个重复的引导测试。给出了分支长度之和为1.04980780的最优树。箭头表示ABBV-1分离物UoG-CG。补充材料和方法.表S1。用于ABBV-1 UoG-CG测序的引物。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
范佩芬,李茜,A,邓,L。et al。安大略水鸟bornavir1的分离及其在不朽禽细胞系中的复制特性。性研究J17, 16(2020)。https://doi.org/10.1186/s12985-020-1286-6
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12985-020-1286-6
关键字
- 禽流感bornavirus
- 水鸟博尔纳病毒1型
- ABBV-1在禽细胞中的复制
- 持续感染
- 永生禽细胞系,鸭胚胎成纤维细胞