波梅KW,康普顿T.病毒的固有感知toll样受体。中国病毒学杂志,2004;78:7867-73。
中科院PubMed公共医学中心谷歌学者
Mahla RS, Reddy MC, Prasad DV, Kumar H.甜PAMPs:糖复合物PAMPs在先天免疫和疫苗生物学中的作用。前沿免疫杂志,2013;4:48。
PubMed公共医学中心谷歌学者
田明,上松,竹内。病原体识别与先天免疫。细胞。2006;124:783 - 801。
中科院PubMed谷歌学者
赛哈尔T,马加勒斯R,费尔赫斯特AM。SLE中的TLR7和TLR9:当感知自我出现问题时。免疫res 2012; 53:58-77。
中科院PubMed谷歌学者
Takeuchi O, Akira S.模式识别受体与炎症。细胞。2010;140:805-20。
中科院PubMed谷歌学者
Kawai T, Akira S.模式识别受体在先天免疫中的作用:toll样受体的更新。中华免疫杂志,2010;11:373-84。
中科院PubMed谷歌学者
宋伟,全玉杰,南宫B,洪敏,尹思。在鞭毛蛋白上有一个保守的TLR5结合和激活热点。科学通报2017;7:40878。
中科院PubMed公共医学中心谷歌学者
高苏V,孙S,申D,宋kd。深入了解dsrna结合TLR3复合物的动态性质。科学通报2019;9:3652。
PubMed公共医学中心谷歌学者
尹思,Kurnasov O, Natarajan V, Hong M, Gudkov AV, Osterman AL, Wilson IA。tlr5 -鞭毛蛋白识别和信号转导的结构基础。科学。2012;335:859 - 64。
中科院PubMed公共医学中心谷歌学者
柯林斯B,威尔逊IA。小鼠TLR9 c端结构域的晶体结构。蛋白质。2014;82:2874-8。
中科院PubMed公共医学中心谷歌学者
大藤浩,田吉,田志,清水,等。toll样受体的结构与功能。微生物感染。2014;16:273-82。
中科院PubMed谷歌学者
Ohto U, Shibata T, Tanji H, Ishida H, Krayukhina E, Uchiyama S, Miyake K, Shimizu T. CpG的结构基础和toll样受体抑制性DNA识别9。大自然。2015;520:702-5。
中科院PubMed谷歌学者
Maeda K, Akira S. TLR7结构:Z-Loop切割。免疫力。2016;45:705-7。
中科院PubMed谷歌学者
Zhang Z, Ohto U, Shibata T, Krayukhina E, Taoka M, Yamauchi Y, Tanji H, Isobe T, Uchiyama S, Miyake K, Shimizu T结构分析表明toll样受体7是鸟苷和单链RNA的双重受体。免疫力。2016;45:737-48。
中科院PubMed谷歌学者
苏玲,王勇,王杰,Mifune Y, Morin MD, Jones BT, Moresco EMY, Boger DL, Beutler B,张华。合成激动剂diprovocim激活TLR2/TLR1的结构基础。中华医学化学杂志2019;62:2938-49。
中科院PubMed公共医学中心谷歌学者
Hallman M, Ramet M, Ezekowitz RA。toll样受体作为病原体的传感器。儿科决议2001;50:315-21。
中科院PubMed谷歌学者
张亚尔,崔志华,申世杰,朴志华。结核分枝杆菌ESAT6通过tlrs介导的信号通路诱导巨噬细胞ifn - β基因表达。细胞因子。2018;104:104-9。
中科院PubMed谷歌学者
Kugelberg E.树突状细胞:TLR激动剂触发快速代谢变化。中华免疫杂志2014;14:209。
中科院PubMed谷歌学者
Zahm CD, Colluru VT, McIlwain SJ, Ong IM, McNeel DG。在T细胞活化过程中TLR刺激降低CD8(+) T细胞上PD-1的表达。癌症免疫杂志2018;6:1364-74。
中科院PubMed公共医学中心谷歌学者
费海提,雷诺兹,JM。TLR在小鼠CD4(+) T淋巴细胞中的功能及其在炎症中的作用方法Mol生物学,2016;1390:215-27。
中科院PubMed谷歌学者
华志,侯斌。TLR信号通路在b细胞发育和激活中的作用。细胞免疫杂志,2013;10:103-6。
中科院PubMed谷歌学者
Naradikian MS, Myles A, Beiting DP, Roberts KJ, Dawson L, Herati RS, Bengsch B, Linderman SL, Stelekati E, Spolski R,等。前沿:IL-4, IL-21和ifn - γ相互作用控制tlr激活B细胞中T-bet和CD11c的表达。中华免疫杂志,2016;197:1023-8。
中科院PubMed谷歌学者
Akira S, Takeda K, Kaisho T. toll样受体:连接先天免疫和获得性免疫的关键蛋白。中华免疫杂志2001;2:675-80。
中科院PubMed谷歌学者
Menden H, Xia S, Mabry SM, Noel-MacDonnell J, Rajasingh J, Ye SQ, Sampath V.组蛋白去乙酰化酶6在发育中的肺中调控内皮细胞myd88依赖的典型TLR信号、肺部炎症和肺泡重塑中国生物医学工程杂志。2019;317:L332-46。
中科院PubMed公共医学中心谷歌学者
Thomalla M, Schmid A, Neumann E, Pfefferle PI, Muller-Ladner U, Schaffler A, Karrasch T.脂肪细胞中抗炎toll样受体9 (TLR 9)通路的证据。《内分泌杂志》2019;240:325-43。
中科院PubMed谷歌学者
杨艳,孙颖,徐洁,鲍凯,罗敏,刘旭,王艳。上皮细胞通过调节PI3K/Akt/mTOR信号通路减弱单核细胞来源的巨噬细胞对结核分枝杆菌的toll样受体介导的炎症反应。介质炎症。2018;2018:3685948。
PubMed公共医学中心谷歌学者
刘忠文,朱海涛,陈坤林,邱晨,唐克峰,牛晓林。硒可减弱高糖诱导的ROS/TLR-4大鼠心肌细胞凋亡。Biol Trace Elem res 2013; 156:262-70。
中科院PubMed谷歌学者
Kawai T, Akira S. TLR信号。中华免疫杂志2007;19:24-32。
中科院PubMed谷歌学者
李郭张年代,余米,Q, R, G,棕褐色,李X, Y,吴M .膜联蛋白A2绑定到核内体和消极的调节通过TRAM-TRIF TLR4-triggered炎症反应通路。科学通报2015;5:15859。
中科院PubMed公共医学中心谷歌学者
胡霞,于艳,陈玉玉,夏强。乙酰化在tlr4介导的先天性免疫应答中的作用。中国生物医学工程学报,2013;
中科院PubMed谷歌学者
Divanovic S, Trompette A, Atabani SF, Madan R, Golenbock DT, Visintin A, Finberg RW, Tarakhovsky A, Vogel SN, Belkaid Y,等。RP105/MD-1抑制TLR-4/MD-2信号。内毒素杂志2005;11:363-8。
中科院PubMed谷歌学者
庄士华,李志刚。Triad3A, E3泛素蛋白连接酶调节toll样受体。中华免疫杂志2004;5:495-502。
中科院PubMed谷歌学者
Nakata T, Yasuda M, Fujita M, Kataoka H, Kiura K, Sano H, Shibata K. CD14直接与三酰化脂肽结合,并促进toll样受体2和1的受体复合体识别脂肽,而不与复合体结合。细胞微生物学。2006;8:1899-909。
中科院PubMed谷歌学者
Ranoa DR, Kelley SL, taps RI。人脂多糖结合蛋白(LBP)和CD14独立地将三酰化脂蛋白传递给toll样受体1 (TLR1)和TLR2,并促进三元信号复合物的形成。中国生物医学工程学报,2013;
中科院PubMed公共医学中心谷歌学者
特纳ML,克罗宁JG,希利GD,谢尔登IM。牛子宫内膜上皮细胞和基质细胞在先天免疫中发挥作用,并通过toll样受体TLR2, TLR1和TLR6在体外启动对细菌脂肽的炎症反应。内分泌学。2014;155:1453 - 65。
PubMed公共医学中心谷歌学者
施罗德NW,莫拉斯S,亚历山大C,哈曼L,哈东T,查林格U,戈贝尔UB,韦伯JR,舒曼RR。肺炎链球菌和金黄色葡萄球菌的脂teichoic acid (LTA)通过toll样受体(TLR)-2、脂多糖结合蛋白(LBP)和CD14激活免疫细胞,而TLR-4和MD-2不参与。中国生物化学杂志,2003;
PubMed谷歌学者
Into T, Kiura K, Yasuda M, Kataoka H, Inoue N, Hasebe A, Takeda K, Akira S, Shibata K.发酵支原体膜脂蛋白刺激人toll样受体(TLR) 2和TLR6在NF-kappa B激活后诱导凋亡细胞死亡。细胞微生物学,2004;6:187-99。
中科院PubMed谷歌学者
Roeder A, Kirschning CJ, Rupec RA, Schaller M, Weindl G, Korting HC。toll样受体是先天性抗真菌免疫的关键介质。医学Mycol, 2004;42:48 85 - 98。
中科院PubMed谷歌学者
Mayer ML, Phillips CM, Townsend RA, Halperin SA, Lee SF。从革兰氏阳性疫苗载体戈登链球菌分离的toll样受体激动剂对树突状细胞的差异激活。中华免疫杂志(英文版);2009;
中科院PubMed谷歌学者
洪文文,白继杰,姜士生,尹春春,徐东东,韩盛华。变形链球菌脂质磷酸与toll样受体2通过脂质部分相互作用诱导小鼠巨噬细胞炎症介质。中华免疫杂志2014;57:84 - 91。
中科院PubMed谷歌学者
Taghavi M, Mortaz E, Khosravi A, Vahedi G, Folkerts G, Varahram M, Kazempour-Dizaji M, Garssen J, Adcock IM。Zymosan可减弱小鼠黑色素瘤生长进展,增加脾细胞增殖并诱导TLR-2/4和tnf - α表达。炎症(伦敦)。2018; 15:5。
谷歌学者
Schwandner R, Dziarski R, Wesche H, Rothe M, Kirschning CJ。肽聚糖和脂磷酸诱导的细胞活化是由toll样受体2介导的。中国生物化学杂志,1999;
中科院PubMed谷歌学者
Takeuchi O, Hoshino K, Kawai T, Sanjo H, Takada H, Ogawa T, Takeda K, Akira S. TLR2和TLR4在革兰氏阴性和革兰氏阳性细菌细胞壁成分识别中的差异作用。免疫力。1999;11:443-51。
中科院PubMed谷歌学者
Talreja J, Kabir MH. M BF, Stechschulte DJ, Dileepan KN:组胺诱导内皮细胞toll样受体2和4表达,增强对革兰氏阳性和革兰氏阴性细菌细胞壁成分的敏感性。免疫学。2004;113:224-33。
中科院PubMed公共医学中心谷歌学者
Castillo C, Munoz L, Carrillo I, Liempi A, Medina L, Galanti N, Maya JD, Kemmerling U. toll样受体-2介导体外感染人胎盘绒毛膜绒毛外植体对抗克氏锥虫的局部先天免疫反应。胎盘。2017;60:40-6。
中科院PubMed谷歌学者
Shukla S, Richardson ET, Drage MG, Boom WH, Harding CV:结核分枝杆菌脂蛋白和脂聚糖结合toll样受体2与激动剂活性和功能结局相关.感染Immun 2018,86.
Bieback K, Lien E, Klagge IM, Avota E, Schneider-Schaulies J, Duprex WP, Wagner H, Kirschning CJ, Ter Meulen V, Schneider-Schaulies S.野生型麻疹病毒的血凝素蛋白激活toll样受体2信号。病毒学杂志,2002;76:8729-36。
中科院PubMed公共医学中心谷歌学者
Gravina HD, Antonelli L, Gazzinelli RT, Ropert C. TLR2和TLR9在克氏锥虫感染期间免疫应答调节中的差异使用。PLoS ONE。2013; 8: e63100。
中科院PubMed公共医学中心谷歌学者
王婷,Town T, Alexopoulou L, Anderson JF, Fikrig E, Flavell RA。toll样受体3介导西尼罗河病毒进入大脑,导致致命脑炎。中华医学杂志2004;10:1366-73。
中科院PubMed谷歌学者
Szomolanyi-Tsuda E, Liang X, Welsh RM, Kurt-Jones EA, Finberg RW。TLR2在NK细胞介导的小鼠巨细胞病毒体内控制中的作用中国病毒学杂志,2006;
中科院PubMed公共医学中心谷歌学者
萨库纳坦,库马尔,M巴约瑞克,MA Purbhoo, Culley FJ。呼吸道合胞病毒感染、TLR3配体和促炎细胞因子诱导CD161配体LLT1在呼吸道上皮的表达。中国病毒学杂志,2014;88:2366-73。
PubMed公共医学中心谷歌学者
托尔样受体3与神经系统病毒感染。中华神经科学杂志,2017;
中科院PubMed谷歌学者
Oliveira AC, Peixoto JR, de Arruda LB, Campos MA, Gazzinelli RT, Golenbock DT, Akira S, Previato JO, Mendonca-Previato L, Nobrega A, Bellio M.功能性TLR4表达对克氏锥虫糖肌醇脂有促炎反应,对克氏锥虫感染有更高的抗性。中华免疫杂志,2004;
中科院PubMed谷歌学者
Medeiros MM, Peixoto JR, Oliveira AC, Cardilo-Reis L, Koatz VL, Van Kaer L, Previato JO, Mendonca-Previato L, Nobrega A, Bellio M.克氏锥虫糖肌醇磷脂(GIPL)的toll样受体4 (TLR4)依赖性促炎和免疫调节特性。中华生物医学杂志,2007;82:488-96。
中科院PubMed谷歌学者
王敏,王峰,杨娟,赵东,王华,邵峰,王伟,孙瑞,凌明,翟娟,宋松。甘露聚糖结合凝集素通过toll样受体2和toll样受体4抑制pma激活的THP-1细胞中白色念珠菌诱导的细胞反应。PLoS ONE。2013; 8: e83517。
PubMed公共医学中心谷歌学者
Plociennikowska A, Hromada-Judycka A, Borzecka K, Kwiatkowska K. TLR4和raft蛋白在lps诱导的促炎信号中的合作。中国生物医学工程学报(英文版);
中科院PubMed谷歌学者
张建昌,李娟,甘比尼,巴图格达拉HM,萨提S,马丽泽,范林,Pellecchia M, Nair MG。人类抵抗素通过阻断LPS-TLR4相互作用来防止内毒素休克。中国科学院学报(自然科学版),2017;
中科院PubMed公共医学中心谷歌学者
柳志强,金世杰,罗士,姜志,何正,李丹,李鸿科,李卓,朴斌,尹泰,金敏。LPS转移级联的重建揭示了LBP、CD14和TLR4-MD2中有效识别和转移LPS的结构决定因素。免疫力。2017;46:38-50。
中科院PubMed谷歌学者
袁霞,胡涛,何红,邱红,吴霞,陈娟,王敏,陈超,黄松。呼吸道合胞病毒大量感染N2a神经元细胞,导致TLR4和核仁蛋白的调制,RSV F蛋白与TLR4和核仁共定位。中国生物医学工程学报,2018;25:13。
PubMed公共医学中心谷歌学者
McHeik S, Al-Akl NS, Abdelnoor AM。变性鞭毛蛋白对小鼠toll样受体5 (TLR-5)的影响。Endocr Metab免疫紊乱药物靶点,2018;18:412-6。
中科院PubMed谷歌学者
Ahmed M, Mitchell LM, Puckett S, Brzoza-Lewis KL, Lyles DS, Hiltbold EM.水泡性口炎病毒M蛋白突变体通过tlr依赖和-独立机制刺激toll样受体7 (TLR7)阳性树突状细胞成熟。中国病毒学杂志,2009;83:2962-75。
中科院PubMed公共医学中心谷歌学者
对于EE, Broughton BR, Hendricks KS, Vlahos R, Selemidis S.甲型流感病毒和TLR7激活增强了巨噬细胞中NOX2氧化酶依赖性ROS的产生。自由基法案2014;48:940-7。
中科院PubMed谷歌学者
田娟,焦鑫,王鑫,耿娟,王锐,刘楠,高鑫,Griffin N,单峰。甲硫氨酸脑啡肽通过抑制TLR7-MyD88-TRAF6-NF-kappaB p65信号通路抗甲型流感病毒感染的新作用。《免疫药物学杂志》2018;55:38-48。
中科院PubMed谷歌学者
Heil F, Hemmi H, Hochrein H, Ampenberger F, Kirschning C, Akira S, Lipford G, Wagner H, Bauer S.通过toll样受体7和8识别单链RNA的物种特异性。科学。2004;303:1526-9。
中科院PubMed谷歌学者
韩X,李X,岳SC, Anandaiah A, Hashem F, Reinach PS, Koziel H, Tachado SD。HIV-1单链RNA (ssRNA)对人巨噬细胞肿瘤坏死因子α (TNFalpha)释放的表观遗传调控依赖于TLR8信号通路。中国生物化学杂志,2012;
中科院PubMed公共医学中心谷歌学者
Bernard MA, Han X, Inderbitzin S, Agbim I, Zhao H, Koziel H, Tachado SD。hiv来源的ssRNA与TLR8结合,诱导炎症驱动的巨噬细胞泡沫细胞形成。PLoS ONE。2014; 9: e104039。
PubMed公共医学中心谷歌学者
Krug A, French AR, Barchet W, Fischer JA, Dzionek A, Pingel JT, Orihuela MM, Akira S, Yokoyama WM, Colonna M. IPC和DC对MCMV的tlr9依赖识别产生协调的细胞因子反应,激活抗病毒NK细胞功能。免疫力。2004;21:107-19。
中科院PubMed谷歌学者
Zolini GP, Lima GK, Lucinda N, Silva MA, Dias MF, Pessoa NL, Coura BP, Cartelle CT, Arantes RM, Kroon EG, Campos MA。在小鼠模型中,对HSV-1的防御是由iNOS介导的,并由三叉神经节中TLR2和TLR9的激活协调。神经炎症杂志2014;11:20。
PubMed公共医学中心谷歌学者
Parroche P, Lauw FN, Goutagny N, Latz E, Monks BG, Visintin A, Halmen KA, Lamphier M, Olivier M, Bartholomeu DC,等。疟疾疟原虫色素在免疫上是惰性的,但通过向toll样受体9呈递疟疾DNA从根本上增强先天反应。中国科学院学报(自然科学版)2007;104:1919-24。
中科院PubMed公共医学中心谷歌学者
Santamaria MH, Perez Caballero E, Corral RS.弓形虫DNA中未甲基化的CpG基序诱导肠上皮细胞中α -防御素-5的TLR9和ifn - β依赖表达。寄生虫学。2016;143:60-8。
中科院PubMed谷歌学者
Pohar J, Yamamoto C, Fukui R, Cajnko MM, Miyake K, Jerala R, Bencina M.人TLR9对双cpg基序的选择性及其对基因组DNA识别的影响。中华免疫杂志,2017;198:2093-104。
中科院PubMed谷歌学者
成人单纯疱疹病毒1型脑炎:病理生理学、诊断和治疗。神经病治疗。2016;13:493 - 508。
中科院PubMed公共医学中心谷歌学者
Mader J, Gallo A, Schommartz T, Handke W, Nagel CH, Gunther P, Brune W, Reich K.从螺旋藻中提取的螺旋藻钙抑制单纯疱疹病毒1附着在人角质形成细胞上,对唇疱疹具有保护作用。中华变态反应临床免疫杂志,2016;37(1):1 - 3。
谷歌学者
Koyanagi N,今井T, Shindo K,佐藤A,藤井W,一野和T,竹村N,角田S,植松S,清野H,等。单纯疱疹病毒-1逃避CD8+ T细胞积累有助于病毒性脑炎。中国临床医学杂志,2017;
PubMed公共医学中心谷歌学者
Majer A, Caligiuri KA, Gale KK, Niu Y, Phillipson CS, Booth TF, Booth SA。小鼠大脑中多个miR-200/182成员的诱导与急性单纯疱疹病毒1型脑炎相关。PLoS ONE。2017; 12: e0169081。
PubMed公共医学中心谷歌学者
Suazo PA, Tognarelli EI, Kalergis AM, Gonzalez PA。单纯疱疹病毒2型感染:与HIV和新型杀微生物剂的分子关联以预防疾病。医学微生物免疫学杂志2015;204:161-76。
中科院PubMed谷歌学者
Hensel MT, Marshall JD, Dorwart MR, Heeke DS, Rao E, Tummala P, Yu L, Cohen GH, Eisenberg RJ, Sloan DD:用稳定乳剂和toll样受体9激动剂佐剂的预防性单纯疱疹病毒2 (HSV-2)疫苗可诱导强大的HSV-2特异性细胞介导免疫反应,预防症状性疾病,并减少潜在的病毒库.J病毒2017,91.
Betta M, Laurino M, Pugliese A, Guzzetta G, Landi A, Manfredi P.大规模常规水痘接种对水痘和带状疱疹最佳控制的展望。Proc生物科学2016;283:20160054。
PubMed公共医学中心谷歌学者
水痘带状疱疹病毒血管病变:扩大的临床谱系和发病机制。中国神经免疫杂志,2017;
中科院PubMed公共医学中心谷歌学者
邓米尔SK,霍格奎斯特KA,巴尔福HH。传染性单核细胞增多症。中国生物医学工程学报,2015;29(4):531 - 531。
中科院PubMed公共医学中心谷歌学者
辛维AK,哈林顿AM,芬斯克TS.移植后淋巴增生性疾病。癌症治疗决议2015;165:305-27。
PubMed谷歌学者
张娟,贾林,曾明昌,曹文伟。EBV感染与鼻咽癌糖代谢的关系。Adv Exp Med biology, 2017; 18:75 - 90。
中科院PubMed谷歌学者
Abdelrahim LM, Peh SC, Kallarakkal TG。eb病毒在口腔颌面部b细胞非霍奇金淋巴瘤中的感染:有证据吗?《马来病毒学杂志》2018;40:49-56。
中科院PubMed谷歌学者
默丫。急性获得性巨细胞病毒感染的感染性单核细胞增多样综合征和胃肠道疾病。新加坡医学杂志,2005;46:421-3。
中科院PubMed谷歌学者
Yonezawa A, Onaka T, Imada K.巨细胞病毒相关传染性单核细胞增多综合征伴CD8+ T细胞短暂单克隆扩增。林正。2009;50:652-7。
PubMed谷歌学者
Leach CT。儿童人类疱疹病毒-6和-7感染:红疹和其他综合征的病因儿科,2000;12:269-74。
中科院PubMed谷歌学者
Razonable RR, Paya CV。人疱疹病毒-6和-7感染对肝移植结果的影响肝脏移植,2002;8:651-8。
PubMed谷歌学者
bose S, Roque-Afonso AM, Vaghefi P, Gigou M, Dussaix E, ducros - vallee JC, Samuel D, Guettier C.肝移植患者并发人疱疹病毒6感染的急性肝炎合并门静脉周围融合性坏死。中华临床病理学杂志,2013;
PubMed谷歌学者
绪方M,大岛K,池部T,高野K,金森H,近藤T,上田Y,森T,桥本H,小川H,等。异基因造血干细胞移植后人疱疹病毒-6脑炎的临床特征和预后。骨髓移植。2017;52:1563-70。
中科院PubMed谷歌学者
卡波西肉瘤相关疱疹病毒:一种与卡波西肉瘤、原发性积液淋巴瘤和多中心卡波西病相关的嗜淋巴人疱疹病毒。中华实用诊断学杂志,1997;14(4):344 - 344。
中科院PubMed谷歌学者
说J.卡波西肉瘤相关疱疹病毒(KSHV):一种与卡波西肉瘤、原发性积液淋巴瘤和多中心Castleman病相关的新病毒病原体。西部医学,1997;167:37-8。
中科院PubMed公共医学中心谷歌学者
van Rhee F, Wong RS, Munshi N, Rossi JF, Ke XY, Fossa A, Simpson D, Capra M,刘涛,Hsieh RK,等。Siltuximab治疗多中心Castleman病:随机、双盲、安慰剂对照试验《柳叶刀》,2014;15:966-74。
PubMed谷歌学者
Mariggio G, Koch S, Schulz TF:卡波西肉瘤疱疹病毒发病机制.中国生物工程学报2017,372.
哈里斯KD。单纯疱疹病毒性角膜炎。家庭健康,2019;37:281-4。
PubMed谷歌学者
Vitale S, Loubatier C, Cannavo I, Giordanengo V.由于US7基因单核苷酸多态性导致的HSV-1感染分子诊断问题。中国临床病毒学杂志2019;
中科院PubMed谷歌学者
孙玲,李强。单纯疱疹病毒(HSV)的mirna。生物学报。2012;27:33 - 8。
PubMed谷歌学者
Peri P, Mattila RK, Kantola H, Broberg E, Karttunen HS, Waris M, Vuorinen T, Hukkanen v单纯疱疹病毒1型Us3基因缺失对培养单核细胞toll样受体应答的影响病毒J. 2008;5:14 4。
PubMed公共医学中心谷歌学者
van Lint AL, Murawski MR, Goodbody RE, Severa M, Fitzgerald KA, Finberg RW, Knipe DM, Kurt-Jones EA.单纯疱疹病毒即早期ICP0蛋白抑制toll样受体2依赖的炎症反应和NF-kappaB信号。中国病毒学杂志,2010;84:10802-11。
PubMed公共医学中心谷歌学者
Cermelli C, Orsi CF, Ardizzoni A, Lugli E, Cenacchi V, Cossarizza A, Blasi E.单纯疱疹病毒1型抗真菌防御异常,阻止单核细胞激活和下调toll样受体2。微生物学杂志2008;52:575-84。
中科院PubMed谷歌学者
贾吉琪,王淑娟,王志强,马丹丹,刘比莫夫,王志强。单纯疱疹病毒1型(HSV-1)糖蛋白K (gK)致病CD8(+) T细胞在眼病恶化中的作用。前沿免疫。2018;9:2895。
中科院PubMed公共医学中心谷歌学者
陆霞,黄超,张艳,林艳,王霞,李强,刘松,唐娟,周玲。单纯疱疹病毒2的Us2基因产物通过靶向TAK1调控NF-kappaB的激活。科学通报2017;7:8396。
PubMed公共医学中心谷歌学者
郭玉娟,罗涛,吴峰,梅玉文,彭健,刘辉,李海红,张世林,董建辉,方勇,赵玲。TLR2和TLR9参与绿原酸对hsv -1感染小胶质细胞的抗炎作用。生命科学学报,2015;
中科院PubMed谷歌学者
王旭,李勇,刘松,余旭,李磊,石超,何伟,李静,徐磊,胡忠,等。单纯疱疹病毒1 (HSV-1)蛋白ICP6直接激活RIP3/ mlkl依赖性坏死,触发宿主抗病毒防御。中国科学院学报(自然科学版),2014;
中科院PubMed公共医学中心谷歌学者
王俊杰,周s,王俊杰,王俊杰。单纯疱疹病毒感染中枢神经系统特异性先天免疫反应的研究进展。中国病毒学杂志,2012;86:2273-81。
中科院PubMed公共医学中心谷歌学者
Kurt-Jones EA, Chan M, Zhou S, Wang J, Reed G, Bronson R, Arnold MM, Knipe DM, Finberg RW。单纯疱疹病毒1与toll样受体2相互作用可导致致命性脑炎。中国科学院学报(自然科学版)2004;
中科院PubMed公共医学中心谷歌学者
Sorensen LN, Reinert LS, Malmgaard L, Bartholdy C, Thomsen AR, Paludan SR. TLR2和TLR9协同控制大脑单纯疱疹病毒感染。中华免疫杂志2008;181:8604-12。
中科院PubMed谷歌学者
Leoni V, Gianni T, Salvioli S, Campadelli-Fiume G.单纯疱疹病毒糖蛋白gH/gL和gB与toll样受体2结合,可溶性gH/gL足以激活NF-kappaB。中国病毒学杂志,2012;86:655 - 62。
中科院PubMed公共医学中心谷歌学者
陈敏,金世,许志勇,李美,金敏,白胜,李海,李卓。由三酰化脂肽结合诱导的TLR1-TLR2异源二聚体的晶体结构。细胞。2007;130:1071 - 82。
中科院PubMed谷歌学者
刘红,陈凯,冯伟,吴霞,李慧。TLR4-MyD88/Mal-NF-kB轴参与HSV-2感染人宫颈上皮细胞PLoS ONE。2013; 8: e80327。
PubMed公共医学中心谷歌学者
Villalba M, Hott M, Martin C, Aguila B, Valdivia S, Quezada C, Zambrano A, Concha MI, Otth C单纯疱疹病毒1型诱导toll样受体2和4同时激活,并在星形胶质细胞中表达内源性配体血清淀粉样蛋白A。医学微生物免疫杂志,2012;201:371-9。
中科院PubMed谷歌学者
Brun P, Scarpa M, Marchiori C, Conti J, Kotsafti A, Porzionato A, De Caro R, Scarpa M, Calistri A, Castagliuolo i单纯疱疹病毒1型在肠道神经元感染过程中利用toll样受体2招募巨噬细胞。前沿微生物,2018;9:2148。
PubMed公共医学中心谷歌学者
Strickson S, Emmerich CH, Goh ETH, Zhang J, Kelsall IR, Macartney T, Hastie CJ, Knebel A, Peggie M, Marchesi F,等。TRAF6和Pellino E3连接酶在MyD88和RANKL信号通路中的作用中国科学院学报(自然科学版),2017;
中科院PubMed公共医学中心谷歌学者
金月亮G J,最小值Y, Wi SM,垫片JH,春E,李肯塔基州。磷酸肌醇依赖激酶-1通过中断TLR4信号通路中TAK1-TAB2复合物的形成抑制TRAF6的泛素化。手机信号。2015;27:2524-33。
中科院PubMed谷歌学者
Vollmer S, Strickson S, Zhang T, Gray N, Lee KL, Rao VR, Cohen P.白细胞介素-1和toll样受体激动剂激活IRAK1和IRAK4的机制。生物化学杂志,2017;474:2027-38。
中科院PubMed谷歌学者
林春生,罗玉春,吴华。MyD88-IRAK4-IRAK2复合物在TLR/IL-1R信号通路中的螺旋组装。大自然。2010;465:885 - 90。
中科院PubMed公共医学中心谷歌学者
Besse A, Lamothe B, Campos AD, Webster WK, Maddineni U, Lin SC, Wu H, Darnay BG。依赖tak1的信号通路需要与TAB2/TAB3的功能相互作用。中国生物化学杂志,2007;
中科院PubMed谷歌学者
Broglie P, Matsumoto K, Akira S, Brautigan DL, Ninomiya-Tsuji J. TAK1激酶接头TAK1结合蛋白2通过在肿瘤坏死因子信号通路中招募TAK1激酶的激活物和抑制剂,在TAK1信号通路中发挥双重作用。中国生物医学工程学报,2010;
中科院PubMed谷歌学者
孙林,邓林,艾志强,夏志平,陈志军。在T淋巴细胞中,TRAF6泛素连接酶和TAK1激酶介导BCL10和MALT1激活IKK。生物化学学报。2004;14(4):369 - 369。
中科院PubMed谷歌学者
Kim ML, Jeong HG, Kasper CA, Arrieumerlou C. IKKalpha参与nod1介导的肽聚糖识别下游典型NF-kappaB激活。PLoS ONE。2010; 5: e15371。
PubMed公共医学中心谷歌学者
Mansur DS, Kroon EG, Nogueira ML, Arantes RM, Rodrigues SC, Akira S, Gazzinelli RT, Campos MA。单纯疱疹病毒1感染髓样分化因子88缺陷小鼠致死性脑炎Am J Pathol. 2005; 166:1419-26。
中科院PubMed公共医学中心谷歌学者
蔡敏,李敏,王凯,王松,吕强,闫娟,Mossman KL,林瑞,郑晨。单纯疱疹病毒1编码包膜糖蛋白B通过toll样受体2和MyD88/ traf6依赖信号通路激活NF-kappaB。PLoS ONE。2013; 8: e54586。
中科院PubMed公共医学中心谷歌学者
Gianni T, Leoni V, Campadelli-Fiume G.单纯疱疹病毒gH/gL通过alphavbeta3整合素在上皮和神经元细胞系中诱导I型干扰素和NF-kappaB激活中国病毒学杂志,2013;87:13911-6。
中科院PubMed公共医学中心谷歌学者
金文杰,崔继伟,张文杰,姜玉生,李长波,Synytsya,朴毅。低分子量甘露半乳聚糖通过激活toll样受体2来预防单纯疱疹病毒1型感染。中国生物医学杂志,2017;
中科院PubMed谷歌学者
Vageli DP, Exarchou A, Zafiriou E, Doukas PG, Doukas S, rousski - schulze A. tnf - α抑制剂对银屑病斑块促炎白细胞介素-33和toll样受体-2和-9转录水平的影响中华外科杂志2015;10:1573-7。
中科院PubMed公共医学中心谷歌学者
蔡淑梅,李明兰,郑芳芳。疱疹病毒感染与toll样受体2。中国生物医学工程学报。2012;3:59 - 601。
中科院PubMed公共医学中心谷歌学者
Aravalli RN, Hu S, Rowen TN, Palmquist JM, Lokensgard JR.前沿:tlr2介导的促炎细胞因子和趋化因子的产生对单纯疱疹病毒的反应。中华免疫杂志,2005;
中科院PubMed谷歌学者
吕霞,王红,苏安,徐松,褚艳。单纯疱疹病毒2型感染通过TLR4信号通路触发生殖器上皮细胞AP-1转录活性。病毒学报,2018;
中科院PubMed公共医学中心谷歌学者
王晓燕,王晓燕,王晓燕,等。HSV-1诱导人单核细胞IL-15基因表达的研究进展。血。2008;112:2360-8。
中科院PubMed谷歌学者
Kurt-Jones EA, Belko J, Yu C, Newburger PE, Wang J, Chan M, Knipe DM, Finberg RW。toll样受体在新生儿单纯疱疹感染中的作用。中华传染病杂志,2005;
中科院PubMed谷歌学者
肖志刚,胡淑娟,李志刚,李志刚。单纯疱疹病毒通过小胶质细胞toll样受体-2诱导神经氧化损伤。神经炎症杂志。2010;7:35。
PubMed公共医学中心谷歌学者
Reinert LS, Harder L, Holm CK, Iversen MB, Horan KA, Dagnaes-Hansen F, Ulhoi BP, Holm TH, Mogensen TH, Owens T,等。TLR3缺失使星形胶质细胞对单纯疱疹病毒感染具有许可性,并促进小鼠中枢神经系统感染的建立。中国科学(d辑),2012;
中科院PubMed公共医学中心谷歌学者
Willmann O, ahmadi - nejad P, Neumaier M, Hennerici MG, Fatar M. toll样受体3免疫缺陷可能导致hsv -2相关的mollaret脑膜炎。神经科学。2010;63:249-51。
PubMed谷歌学者
Tabeta K, Hoebe K, Janssen EM, Du X, Georgel P, Crozat K, Mudd S, Mann N, Sovath S, Goode J,等。Unc93b1突变3d通过toll样受体3,7和9破坏外源性抗原的呈递和信号。中华免疫杂志,2006;7:156-64。
中科院PubMed谷歌学者
Brinkmann MM, Spooner E, Hoebe K, Beutler B, Ploegh HL, Kim YM。ER膜蛋白UNC93B与TLR3、7和9之间的相互作用对TLR信号通路至关重要。中国生物医学工程学报,2007;
中科院PubMed公共医学中心谷歌学者
Kim YM, Brinkmann MM, Paquet ME, Ploegh HL。UNC93B1将核苷酸传感toll样受体传递给内溶酶体。大自然。2008;452:234-8。
中科院PubMed谷歌学者
Pelka K, Bertheloot D, Reimer E, Phulphagar K, Schmidt SV, Christ A, Stahl R, Watson N, Miyake K, Hacohen N,等。伴侣UNC93B1调节toll样受体的稳定性,独立于内体TLR转运。免疫力。2018;48 (911 - 922):e917。
谷歌学者
李志强,李志强,李志强,等。toll样受体对先天性免疫功能的影响。临床微生物学Rev. 2008; 21:13-25。
中科院PubMed公共医学中心谷歌学者
徐秀华,李秀华,李秀华。中枢神经系统病毒感染中的toll样受体。中国生物医学工程杂志,2009;36:433 - 433。
中科院PubMed谷歌学者
Mielcarska MB, Bossowska-Nowicka M, Toka FN。TLR3及其信号组分的功能失效有助于单纯疱疹性脑炎。中国神经免疫杂志,2018;
中科院PubMed谷歌学者
Weber F, Wagner V, Rasmussen SB, Hartmann R, Paludan SR.双链RNA由正链RNA病毒和DNA病毒产生,但在负链RNA病毒中检测不到数量。中国病毒学杂志2006;80:5059-64。
中科院PubMed公共医学中心谷歌学者
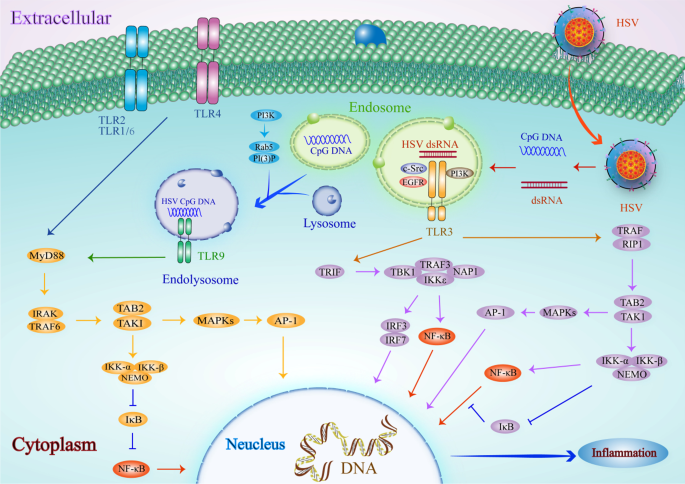
沃尔AA,罗林,洪勇,唐世杰,Condon ND, Blumenthal A, Sweet MJ, Stow JL。小GTPase rab8a募集磷脂酰肌醇3-激酶γ调节信号和细胞因子输出从内体toll样受体。中国生物医学工程学报,2017;
中科院PubMed公共医学中心谷歌学者
孙华,庄刚,柴林,王铮,约翰逊D,马勇,陈永华。TIPE2通过靶向磷脂酰肌醇3激酶- rac途径控制对RNA的先天免疫。中华免疫杂志,2012;
中科院PubMed谷歌学者
Yamashita M, Chattopadhyay S, Fensterl V, Saikia P, Wetzel JL, Sen GC。表皮生长因子受体在toll样受体3信号通路中起重要作用。科学通报。2012;5:ra50。
PubMed公共医学中心谷歌学者
Donepudi M, Resh MD. c-Src与EGF受体的转运和共定位促进了EGF配体独立的EGF受体激活和信号通路。《手机信号》,2008;20:1359-67。
中科院PubMed公共医学中心谷歌学者
考夫JL,邵MX,上木IF,纳德尔JA。多个TLRs通过信号级联激活EGFR,在气道上皮中产生先天免疫反应。中国生物医学工程杂志。2008;29(2):1066 - 1066。
中科院PubMed谷歌学者
Johnsen IB, Nguyen TT, Ringdal M, Tryggestad AM, Bakke O, Lien E, Espevik T, Anthonsen MW。toll样受体3与c-Src酪氨酸激酶结合在核内体上启动抗病毒信号。Embo j . 2006; 25:3335-46。
中科院PubMed公共医学中心谷歌学者
内藤E, Dewa K,山内H,三谷K,小米南R.基于磺化DNA非放射性探针的DNA指纹。日本生作。1989;43:24 5 - 5。
中科院PubMed谷歌学者
Oshiumi H, Matsumoto M, Funami K, Akazawa T, Seya T. TICAM-1,一种参与toll样受体3介导的干扰素诱导的适配器分子。中华免疫杂志2003;4:161-7。
中科院PubMed谷歌学者
Yamamoto M, Sato S, Hemmi H, Hoshino K, Kaisho T, Sanjo H, Takeuchi O, Sugiyama M, Okabe M, Takeda K, Akira S转接器TRIF在myd88独立toll样受体信号通路中的作用科学。2003;301:640-3。
中科院PubMed谷歌学者
jung SM, Park ZY, Rani S, Takeuchi O, Akira S, Lee JY. Akt通过与TANK-binding kinase 1相互作用激活TLRs依赖的信号通路。中华免疫杂志2011;186:499-507。
中科院PubMed谷歌学者
韩kj,苏旭,徐乐革,斌LH,张军,舒海波。trif诱导的干扰素刺激反应元件和NF-kappaB激活和凋亡途径的机制。中国生物化学杂志,2004;
中科院PubMed谷歌学者
Ruckdeschel K, Pfaffinger G, Haase R, Sing A, Weighardt H, Hacker G, Holzmann B, Heesemann J.在细菌感染的小鼠巨噬细胞中,细胞凋亡的信号通路主要涉及toll/IL-1受体结构域的连接体诱导ifn - β,而不是MyD88。中华免疫杂志2004;173:320 - 8。
中科院PubMed谷歌学者
Ueda S, Mineta T, Nakahara Y, Okamoto H, Shiraishi T, Tabuchi K.地塞米松对胶质母细胞瘤DNA修复基因o6 -甲基鸟嘌呤-DNA甲基转移酶的诱导。中华神经外科杂志,2004;01:659 - 63。
中科院PubMed谷歌学者
Sasai M, Oshiumi H, Matsumoto M, Inoue N, Fujita F, Nakanishi M, Seya T.前沿:nf - kapab激活激酶相关蛋白1参与TLR3/Toll-IL-1同源结构域包含适配体分子1介导的IFN调节因子3激活。中华免疫杂志,2005;34(4):344 - 344。
中科院PubMed谷歌学者
黑客H, Redecke V, Blagoev B, Kratchmarova I, Hsu LC, Wang GG, Kamps MP, Raz E, Wagner H,黑客G,等。通过TRAF3和TRAF6的不同效应功能,toll样受体信号传递的特异性。大自然。2006;439:204-7。
PubMed谷歌学者
Oganesyan G, Saha SK, Guo B, He JQ, Shahangian A, Zarnegar B, Perry A, Cheng G. TRAF3在toll样受体依赖性和非依赖性抗病毒应答中的关键作用。大自然。2006;439:208-11。
中科院PubMed谷歌学者
Fitzgerald KA, McWhirter SM, Faia KL, Rowe DC, Latz E, Golenbock DT, Coyle AJ, Liao SM, Maniatis T. IKKepsilon和TBK1是IRF3信号通路的重要组成部分。中华免疫杂志2003;4:491-6。
中科院PubMed谷歌学者
Doyle S, Vaidya S, O 'Connell R, Dadgostar H, Dempsey P, Wu T, Rao G, Sun R, Haberland M, Modlin R, Cheng G. IRF3介导TLR3/ tlr4特异性抗病毒基因程序。免疫力。2002;17:251 - 63。
中科院PubMed谷歌学者
刘震,关勇,孙霞,石玲,梁锐,吕霞,辛伟。HSV-1通过toll样受体3激活小鼠星形胶质细胞NF-kappaB,增加tnf - α和IL-6的表达。神经科学,2013;35:755-62。
中科院PubMed谷歌学者
Jiang Z, Zamanian-Daryoush M, Nie H, Silva AM, Williams BR, Li X. Poly(I-C)诱导的toll样受体3 (TLR3)介导的NFkappa B和MAP激酶的激活是通过使用TLR3- traf6 - tak1 - tab2 - pkr信号成分的白细胞介素-1受体相关激酶(IRAK)独立途径实现的。中国生物化学杂志,2003;
中科院PubMed谷歌学者
沈建辉,肖c,陈志强,陈志强,陈志强,陈志强,等。TAK1在体内多条信号通路中起重要作用,而不是TAB1或TAB2。基因工程学报,2005;
中科院PubMed公共医学中心谷歌学者
Meylan E, Burns K, Hofmann K, Blancheteau V, Martinon F, Kelliher M, Tschopp J. RIP1是toll样受体3诱导NF-kappa B激活的重要介质。中华免疫杂志2004;5:503-7。
中科院PubMed谷歌学者
以色列a . IKK复合体,NF-kappaB激活的中心调节因子。中国生物医学工程学报。2010;2:a000158。
PubMed公共医学中心谷歌学者
马勇,何斌。单纯疱疹病毒的识别:toll样受体及其以外。中华分子生物学杂志,2014;426:1133-47。
中科院PubMed谷歌学者
Sato S, Sugiyama M, Yamamoto M, Watanabe Y, Kawai T, Takeda K, Akira S Toll/IL-1受体域包含适配器诱导ifn - β (TRIF)与TNF受体相关因子6和tank结合激酶1结合,并激活两种不同的转录因子,NF-kappa B和ifn -调节因子-3,在Toll样受体信号通路中。中华免疫杂志,2003;
中科院PubMed谷歌学者
Gohda J, Matsumura T, Inoue J.前沿:tnfr相关因子(TRAF) 6在TLR信号通路中对myd88依赖通路至关重要,而不是toll/IL-1受体结构域包含转体诱导ifn - β (TRIF)依赖通路。中华免疫杂志,2004;
中科院PubMed谷歌学者
Hochrein H, Schlatter B, O 'Keeffe M, Wagner C, Schmitz F, Schiemann M, Bauer S, Suter M, Wagner H.单纯疱疹病毒1型通过依赖toll样受体9和不依赖受体的途径诱导ifn - α的产生。中国科学院学报(自然科学版)2004;
中科院PubMed公共医学中心谷歌学者
李丽娟,李丽娟,李丽娟,李丽娟,等。toll样受体9介导的单纯疱疹病毒2型在树突状细胞中的识别。中华检验医学杂志,2003;
中科院PubMed公共医学中心谷歌学者
吴昌昌,李J, Raz E, Corr M, Carson DA。toll样受体9激活寡核苷酸聚集的必要性。生物化学学报,2004;29(2):33071 - 8。
中科院PubMed谷歌学者
Latz E, Schoenemeyer A, Visintin A, Fitzgerald KA, Monks BG, knnetter CF, Lien E, Nilsen NJ, Espevik T, Golenbock DT。TLR9信号在溶酶体中从ER转移到CpG DNA。中华免疫杂志2004;5:190-8。
中科院PubMed谷歌学者
Zeigerer A, Gilleron J, Bogorad RL, Marsico G, Nonaka H, Seifert S, Epstein-Barash H, Kuchimanchi S, Peng CG, Ruda VM,等。Rab5是体内内溶酶体系统生物发生所必需的。大自然。2012;485:465 - 70。
中科院PubMed谷歌学者
Rink J, Ghigo E, Kalaidzidis Y, Zerial M. Rab转化作为从早期到晚期核内体的进展机制。细胞。2005;122:735-49。
中科院PubMed谷歌学者
McDermott H, Kim K.内吞入口的分子动力学和内吞和循环交通的规则。中国生物医学工程学报(英文版);
中科院PubMed谷歌学者
霍塔丽,李志刚,李志刚,核内体成熟。Embo j . 2011; 30:3481-500。
中科院PubMed公共医学中心谷歌学者
Futter CE, Collinson LM, Backer JM, Hopkins CR.人VPS34在多泡核内体内囊泡形成中是必需的。中国生物医学工程学报,2001;
中科院PubMed公共医学中心谷歌学者
Vieira OV, Botelho RJ, Rameh L, Brachmann SM, Matsuo T, Davidson HW, Schreiber A, Backer JM, Cantley LC, Grinstein S.一类和三类磷脂酰肌醇3激酶在吞噬体形成和成熟中的独特作用。中国生物医学工程学报,2001;
中科院PubMed公共医学中心谷歌学者
Shuto T,徐辉,王波,韩杰,Kai H,顾xx, Murphy TF, Lim DJ,李建德。非分型流感嗜血杆菌对NF-kappa B的激活是由上皮细胞中依赖toll样受体2- tak1的NIK-IKK α / β - i kappa B α和MKK3/6-p38 MAP激酶信号通路介导的。中国科学院学报(自然科学版)2001;
中科院PubMed公共医学中心谷歌学者
Takeshita F, Leifer CA, Gursel I, Ishii KJ, Takeshita S, Gursel M, Klinman DM.前沿:toll样受体9在CpG dna诱导的人类细胞激活中的作用。中华免疫杂志2001;167:3555-8。
中科院PubMed谷歌学者
蒋喆,Ninomiya-Tsuji J, Qian Y, Matsumoto K,李霞。白细胞介素-1 (IL-1)受体相关激酶依赖的IL-1诱导信号复合物磷酸化质膜上的TAK1和TAB2,并激活细胞质中的TAK1。细胞生物学杂志,2002;22:7158-67。
中科院PubMed公共医学中心谷歌学者
Takeshita F, Gursel I, Ishii KJ, Suzuki K, Gursel M, Klinman DM. CpG DNA与toll样受体相互作用介导的信号转导通路。中华免疫杂志2004;16:17-22。
中科院PubMed谷歌学者
Gomes MT, Campos PC, Pereira Gde S, Bartholomeu DC, Splitter G, Oliveira SC.激活MAPK/ pf - kappab需要TLR9,但不与TLR2或TLR6合作诱导宿主对中止布鲁氏菌的抗性。中华生物医学杂志,2016;99:771-80。
中科院PubMed谷歌学者
王伟,王晓明,王晓明。NF-kappaB诱导激酶对NF-kappaB激活通路的受体特异性信号通路研究。免疫力。2004;21:477 - 89。
中科院PubMed谷歌学者
Yamaoka S, Courtois G, Bessia C, Whiteside ST, Weil R, Agou F, Kirk HE, Kay RJ, Israel a . NF-kappaB活化必需的IkappaB激酶复合物组分NEMO的互补克隆。细胞。1998;93:1231-40。
中科院PubMed谷歌学者
Hacker H, Mischak H, Hacker G, Eser S, Prenzel N, Ullrich A, Wagner H. CpG-DNA对丝裂原活化蛋白激酶的细胞类型特异性激活控制抗原提呈细胞释放白介素-12。中国科学院学报(自然科学版),1999;
中科院PubMed公共医学中心谷歌学者
哈特曼G,克里格AM。新发现的CpG DNA基序在人原代B细胞中的机制和功能。中华免疫杂志2000;164:944-53。
中科院PubMed谷歌学者
阮敏,Thorn K,刘珊,李松,杨伟,张晨,张晨。cpg - odn处理的癌细胞分泌IL-6部分通过TLR-9/AP-1途径促进口腔鳞状细胞癌t细胞免疫应答。国际肿瘤学杂志,2014;44:2103-10。
中科院PubMed谷歌学者
缪俊杰,王志强,王志强,王志强。水痘带状疱疹病毒感染:临床特征、疾病的分子发病机制和潜伏期。神经临床杂志2008;26:675-97。
PubMed公共医学中心谷歌学者
Campbell TM, McSharry BP, Steain M, Slobedman B, Abendroth A.水痘带状疱疹病毒和单纯疱疹病毒1在生产性感染过程中对NKG2D配体表达的差异调节。中国病毒学杂志,2015;
中科院PubMed公共医学中心谷歌学者
Wang JP, Kurt-Jones EA, Shin OS, Manchak MD, Levin MJ, Finberg RW。水痘带状疱疹病毒通过toll样受体2激活人单核细胞和巨噬细胞中的炎性细胞因子。中国病毒学杂志,2005;79:12658-66。
中科院PubMed公共医学中心谷歌学者
Black AP, Jones L, Malavige GN, Ogg GS。水痘带状疱疹病毒感染角质形成细胞时的免疫逃避。中华临床医学杂志。2009;34:e941-944。
中科院PubMed谷歌学者
于宏辉,黄宏宏,郭宏宏,辛建明,欧春,徐泰,杨德东。水痘带状疱疹病毒感染的人单个核细胞通过tlr9依赖和-独立途径产生ifn - α细胞免疫杂志2011;8:181-8。
中科院PubMed公共医学中心谷歌学者
Malmgaard L, Melchjorsen J, Bowie AG, Mogensen SC, Paludan SR.病毒通过tlr依赖和-独立途径激活巨噬细胞。中华免疫杂志2004;173:6890-8。
中科院PubMed谷歌学者
Sironi M, Peri AM, Cagliani R, Forni D, Riva S, Biasin M, Clerici M, Gori A.成人单纯疱疹病毒和水痘带状疱疹病毒脑炎患者TLR3突变中华流行病学杂志,2017;15(3):344 - 344。
中科院PubMed谷歌学者
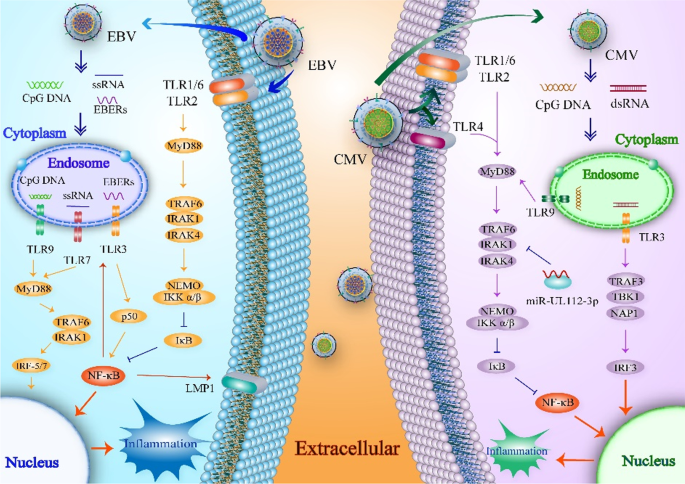
艾博年,田川,吴晓明,王晓明,等:eb病毒的MicroRNAs与先天性和适应性抗病毒免疫的关系。J病毒2017,91.
van Gent M, Braem SG, de Jong A, Delagic N, Peeters JG, Boer IG, Moynagh PN, Kremmer E, Wiertz EJ, Ovaa H,等。爱泼斯坦-巴尔病毒大被膜蛋白BPLF1通过干扰toll样受体信号通路参与先天免疫逃避。科学通报。2014;10:e1003960。
PubMed公共医学中心谷歌学者
van Gent M, Gram AM, Boer IGJ, Geerdink RJ, Lindenbergh MFS, Lebbink RJ, Wiertz EJ, ress ME。在多产的被感染的B细胞中沉默eb病毒的关闭蛋白指向了(先天的)免疫逃避目标。中国病毒学杂志,2015;96:858-65。
PubMed谷歌学者
van Gent M, Griffin BD, Berkhoff EG, van Leeuwen D, Boer IG, Buisson M, Hartgers FC, Burmeister WP, Wiertz EJ, resing ME。EBV溶相蛋白BGLF5在生产性感染过程中有助于TLR9的下调。中华免疫杂志2011;186:1694-702。
PubMed谷歌学者
Gaudreault E, Fiola S, Olivier M, Gosselin J. Epstein-Barr病毒通过TLR2诱导人单核细胞分泌MCP-1。中国病毒学杂志。2007;81:8016-24。
中科院PubMed公共医学中心谷歌学者
Ntoufa S, Vilia MG, Stamatopoulos K, Ghia P, Muzio M. toll样受体信号:b细胞淋巴样恶性肿瘤中NF-kappaB激活的复杂网络。中国肿瘤杂志2016;39:15-25。
中科院PubMed谷歌学者
李震,段勇,程胜,陈勇,胡勇,张磊,何娟,廖强,杨林,孙丽强。ebv编码RNA经TLR3诱导鼻咽癌炎症反应。Oncotarget。2015;6:24291 - 303。
PubMed公共医学中心谷歌学者
爱泼斯坦-巴尔病毒编码rna:病毒发病机制中的关键分子。癌症(巴塞尔)。2014; 6:1615-30。
谷歌学者
Martin HJ, Lee JM, Walls D, Hayward SD。eb病毒对toll样受体7信号通路的操纵。中国病毒学杂志,2007;81:9748-58。
中科院PubMed公共医学中心谷歌学者
Schoenemeyer A, Barnes BJ, Mancl ME, Latz E, Goutagny N, Pitha PM, Fitzgerald KA, Golenbock DT。干扰素调节因子IRF5是toll样受体7信号转导的中心中介。中国生物医学工程学报,2005;
中科院PubMed谷歌学者
菲德勒R,科斯特M,鲍曼M,扬兹A,杜洛埃E,汉默施密特W,德勒克卢泽HJ。爱泼斯坦-巴尔病毒裂解程序由两个转激活子的协同作用控制。中国科学院学报,2000;
中科院PubMed公共医学中心谷歌学者
Ladell K, Dorner M, Zauner L, Berger C, Zucol F, Bernasconi M, Niggli FK, Speck RF,纳达尔D.免疫激活抑制溶解eb病毒感染的启动。细胞微生物学,2007;9:2055-69。
中科院PubMed谷歌学者
崔giai E, Becker S, Subbarao K, Kolesnikova L, Uematsu Y, Gismondo MR, Murphy BR, Rappuoli R, Lanzavecchia A.记忆B细胞制备人单克隆抗体的高效方法:对SARS冠状病毒的有效中和。《医学杂志》2004;10:875 - 5。
中科院PubMed公共医学中心谷歌学者
Fiola S, Gosselin D, Takada K, Gosselin J. TLR9有助于原代单核细胞和浆细胞样树突状细胞识别EBV。中华免疫杂志2010;185:3620-31。
中科院PubMed谷歌学者
Salloum N, Hussein HM, Jammaz R, Jiche S, Uthman IW, Abdelnoor AM, Rahal EA. eb病毒DNA除了通过toll样受体9增强白细胞介素- 17a的产生外,还可以调节t细胞编程。PLoS ONE。2018; 13: e0200546。
PubMed公共医学中心谷歌学者
Dell 'Oste V, Biolatti M, Galitska G, Griffante G, Gugliesi F, Pasquero S, Zingoni A, Cerboni C, De Andrea M.调音管弦乐队:HCMV与先天免疫。前沿微生物,2020;11:661。
PubMed公共医学中心谷歌学者
崔海杰,Park A, Kang S, Lee E, Lee TA, Ra EA, Lee J, Lee S, Park B.人巨细胞病毒编码的US9靶向MAVS和STING信号以逃避I型干扰素免疫应答。Nat Commun. 2018;9:125。
PubMed公共医学中心谷歌学者
人类巨细胞病毒感染的表现:急性和慢性疾病的拟议机制。中华微生物学杂志,2008;25:417 - 70。
中科院PubMed谷歌学者
付永忠,苏松,高永强,王培平,黄志富,胡敏敏,罗文伟,李松,罗明明,王永智,舒海波。人巨细胞病毒被膜蛋白UL82抑制sting介导的信号传导以逃避抗病毒免疫。细胞宿主微生物,2017;21:231-43。
中科院PubMed谷歌学者
Park A, Ra EA, Lee TA, Choi HJ, Lee E, Kang S, Seo JY, Lee S, Park B. hcmv编码的US7和US8通过特异性靶向tlr信号通路作为先天免疫拮抗剂。Nat Commun. 2019;10:4670。
PubMed公共医学中心谷歌学者
Skert C, Fogli M, Garaffa E, Perucca S, Fiorentini S, Cancelli V, Turra A, Ribolla R, Fili C, Malagola M,等。在异基因干细胞移植早期,T淋巴细胞和单核细胞的特异性toll样受体与细菌、真菌和巨细胞病毒感染相关。中华传染病杂志2014;16:697-712。
中科院PubMed谷歌学者
Smith PD, Shimamura M, Musgrove LC, Dennis EA, Bimczok D, Novak L, Ballestas M, Fenton A, Dandekar S, Britt WJ, Smythies LE。巨细胞病毒增强巨噬细胞TLR表达和myd88介导的信号转导,增强诱导性炎症反应。中华免疫杂志2014;193:5604-12。
中科院PubMed谷歌学者
Becker M, Lemmermann NA, Ebert S, Baars P, Renzaho A, Podlech J, Stassen M, Reddehase MJ。肥大细胞通过TLR3/TRIF信号依赖和非依赖机制作为巨细胞病毒的快速天然传感器。中国生物医学工程杂志,2015;
中科院PubMed谷歌学者
Landais I, Pelton C, Streblow D, DeFilippis V, McWeeney S, Nelson JA。人巨细胞病毒miR-UL112-3p靶向TLR2并调节TLR2/IRAK1/NFkappaB信号通路。公共科学图书馆,2015;11:e1004881。
PubMed公共医学中心谷歌学者
Compton T, Kurt-Jones EA, Boehme KW, Belko J, Latz E, Golenbock DT, Finberg RW。人巨细胞病毒通过CD14和toll样受体2激活炎性细胞因子反应。中国病毒学杂志2003;77:4588-96。
中科院PubMed公共医学中心谷歌学者
人巨细胞病毒包膜糖蛋白B和H在允许细胞中TLR2激活是必需的。中华免疫杂志2006;177:7094-102。
中科院PubMed谷歌学者
Brown RA, Gralewski JH, Razonable RR。R753Q多态性废除toll样受体2信号通路,以响应人类巨细胞病毒。临床感染杂志,2009;49:e96-99。
中科院PubMed谷歌学者
Borden EC, Sen GC, Uze G, Silverman RH, Ransohoff RM, Foster GR, Stark GR. 50岁时干扰素:过去、现在和未来对生物医学的影响。新药品发现,2007;6:975-90。
中科院PubMed公共医学中心谷歌学者
张玲,于娟,刘震。人巨细胞病毒表达的MicroRNAs。病毒J. 2020;17:34。
中科院PubMed公共医学中心谷歌学者
加图j, Gioia R, Chau TL, Patrascu F, Warnier M, Close P, Chapelle JP, Muraille E, Brown K, Siebenlist U,等。脂多糖介导的干扰素调节因子激活涉及tbk1 - ikkepsilon依赖的Lys(63)连接的多泛素化和TANK/I-TRAF的磷酸化。中国生物化学杂志,2007;
中科院PubMed谷歌学者
Cohen L, Henzel WJ, Baeuerle PA。IKAP是IkappaB激酶复合物的支架蛋白。大自然。1998;395:292-6。
中科院PubMed谷歌学者
Watters TM, Kenny EF, O 'Neill LA。Toll/IL-1受体连接蛋白的结构、功能及调控。免疫细胞生物学杂志,2007;85:411-9。
中科院PubMed谷歌学者
Kawagoe T, Sato S, Matsushita K, Kato H, Matsui K, Kumagai Y, Saitoh T, Kawai T, Takeuchi O, Akira S. IRAK1和IRAK2对toll样受体依赖反应的顺序控制。中华免疫杂志2008;9:684-91。
中科院PubMed谷歌学者
Loiarro M, Gallo G, Fanto N, De Santis R, Carminati P, Ruggiero V, Sette C. MyD88死亡结构域与下游激酶招募相关的关键残基的鉴定。生物化学学报。2009;284:28093-103
中科院PubMed公共医学中心谷歌学者
吴文恩,Young RM, Schmitz R, Jhavar S,肖伟,Lim KH, Kohlhammer H,徐伟,杨勇,赵华,等。人类淋巴瘤中的致癌活性MYD88突变。大自然。2011;470:115-9。
中科院PubMed谷歌学者
Hemmi H, Takeuchi O, Kawai T, Kaisho T, Sato S, Sanjo H, Matsumoto M, Hoshino K, Wagner H, Takeda K, Akira S.一个toll样受体识别细菌DNA。大自然。2000;408:740-5。
中科院PubMed谷歌学者
克里格。细菌DNA中的CpG基序及其免疫效应。中华免疫杂志2002;20:709-60。
中科院PubMed谷歌学者
De Bolle L, Naesens L, De Clercq E.人类疱疹病毒6生物学、临床特征和治疗的最新进展。临床微生物学杂志2005;18:217-45。
PubMed公共医学中心谷歌学者
Zerr DM.人类疱疹病毒6:临床更新。疱疹。2006;13:20-4。
PubMed谷歌学者
古川M,安川M, Yakushijin Y, Fujita S.人疱疹病毒6和7对CD4+ T细胞表面分子表达和功能的不同影响。中华免疫杂志,1994;
中科院PubMed谷歌学者
长谷川A,康川M, Sakai I, Fujita S.转录调节因子YY1与c-Myc关联受损诱导CXC趋化因子受体4转录下调。中华免疫杂志2001;166:1125-31。
中科院PubMed谷歌学者
Murakami Y, Tanimoto K, Fujiwara H, An J, Suemori K, Ochi T, Hasegawa H, yasawa M.人疱疹病毒6感染损害toll样受体信号。杨晓明,2010;7:91。
PubMed公共医学中心谷歌学者
Zandi E, Rothwarf DM, Delhase M, Hayakawa M, Karin M. IkappaB激酶复合体(IKK)包含两个激酶亚基,IKKalpha和IKKbeta,是IkappaB磷酸化和NF-kappaB激活所必需的。细胞。1997;91:243-52。
中科院PubMed谷歌学者
El-Ela MA, Shaarawy E, El-Komy M, Fawzy M, Hay RA, Hegazy R, Sharobim A, Moustafa N, Rashed L, Sayed Amr KS。玫瑰糠疹的发病机制中,人疱疹病毒感染与toll样受体之间是否存在联系?病例对照研究。皮肤性病学杂志,2016;24:282-7。
PubMed谷歌学者
Prantsidis A, Rigopoulos D, Papatheodorou G, Menounos P, Gregoriou S, alexius - mousatou I, Katsambas A.玫瑰糠疹患者皮肤中人疱疹病毒8的检测。皮肤性病学杂志2009;89:604-6。
PubMed谷歌学者
上田K. KSHV基因组复制和潜伏期维持。Adv Exp医学生物学。2018;1045:299-320。
中科院PubMed谷歌学者
Jacobs SR, Gregory SM, West JA, Wollish AC, Bennett CL, Blackbourn DJ, Heise MT, Damania B.卡波西肉瘤相关疱疹病毒的干扰素调节因子在抑制toll样受体3介导的干扰素激活方面存在差异。中国病毒学杂志,2013;
中科院PubMed公共医学中心谷歌学者
Meyer F, Ehlers E, Steadman A, Waterbury T, Cao M, Zhang L. TLR-TRIF通路增强KSHV复制和转录激活因子的表达。中国生物化学杂志,2013;
中科院PubMed公共医学中心谷歌学者
Lingel A, Ehlers E,王强,曹敏,Wood C,林r,张磊。卡波西肉瘤相关疱疹病毒通过调节其RNA降低细胞髓细胞分化初反应基因88 (MyD88)的表达。中国病毒学杂志2016;90:180-8。
中科院PubMed谷歌学者
western J, Damania B.卡波西肉瘤相关疱疹病毒在原发性感染期间TLR3通路的上调。中国病毒学杂志。2008;82:5440-9。
中科院PubMed公共医学中心谷歌学者
West JA, Gregory SM, Sivaraman V, Su L, Damania B.卡波西肉瘤相关疱疹病毒激活浆细胞样树突状细胞。中国病毒学杂志,2011;
中科院PubMed谷歌学者
tlr4介导的炎症通过激活STAT3通路促进kshv诱导的细胞转化和肿瘤发生。癌症决议2017;77:7094-108。
中科院PubMed公共医学中心谷歌学者
Lagos D, Vart RJ, Gratrix F, Westrop SJ, Emuss V, Wong PP, Robey R, Imami N, Bower M, Gotch F, Boshoff C. toll样受体4介导卡波西肉瘤疱疹病毒的先天免疫。细胞宿主微生物。2008;4:470-83。
中科院PubMed公共医学中心谷歌学者
Abend JR, Ramalingam D, Kieffer-Kwon P, Uldrick TS, Yarchoan R, Ziegelbauer JM。卡波西肉瘤相关疱疹病毒microRNAs靶向IRAK1和MYD88, toll样受体/白介素- 1r信号级联的两个组分,以减少炎症细胞因子的表达。中国病毒学杂志,2012;86:11663-74。
中科院PubMed公共医学中心谷歌学者
Bussey KA, Reimer E, Todt H, Denker B, Gallo A, Konrad A, Ottinger M, Adler H, Sturzl M, Brune W, Brinkmann MM. γ疱疹病毒卡波西肉瘤相关疱疹病毒和小鼠γ疱疹病毒68调节toll样受体诱导的促炎细胞因子反应。中国病毒学杂志,2014;88:9245-59。
PubMed公共医学中心谷歌学者
Lore K, Betts MR, Brenchley JM, Kuruppu J, Khojasteh S, Perfetto S, Roederer M, Seder RA, Koup RA。toll样受体配体调节树突状细胞以增强巨细胞病毒和hiv -1特异性T细胞反应。中华免疫杂志,2003;
中科院PubMed谷歌学者
Lucinda N, Figueiredo MM, Pessoa NL, Santos BS, Lima GK, Freitas AM, Machado AM, Kroon EG, Antonelli LR, Campos MA。树突状细胞、巨噬细胞、NK细胞和CD8(+) T淋巴细胞通过产生il1 - β、iNOS和颗粒酶b在三叉神经节控制HSV-1中发挥关键作用。
PubMed公共医学中心谷歌学者
Kawai T, Akira S.通过模式识别受体的抗病毒信号。中国生物化学杂志,2007;
中科院PubMed谷歌学者
李勇,李春霞,李志强,李志强,李志强,等。外用SMIP-7.7是一种toll样受体7激动剂,可在生殖器疱疹豚鼠模型中预防单纯生殖器疱疹病毒2型疾病。红伞化学化学。2014;23:189-96。
PubMed谷歌学者
Dendouga N, Fochesato M, Lockman L, Mossman S, Giannini SL.使用TLR激动剂和QS21的水痘带状疱疹病毒糖蛋白E疫苗对小鼠的细胞介导免疫应答。疫苗。2012;30:3126-35。
中科院PubMed谷歌学者
赵斌,俞建明,张淑娟,安建伟,金海霞,宋艺,朴海霞,陈德华,朱世生。水芹病原菌蛋白的克隆、表达、纯化及其生物学特性。生物制药公牛,2020;43:158-68。
中科院PubMed谷歌学者
苏阿瑞,邱敏,李永利,徐文涛,宋文文,王晓辉,宋海燕,郑楠,吴志伟。BX-795通过阻断JNK/p38通路抑制HSV-1和HSV-2复制,而不干扰宿主细胞中的PDK1活性。中国药理学杂志,2017;38:402-14。
中科院PubMed公共医学中心谷歌学者