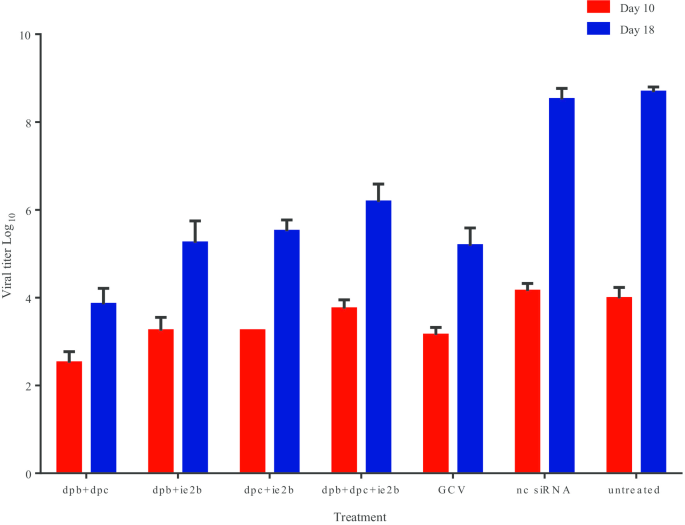
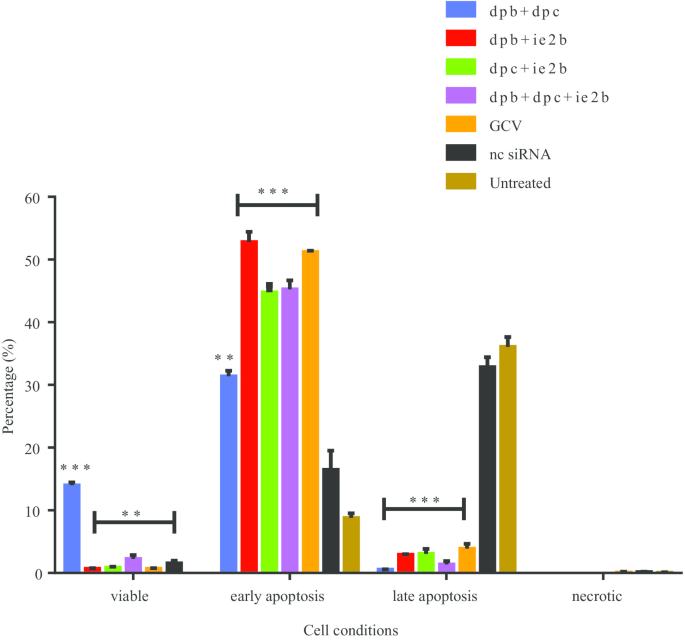
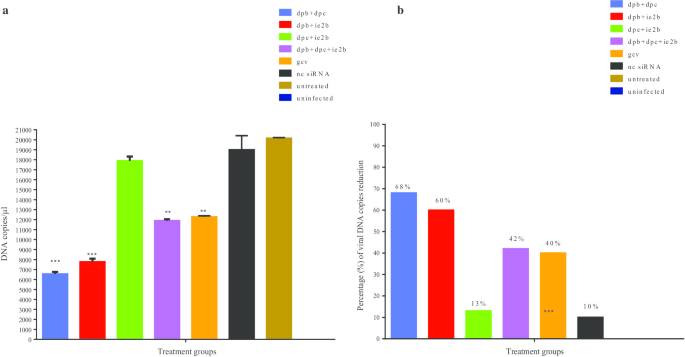
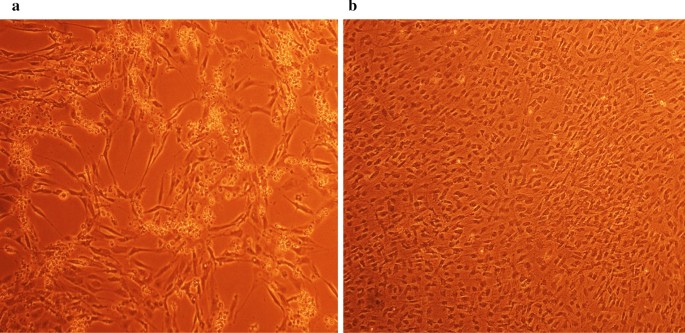
AshwaqAhmed A, KrishnanNair B, JamiluAbubakar B, FaezFirdausJesse A, ZeenatulAllaudin N, Rasedee A,等。巨细胞病毒复制的步骤和抗病毒药物的作用。抗感染药物,2018;16(2):80-95。
文章中科院谷歌学者
Manicklal S, Emery VC, Lazzarotto T, Boppana SB, Gupta RK。先天性巨细胞病毒的“无声”全球负担。临床微生物学杂志,2013;26(1):86-102。
文章中科院PubMed公共医学中心谷歌学者
李文杰,李志强,李志强,等。德国成人巨细胞病毒(CMV)的血清流行率。PLoS ONE。2018; 13 (7): e0200267-e。
文章中科院谷歌学者
Wurzer P, Guillory A, Parvizi D, Clayton RP, Branski LK, Kamolz L-P,等。烧伤患者中的人类疱疹病毒:一项系统综述。烧伤。2017;(1):43的男性。
文章PubMed谷歌学者
Vancíková Z, Dvorák P.免疫功能正常和免疫功能低下个体巨细胞病毒感染——综述。免疫内源性代谢紊乱。2001;1(2):179-87。
文章PubMed谷歌学者
金CS。先天性和围产期巨细胞病毒感染。韩国儿科杂志,2010;53:14。
文章谷歌学者
马尔姆G,英格曼M-L。先天性巨细胞病毒感染。中国新生儿科杂志,2007;12(3):154-9。
文章谷歌学者
Fire A, Xu S, Montgomery MK, Kostas SA, Driver SE, Mello CC秀丽隐杆线虫.大自然。1998;391(6669):806 - 11所示。
文章中科院PubMed谷歌学者
Dana H, Chalbatani GM, Mahmoodzadeh, Karimloo R, Rezaiean O, Moradzadeh A,等。siRNA的分子机制和生物学功能。中华生物医学杂志,2017;13(2):48-57。
PubMed公共医学中心谷歌学者
Ahmadzada T, Reid G, McKenzie DR. siRNA和miRNA治疗的基础和乳腺癌靶向纳米颗粒递送系统的综述。生物工程学报,2018;10(1):69-86。
文章中科院PubMed公共医学中心谷歌学者
barry S. siRNA用于流感治疗。病毒。2010;2(7):1448 - 57。
文章中科院PubMed公共医学中心谷歌学者
RNA干扰作为一种控制人类病毒感染的前瞻性工具。前沿微生物,2018;9:2151。
文章PubMed公共医学中心谷歌学者
陈杰,李峰,徐勇,张伟,胡勇,付勇,等。sdf -1特异性siRNA的胆固醇修饰可以通过Akt通路抑制治疗靶向血管生成。Exp Eye res 2019; 184:64-71。
文章中科院PubMed谷歌学者
杨晓明,杨晓明,杨晓明,Łucejko M. siRNA抗乙型肝炎病毒感染药物的开发。中国生物医学杂志,2018;18(6):609-17。
文章中科院PubMed谷歌学者
Togtema M, Jackson R, Grochowski J, Villa PL, Mellerup M, Chattopadhyaya J,等。靶向人乳头瘤病毒16e6的合成siRNA:体外纳米治疗方法的展望。纳米医学。2018;13(4):455 - 74。
文章中科院PubMed谷歌学者
王晓燕,王晓燕,王晓燕,王晓燕。21-核苷酸RNA在哺乳动物细胞RNA干扰中的作用。大自然。2001;411(6836):494 - 8。
文章中科院PubMed谷歌学者
库雷希A,坦特里VG,克尔马尼AR, Ahangar AG。抗病毒siRNA的研究现状。中国医学杂志。2018;28(4):e1976。
文章中科院PubMed公共医学中心谷歌学者
格林D,凯马。组合RNAi:对抗进化目标的制胜策略?Mol Ther Am Soc Gene Ther, 2007;15(5): 878-88。
文章中科院谷歌学者
李志刚,李志刚,李志刚,李志刚。人类免疫缺陷病毒1型在RNA干扰下的逃逸。中国病毒学杂志,2003;77(21):11531-5。
文章中科院PubMed公共医学中心谷歌学者
王志强,王志强,王志强,等。脊髓灰质炎病毒在RNA干扰下的逃逸:短干扰RNA靶识别及其对治疗方法的影响。中国病毒学杂志,2005;79(2):1027-35。
文章中科院PubMed公共医学中心谷歌学者
Wilson JA, Richardson CD.丙型肝炎病毒复制子可避免由针对NS5b编码区的短干扰RNA诱导的RNA干扰。中国病毒学杂志,2005;79(11):7050-8。
文章中科院PubMed公共医学中心谷歌学者
张旭,郑辉,徐明,周勇,李霞,杨峰,等。针对口蹄疫病毒的组合RNAi慢病毒载体的体外和体内评价。Mol Med . 2015;12(5): 6672-8。
文章中科院PubMed公共医学中心谷歌学者
Mandal A, Ganta KK, Chaubey B.抗La自身抗原的sirna与NS5B或hVAP-A的组合具有抑制HCV复制的加性作用。肝炎Res治疗。2016。https://doi.org/10.1155/2016/9671031.
文章谷歌学者
Braga ACS, Carneiro BM, Batista MN, Akinaga MM, Rahal P.利用siRNA靶向病毒和Hsp90抑制丙型肝炎病毒。细胞应激伴侣。2017;22(1):113-22。
文章中科院PubMed谷歌学者
麦克唐纳P, Sheehy PA,诺里斯JM。联合siRNA治疗猫冠状病毒可以延缓体外抗病毒耐药性的出现。中国兽医杂志,2015;26(1):10-8。
文章中科院PubMed谷歌学者
Abdullah JM, Ahmad F, Ahmad KA, Ghazali MM, Jaafar H, Ideris A,等。恶性胶质瘤患者BAX和cyclin D1基因的分子遗传学分析神经科学,2007;29(3):239-42。
文章中科院PubMed谷歌学者
沈妮,李志强,李志强,李志强,李志强。凋亡素最小功能区截断诱导MCF-7细胞选择性凋亡的研究。癌症杂志,2013;13(1):488。
文章中科院谷歌学者
哈尼H,易卜拉欣TA,奥斯曼AM, Lila MA, Allaudin ZN。功能性朗格汉斯胰岛的分离、密度纯化和体外培养维持可作为糖尿病研究的替代胰岛来源异种移植。2010;17(6):469 - 80。
文章PubMed谷歌学者
Vakhshiteh F, Allaudin ZN, MohdLila MA, Hani H.山羊胰岛体外生存能力和胰岛素分泌的大小相关评估。异种移植。2013;20(2):82 - 8。
文章PubMed谷歌学者
刘志刚,刘志刚,李志刚,王志刚,王志刚,等。家鼠胎盘-子宫巨细胞病毒(RCMV)的研究进展。中国寄生虫病杂志,2003;48(12):2353-67。
文章中科院PubMed谷歌学者
Loh H-S, Mohd-Lila M-A, Abdul-Rahman S-O, Kiew L-J。一种经胎盘巨细胞病毒的发病机制和垂直传播。中国病毒学杂志,2006;3(1):42。
文章中科院PubMed公共医学中心谷歌学者
Balakrishnan KN, Abdullah AA, Camalxaman SN, Quah YW, Abba Y, Hani H,等。大鼠巨细胞病毒ALL-03株(马来西亚株)全基因组序列。基因组公告:美国微生物学会;2015.p . e00451-15。
谷歌学者
Balakrishnan KN, Abdullah AA, Bala J, Abba Y, Sarah SA, Jesse FFA,等。RCMV ALL 03开放阅读框(ORF)在世界上几种不同巨细胞病毒毒株中的鉴定与比较感染Genet Evol, 2017; 54:81-90。
文章中科院PubMed谷歌学者
Reed LJ, Muench H.估算50%终点的简单方法。中华流行病学杂志,1938;27(3):493-7。
文章谷歌学者
张志刚,张志刚,张志刚,张志刚,等。MIQE指南:定量实时PCR实验发表的最少信息。临床化学杂志,2009;55(4):611-22。
文章中科院PubMed谷歌学者
海姆斯JD,凯利MA。演示了从qPCR数据计算相对基因表达的ΔΔCq计算方法。美国:Thermo Scientific;2015.
谷歌学者
Torre-Cisneros J, Aguado JM, Caston JJ, Almenar L, Alonso A, Cantisán S,等。实体器官移植受者巨细胞病毒感染的管理:SET/GESITRA-SEIMC/REIPI建议生物工程学报2016;30(3):119-43。
文章中科院谷歌学者
Schleiss MR, Permar SR, Plotkin SA。先天性巨细胞病毒感染疫苗的研制进展。临床疫苗免疫杂志,2017a;24(12):e00268-17。
文章谷歌学者
Bruminhent J, Razonable RR。肝移植受者巨细胞病毒感染和疾病的处理世界肝病杂志,2014;6(6):370-83。
文章PubMed公共医学中心谷歌学者
Lawrence RS, Durch JS, Stratton KR. 21世纪疫苗:决策工具。纽约:国家科学院出版社;2001.
谷歌学者
Plotkin SA, Boppana SB.人类巨细胞病毒疫苗。疫苗。2019;37(50):7437 - 42。
文章中科院PubMed公共医学中心谷歌学者
Schleiss MR, Permar SR, Plotkin SA。先天性巨细胞病毒感染疫苗的研制进展。临床疫苗免疫。2017b;24(12):e00268-e317。
文章中科院PubMed公共医学中心谷歌学者
Martin-Vicente M, Resino S, Martinez I. sirna介导的细胞先天免疫反应和人类呼吸道合胞病毒复制的同步调节。生物分子。2019;9(5):165。
文章中科院公共医学中心谷歌学者
辛晓梅,李国强,金媛媛,庄敏,李东。小干扰rna组合在HepG2中介导对乙型肝炎病毒cccDNA的抑制作用。2.15细胞。世界胃肠病杂志。2008;14(24):3849。
文章中科院PubMed公共医学中心谷歌学者
边忠,肖安,曹敏,刘敏,刘松,焦勇,等。联合靶向病毒基因和热休克的sirna抗hbv疗效70。中国病毒学杂志,2012;9(1):275。
文章中科院PubMed公共医学中心谷歌学者
Vigne S, Duraffour S, Andrei G, Snoeck R, Garin D, Crance J-M。针对B1R和G7L基因的两个小干扰rna及其与西多福韦的协同组合抑制痘苗病毒复制中国生物医学杂志。2009;53(6):2579-88。
文章中科院PubMed公共医学中心谷歌学者
王晓明,李志强,李志强,等。一种高效、高效的小干扰rna制备方法。核酸研究,2003;31(7):e38-e。
文章中科院谷歌学者
Gaglione M, Mercurio ME, Potenza N, Mosca N, Russo A, Novellino E,等。含末端酰胺键的siRNAs的合成及基因沉默特性。生物医学学报(英文版)。2014;
文章PubMed公共医学中心谷歌学者
Potaczek DP, Garn H, Unger SD, Renz H.反义分子:一类新的药物。中华过敏临床免疫杂志,2016;37(5):344 - 344。
文章中科院PubMed谷歌学者
Saw PE, Song EW。siRNA疗法:临床现实。中国生命科学,2019;
文章中科院PubMed谷歌学者
胡斌,翁勇,夏晓红,梁霞,黄艳。siRNA治疗的临床进展。中国基因医学杂志,2019;21(7):e3097。
文章PubMed谷歌学者
seten RL, Rossi JJ, Han S.基于rnai的治疗的现状和未来方向。Nature Rev . Drug discovery . 2019;18(6): 421-46。
文章中科院谷歌学者
Taylor SC, Laperriere G, Germain H. Droplet数字PCR与qPCR用于低丰度靶点的基因表达分析:从无意义变量到发表质量数据。科学通报2017;7(1):2409。
文章中科院PubMed公共医学中心谷歌学者
全P-L, Sauzade M, brzes E. dPCR技术综述。传感器(巴塞尔)。2018; 18(4): 1271。
文章中科院谷歌学者
汤姆森BJ。病毒和细胞凋亡。中华临床医学杂志,2001;26(2):344 - 344。
文章中科院PubMed公共医学中心谷歌学者
Çam M, Handke W, Picard-Maureau M, Brune W.巨细胞病毒通过两种单独的病毒蛋白抑制Bak和bax介导的细胞凋亡。细胞死亡差异。2010;17(4):655-65。
文章中科院PubMed谷歌学者
第20章抗病毒治疗。In: Katze MG, Korth MJ, Law GL, Nathanson N,编辑。病毒的发病机理。第三版。波士顿:学术出版社;2016.p . 271 - 87。
章谷歌学者
李志强,李志强,李志强,等。RISC结合的竞争预测siRNA的体外效力。核酸研究,2006;34(16):4467-76。
文章中科院PubMed公共医学中心谷歌学者
siRNA效率:结构还是序列——这是个问题。生物工程学报。2006;2006(4):83757。
PubMed公共医学中心谷歌学者
何峰,韩艳,龚娟,宋娟,王宏,李艳。基于多选择性siRNA表征及其组合在评分水平上预测siRNA疗效。科学通报2017;7(1):44836。
文章中科院PubMed公共医学中心谷歌学者
肖飞E, Stadler BM, Debatis M, Wang S, Lu S, Kowalik TF。RNA干扰介导的靶向人类巨细胞病毒即早期或早期基因产物抑制病毒复制,对细胞功能有不同的影响。中国病毒学杂志,2012;86(10):5660-73。
文章中科院PubMed谷歌学者
Bala JA, Balakrishnan KN, Abdullah AA, Adamu L, Noorzahari MS, May LK,等。在马来西亚半岛东部的登嘉楼州,绵羊和山羊中奥尔夫病毒感染与牛群健康计划的关联。BMC Vet res 2019;15(1):250。
文章中科院PubMed公共医学中心谷歌学者
Laere E, Ling APK, Wong YP, Koh RY, Mohd Lila MA, Hussein S.植物基疫苗:生产和挑战。J学报2016;2016:4928637。
谷歌学者