细胞
使用成纤维细胞MRC-5细胞(American Type Culture Collection [ATCC®cc -171])。MRC-5细胞在添加10%热灭活胎牛血清(Gibco, Carlsbad, CA)、l -谷氨酰胺和碳酸氢钠以及1%青霉素-链霉素(MEM- 10fbs)的Eagle 's最低必需培养基(MEM)中培养。视网膜色素上皮细胞系ARPE-19 (ATCC®CRL-2302™)和hTERT(人端粒酶反转录酶)-永生的RPE-1 (ATCC®CRL-4000™)都是上皮细胞系,在Dulbecco的改良Eagle培养基(DMEM)/F-12(1:1)中培养,包括L-谷氨酰胺和2.438 g/L碳酸碳酸钠(Gibco),补充10%热灭活胎牛血清(Gibco或Hyclone, GE Healthcare UK Ltd., UK) (DMEM- 10fbs)。在rp -1培养液中添加0.01 mg/mL的湿霉素B。293FT细胞(Thermo Fisher Scientific, Waltham, MA)在添加5%胎牛血清(Gibco) (DMEM- 5fbs)的DMEM (Wako, Odawara, JAPAN)中培养。293FT细胞在胶原蛋白涂层板中培养(TOYOBO,大阪,日本)。
病毒
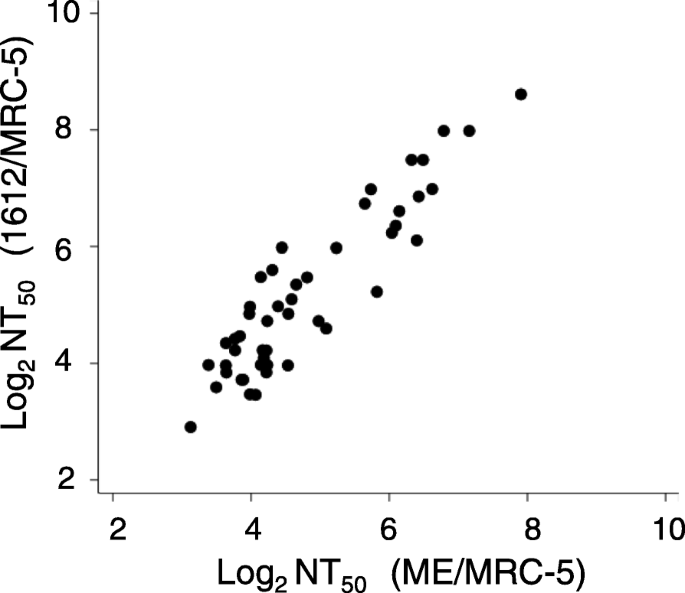
HCMV菌株Merlin (ME, ATCC®VR-1590™)被用作构建质粒的来源,并用于MRC-5细胞中的NT抗体分析。在ECs中NT滴度的测量中,使用了HCMV临床菌株1612,该菌株是我们实验室从一名有症状的HCMV疾病的2个月大婴儿的尿液中分离出来的。HCMV 1612菌株在MRC-5细胞中传代3次,在ARPE-19细胞中传代5次。在感染1612株的ARPE-19细胞中,传代后1周证实有明显的CPE。ME菌株在MRC-5细胞中传代2次后进行大量培养。ME株或1612株感染的细胞在完全CPE下收获,并悬浮在无fbs的培养基中,然后在−80°C保存。将储存的细胞反复冷冻和解冻两次,然后用MRC-5细胞计数CPE确定上清液中的感染剂量。用MRC-5细胞测定ME株和1612株的滴度分别为3.6 × 104斑块形成单位(PFU)/mL, 3.5 × 105分别空斑形成单位/毫升。由于HCMV 1612株具有感染ec的能力,故采用HCMV 1612株检测ec NT抗体滴度。
血清取样(受试者选择)和伦理考虑
研究人员招募了78名健康志愿者。志愿者的年龄从20岁到60岁不等1).所有血清样本首先使用市售酶联免疫吸附试验(ELISA)试剂盒(DENKA SEIKEN, Tokyo, Japan)检测针对HCMV总蛋白的HCMV IgG抗体阳性,并根据制造商的说明确定HCMV-IgG ELISA滴度。然后通过间接免疫荧光试验(IIFA)和HCMV-NT试验进一步检测hcmv - igg阳性血清的hcmv抗体滴度,如下所述。血清样本在56°C下热灭活30分钟,然后用任何测定方法检测抗体滴度。
HCMV中和试验
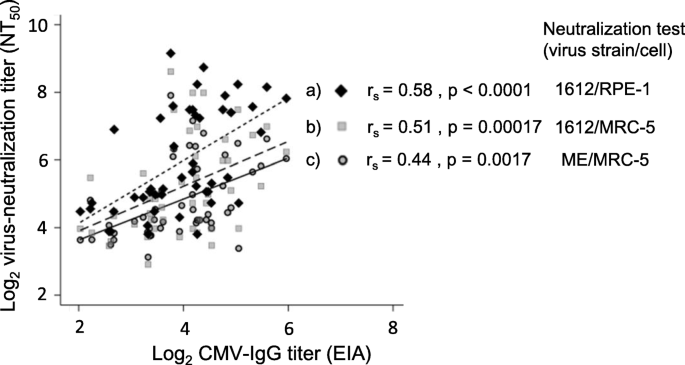
HCMV-NT滴度采用常规斑块减少试验进行评估。简而言之,用维持培养基MEM-2FBS或DMEM-2FBS连续稀释血清样本。将60 μL稀释后的血清样品与含有60个HCMV空斑形成单位(pfu)的等体积病毒溶液混合,在u底96孔板(Greiner Bio-One JAPAN, Tokyo, JAPAN)中37℃孵育1小时。然后将100微升的混合物添加到ECs (rp -1)或成纤维细胞(MRC-5)细胞的单层中。在进行中和过程之前,在96孔板(CORNING, CORNING, NY)中每孔播种15,000个细胞制备细胞片。HCMV ME用于MRC-5细胞中的HCMV- nt检测,而HCMV 1612用于rp -1细胞和MRC-5细胞中的HCMV- nt检测。HCMV ME-MRC-5平板在接种后4天固定、结晶紫染色、福尔玛林和甲醇处理、洗涤,在接种后2天固定处理并测定rp -1细胞和MRC-5细胞中抗HCMV 1612的NT抗体效价。染色、洗涤、干燥后,用体视显微镜观察由凝聚细胞组成的CPE。50%病毒-NT滴度(NT50)定义为最高稀释水平的倒数,在最高稀释水平时,斑块数量少于对照的一半。每个测试一式三份。
用聚合酶链式反应扩增HCMV糖蛋白基因组构建质粒
采用聚合酶链式反应(PCR)扩增HCMV ME基因gP的每个开放阅读框(ORF),引物参照ME序列设计(GenBank Accession no;AY446894.2)。所有引物和寡核苷酸均购自Eurofins Genomics (Tokyo, Japan)。30 μL的反应由15 μL Q5 High-Fidelity 2X Master Mix (New England Biolabs, Ipswich, MA),每个引物0.5 μM和模板DNA组成。PCR扩增子条带从10%琼脂糖电泳凝胶中分离,并使用FastGene凝胶/PCR提取试剂盒(NIPPON Genetics, Tokyo, JAPAN)进行纯化。使用NanoDrop 2000c分光光度计(赛默飞世尔科学公司)对纯化的DNA进行定量。
质粒构建
首先,从感染HCMV-ME的MRC-5细胞经两步常规逆转录纯化的RNA中提取cDNA,扩增HCMV-ME每个gP的ORF。ME-UL128 wt合成DNA寡核苷酸(UL128中的G > A是固定的)购自Integrated DNA Technologies (Coralville, IA)。每个ORF基因被克隆到修饰的pHEK293 ULTRA表达载体II (Takara Bio Inc., Shiga, Japan)的克隆位点上,该载体作为一种在羧基端带有指定标签的融合蛋白形式,用于重组蛋白在哺乳动物细胞中的表达(图2)。1).根据制造商的说明,使用Fusion™HD (Takara Bio Inc .)进行感兴趣基因的插入。
桑格DNA测序
核苷酸序列使用ABI Prism 3130 Avant遗传分析仪(Applied Biosystems, Foster City, CA)测定。使用DNA发电机(Blue-Tractor Software, North Wales, UK)将序列与参考序列进行比对。经Sanger DNA测序,所构建质粒的核苷酸序列与原序列一致。
采用Sanger测序法测定1612株UL128L (UL128-131A位点)的序列,PCR产物采用引物UL128L- f (GCGTATTTCGGACAAACACACA)和UL128L- r (CGCATGTTGCAGACTGAGAAAGA)扩增[22].经证实,HCMV 1612的UL128L基因没有突变。
间接免疫荧光测定用抗原制剂
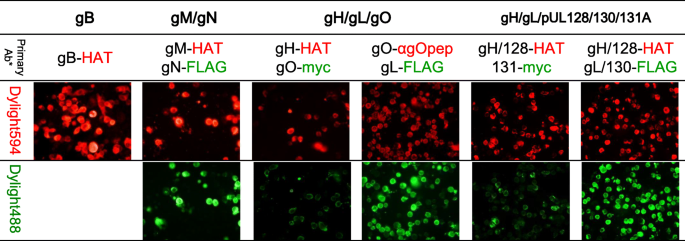
用pHEK293-gB转染293FT细胞,获得重组gB的表达。使用pHEK293 Enhancer Vector (Takara Bio Inc.)和HuGENE HD (Promega)共转染相同的细胞,分别与pHEK-gM和pHEK-gN、pHEK-gH、pHEK-gL和pHEK-gO和pHEK-gH、pHEK-gL、pUL128、pUL130和pUL131A共转染gM/gN、gH/gL/gO和PC表达。
用每个指定质粒或质粒组合转染的293FT细胞用磷酸盐缓冲盐水(PBS)(−)清洗,并在玻片上标记(Matsunami glass IND., Ltd.,大阪,日本),并用甲醇和丙酮混合物按1:1的比例混合固定。
通过检测各自的标签,IIFA确认gc的表达。该抗体用于组氨酸亲和力的检测标签(HAT)融合蛋白、c-myc融合蛋白和flag -标签融合蛋白分别为兔抗HAT标签多克隆抗体(GenScript, Piscataway, NJ)、小鼠myc单克隆抗体(Aviva Systems Biology, San Diego, CA)和抗flag M2单克隆抗体(Sigma-Aldrich Japan, Tokyo, Japan)。二抗为Alexa Fluor DyLight 488偶联山羊抗小鼠IgG H + L抗体或DyLight 594偶联山羊抗兔IgG H + L抗体(Invitrogen)。抗氧化石墨烯肽兔抗体(肽序列:KLKRKQALVKEQPQKKNKKS [23])由Eurofins基因公司(东京,日本)生产。
间接免疫荧光法检测每种gc抗体
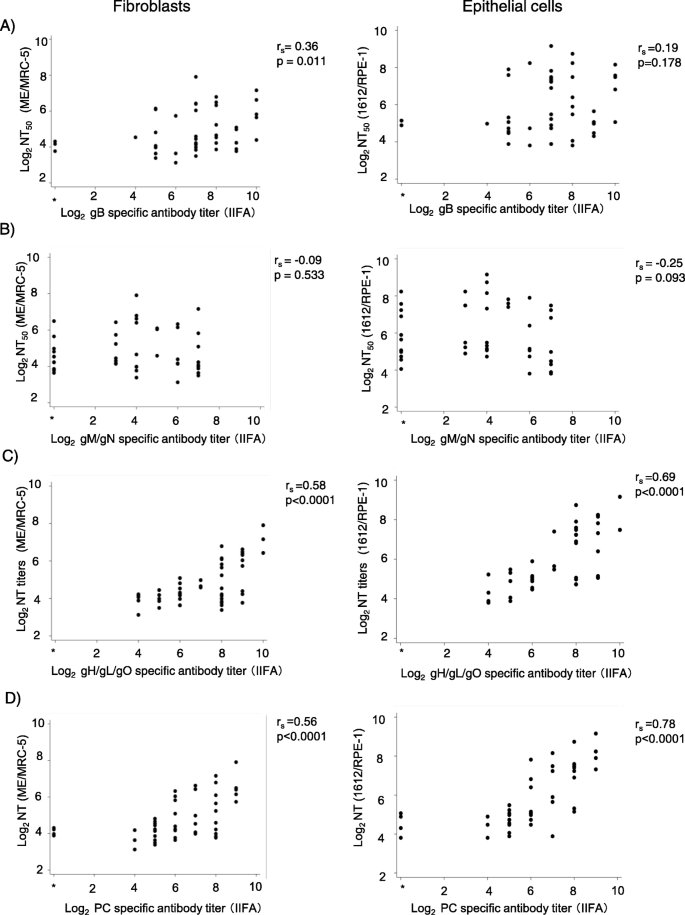
为了测量血清中每种gc特异性IIFA滴度,将血清样本用PBS连续稀释两倍并添加到载玻片上。在37°C孵育1 h后,用PBS洗涤3次,然后与异硫氰酸荧光素(FITC)标记的山羊抗人IgG h + L (Invitrogen, Carlsbad, CA)反应。抗体滴度定义为最高稀释水平的倒数,在最高稀释水平检测到特异性荧光信号。用不含gp的质粒载体转染的细胞作为阴性对照。两份cmv - igg阴性血清IIFA抗体检测阴性。由于在IIFA中对特异性抗体滴度的测量存在主观性的担忧,fitc特异性信号由两位专家观察以确保一致性。为了尽可能避免发现伪影,固定细胞中的信号先在较低的放大倍率下观察,然后再在较高的放大倍率下观察。显然,与阴性对照组不同的阳性信号被确定为阳性。
统计分析
使用Stata15软件程序(STATA Corporation, College Station, TX)进行统计分析。相关性的非参数分析采用斯皮尔曼检验。P< 0.05为有统计学意义。
下一代测序
HCMV ME和HCMV 1612的氨基酸序列同源性经下一代测序仪(NGS)碱基序列测定证实。用QIAmp DNA Mini Kit (QIAGEN, Hilden, Germany)从感染HCMV 1612的ARPE-19细胞中经反复冻融循环处理2次后提取HCMV 1612基因组DNA。然后按照制造商的说明,使用Ion Xpress Plus Fragment Library Kit(赛默飞世尔科学公司)制备测序文库。使用离子库TaqMan定量试剂盒(赛默飞世尔科学公司)定量文库浓度。对文库进行乳剂PCR,将文库调整为50pm浓度,以等摩尔量混合,并在离子厨师系统(赛默飞世尔科学公司)上与捕获珠混合,并辅以离子激流个人基因组机(PGM)模板200试剂盒(赛默飞世尔科学公司)。根据制造商的说明,使用Ion 314 Chip Kit v2(赛默飞世尔科学)和Ion Torrent PGM测序200 Kit v2(赛默飞世尔科学)对模板库进行测序。将所得的FASTQ格式文件导入CLC Genomics Workbench 9.0.1 (QIAGEN)进行同源性分析。1612株的gP序列均在GenBank中注册,登录号为LC425070-LC425078。