冠状病毒科和动脉病毒科组成的新目。医学杂志。1997;142:629-33。
中科院PubMed谷歌学者
Benfield DA, Nelson E, Collins JE, Harris L, Goyal SM, Robison D, Christianson WT, Morrison RB, Gorcyca D, Chladek D.猪不孕症和呼吸综合征(SIRS)病毒(ATCC vr2332分离株)的鉴定。中华检验医学杂志,1992;4(4):391 - 391。
文章中科院谷歌学者
猪繁殖与呼吸综合征(PRRS)病毒结构蛋白和非结构蛋白在病毒发病机制中的作用。动物健康,2010;11:35 - 63。
文章谷歌学者
“PRRS Plus”-PRRS病毒与其他病原体的联合感染。假设。1998;1997:1998b - 2000。
谷歌学者
Zimmerman JJ, Yoon KJ, Wills RW, Swenson SL. PRRSV总体概况:来自美国的视角。兽医微生物。1997;55:187-96。
文章中科院谷歌学者
田坤,于翔,赵涛,冯勇,曹忠,王超,胡勇,陈旭,胡东,田翔,等。致命PRRSV变异的出现:中国非典型PRRS的空前暴发和独特标志的分子解剖。科学通报,2007;2:526。
文章谷歌学者
孟XJ。猪繁殖与呼吸综合征病毒的异质性:对当前疫苗效力和未来疫苗开发的影响兽医与微生物学杂志。2000;74:309-29。
文章中科院谷歌学者
Murtaugh MP, Stadejek T, Abrahante JE, Lam TT, Leung FC。猪繁殖与呼吸综合征病毒的多样性不断扩大。病毒研究。2010;154:18-30。
文章中科院谷歌学者
南颖,吴超,顾刚,孙伟,张玉军,周爱明。PRRSV改良疫苗的研究进展与展望[j]。中华微生物学杂志,2017;8:1635。
文章谷歌学者
Murtaugh MP, Xiao Z, Zuckermann F.猪对猪繁殖与呼吸综合征病毒感染的免疫反应。病毒免疫。2002;15:53 - 47。
文章中科院谷歌学者
张建军,张建军,张建军,张建军。猪繁殖与呼吸综合征病毒CD163基因的表达及其对猪繁殖与呼吸综合征病毒的易感性研究。中国生物医学工程学报,2007;31(1):391 - 391。
文章中科院谷歌学者
陈建军,陈建军,陈建军,陈建军。稳定转染唾液黏附素和CD163制备猪繁殖与呼吸综合征病毒易感细胞系。生物工程学报。2010;10:48。
文章谷歌学者
刘建军,张建军,李建军,等。猪肺泡巨噬细胞的分离与克隆。J病毒方法。2002; 104:203-16。
文章中科院谷歌学者
李玉军,朴志强,南娥,金诗诗,李玉生,杜李生,李超。猪繁殖与呼吸综合征病毒肺泡巨噬细胞的培养。中华微生物学杂志,2010;32(3):391 - 391。
文章中科院谷歌学者
Whitworth KM, Rowland RR, Ewen CL, Trible BR, Kerrigan MA, Cino-Ozuna AG, Samuel MS, Lightner JE, McLaren DG, milham AJ,等。基因编辑的猪可以免受猪繁殖和呼吸综合征病毒的侵害。生物工程学报。2016;34:20-2。
文章中科院谷歌学者
完整的唾液粘附素(Sn/SIGLEC1/CD169)并不需要猪繁殖与呼吸综合征病毒的附着/内化。中国生物医学工程学报,2013;37(2):591 - 591。
文章中科院谷歌学者
Wells KD, Bardot R, Whitworth KM, Trible BR, Fang Y, milham A, Kerrigan MA, Samuel MS, Prather RS, Rowland RR。用CD163样同源物取代猪CD163清道夫受体富含半胱氨酸的结构域5可以使猪对基因1型猪繁殖与呼吸综合征病毒产生抗性,但对基因2型猪繁殖与呼吸综合征病毒没有抗性。中国生物医学工程学报,2017;31(1):591 - 591。
范戈普,范布里达姆,范·杜尔斯勒尔,杜尔普特,诺温克,HJ。猪繁殖与呼吸综合征病毒感染相关CD163蛋白结构域的鉴定中国生物医学工程学报,2010;34(4):391 - 391。
文章谷歌学者
Burkard C, Lillico SG, Reid E, Jackson B, Mileham AJ, Ait-Ali T, Whitelaw CB, Archibald AL.猪PRRSV抗性的精确工程:缺失CD163 SRCR5结构域的基因组编辑猪巨噬细胞在保持生物学功能的同时完全抵抗两种PRRSV基因型。中华医学杂志,2017;13:e1006206。
文章谷歌学者
魏志,田东,孙丽,林涛,高峰,刘锐,佟刚,袁生。猪繁殖与呼吸综合征病毒小蛋白n -链糖基化对病毒恢复及受体相互作用的影响。病毒学。2012;429:1-11。
文章中科院谷歌学者
Das PB, Dinh PX, Ansari IH, de Lima M, Osorio FA, Pattnaik AK。猪繁殖与呼吸综合征病毒的次要包膜糖蛋白GP2a和GP4与受体CD163相互作用。中国生物医学工程学报,2010;34(4):391 - 391。
文章中科院谷歌学者
Watashi K, Sluder A, Daito T, Matsunaga S, Ryo A, Nagamori S, Iwamoto M, Nakajima S, Tsukuda S, Borroto-Esoda K,等。环孢素a及其类似物通过靶向膜转运体牛磺酸胆酸钠共转运多肽(NTCP)抑制乙型肝炎病毒进入培养的肝细胞。肝脏病学。2014;59:1726-37。
文章中科院谷歌学者
王晓军,胡伟,张泰,毛云云,刘宁宁,王思远。厄贝沙坦是FDA批准的用于高血压和糖尿病肾病的药物,是一种通过干扰Na(+)依赖性牛磺胆酸共转运多肽活性来抑制乙型肝炎病毒进入的有效抑制剂。红伞学报。2015;120:140-6。
文章中科院谷歌学者
Nkongolo S, Ni Y, Lempp FA, Kaufman C, Lindner T, Esser-Nobis K, Lohmann V, Mier W, Mehrle S, Urban S.环孢素a对乙型肝炎和丁型肝炎病毒侵入的抑制作用。国际肝病杂志,2014;32(2):444 - 444。
文章中科院谷歌学者
Kaneko M, Watashi K, Kamisuki S, Matsunaga H, Iwamoto M, Kawai F, Ohashi H, Tsukuda S, Shimura S, Suzuki R,等。一种新型三环聚酮,Vanitaracin A,通过靶向牛磺酸胆酸钠共转运多肽特异性抑制乙型和丁型肝炎病毒的进入。中华微生物学杂志,2015;39(1):1 - 4。
文章中科院谷歌学者
Kaneko M, Futamura Y, Tsukuda S, Kondoh Y, Sekine T, Hirano H, Fukano K, Ohashi H, Saso W, Morishita R,等。化学阵列系统,一个鉴定以牛磺胆酸钠共转运多肽为靶点的新型乙型肝炎病毒进入抑制剂的平台。科学通报2018;8:2769。
文章谷歌学者
钱凯,Morris-Natschke SL, Lee KH。HIV进入抑制剂及其在HIV治疗中的潜力。医学研究,2009;29:369-93。
文章中科院谷歌学者
Kuritzkes博士HIV-1进入抑制剂:综述。当前观点:艾滋病毒/艾滋病。2009; 4:82-7。
文章谷歌学者
Briz V, Poveda E, Soriano V. HIV进入抑制剂:作用机制和耐药途径。中国生物医学工程学报,2006;22(1):444 - 444。
文章中科院谷歌学者
马宏,姜林,乔生,志勇,陈晓霞,杨燕,黄霞,黄敏,李锐,张国平。猪CD163第五清道夫受体富半胱氨酸结构域的晶体结构揭示了猪生殖与呼吸综合征病毒感染的重要残基。中华微生物学杂志,2017;91。
张建军,张建军,张建军,等。基于深度卷积神经网络的生物活性预测研究。arxivorg。2015;arXiv预印本arXiv:1510.02855。
谢超,李丽,Vanhauwaert R, Nguyen KT, Davis MD, Bu G, Wszolek ZK,王旭。Miro1标记帕金森病亚群和Miro1减少物拯救帕金森模型中的神经元损失。中国生物医学工程学报,2019;30(3):391 - 391。
文章中科院谷歌学者
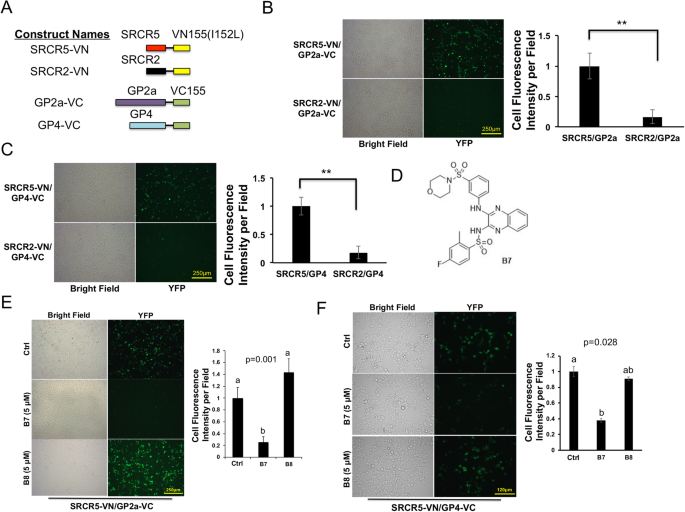
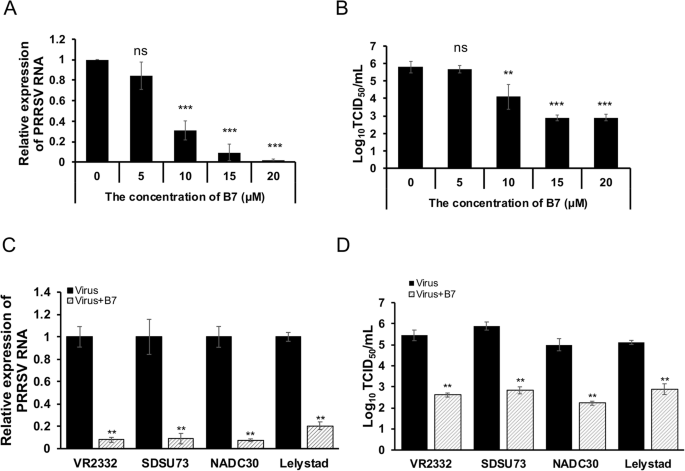
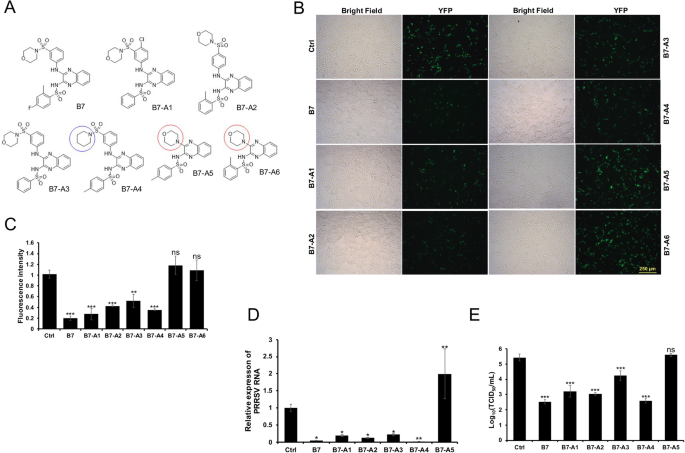
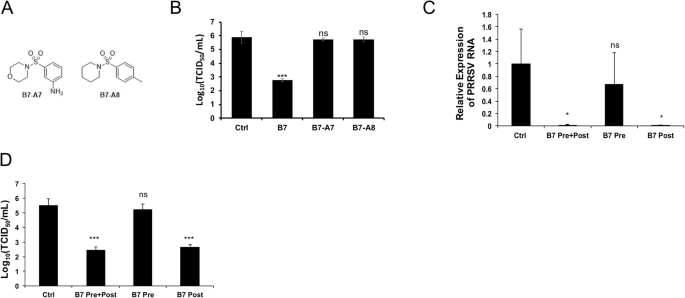
杨玉华,胡建明。一种新型的高信噪比双分子荧光互补检测方法。生物学技术。2010;49:793 - 805。
文章中科院谷歌学者
芬尼DJ。概率分析:对s型响应曲线的一种统计处理。剑桥:剑桥大学出版社,剑桥。1952;78:388-90。
Koch A, Tamez P, Pezzuto J, Soejarto D.肯尼亚马赛人用于抗疟疾治疗的植物评价。中国生物医学工程学报,2009;31(1):391 - 391。
文章中科院谷歌学者
范德海登N, Delputte PL, Favoreel HW, Vandekerckhove J, Van Damme J, Van Woensel PA, Nauwynck HJ。唾液黏附素参与猪繁殖与呼吸综合征病毒进入猪肺泡巨噬细胞。中华病毒学杂志,2003;37(1):391 - 391。
文章中科院谷歌学者
范戈普,范布里德姆W, Delputte PL, Nauwynck HJ。唾液粘附素和CD163在猪繁殖与呼吸综合征病毒的进入过程中联合起来。中国生物医学工程学报,2008;39(1):444 - 444。
文章谷歌学者
范戈普,范布里德姆W, Delputte PL, Nauwynck HJ。猪繁殖与呼吸综合征病毒需要通过cd163阳性的早期内体运输,而不是晚期内体,以进行生产感染。生物学报。2009;154:1939-43。
文章谷歌学者
Van Breedam W, Delputte PL, Van Gorp H, Misinzo G, Vanderheijden N, Duan X, Nauwynck HJ。猪繁殖与呼吸综合征病毒进入猪巨噬细胞。中国生物医学工程学报,2010;31(1):444 - 444。
文章谷歌学者
郭超,王敏,朱忠,何生,刘宏,刘霞,石霞,唐涛,于平,曾杰,等。高效繁殖携带部分缺失CD163 SRCR5结构域的猪,这些猪完全抵抗猪生殖与呼吸综合征病毒2型感染。免疫学杂志,2019;10:18 . 46。
文章中科院谷歌学者
引用本文:Burkard C, Opriessnig T, iliham AJ, Stadejek T, aitali T, Lillico SG, Whitelaw CBA, Archibald AL.缺乏CD163清道夫受体富半胱氨酸结构域5的猪对猪繁殖与呼吸综合征病毒1型感染的抗性。中国生物医学工程学报,2018;32。
刘建军,李建军,李建军,李建军,李建军。猪繁殖与呼吸综合征病毒感染性病毒粒子组装所需包膜蛋白。中国生物医学工程学报,2009;39(1):391 - 391。
文章中科院谷歌学者
薛波,侯刚,张刚,黄健,李磊,南毅,穆毅,王磊,张磊,韩旭,等。与PRRSV GP5外域直接相互作用诱导的MYH9聚集促进了病毒被允许细胞内化。微生物学前缘,2019;10:2313。
文章谷歌学者