方法gydF4y2Ba
化学品和试剂gydF4y2Ba
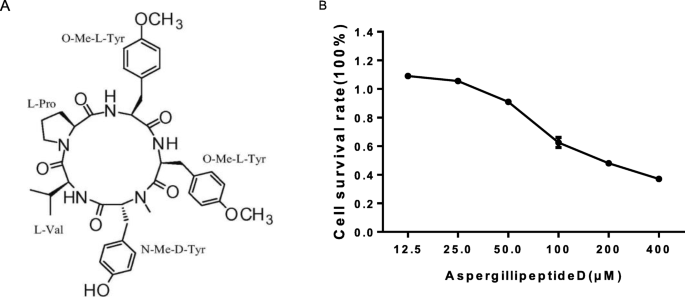
环五肽,gydF4y2BaAspergillipeptidegydF4y2BaD,是从Aspergillus SCSIO 41501真菌菌株中分离得到[gydF4y2Ba14gydF4y2Ba].ACV(阿昔洛韦)和2-(2,5-二甲基-2-噻唑基)-2,5-二苯基- 2h -四唑溴化铵(MTT)是从SigmaAldrich (St. Louis, MO, USA)获得的。Trizol试剂购自Invitrogen公司(Carlsbad, CA, USA)。Dulbecco的改良Eagle培养基(DMEM)、胎牛血清(FBS)和青霉素-链霉素均购自Gibco-BRL (Gland Island, NY, USA)。gydF4y2BaAspergillipeptidegydF4y2BaD和ACV用二甲亚砜(DMSO)溶解,DMSO最终浓度小于0.1%。限制性内切酶购自Takara Bio(志贺,日本)。gydF4y2Ba
细胞和病毒gydF4y2Ba
非洲绿猴肾细胞(Vero;ATCC CCL81)在添加10%热灭活胎牛血清的DMEM中培养。用于病毒稀释的维持培养基是DMEM和2%热灭活胎牛血清。HSV-1/F (ATCC VR-733)保存于本实验室。HSV-1/Blue,源自HSV-1的TK突变体[gydF4y2Ba15gydF4y2Ba],两株临床抗acv的HSV-1株(HSV-1/106和HSV-1/153)是陶鹏(中国科学院广州生物医学与健康研究所)赠送的礼物。所有病毒都在Vero细胞中繁殖,并在−80°C保存,直到进一步使用。gydF4y2Ba
MTT试验gydF4y2Ba
MTT检测按照标准方案进行。简单地说,Vero细胞在96孔板中培养。待细胞融合度达到90%后,在培养皿中加入不同浓度的化合物,每种浓度重复3次。培养48 h后,每孔加入10 μl MTT溶液(5 mg/mL),暗处培养4 h。然后丢弃MTT溶液,每孔加入100 μl DMSO。平板在室温下轻轻摇动15分钟。用酶免疫分析仪(Bio-Rad, Hercules, CA, USA)测量每孔570和630 nm处的光密度(OD)。50%细胞毒浓度(CC50)定义为降低50%细胞活力的浓度。gydF4y2Ba
用空斑法测定病毒滴度gydF4y2Ba
Vero细胞在96孔板中培养。第二天,在感染前准备10倍的与未处理的HSV-1提取物连续稀释。用不同稀释度的100 μl HSV-1感染Vero细胞单层,在37℃、5% CO条件下吸附2 hgydF4y2Ba2gydF4y2Ba.将未吸收的病毒吸出,然后将平板覆盖含有营养培养基的琼脂,在37°C和5% CO下孵育gydF4y2Ba2gydF4y2Ba3天。用结晶紫染色细胞,并在50 h内计数,观察斑块。斑块试验分为3个重复。病毒用连续稀释滴定法定量。TCID50(50%组织培养感染剂量)采用Reed和Muench法公式计算[gydF4y2Ba16gydF4y2Ba]:gydF4y2Ba
Log10 50%终点稀释度= Log10稀释度表示死亡率高于50% -(对数的差值×稀释系数的对数)。gydF4y2Ba
对数差值=[(稀释后死亡率高于50%)-50%]/[(稀释后死亡率高于50%)-(稀释后死亡率低于50%)]。gydF4y2Ba
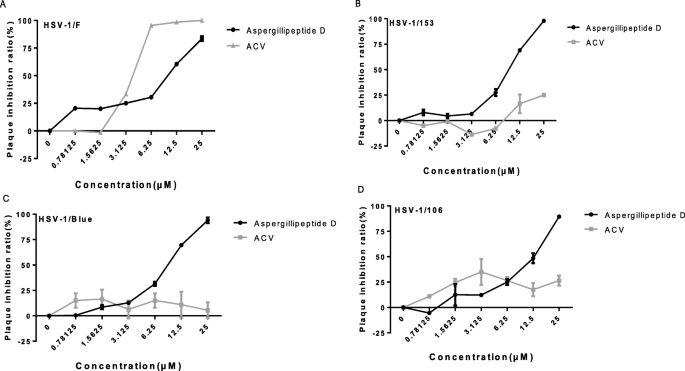
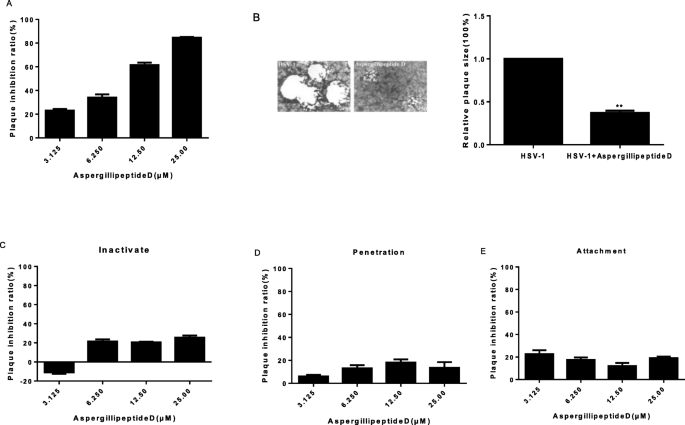
斑块减少试验gydF4y2Ba
用病毒悬液感染含有融合单层Vero细胞的24孔板的实验孔,每孔产生50个空斑。37°C和5% CO2孵育2小时后,吸出未吸收的病毒粒子。gydF4y2BaAspergillipeptidegydF4y2Ba将D溶液(分别为25 μM、12.5 μM、6.25 μM、3.125 μM、1.5625 μM和0.78125 μM)加入相应孔中,再加入含有琼脂的营养培养基;培养皿在37°C和5% CO2下孵育3天。斑块计数方法如上所述。抗病毒活性计算公式如下:gydF4y2Ba
$$ \mathrm{抗病毒}\ \mathrm{活动}\ \左(\%\右)=\frac{\mathrm{牌匾}\ \mathrm{数字}\左(\mathrm{控件}\右)-\mathrm{牌匾}\ \mathrm{数字}\左(\mathrm{控件}\右)}\乘以100\% $$gydF4y2Ba
病毒灭活试验gydF4y2Ba
将Vero细胞培养至24孔板(1.5*10gydF4y2Ba5gydF4y2Ba接种病毒100 μl(每孔50 PFUs),接种病毒100 μlgydF4y2BaAspergillipeptidegydF4y2Ba将不同浓度的D溶液混合,在37°C下孵育2 h。然后将混合物添加到细胞孔中,在37°C下孵育2小时。接种物被移除。细胞补盖3天后固定,按上述方法染色。gydF4y2Ba
病毒附着试验gydF4y2Ba
将Vero细胞培养至24孔板(1.5*10gydF4y2Ba5gydF4y2Ba细胞/孔),第二天细胞在4°C预冷却1 h,用冷PBS冲洗。病毒接种量(每孔50pfus)和gydF4y2BaAspergillipeptidegydF4y2Ba将指定浓度的D添加到细胞孔中,在4°C下再孵育2小时,使病毒附着在细胞上。去除病毒接种体。细胞补盖3天后固定,按上述方法染色。gydF4y2Ba
病毒渗透试验gydF4y2Ba
将Vero细胞培养至24孔板(1.5*10gydF4y2Ba5gydF4y2Ba细胞/孔),第二天细胞在4°C预冷1小时,用冷PBS洗涤,然后在4°C感染病毒(每孔50 pfu)再感染2小时,使病毒附着在细胞上。之后,去除病毒接种物,用冷PBS冲洗细胞。然后不同浓度的gydF4y2BaAspergillipeptidegydF4y2Ba加入D,在37°C下孵育10分钟,以使病毒渗透最大化。孵育后,每孔中加入PBS (pH = 3) 1分钟,使未能穿透细胞的病毒失活。之后,将溶液中和,去除中性PBS。细胞补盖3天后固定,按上述方法染色。gydF4y2Ba
病毒感染后的治疗效果gydF4y2Ba
Vero细胞在24孔板中培养。第二天,在37°C下,用HSV-1(每孔50 pfu)感染细胞2小时。感染后,去除病毒接种体,用PBS冲洗细胞,覆盖gydF4y2BaAspergillipeptidegydF4y2BaD在指定浓度下。3天后,细胞固定,如上所述染色。gydF4y2Ba
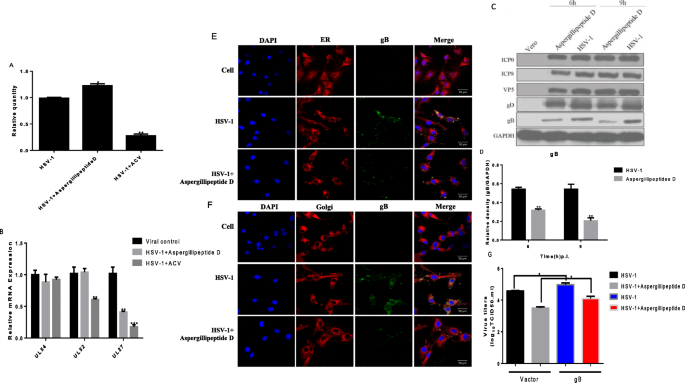
HSV-1 DNA合成分析gydF4y2Ba
Vero细胞在24孔板中培养。第二天,将感染HSV-1的细胞(MOI = 3)在含或不含HSV-1的情况下孵育gydF4y2BaAspergillipeptidegydF4y2BaD (25 μM)保温15 h。使用GeneJET病毒DNA和RNA纯化试剂盒(Thermo)提取病毒DNA。采用RT-PCR法定量检测病毒DNA。然后相对于病毒对照组表达HSV-1基因组拷贝数。引物对如下:gydF4y2BaUL47gydF4y2Ba(f: 5 ' -gacgta cgcgat gag atc aa -3 ', r: 5 ' -gtt acc gga tta CGG gga ct-3 ')。gydF4y2Ba
实时聚合酶链反应gydF4y2Ba
Vero细胞在6孔板中培养。第2天感染HSV-1的细胞(MOI = 3)用gydF4y2BaAspergillipeptidegydF4y2BaD (25 μM)处理3、6、9 h。使用Trizol (Invitrogen)分离总RNA,并使用PrimeScript RT试剂盒(Takara)进行cDNA合成。实时荧光定量PCR (Real-time PCR, RT-PCR)检测即刻早期(IE)基因的表达水平gydF4y2BaUL54gydF4y2Ba早期(E)基因gydF4y2BaUL52gydF4y2Ba晚期(L)基因gydF4y2BaUL27gydF4y2BaHSV-1/F和HSV-1/106在3,6和9 h pi。,分别。引物对与前文所述相同[gydF4y2Ba17gydF4y2Ba].gydF4y2Ba
免疫荧光分析gydF4y2Ba
Vero细胞在共聚焦培养皿中培养,第二天细胞感染HSV-1 (MOI = 3), 37°C 2 h进行病毒吸附。将细胞转入加25 μM或不加25 μM的主培养基中gydF4y2BaAspergillipeptidegydF4y2Bas D并孵育9小时。细胞用4%多聚甲醛(PFA)固定15分钟,用0.02% Triton X-100渗透,均在PBS中,随后用抗gb抗体(Abcam)和Alexa Fluor 488(1:1000)二抗(Invitrogen)孵育60分钟。然后用高尔基追踪器红或er追踪器红(Beyotime, China)对细胞进行染色。每一步之后用PBS反复清洗载玻片,最后用PBS保存。用4,6-二氨基氨基-2-苯基吲哚(DAPI,分子探针)进行额外的核染色20分钟。在共聚焦激光扫描显微镜(LSM 510 meta;蔡司)[gydF4y2Ba17gydF4y2Ba].gydF4y2Ba
西方墨点法gydF4y2Ba
Vero细胞接种于密度为1.5 × 10的60mm细胞培养皿中gydF4y2Ba6gydF4y2Ba细胞/菜。24 h后,细胞在37℃感染HSV-1 (MOI = 3) 2 h。DMEM维护介质包含gydF4y2BaAspergillipeptidegydF4y2Bas D (25 μM)。在感染后6和9小时,用PBS清洗细胞三次,并使用RIPA缓冲液(Beyotime)进行裂解。等量(40 μg/样)蛋白进行Western Blot分析。采用抗HSV-1一抗ICP0 (abcam1:1000)、ICP8 (abcam1: 8000)、VP5 (santa1:1000)、gB (abcam1:1000)、gD (abcam1:1000)检测即早、早、晚蛋白含量变化[gydF4y2Ba18gydF4y2Ba].gydF4y2Ba
免疫共沉淀(co-IP)和LC-MS分析gydF4y2Ba
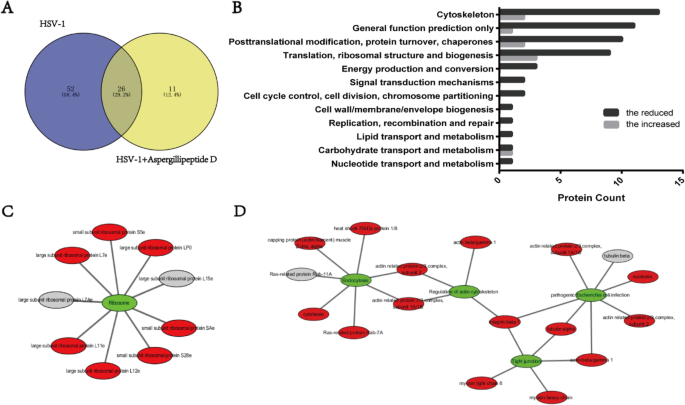
Vero细胞在100mm细胞培养皿中,密度为3 × 10gydF4y2Ba6gydF4y2Ba细胞/菜。24 h后,用gydF4y2BaAspergillipeptidegydF4y2BaD (25 μM),感染HSV-1 (MOI = 3) 9 h。然后将细胞裂解,测量蛋白质浓度,并将其调整为1 mg/ml。加入1.0 μg适当对照IgG(正常小鼠或兔IgG,对应一抗宿主种),再悬量20 μl Protein A/G PLUSA琼脂糖,预清除裂解液。然后,在4°C下孵育30分钟。将最佳稀释度的一抗加入细胞裂解液(上清液)中,4℃孵育1 h,再用30 μl重悬量的Protein A/G plus -琼脂糖在4℃孵育过夜。收集免疫沉淀,PBS洗涤,20 μl 1 × SDS PAGE缓冲液重悬(Beyotime, China)。LC-MS分析由华大基因(中国)提供。gydF4y2Ba
统计分析gydF4y2Ba
结果以均数±标准差计算,用Student 's t检验检验是否有统计学意义。gydF4y2BaPgydF4y2BaP <0.05为差异有统计学意义。gydF4y2Ba