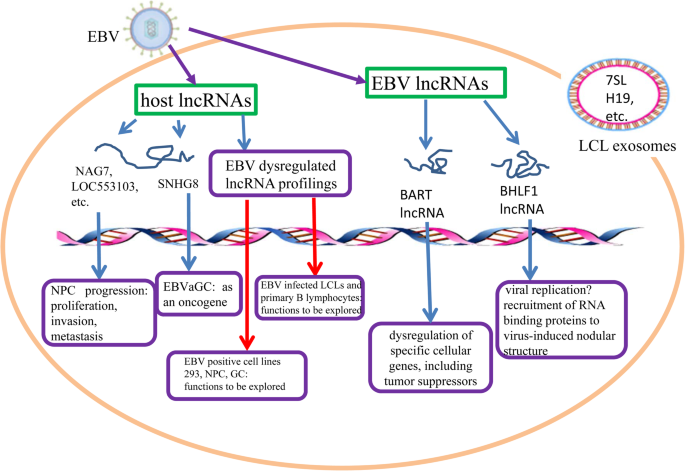
ebv调控的宿主lncRNAs
近年来,lncrna已被证明在先天免疫和抗病毒调节中具有积极和消极的作用。在EBV感染过程中,一些宿主lncrna表现出差异表达(表2)1 ),表明它们在宿主对EBV感染反应中的重要性。异常表达的宿主lncrna被定义为ebv调控的lncrna,可以被ebv编码的蛋白质和microRNAs调控或与之相互作用[22 ].
表1 EBV在感染和相关癌症中调控的细胞lncrna
ebv调控的宿主lncRNAs可能在上皮性癌中发挥作用
EBV感染可导致多种人类肿瘤,包括上皮性癌。鼻咽癌是一种来源于上皮细胞的癌症。它是亚洲,尤其是中国南部和非洲部分地区最常见的头颈部肿瘤。由于鼻咽癌发病时症状隐匿,75-90%的鼻咽癌病例直到晚期才被诊断出来,这一阶段的复发率很高[11 ,23 ,24 ].此外,鼻咽癌患者的治疗效果不理想,5年生存率低,复发率高[24 ,25 ,26 ].鉴于目前的情况,鉴定敏感和特异的生物标志物对于早期诊断高危人群以及评估鼻咽癌治疗效果非常重要。EBV感染与鼻咽癌密切相关,几乎100%的低分化或未分化鼻咽癌病例都存在EBV感染[1 ,2 ].EBV可在鼻咽癌中建立潜伏感染,导致细胞内代谢和分子表达的改变[1 ,2 ,27 ].因此,ebv相关的鼻咽癌发病机制、生物标志物和治疗方法值得探讨。
几乎所有鼻咽癌患者都存在持续潜伏的EBV感染,表明其在鼻咽癌的发生和发展中具有重要的病因学作用。对于鼻咽癌的早期诊断、进展和预后,有必要识别潜在的生物标志物。李晓晓等此前的研究表明,将下一代测序技术应用于7个鼻咽癌组织样本和7个正常鼻咽组织样本中,发现2192个lncrna在鼻咽癌中异常表达,其中62个lncrna反转录调控基因参与EBV感染[13 ].其中,lncRNA-NR2F2反义RNA1 (NR2F21)、序列相似的lncrna -家族95成员C (FAM95C)、长基因间非蛋白编码RNA 1106 (LINC01106)下调,lncRNA-CH507-513H4.6、lncRNA-THAP9反义RNA1 (THAP9-AS1)、lncRNACH507-513H4.3、lncRNA-RP4-794H19.1等lncrna上调[13 ].62个可能被lncrna反式调控的基因,如CD44(透明质酸/CD44信号在头颈部鳞状细胞癌进展中起重要作用)和白细胞介素1受体相关激酶1 (IRAK1)参与EBV感染途径[13 ].然而,只有少数已知的lncrna被功能注释。因此,EBV致鼻咽癌的lncrna相关发病机制、生物标志物及治疗方法值得进一步探讨。
而LINC00312,也被称为NPC相关基因7 (NAG7),是最早被研究的lncRNAs之一,在NPC中作为抑癌基因[28 ].LINC00312在鼻咽癌上皮和各种非癌性鼻咽上皮的表达有明显差异。LINC00312可抑制鼻咽癌细胞增殖,阻止细胞周期从G1期向S期进展,从而加重细胞凋亡。LINC00312表达与ebv编码的非编码RNA呈负相关,EBER1表达与鼻咽癌淋巴结转移呈正相关。同时,LINC00312的相对低表达或高表达可用于区分鼻咽癌预后预测与淋巴结转移或非淋巴转移[28 ].因此,LINC00312可能成为EBV相关性鼻咽癌诊断和治疗的潜在靶点。
有趣的是,EBV至少编码44种成熟的microRNAs (miRNAs),这些miRNAs可以通过直接靶向宿主基因和病毒基因,包括一些含有mirna结合位点的lncrna,促进许多肿瘤的发生和发展[2 ,29 ].根据组织芯片分析,EBV-miR-BART6-3p可以直接靶向并下调lncRNA LOC553103。LOC553103过表达在体内外均可促进肿瘤增殖、侵袭、间充质转化(EMT)和转移[14 ].这些结果无疑说明了LOC553103在鼻咽癌治疗中的潜在应用。病毒mirna和lncrna之间的串扰识别为EBV感染对肿瘤发生的影响提供了新的见解。
新兴研究表明,lncrna可能通过被视为细胞-细胞通信载体的血清细胞外囊泡(如微囊泡和外泌体)卸载到血液中[5 ,30. ].这些微泡可以转移病毒和细胞因子,特别是在疱疹病毒等持续性感染的情况下,并允许病毒对或控制细胞微环境做出反应,这可能对病毒和宿主都有益。释放到血液中的lncrna可以定量分析[5 ,31 ].因此,肿瘤细胞释放的lncrna因其独特的特性可作为潜在的液体活检生物标志物[5 ,30. ].例如,lncRNAs MALAT1、APAF1-AS1和AL359062在鼻咽癌患者的血清循环中显著上调[15 ].这些lncRNAs在NP69细胞(EBV阴性的正常鼻咽上皮细胞)感染EBV后数量增加。此外,循环lncRNAs MALAT1、APAF1-AS1和AL359062也与ebv相关性鼻咽癌患者的不良预后相关,提示其可作为鼻咽癌预后的生物标志物[15 ].这一发现无疑拓宽了lncrna在NPC中的视野,阐明了lncrna的作用,有助于对NPC的综合管理。
胃癌(GC)是另一种类型的上皮性癌,是全球第四大常见癌症,也是癌症死亡的第二大原因。胃癌是一种具有高度异质性的复杂疾病。EBV被认为在GC中起重要的因果作用[1 ,2 ,32 ];其中一种胃癌为ebv相关性胃癌(EBVaGC),以溃疡性为主,主要发生于贲门和胃体。EBVaGC是一种独特的GC亚型,约占所有GC病例的10%。EBV有助于解除宿主lncrna的调控,这可能在人类GC中发挥关键的调控作用。小核仁RNA宿主基因8 (SNHG8)在培养的EBV阳性胃癌细胞中的表达明显高于正常胃黏膜细胞或EBV阴性胃癌组织[33 ,34 ].SNHG8在EBVaGC中的表达与肿瘤-淋巴结转移(TNM)分期显著相关[34 ].进一步研究表明,SNHG8与EBV基因BHLF1、LF3、BHRF1和BNLF2a相互作用。推测SNHG8可调控TRIM28、EIF4A2、NAP1L1、PLD3、RPL18A、TRPM7的表达,可能对胃有直接影响。研究还表明,SNHG8下调抑制细胞生长,抑制细胞周期,促进细胞凋亡。Jing Liu等人最近的研究也发现,用特异性shRNAs敲低SNHG8可以抑制细胞增殖和集落形成,在体外将细胞周期抑制在G0/G1期,在体内抑制肿瘤生长[16 ].因此,SNHG8可能作为癌基因参与EBVaGC的发生发展,这一认识为EBVaGC的治疗和预后提供了信息。
lncrna可以通过调控其靶基因发挥作用。此前已有研究证实,lncRNAs和microRNAs作为竞争性内源性rna (ceRNAs)相互抑制,从而形成一个调节靶mrna的调控ceRNA网络(lncRNAs- mirnas -mRNAs) [5 ,6 ,7 ].在Jing- Jing Jing等人的研究中[17 ],作者利用整合多水平表达数据和生物信息学方法来识别EBVaGC中涉及的关键元素和相互作用,并建立涉及EBVaGC这些关键元素的调控ceRNA网络。在不同的调控网络中观察到CXCL10、GDF5、PTGER3、SMAD5、mir - 6873p、RP5-1039 K5.19、TP73-AS1、EBV-miR-BART1-3p和EBV-miR-BART22等重叠基因和调控因子。ebv相关miRNAs EBV-miR-BART1-3p和EBV-mir-BART22被证明可以调节CXCL10和SMAD5。特别是在ceRNA调控网络中发现了两个未报道的lncrna RP5-1039 K5.19和TP73-AS1,这可能为深入研究EBVaGC提供了新的途径[17 ].
此外,我们最近基于全基因组RNA测序的研究揭示了EBV基因组感染的人胚胎肾细胞(293-EBV)中lncRNA的差异表达谱,并确定了8种lncRNA (lncRNA - bc200、MALAT1、LINC00672、LINC00982、IGFBP7-AS1、LOC100128494、LINC02067、LOC100505716)在EBV阳性NPC (C666-1)和GC细胞系(AGS-EBV)中的表达谱(表2)1 ) [18 ].本研究强调了EBV感染可能影响lncrnas特异性功能改变。我们还探讨了lncRNAs的潜在靶基因。有趣的是,lncrna具有一些潜在的共同靶基因,如eIF4A3、FUS和UPF1。lncrna参与EBV肿瘤发生的确切功能和机制尚在研究中。在进一步的研究中,lncrna在癌症中的数据库可能与致瘤表型有关。然而,我们应该意识到,一种lncRNA的表达模式在不同的癌症和细胞类型中可能不一致(表2)1 ),暗示了它们在不同癌症中的不同作用。差异表达的lncrna也可作为ebv相关鼻咽癌或胃癌诊断和治疗的潜在生物标志物。
ebv调控的宿主lncRNAs参与了淋巴瘤的发生
EBV一旦侵入,在宿主的整个生命周期内潜伏在B淋巴细胞中,且不能被宿主清除。潜伏性EBV感染与人类淋巴类疾病有关,包括伯基特淋巴瘤、霍奇金淋巴瘤和移植后淋巴增生性疾病[1 ].EBV感染可在体内、体外诱导B淋巴细胞增殖、永生化或免疫逃逸[1 ,2 ].人EBV转化淋巴母细胞系(LCL)是通过感染外周血单眼细胞(pbmc)或原代人静息B淋巴细胞(RBLs)获得的,已广泛用于人类遗传学、药物基因组学和免疫学研究。
在最近的一项研究中,通过RNA-seq分析了B95.8株衍生EBV感染RBLs中lncRNAs和反义rna的差异表达[20. ].本研究提供了EBV感染过程中一系列lncrna的动态表达模式。EBV感染后,有26个lncrna立即上调,33个lncrna立即下调。有的可能随着感染时间的延长而改变表达状态。在目前的RNA-seq研究中,发现CYTOR和NORAD lncrna对LCL的生长和生存很重要[20. ].NORAD可以与参与DNA复制和修复的蛋白质结合[35 ].
根据LCL的基因表达分析,lncRNAs 7SL、H19、H19- as以及p53 mRNA在自体LCL中的表达高于pbmc [21 ].这些lncrna与许多其他肿瘤的发展有关,这表明它们可以促进ebv诱导的肿瘤发生的进展。在LCL外泌体货物中发现9个lncRNAs: 7SL、H19、H19上游保守1和2、H19反义、HAR1B、HOXA6as、NDM29、SNHG5和Tsix。LncRNAs H19和H19- as在外泌体中富集,表达上调,其余LncRNAs下调,外泌体中表达水平低于H19和H19- as。也有研究表明,ebv感染细胞释放的外泌体除了影响邻近细胞外,还可能影响肿瘤发生、转移、肿瘤微环境、免疫逃逸和病毒生理的维持,并在感染细胞中发挥持久作用[10 ,30. ].由于LCL外泌体货物转移可能在维持持续性感染和肿瘤发生中发挥作用,因此表征LCL释放的外泌体lncrna非常重要。ebv调控的lncrna可能经常通过循环影响其邻近基因的表达。进一步描述它们在lcl中的作用将是有趣的。
值得注意的是,LCLs不是稳定的癌细胞,相关研究可能不能很好地反映淋巴瘤。一些lncrna如MALAT1可能随着EBV感染时间点在lcl中表达不稳定[20. ].而MALAT1上调可促进弥漫性大B细胞淋巴瘤的肿瘤发生和免疫逃逸,可能与EBV感染有关[19 ].MALAT1也是一种免疫耐受调节因子,在诱导耐受树突状细胞和调节性T细胞中具有重要意义[36 ].
EBV-encoded lncRNAs
病毒感染通常会改变宿主lncRNAs的表达,从而对宿主基因发挥重要的调控作用。另一方面,病毒编码的lncRNA还可以调节宿主基因的表达,这些基因对病毒的感染和发病至关重要。最近发现EBV从病毒基因组中编码自己的lncrna。
ebv编码的BART lncRNAs
在ebv感染的上皮性恶性肿瘤中,包括鼻咽癌和胃癌,病毒基因组BamHI A区域的转录是广泛的。交替拼接的转录本称为BamHI A向右转录本(BARTs)。BARTs内源性高水平表达。在ebv感染的胃癌中,99%的病毒来源的聚腺苷酸转录本来自BARTs [37 ].这些转录本可能导致mirna或lncrna的产生[2 ,37 ,38 ].EBV是第一个被鉴定为编码miRNAs的人类病毒,这些miRNAs映射到基因组的BART区域[2 ,39 ].研究发现BART miRNAs存在差异表达,在上皮组织中大量表达,而在淋巴细胞系中几乎检测不到[39 ].EBV编码的BART mirna已被证实可在体内为EBV阳性肿瘤细胞提供显著的选择性生长优势,包括更有效的肿瘤播种、更大的肿瘤以及更高和更快的死亡率[38 ].拼接BART lncrna的功能尚在研究中。BART lncRNAs位于ebv感染细胞的细胞核中。BART lncRNAs敲低显著影响与细胞粘附、氧化还原酶活性、鼻咽癌转移、炎症和免疫相关基因的表达[40 ].BART lncRNA似乎在启动子区域控制Pol II,从而可能调节鼻咽癌中IFN-beta1和CXCL8的表达[40 ].
最近还发现BART lncrna在EBV溶酶复制诱导中受NF-κB信号的调控,这可能是治疗EBV相关癌的一种选择[11 ].
BART mirna和拼接的或多聚腺苷化的BART核rna都来源于病毒基因组BamHI A区相同的初级转录本[39 ,40 ].这些bart衍生的转录本能够调节宿主细胞基因的表达。BART rna的丰度和特定的剪接模式有助于BART miRNAs的表达。令人印象深刻的是,Aron R. Marquitz的团队提出了第一个证据,表明拼接的BART转录本作为lncrna独立于miRNA的形成。他们还证实BART lncRNA可以下调特定的细胞基因,包括肿瘤抑制基因[40 ].
在潜伏EBV感染期间,BART miRNAs通过靶向基因的3 ' UTR下调一些重要的肿瘤抑制因子,从而改变肿瘤细胞的生长[2 ,40 ].Aron R. Marquitz的团队发现BART lncRNAs在潜伏EBV感染的转录重编程中也起着重要作用。RASA1是RAS癌基因的负调控因子。肿瘤抑制因子RASA1因BART lncRNA表达而下调,但对miRNA靶基因检测没有任何反应[40 ].这意味着lncRNA而不是mirna对RASA1的调控起作用。BART lncrna不同剪接异构体的不同功能仍有待研究。
RNA-seq分析表明BART lncRNAs调控未折叠蛋白反应(UPR)相关基因[41 ].BART lncRNAs可能直接或间接影响构成UPR的主要调控转录因子,包括XBP1、ATF4和ATF6,这些因子可能是EBV肿瘤发生过程中应激反应基因随后减少的原因。ebv阳性胃癌中极高水平的CpG岛启动子甲基化可能促进了基因的沉默。因此,我们推测BART lncRNAs可能对组蛋白调节有影响,或可能有助于指导DNA甲基化表型。很明显,几种转录调节机制被归因于lncrna。综上所述,BART lncRNAs可能对病毒肿瘤发生很重要。然而,BART lncRNAs在EBV潜伏期期间如何下调基因仍需要继续探索。
ebv编码的BHLF1 lncRNAs
BHLF1是一种在潜伏期开始时表达的溶环基因,长度为1980个核苷酸,富含g,也编码一种长链非编码RNA (lncRNA)。BHLF1已被证明在病毒复制周期中发挥lncRNA的作用,通过在转录位点形成RNA-DNA杂化体,它有助于顺式裂解复制(OriLyt)的起源功能[42 ].BHLF1蛋白的表达依赖于另一种裂解循环蛋白SM的存在[37 ].BHLF1 lncRNA仅定位于病毒复制区室表面的结节,而在内部复制区室中未发现[37 ].根据Richard Park的报告,在裂解感染后期,BHLF1 lncRNA包含一系列串联重复序列,这可能在将rna结合蛋白募集到VINORCs(病毒诱导的结节结构)中发挥结构和支架作用。因此,BHLF1 lncRNA可能有助于病毒复制。