郭娟,李峰,钱松,毕东,何青,金辉,罗蓉,李松,孟x,李忠。TGEV感染通过激活NF-kappaB信号上调FcRn表达。科学报告2016;6:32154。
文章中科院谷歌学者
Pritchard GC, Paton DJ, Wibberley G, Ibata G.英国传染性胃肠炎和猪流行性腹泻。兽医杂志1999;144:616-8。
文章中科院谷歌学者
柯南道尔LP。猪传染性肠胃炎。北方兽医,1951;32:477-8。
中科院PubMed谷歌学者
Eleouet JF, Rasschaert D, Lambert P, Levy L, Vende P, Laude H.传染性胃肠炎病毒多蛋白编码基因1全序列(20个碱基)。病毒学。1995;206:817-22。
文章中科院谷歌学者
黄C, Lokugamage KG, Rozovics JM, Narayanan K, Semler BL, Makino S. α -冠状病毒传染性胃肠炎病毒nsp1蛋白抑制哺乳动物细胞和无细胞HeLa细胞提取物中蛋白质翻译,但不影响兔网织细胞裂解液。中国病毒学杂志,2011;85:638-43。
文章中科院谷歌学者
Bowie AG, Unterholzner L.病毒逃避和模式识别受体信号的颠覆。中华免疫杂志2008;8:911-22。
文章中科院谷歌学者
萨德勒AJ,威廉姆斯BR。干扰素诱导的抗病毒效应器。免疫杂志2008;8:559-68。
文章中科院谷歌学者
Randall RE,好孩子S.干扰素和病毒:诱导,信号,抗病毒反应和病毒对抗之间的相互作用。中国病毒学杂志,2008;89:1-47。
文章中科院谷歌学者
Hayden MS, Ghosh S. NF-kappaB免疫生物学。Cell Res. 2011; 21:223-44。
文章中科院谷歌学者
梁鹏,张华,王刚,李松,丛松,罗勇,张波。KPNB1、XPO7和IPO8介导nf - kappab /p65转位进入细胞核。交通。2013;14:1132-43。
中科院PubMed谷歌学者
李娟,刘勇,张霞。小鼠冠状病毒通过RIG-I和MDA5识别诱导少突胶质细胞产生I型干扰素。中国病毒学杂志,2010;84:6472-82。
文章中科院谷歌学者
方勇,方林,王勇,雷勇,罗荣,王东,陈红,肖松。猪繁殖与呼吸综合征病毒非结构蛋白2参与NF-kappaB激活。张晓明,2012;9:83。
文章中科院谷歌学者
丛峰,刘霞,韩震,邵勇,孔霞,刘松。冠状病毒感染鸡传染性支气管炎后鸡肾组织转录组分析。BMC Genomics. 2013;14:743。
文章中科院谷歌学者
程卫东,王晓明,王晓明,王晓明。人肾癌细胞通过激活p38 MAPK/NF-kappaB/IkappaBalpha通路对新城疫病毒感染产生反应。Cell Oncol (Dordr)。2015; 38:279 - 88。
文章中科院谷歌学者
Khatiwada S, Delhon G, Nagendraprabhu P, Chaulagain S, Luo S, Diel DG, Flores EF, Rock DL。一种副病毒病毒粒子蛋白在感染早期抑制NF-kappaB信号。公共科学图书馆,2017;13:e1006561。
文章谷歌学者
Dufrasne FE, Lucchetti M, Martin A, Andre E, Dessilly G, Kabamba B, Goubau P, Ruelle J. HIV-2包膜糖蛋白对NF-kappaB信号通路的调控及其不完全BST-2拮抗作用。病毒学。2018;513:11-6。
文章中科院谷歌学者
张晓明,张晓明,张晓明,等。人冠状病毒OC43结构蛋白和辅助蛋白对抗病毒反应元件转录激活的影响。Intervirology。2018;61:30-5。
文章中科院谷歌学者
Canton J, Fehr AR, Fernandez-Delgado R, Gutierrez-Alvarez FJ, Sanchez-Aparicio MT, Garcia-Sastre A, Perlman S, Enjuanes L, Sola I. MERS-CoV 4b蛋白在感染期间干扰nf - kapab依赖的先天免疫反应。公共科学图书馆,2018;14:e1006838。
文章谷歌学者
徐旭,张宏,张强,董健,梁颖,黄艳,刘海军,佟东。猪流行性腹泻病毒E蛋白引起内质网应激,上调白细胞介素-8表达。2013;10:26。
文章中科院谷歌学者
张强,马军,刘东。猪流行性腹泻病毒非结构蛋白1抑制NF-kappaB活性对先天免疫逃避的影响。病毒学。2017;510:111-26。
文章中科院谷歌学者
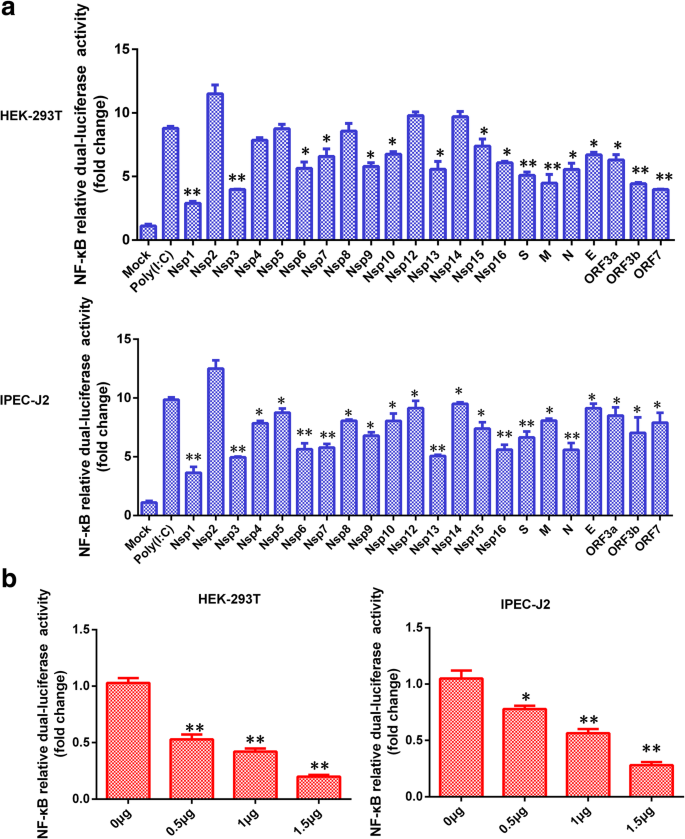
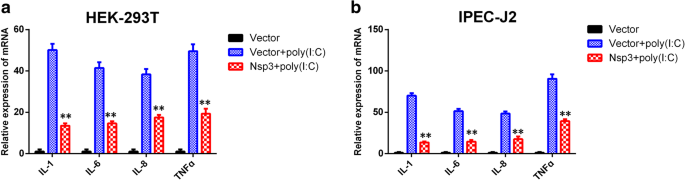
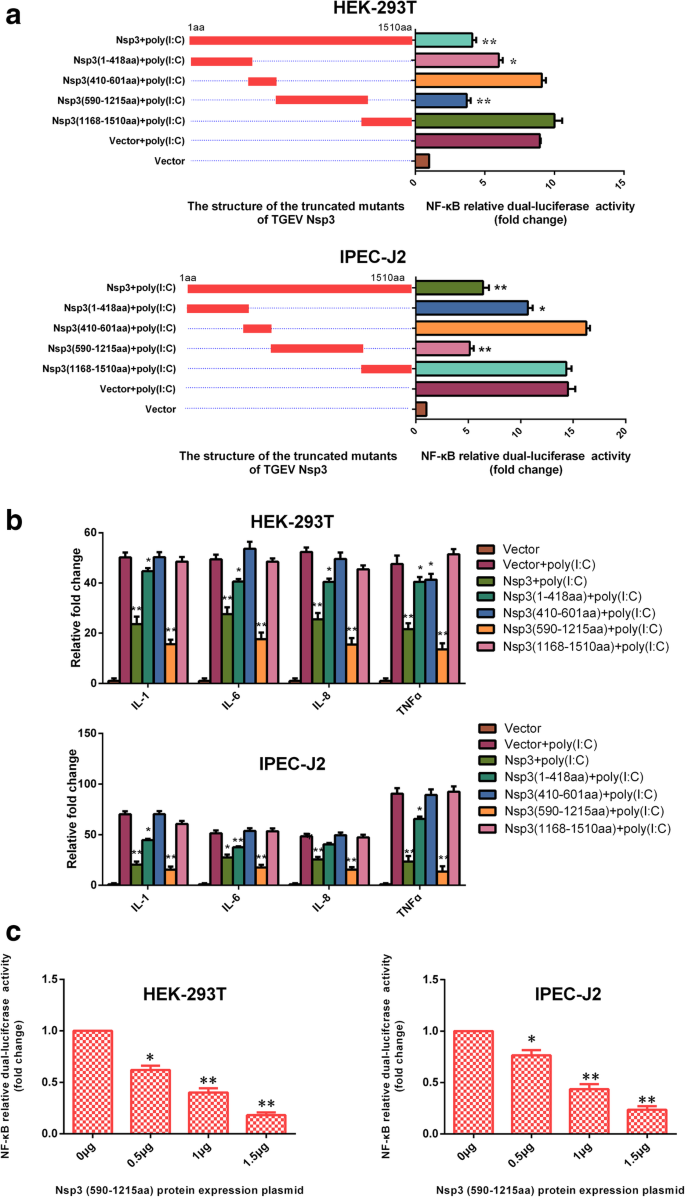
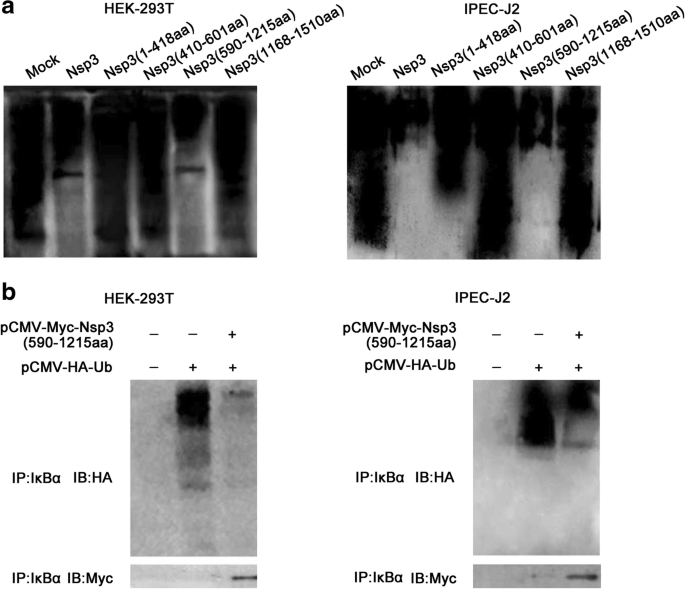
王磊,乔鑫,张松,秦勇,郭涛,郝忠,孙林,王旭,王勇,姜勇,等。猪传染性胃肠炎病毒非结构蛋白2通过NF-kappaB激活参与炎症。毒性。2018;9:1685 - 98。
文章中科院谷歌学者
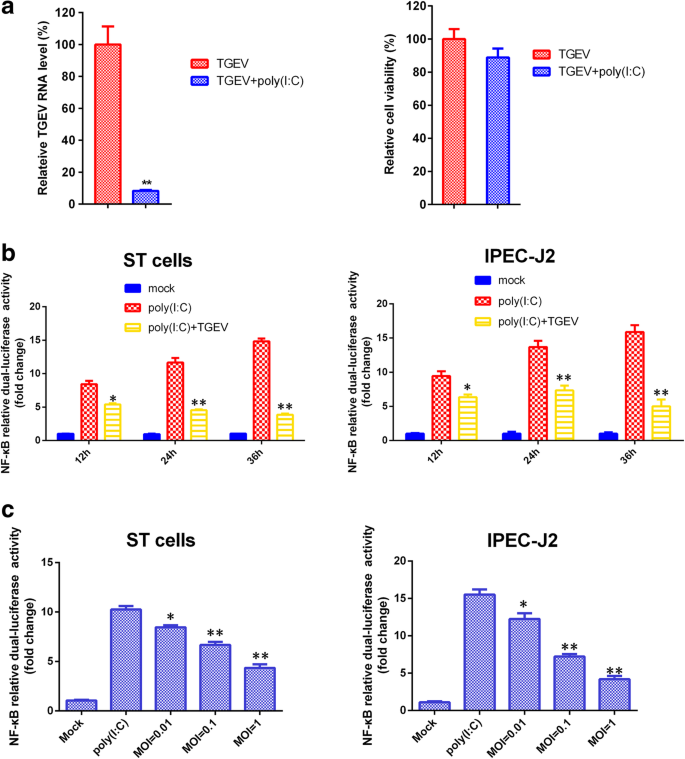
丁震,安凯,谢磊,吴伟,张瑞,王东,方勇,陈红,肖松,方磊。传染性胃肠炎病毒感染通过rll介导的信号通路诱导NF-kappaB激活。病毒学。2017;507:170-8。
文章中科院谷歌学者
Alexopoulou L, Holt AC, Medzhitov R, Flavell RA。toll样受体3识别双链RNA并激活NF-kappaB。大自然。2001;413:732-8。
文章中科院谷歌学者
Salminen A, Huuskonen J, Ojala J, Kauppinen A, Kaarniranta K, Suuronen T.衰老过程中先天免疫系统的激活:NF-kB信号通路是炎症衰老的分子罪魁祸首。老化决议Rev. 2008; 7:83-105。
文章中科院谷歌学者
DeDiego ML, Nieto-Torres JL, Regla-Nava JA, Jimenez-Guardeno JM, Fernandez-Delgado R, Fett C, Castano-Rodriguez C, Perlman S, Enjuanes L.抑制严重急性呼吸综合征冠状病毒感染小鼠的nf - kapab介导的炎症可增加生存率。中国病毒学杂志,2014;88:913-24。
文章谷歌学者
雷军,郭晓峰,李志强,等。新型冠状病毒Nsp3蛋白的结构与功能研究。Antivir Res. 2018; 149:58-74。
文章中科院谷歌学者
王刚,陈刚,郑东,程刚,唐华。小鼠肝炎病毒A59 (MHV-A59)的PLP2靶向TBK1负调控细胞I型干扰素信号通路。科学通报。2011;6:e17192。
文章中科院谷歌学者
Tan J, Vonrhein C, Smart OS, Bricogne G, Bollati M, Kusov Y, Hansen G, Mesters JR, Schmidt CL, Hilgenfeld R. SARS冠状病毒的SARS-unique domain (SUD)包含两个结合G-四plex的宏域。公共科学图书馆,2009;5:e1000428。
文章谷歌学者
王志伟,王志伟,王志伟,等。NF-kappaB p65的表达机制及调控策略。中国炎症杂志2018;11:407-19。
文章谷歌学者
李志强,李志强。核因子κ B在细胞因子基因调控中的作用。中国生物医学工程学报。1997;17(2):344 - 344。
文章中科院谷歌学者
王晓明,王晓明,王晓明,王晓明。核因子kappab与眼表炎症和疾病的关系。Ocul Surf. 2012; 10:137-48。
文章谷歌学者
李Q, Verma IM。NF-κB在免疫系统中的调控。免疫杂志2002;2:725。
文章中科院谷歌学者
余霞,兰萍,侯霞,韩青,陆楠,李婷,焦超,张杰,张超,田忠。HBV通过抑制NF-kappaB通路和ROS产生抑制lps诱导的NLRP3炎症小体激活和il -1 β的产生。国际肝病杂志,2017;66:693-702。
文章中科院谷歌学者
Villalba M, Fredericksen F, Otth C, Olavarria VH。牛IER3基因的分子特征:在牛病毒性腹泻病毒-1感染的MDBK细胞中,IER3过表达通过阻断NF-kappaB活性下调IL-8。中华免疫杂志2017;92:169-79。
文章中科院谷歌学者
Wojdyla JA, Manolaridis I, van Kasteren PB, Kikkert M, Snijder EJ, Gorbalenya AE, Tucker PA。来自传染性胃肠炎病毒的木瓜蛋白酶1:晶体结构和对病毒和细胞底物的酶活性。中国病毒学杂志,2010;84:10063-73。
文章中科院谷歌学者
陈鑫,王凯,邢颖,涂健,杨鑫,赵强,李凯,陈卓。冠状病毒膜相关木瓜样蛋白酶通过与Beclin1相互作用诱导自噬,负向调控抗病毒先天免疫。中国生物工程学报。2014;5:912-27。
文章中科院谷歌学者
Frieman M, Ratia K, Johnston RE, Mesecar AD, Baric RS.严重急性呼吸综合征冠状病毒木瓜蛋白酶泛素样结构域和催化结构域调节IRF3和NF-kappaB信号通路的拮抗作用。中国病毒学杂志,2009;83:6689-705。
文章中科院谷歌学者
袁玲,陈震,宋松,王松,田春,邢刚,陈霞,肖志霞,何峰,张磊。冠状病毒木瓜蛋白酶降解p53抑制I型干扰素信号。中国生物化学杂志,2015;29:3172 - 82。
文章中科院谷歌学者
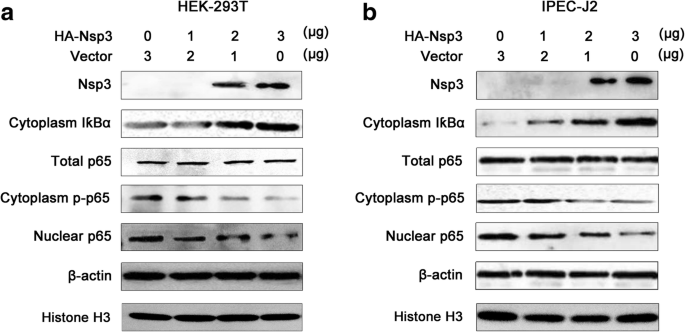
胡娟,马志刚,杨永明,李国强。抑制p65磷酸化与抑制IkappaBalpha多泛素化和降解相一致。分子化学,2005;44:274-84。
文章中科院谷歌学者