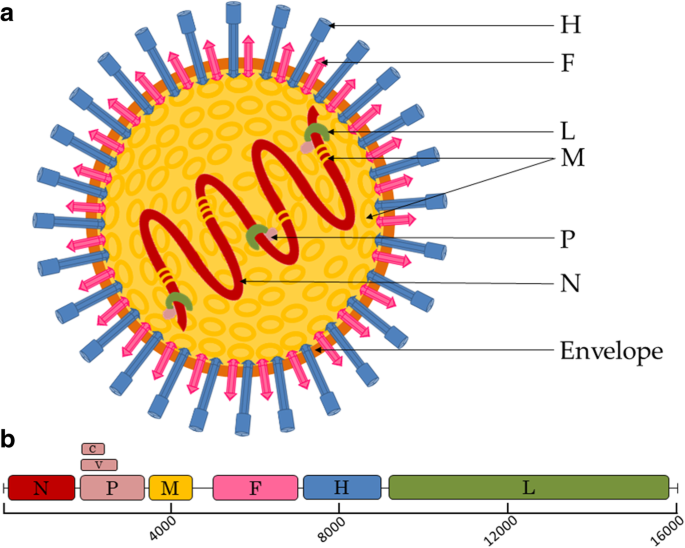
Murphy FA, Fauquet CM, Bishop DH, Ghabrial SA, Jarvis AW, Martelli GP, Mayo MA, Summers MD:病毒分类学:病毒的分类和命名.施普林格科技商业传媒;2012.
谷歌学者
MacLachlan N, Dubovi E, Fenner F:副粘病毒科.2011.
Lempp C, Spitzbarth I, Puff C, Cana, Kegler K, Techangamsuwan S, Baumgartner W, Seehusen F.犬瘟热白脑炎发病机制的新认识。病毒。2014;6:2571 - 601。
文章中科院PubMed公共医学中心谷歌学者
马志刚,李志刚。犬瘟热病毒感染的易感宿主多样性:系统综述和数据综合。BMC Vet Res. 2016;12:78。
文章PubMed公共医学中心谷歌学者
Beineke A, Baumgartner W, Wohlsein P.犬瘟热病毒跨物种传播的最新进展。同一个健康,2015;1:49-59。
文章PubMed公共医学中心谷歌学者
da Fontoura BR, Streck AF, Nunes Weber M, Maboni Siqueira F, Muniz Guedes RL, Wageck Canal C.疫苗株对犬瘟热病毒进化的影响。感染Genet Evol 2016; 41:262-9。
文章中科院谷歌学者
副粘病毒RNA合成,mRNA编辑和基因组六聚体阶段:综述。病毒学。2016;498:94-8。
文章中科院PubMed谷歌学者
da Fontoura BR, von Messling V.麻疹病毒实验动物模型:从犬瘟热病毒了解麻疹病毒发病机制。病毒。2016;8。
张志刚,张志刚,张志刚,张志刚。麻疹病毒编辑提供了额外的富含半胱氨酸的蛋白质。细胞。1989;56:759 - 64。
文章中科院PubMed谷歌学者
Mahy BW, Van Regenmortel MH.动物和细菌病毒学台式百科全书。剑桥:爱思唯尔;2010.
von Messling V, Svitek N, Cattaneo R.受体(SLAM [CD150])识别和V蛋白支持一种以淋巴细胞为基础的粘膜组织和淋巴器官的快速入侵。中国病毒学杂志,2006;80:6084-92。
文章中科院谷歌学者
von Messling V, Zimmer G, Herrler G, Haas L, Cattaneo R.犬瘟热病毒的血凝素决定趋同性和细胞致病性。中国病毒学杂志,2001;75:6418-27。
文章谷歌学者
Tumpey TM, Basler CF, Aguilar PV, Zeng H, Solorzano A, Swayne DE, Cox NJ, Katz JM, Taubenberger JK, Palese P, Garcia-Sastre A.重建1918年西班牙流感大流行病毒的特征。科学。2005;310:77 - 80。
文章中科院PubMed谷歌学者
冯梅斯林V, Oezguen N,郑Q, Vongpunsawad S, Braun W, Cattaneo R.附近的血凝素残基簇支持slam依赖的犬瘟热病毒进入外周血单个核细胞。中国病毒学杂志,2005;79:5857-62。
文章中科院谷歌学者
Pratakpiriya W, Seki F, Otsuki N, Sakai K, Fukuhara H, Katamoto H, Hirai T, Maenaka K, Techangamsuwan S, Lan NT: Nectin4是犬瘟热病毒的上皮细胞受体,参与神经毒力。J Virol 2012:JVI。00824 - 00812。
Mühlebach MD, Mateo M, Sinn PL, Prüfer S, Uhlig KM, Leonard VH, Navaratnarajah CK, Frenzke M, Wong XX, Sawatsky B.粘附连接蛋白nectin-4是麻疹病毒的上皮受体。大自然。2011;480:530。
文章中科院PubMed公共医学中心谷歌学者
陈娟,梁霞,陈凤芬。犬瘟热病毒利用不同受体感染鸡胚成纤维细胞和vero细胞。生物学报。2011;26:139-45。
文章中科院PubMed谷歌学者
柯桂敏,何超,蒋迈杰,山野端田B,钟春春,林美美,石玉云,杨明明,田玉春,廖培平,朱丕平。犬瘟热病毒血凝素基因的系统动力学分析。BMC Vet Res. 2015;11:164。
文章中科院PubMed公共医学中心谷歌学者
Mochizuki M, Hashimoto M, Hagiwara S, Yoshida Y, Ishiguro S.犬瘟热病毒基因型分析临床微生物学杂志。1999;37:2936-42。
中科院PubMed公共医学中心谷歌学者
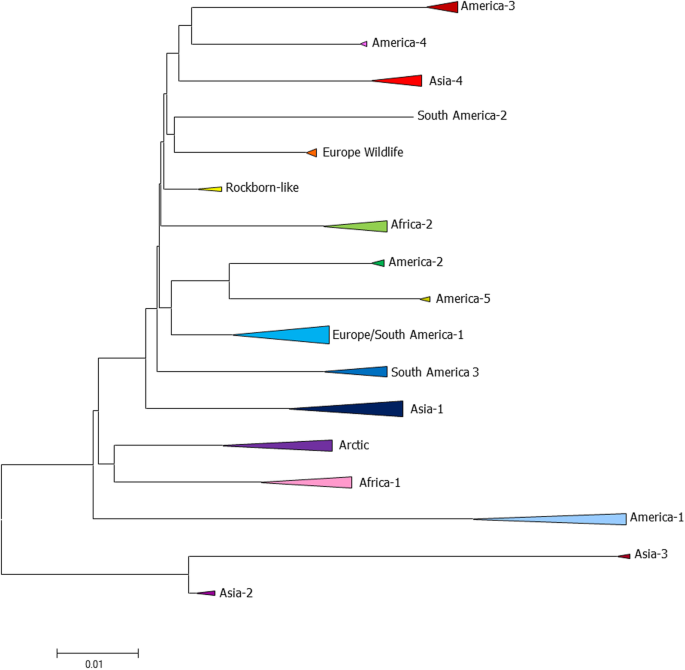
阿尼斯E,纽维尔TK,戴尔N,威尔克斯RP。美国流行的犬瘟热病毒野生株的系统发育分析。病毒,2018;15:118。
文章中科院PubMed公共医学中心谷歌学者
blxenkrone -Møller M, Svansson V, Appel M, Krogsrud J, Have P, Örvell C.不同食肉动物麻疹病毒现场分离株的抗原关系。阿奇·维罗尔,1992;123:279-94。
文章PubMed谷歌学者
Espinal MA, Diaz FJ, Ruiz-Saenz J.南美哥伦比亚家犬犬瘟热病毒谱系的系统发育证据。兽医微生物,2014;172:168-76。
文章PubMed谷歌学者
Haas L, Martens W, Greiser-Wilke I, Mamaev L, Butina T, Maack D, Barrett T.德国现有野生型犬瘟热病毒分离株血凝素基因分析。病毒决议1997;48:165-71。
文章中科院PubMed谷歌学者
Harder TC, Kenter M, Vos H, Siebelink K, Huisman W, van Amerongen G, Orvell C, Barrett T, Appel MJ, Osterhaus AD。来自患病大型猫科动物的犬瘟热病毒:生物学特性和系统发育关系。中华病毒学杂志,1996;32 (Pt 3): 397-405。
文章中科院PubMed谷歌学者
Iwatsuki K, Tokiyoshi S, Hirayama N, Nakamura K, Ohashi K, Wakasa C, Mikami T, Kai C.犬瘟热病毒H蛋白抗原性差异。兽医微生物学杂志2000;71:281-6。
文章中科院PubMed谷歌学者
Panzera Y, Calderon MG, Sarute N, Guasco S, Cardeillac A, Bonilla B, Hernandez M, Francia L, Bedo G, La Torre J, Perez R.南美洲犬瘟热病毒两种共循环遗传谱系的证据。病毒决议2012;163:401-4。
文章中科院PubMed谷歌学者
莱利是MC,威尔克斯是RP。新出现的犬瘟热病毒株的测序揭示了美国与野生动物和家养犬类疾病相关的新的独特遗传谱系。病毒J. 2015; 12:19 2。
文章中科院PubMed公共医学中心谷歌学者
Nikolin VM, Olarte-Castillo XA, Osterrieder N, Hofer H, Dubovi E, Mazzoni CJ, Brunner E, Goller KV, Fyumagwa RD, Moehlman PD,等。塞伦盖蒂生态系统中的犬瘟热病毒:对不同食肉动物物种的分子适应。分子生物学学报,2017;26:2111-30。
文章中科院PubMed谷歌学者
赵俊杰,闫晓军,柴晓林,Martella V,罗桂兰,张海林,高辉,刘彦霞,白霞,张磊,等。中国繁殖狐狸、貉和水貂犬瘟热病毒株血凝素基因的系统发育分析兽医微生物,2010;140:34-42。
文章中科院PubMed谷歌学者
Radtanakatikanon A, Keawcharoen J, Charoenvisal NT, Poovorawan Y, Prompetchara E, Yamaguchi R, Techangamsuwan S.泰国犬瘟热病毒分离株基因型谱系及限制性片段长度多态性兽医微生物,2013;166:76-83。
文章中科院PubMed谷歌学者
Martella V, Blixenkrone-Moller M, Elia G, Lucente MS, Cirone F, Decaro N, Nielsen L, Banyai K, Carmichael LE, Buonavoglia C.犬瘟热病毒疫苗Rockborn株的光影。疫苗。2011;29:1222-7。
文章中科院PubMed谷歌学者
长尾Y,西尾Y,盐田H, Tamaru S,下岛M,后藤M, Une Y,佐藤A,池部Y,前田K.老虎犬瘟热病毒爆发:可能从野生动物传播到动物园动物。中华兽医科学(英文版)2012;
文章中科院PubMed谷歌学者
阿尼斯E,霍福德AL, Galyon GD,威尔克斯RP。犬瘟热病毒遗传变异的抗原分析。兽医微生物,2018;219:154-60。
文章中科院PubMed谷歌学者
Beaty SM, Park A, Won ST, Hong P, Lyons M, Vigant F, Freiberg AN, tenOever BR, Duprex WP, Lee B.高效和强大的副粘病毒反向遗传系统。mSphere。2017; 2(2)。
Gassen U, Collins FM, Duprex WP, Rima BK.犬瘟热病毒抢救系统的建立。中国病毒学杂志,2000;74:10737-44。
文章中科院PubMed公共医学中心谷歌学者
杜普丽,马丽娟,王丽娟,等。麻疹病毒在星形细胞瘤细胞间传播的研究。中国病毒学杂志,1999;73:9568-75。
中科院PubMed公共医学中心谷歌学者
杜prex WP, Mcquaid S, Roscic-Mrkic B, Cattaneo R, Mccallister C, Rima BK.表达增强绿色荧光蛋白的重组麻疹病毒感染神经细胞的体外和体内研究。中国病毒学杂志,2000;74:7972-9。
文章中科院PubMed公共医学中心谷歌学者
Ludlow M, Nguyen DT, Silin D, Lyubomska O, de Vries RD, von Messling V, McQuaid S, de Swart RL, Duprex WP。重组犬瘟热病毒株Snyder Hill表达绿色或红色荧光蛋白可引起雪貂脑膜脑炎。中国病毒学杂志,2012;86:7508-19。
文章中科院PubMed公共医学中心谷歌学者
Von Messling V, Milosevic D, Cattaneo R.趋向性照射:致命麻疹病毒通过宿主免疫系统点燃以淋巴细胞为基础的通路。中国科学院学报(自然科学版)2004;
文章谷歌学者
Sawatsky B, Cattaneo R, von Messling V:犬瘟热病毒传播和传播到Naive雪貂:slam依赖进入的选择压力。J Virol 2018:JVI。00669 - 00618。
de Vries RD, Ludlow M, de Jong A, Rennick LJ, Verburgh RJ, van Amerongen G, van Riel D, van Run P, Herfst S, Kuiken T,等。通过研究多色犬瘟热病毒在雪貂体内的竞争,描述麻疹病毒的进入、传播和空气传播。公共科学图书馆,2017;13:e1006371。
文章中科院PubMed公共医学中心谷歌学者
Stephensen CB, Welter J, Thaker SR, Taylor J, Tartaglia J, Paoletti E.雪貂犬瘟热病毒(CDV)感染作为测试麻疹病毒疫苗策略的模型:基于nyac和alac的CDV重组可预防症状感染。中国病毒学杂志,1997;71:1506-13。
中科院PubMed公共医学中心谷歌学者
王凤霞,张世强,朱红文,杨勇,孙楠,谭波,李志刚,程世平,付泽峰,温永杰。表达犬瘟热病毒H蛋白的重组狂犬病毒能保护狗免于犬瘟热病毒的致命攻击。兽医微生物,2014;174:362-71。
文章中科院PubMed谷歌学者
da Fontoura Budaszewski R, Hudacek A, Sawatsky B, Krämer B, Xiangping Y, Schnell MJ, von Messling V:显示犬瘟热病毒糖蛋白的灭活重组狂犬病毒诱导对两种病原体的保护性免疫。J Virol 2017:JVI。02077 - 02016。
王霞,冯宁,葛娟,帅林,彭林,高原,杨松,夏霞,卜震。重组犬瘟热病毒作为狂犬病和犬瘟热病毒二价活疫苗的研究。疫苗。2012;30:5067 - 72。
文章中科院PubMed谷歌学者
Avila M, Khosravi M, Alves L, Ader-Ebert N, Bringolf F, Zurbriggen A, Plemper RK, platet P.融合蛋白球状头疏水残基调控犬瘟热病毒包膜蛋白相互作用。中国病毒学杂志,2015;
文章中科院PubMed谷歌学者
Beineke A, Puff C, Seehusen F, Baumgartner W.系统性和神经性犬瘟热的发病机制和免疫病理。兽医免疫学杂志2009;127:1-18。
文章中科院PubMed谷歌学者
Amude A, Alfieri A, Alfieri A.犬犬瘟热脑脊髓炎的临床病理发现没有该病的特征性体征。中国兽医科学,2007;42:416 - 22。
文章中科院PubMed谷歌学者
Koutinas AF, Baumgartner W, Tontis D, Polizopoulou Z, Saridomichelakis MN, Lekkas S.犬瘟热病毒诱导的狗足垫角化过度(硬垫病)的组织病理学和免疫组织化学。兽医病理学,2004;41:2-9。
文章中科院PubMed谷歌学者
陈志强,李志强,陈志强,等。犬瘟热病毒感染致脱髓鞘的研究进展。神经病理学杂志2005;109:56-68。
文章PubMed谷歌学者
Schobesberger M, Summerfield A, Doherr MG, Zurbriggen A, Griot C.犬瘟热病毒诱导的未感染淋巴细胞耗竭与细胞凋亡相关。兽医免疫学。2005;104:33-44。
文章中科院PubMed谷歌学者
Ulrich R, Puff C, Wewetzer K, Kalkuhl A, Deschl U, Baumgartner W.犬瘟热病毒诱导的脱髓鞘白脑炎的转录变化有利于双相脱髓鞘模式。科学通报。2014;9:e95917。
文章中科院PubMed公共医学中心谷歌学者
犬瘟热病毒A75/17-CDV毒株核衣壳蛋白的核苷酸和推断氨基酸序列。兽医微生物学杂志,1995;44:11 - 7。
文章中科院PubMed谷歌学者
李志强,李志强,李志强,等。负链RNA病毒的合成机制研究。病毒学。2015;479 - 480:532 - 44。
文章中科院PubMed谷歌学者
张志刚,张志刚,张志刚。病毒进入机制:副粘病毒进入的多样性增加。Febs j . 2009; 276:7217-27。
文章中科院PubMed公共医学中心谷歌学者
Bringolf F, Herren M, Wyss M, Vidondo B, Langedijk JP, Zurbriggen A, platet P.犬瘟热病毒基质蛋白二聚化效率调节膜芽萌发活性。中国病毒学杂志,2017;91:JVI: 00521-17。
谷歌学者
Otsuki N, Nakatsu Y, Kubota T, Sekizuka T, Seki F, Sakai K, Kuroda M, Yamaguchi R, Takeda M.犬瘟热病毒V蛋白是病毒在人上皮细胞中复制所必需的。科学通报。2013;8:e82343。
文章中科院PubMed公共医学中心谷歌学者
Avila M, Alves L, Khosravi M, Ader-Ebert N, Origgi F, Schneider-Schaulies J, Zurbriggen A, Plemper RK, platet P.犬瘟热病毒预融合F复合物触发范围的分子决定因素。中国病毒学杂志,2014;88:2951-66。
文章中科院PubMed公共医学中心谷歌学者
Khosravi M, Bringolf F, Rothlisberger S, Bieringer M, Schneider-Schaulies J, Zurbriggen A, Origgi F, platet P.犬瘟热病毒融合激活:CD150/SLAM残基E123的关键作用中国病毒学杂志,2016;90:1622-37。
文章中科院PubMed公共医学中心谷歌学者
彭志强,李志强,李志强。麻疹病毒融合蛋白:结构、功能和抑制。病毒。2016;8:112。
文章中科院PubMed公共医学中心谷歌学者
Moss WJ, Griffin DE,全球消除麻疹。微生物学报。2006;4:9 9 - 8。
文章中科院PubMed谷歌学者
Das K, Arnold E.负链RNA病毒L蛋白:一台机器,多种活动。细胞。2015;162:239-41。
文章中科院PubMed谷歌学者
羊肉RA。副粘病毒科:病毒及其复制;2001.
谷歌学者
王晓明,王晓明,王晓明,冯晓明,等。病毒与宿主相互作用的研究进展。在:Adv病毒决议第100卷。剑桥:爱思唯尔;2018;p . 75 - 98。
Anderson DE, Castan A, Bisaillon M, von Messling V.犬瘟热病毒M 3 ' UTR中的元素有助于控制复制效率和毒力。公共科学图书馆,2012;7:e31561。
文章中科院PubMed公共医学中心谷歌学者
冯梅斯林V, Cattaneo R.氨基末端前体序列调节犬瘟热病毒融合蛋白功能。中国病毒学杂志,2002;76:4172-80。
文章中科院谷歌学者
Anderson DE, Von Messling V.犬瘟热病毒M和F基因之间的区域通过控制融合蛋白表达调节毒力。中国病毒学杂志,2008;82:10510-8。
文章中科院PubMed公共医学中心谷歌学者
王晓明,王晓明,王晓明。犬瘟热病毒持久性的决定因素。兽医微生物学,1997;57:83-93。
文章中科院PubMed谷歌学者
王晓明,王晓明,王晓明,等。犬瘟热病毒基质信使RNA 3 '非翻译区短开放阅读框的研究。病毒决议2010;153:234-43。
文章中科院PubMed谷歌学者
Dietzel E, Anderson DE, Castan A, von Messling V, Maisner A.犬瘟热病毒基质蛋白影响极化上皮细胞的颗粒感染性、颗粒组成和包膜分布并调节毒性。中国病毒学杂志,2011;85:7162-8。
文章中科院PubMed公共医学中心谷歌学者
张志刚,张志刚,张志刚。副粘病毒糖蛋白的掺入、组装和出芽:感染性颗粒产生的三步舞。病毒。2014;6:3019-54。
文章中科院PubMed公共医学中心谷歌学者
Salditt A, Koethe S, Pohl C, Harms H, Kolesnikova L, Becker S, Schneider-Schaulies S.麻疹病毒M蛋白驱动的颗粒产生不涉及运输(ESCRT)系统所需的内体分选复合物。中国病毒学杂志,2010;
文章中科院PubMed谷歌学者
Imhoff H, von Messling V, Herrler G, Haas L.犬瘟热病毒感染需要病毒包膜中的胆固醇。中国病毒学杂志,2007;81:4158-65。
文章中科院PubMed公共医学中心谷歌学者
Sawatsky B, Bente DA, Czub M, von Messling V.病毒和亨尼帕病毒附着蛋白细胞质结构域不同程度地影响蛋白表达、融合支持和颗粒组装。J Gen Virol, 2016; 97:1066-76。
文章中科院PubMed谷歌学者
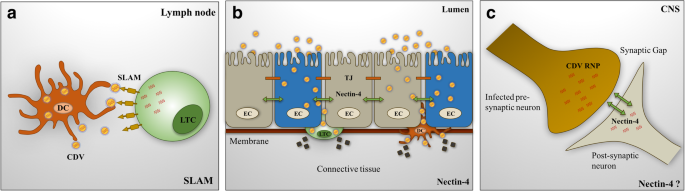
Noyce RS, Delpeut S, Richardson CD。犬nectin-4是犬瘟热病毒的上皮细胞受体,促进病毒进入和合胞体形成。病毒学。2013;436:210-20。
文章中科院PubMed谷歌学者
Ono N, Tatsuo H, Tanaka K, Minagawa H, Yanagi Y. V人类SLAM结构域(CDw150)对其作为麻疹病毒受体的功能至关重要。中国病毒学杂志,2001;
文章中科院PubMed公共医学中心谷歌学者
De Witte L, De Vries RD, Van Der Vlist M, Yüksel S, Litjens M, De Swart RL, Geijtenbeek TB。DC-SIGN和CD150在麻疹病毒从树突状细胞向t淋巴细胞的传播中具有不同的作用。科学通报。2008;4:e1000049。
文章中科院PubMed公共医学中心谷歌学者
Leonard VH, Sinn PL, Hodge G, Miest T, Devaux P, Oezguen N, Braun W, McCray PB, McChesney MB, Cattaneo r麻疹病毒对其上皮细胞受体不可见,但在恒河猴中仍然具有毒性,但不能穿过气道上皮细胞,也不会脱落。《临床投资杂志》2008;118:2448-58。
中科院PubMed公共医学中心谷歌学者
Delpeut S, Sawatsky B, Wong X-X, Frenzke M, Cattaneo R, Von Messling V:在一种新的发病机制模型中,Nectin-4相互作用控制麻疹病毒毒力,松鼠猴(sciureus)。J病毒2017:JVI。02490 - 02416。
Nectin 4是麻疹病毒的上皮细胞受体。微生物学杂志,2012;20:429-39。
文章中科院PubMed谷歌学者
Haines DM, Martin KM, Chelack BJ, Sargent RA, Outerbridge CA, Clark EG。毛发皮肤、鼻黏膜和足垫上皮中犬瘟热病毒的免疫组化检测:一种死前诊断感染的方法中华兽医杂志1999;11:396-9。
文章中科院谷歌学者
Sawatsky B, Wong X-X, Hinkelmann S, Cattaneo R, Von Messling V.犬瘟热病毒上皮细胞感染是临床疾病所必需的,但不是免疫抑制。中国病毒学杂志,2012:JVI。06414 - 1。
Takenaka A, Sato H,池田F, Yoneda M, Kai C.犬瘟热病毒从循环脑脊液进入中枢神经系统的感染进展。中国病毒学杂志,2016;90:9285-92。
文章中科院PubMed公共医学中心谷歌学者
戴培文,李志刚,刘志刚。宿主因子与麻疹病毒复制的关系。《中国医学杂志》2012;2:773-83。
文章中科院PubMed谷歌学者
Pratakpiriya W, Ping Teh AP, Radtanakatikanon A, Pirarat N, Thi Lan N, Takeda M, Techangamsuwan S, Yamaguchi R.犬瘟热病毒受体nectin-4在犬中枢神经系统中的表达。科学通报2017;7:349。
文章中科院PubMed公共医学中心谷歌学者
Ludlow M, Rennick LJ, Nambulli S, de Swart RL, Duprex WP。利用雪貂模型研究麻疹病毒的进入、传播、传播和跨种感染。《中国医学杂志》2014;4:15-23。
文章中科院PubMed谷歌学者
Di Guardo G, giacominellis stuffler R, Mazzariol S.评论:slam和nectin -4独立的犬瘟热病毒在星形细胞中的非细胞溶解性传播。前沿微生物。2016;7:2011。
PubMed公共医学中心谷歌学者
Wyss-Fluehmann G, Zurbriggen A, Vandevelde M, platet P.犬瘟热病毒在脱髓鞘脑炎中通过星形胶质细胞内快速细胞间传播的持久性受病毒附着蛋白控制。神经病理学报2010;119:617-30。
文章中科院PubMed公共医学中心谷歌学者
Rothlisberger A, Wiener D, Schweizer M, Peterhans E, Zurbriggen A, platet P.毒性犬瘟热病毒V蛋白的两个结构域选择性抑制STAT1和STAT2核输入。中国病毒学杂志,2010;84:6328-43。
文章中科院PubMed公共医学中心谷歌学者
Svitek N, Gerhauser I, Goncalves C, Grabski E, Döring M, Kalinke U, Anderson DE, Cattaneo R, Von Messling V.麻疹病毒对干扰素反应的控制:STAT2和mda5与雪貂犬瘟热病毒毒力的相关性,而不是STAT1。中国病毒学杂志。2013:JVI。03076 - 13所示。
Massé N, Ainouze M, Néel B, Wild TF, Buckland R, Langedijk JP。麻疹病毒(MV)血凝素:证据表明MV受体SLAM和CD46的附着位点在球状头重叠。中国病毒学杂志,2004;78:9051-63。
文章中科院PubMed公共医学中心谷歌学者
李JK,普鲁士A,包T,白LK,施耐德JP, Plemper RK。副粘病毒融合与附着蛋白的功能相互作用。生物化学学报。2008;283:16561-72。
文章中科院PubMed公共医学中心谷歌学者
Martella V, Cirone F, Elia G, Lorusso E, Decaro N, Campolo M, Desario C, Lucente M, Bellacicco A, blixenkrone -M .意大利犬瘟热病毒(CDV)毒株血凝素基因的异质性兽医微生物学杂志,2006;116:301-9。
文章中科院PubMed谷歌学者
Langedijk JP, Janda J, Origgi FC, Örvell C, Vandevelde M, Zurbriggen A, platet P.犬瘟热病毒通过位于附着蛋白一侧的重叠和不同区域感染犬角化细胞和免疫细胞。中国病毒学杂志,2011:JVI。05340 - 11。
hasiguchi T, Ose T, Kubota M, Maita N, Kamishikiryo J, Maenaka K, Yanagi Y.麻疹病毒血凝素与细胞受体SLAM结合的结构。分子生物学杂志,2011;18:135-41。
文章中科院PubMed谷歌学者
张鑫,陆刚,齐军,李勇,何颖,徐鑫,史军,张长武,闫娟,高方锋。麻疹病毒血凝素与其上皮受体胶凝素-4结合的结构。分子生物学杂志,2013;20:67-72。
文章中科院PubMed谷歌学者
Noyce RS, Bondre DG, Ha MN, Lin L-T, Sisson G, Tsao M-S, Richardson CD.肿瘤细胞标记物PVRL4 (nectin 4)是麻疹病毒的上皮细胞受体。公共科学图书馆,2011;7:e1002240。
文章中科院PubMed公共医学中心谷歌学者
Otsuki N, Sekizuka T, Seki F, Sakai K, Kubota T, Nakatsu Y, Chen S, Fukuhara H, Maenaka K, Yamaguchi R.犬瘟热病毒具有完整的C蛋白,利用人nectin4作为受体在人上皮细胞中复制的潜力。病毒学。2013;435:485 - 92。
文章中科院PubMed谷歌学者
Sakai K,永田N, Ami Y, Seki F, Suzaki Y,岩田吉川N,铃木T,福志S,水谷T,吉川T,等。2008年日本食蟹猴爆发致命犬瘟热病毒。中国病毒学杂志,2013;87:1105-14。
文章中科院PubMed公共医学中心谷歌学者
de Vries RD, Ludlow M, Verburgh RJ, van Amerongen G, Yuksel S, Nguyen DT, McQuaid S, Osterhaus AD, Duprex WP, de Swart RL。对非人灵长类动物接种麻疹疫苗可部分预防犬瘟热病毒感染。中国病毒学杂志,2014;88:4423-33。
文章中科院PubMed公共医学中心谷歌学者
刘冯N, Y,王J,徐W,李T, T小王,小王L,于Y,王H,赵Y犬瘟热病毒隔绝猴子有效地复制在维洛细胞表达非人类灵长类动物大满贯受体而不是人类受体。BMC Vet Res. 2016;12:160。
文章中科院PubMed公共医学中心谷歌学者
Appel MJ, Shek WR, Shesberadaran H, Norrby E.麻疹病毒和灭活的犬瘟热病毒诱导犬瘟热不完全免疫。阿奇·维罗尔,1984;82:73-82。
文章中科院PubMed谷歌学者
犬瘟热疫苗与麻疹疫苗预防幼犬犬瘟热的比较。Vet Rec. 1994; 135:349-53。
文章中科院PubMed谷歌学者