患者和血液样本的采集
本研究前瞻性地纳入了2012年11月至2015年1月在上海道培医院采用RIC方案进行单倍体造血干细胞移植的28例患者。
所有患者均接受HLA-A*0201-或HLA-A*1101阳性供体单次单倍体造血干细胞移植。9例患者因移植后100天内复发(3例)或供体淋巴细胞输注(6例)而被排除;最终纳入19例可评估患者。
入选的19例患者供体HLA-A*0201(10例)或HLA-A*1101(9例)阳性,28例健康志愿者(均为EBV长期携带者)携带HLA-A*0201(9例)或HLA-A*1101(19例),49例阴性对照组均为HLA-A*0201-和HLA-A*1101阴性。根据供体组织类型将患者分为HLA-A*0201组和HLA-A*1101组。患者、供体、健康的长期EBV携带者和阴性对照均在EBV- igm血清序列中呈阴性反应,在EBV- igg血清序列中呈阳性反应。所有患者在移植后+ 30、+ 60和+ 90天的骨穿刺和嵌合检查均为100%供体类型。
在常规实验室抽血时采集患者外周血样品(5ml)。从28名HLA-A*0201-或HLA-A*1101阳性的健康志愿者的血液样本中获得EBV- ctl的基线水平,以确定健康的长期EBV携带者。取HLA-A*0201-和HLA-A*1101阴性志愿者血样作为阴性对照。从19名患者中获得48份血液样本。在HLA-A*0201组中,5名患者分别在+ 30、+ 60和+ 90天提供血液样本;4例患者+ 30和+ 60天;一名患者在单体造血干细胞移植后+ 30天。1例患者死于侵袭性肺曲霉菌病,2例患者死于单倍体移植后+ 74和+ 87天死于ebv相关疾病/PTLDs, 2例患者在+ 90天失去随访(他们没有死亡,并在+ 120天恢复随访)。我们在移植后+ 30天通过骨穿刺和短串联重复(STR)检查发现+ 43天死亡的患者为100%供体型。然而,在+ 33天,该患者出现高热、肺部感染和血细胞减少,并在+ 37天发现嵌合率下降至供体受体的23%。 Secondary graft failure was observed, which was thought to be related to the serious pulmonary fungal infection. In the HLA-A*1101 group, blood samples were obtained from six patients at + 30, + 60, and + 90 days and from three patients at + 30 and + 60 days; the other three patients died because of invasive pulmonary aspergillosis (one case), cytomegalovirus (CMV) pneumonia (one case), and EBV-related gastroenteritis (one case).
检测血清ebv特异性抗体状态
根据制造商说明书,使用抗eb - Barr病毒(EBV- vca) IgM人体外酶联免疫吸附试验(ELISA)试剂盒和EBV- vca -IgG人体外酶联免疫吸附试验(艾克生物科学,上海,中国)检测患者、供体、健康的长期EBV携带者和阴性对照在HSCT前的血清EBV-IgM和IgG状态。
HLA的差距
HLA-A, HLA-B, HLA-Cw和HLA-DRB1分型使用高分辨率DNA技术,根据制造商的说明。试剂(Special Monoclonal Tray- asian HLA Class I和Micro SSP HLA Class I和II ABDR DNA分型托盘;一个Lambda, Canoga Park, CA)被商业进口。
嵌合现象分析
单倍体造血干细胞移植后,连续6个月每月检测骨髓嵌合。嵌合性测定采用STR DNA指纹图谱和染色体荧光原位杂交(FISH)两种方法之一。通过性别匹配的供体-受体对受体BM细胞中STR的DNA指纹图谱评估嵌合性;然而,在性别不匹配的供体-受体配对中,用FISH分析嵌合性。
Haplo-HSCT过程
调节方案为:阿糖胞苷(2.0 g/m2),每日一次,第13 - 12天,氟达拉滨(30mg /m2)每日1次,第11至第7天;布硫凡(0.8 mg/kg,每6 h),第6至第4天;ATG(费森尤斯,5 mg/kg),每日1次,第5至第2天(11例);或静脉注射阿糖胞苷(2.0 g/m2),每日1次,在−14至−13天,氟达拉滨(30mg /m2),每日一次,在−12至−8天,硫替帕(125 mg/m2),每日1次,第8至第5天;ATG(费森尤斯,5mg /kg),每日1次,第5至第2天(8例患者)。
对于GVHD的预防和管理,每位患者给予环孢素A (CSA, 2.5 mg/kg,每日两次,静脉注射),短疗程的甲氨蝶呤(15 mg/m2每日1次,静脉注射,第1天和10 mg/m2+ 1 ~ + 14天口服霉酚酸酯(7.5 mg/kg,每天两次)作为GVHD的预防。如果患者出现病毒活化,包括CMV或EBV,并且当时没有GVHD,则取消CSA。如果患者发生aGVHD < II级,则给予甲基强的松龙(0.25 mg/kg/天)。只有2例患者发生III级aGVHD,发生在CSA变细之前。
采集造血干细胞:分别于第01天和第02天采集供体骨髓和外周血,使用粒细胞集落刺激因子(7.5 μg/kg/d,第4天至第02天)。
所有患者的支持性护理相似。所有血液制品都进行了辐射,白细胞被清除。在调节过程中常规使用卡泊芬净进行抗真菌预防,移植后使用伏立康唑。肺孢子虫预防,典型的是甲氧苄啶-磺胺甲恶唑,直到移植后6个月。阿昔洛韦,通常400毫克口服,每天两次,直到移植后24个月。
EBV在外周血中的再激活监测和EBV相关疾病的定义
EBV-DNA拷贝数用外周血标本或活检标本定量PCR (qPCR)测定。简单地说,基因组DNA是从250 μL全血或消化组织中分离出来的,使用Axyprep Mag组织血液基因组DNA试剂盒(Axygen, Union City, CA,USA),根据制造商的说明。qPCR在ABI 7300热循环仪上使用市售EBV PCR试剂盒(Daan Gene Technology, Guangzhou, China)进行,结果显示为全血DNA拷贝数/mL, EBV的检测阈值为500拷贝数/mL。
在单倍体造血干细胞移植后30天内每周监测EBV-DNA拷贝数,随后每隔一周监测一次,直到移植后3个月或直到外周血中检测不到EBV-DNA为止。
EBV-DNAemia定义为连续两个时间点EBV-DNA载量超过500拷贝/mL,没有任何ebv相关疾病的迹象或症状,包括可能的和已证实的PTLDs。可能的ptld被定义为显著的淋巴结病、肝脾肿大或其他末端器官表现,伴有EBV-DNA高血负荷和缺乏组织活检和其他有文献记载的原因[12].经证实的PTLDs诊断为在组织标本中检测到EBV核酸或EBV编码蛋白,同时伴有受感染器官的症状和/或体征[12].
MHC i类肽五聚物(五聚体)和试剂
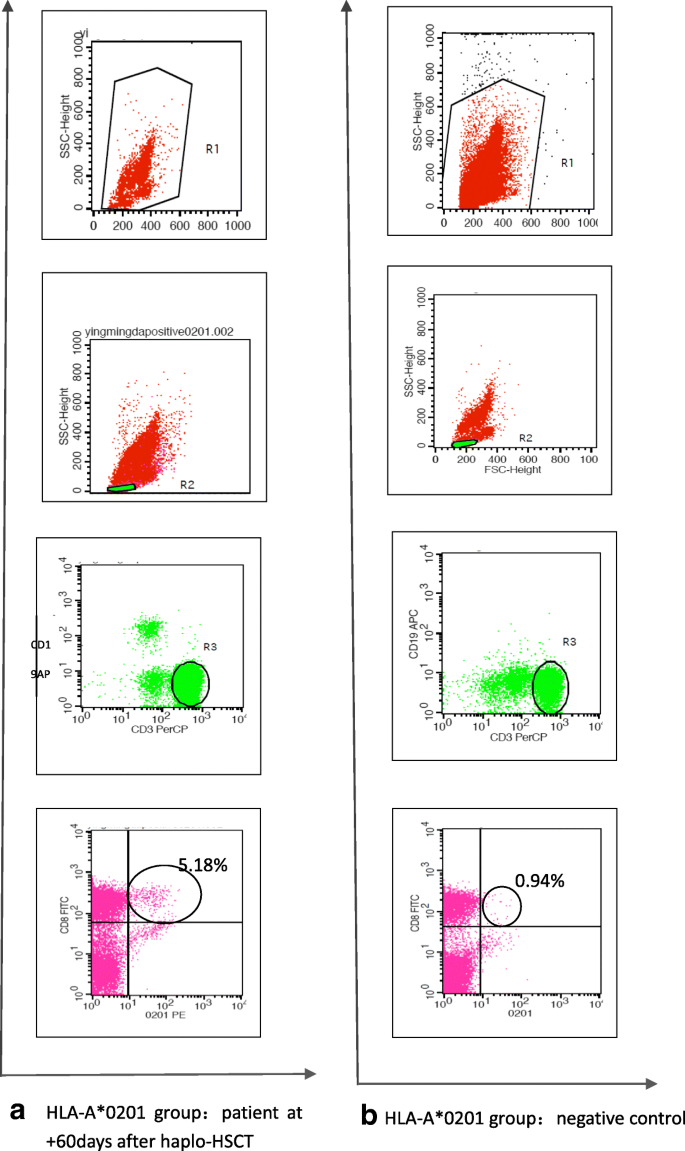
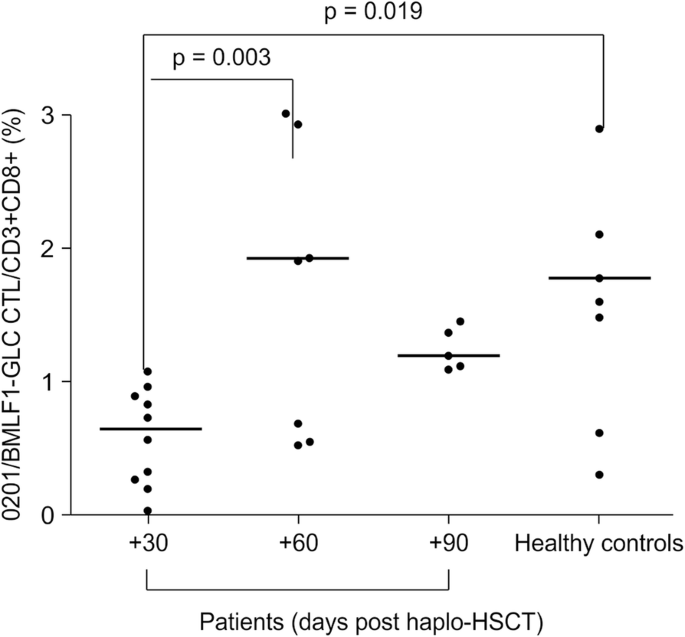
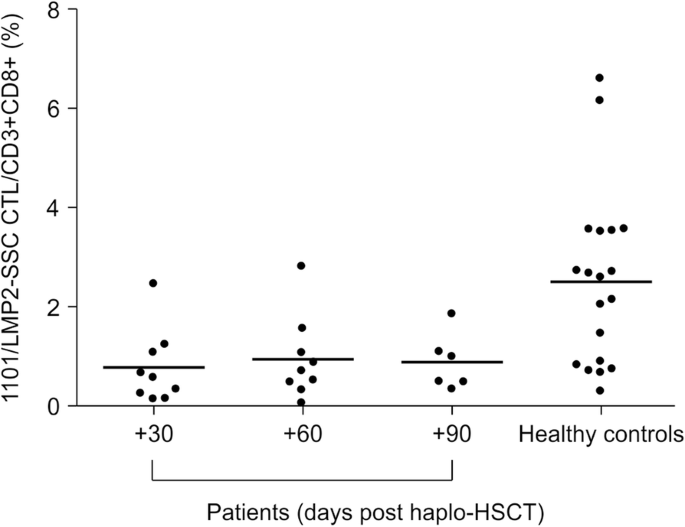
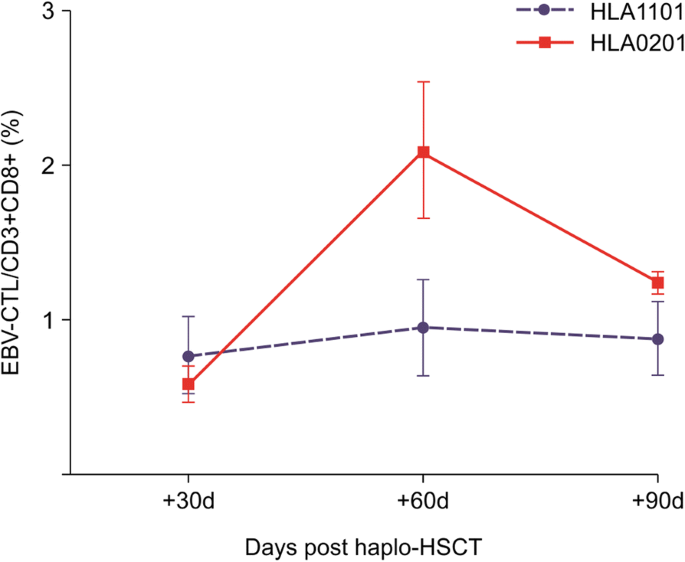
使用了两个EBV肽表位:HLA-A*0201限制性表位GLCTLVAML,来自裂解周期蛋白BMLF1(氨基酸259-267),HLA-A*1101限制性表位SSCSSCPLSK,来自潜在周期蛋白LMP2(氨基酸340-349)。五聚物HLA-A*0201/BMLF1-GLC和HLA-A*1101/LMP2-SSC购自ProImmune, Ltd. (Oxford, UK)。五聚体用藻红菊酯(PE)标记。单克隆抗体,包括抗cd3(橄榄素叶绿素蛋白-[PerCP])、抗cd8(异硫氰酸荧光素-[FITC])和抗cd19(异藻蓝蛋白-[APC]),购自BD生物科学公司(Franklin Lakes, NJ, USA)。实验方案和操作由ProImmune, Ltd. (Oxford, UK)的Pentamer手册推荐。根据协议,细胞从不匹配的五聚体(不相关的MHC等位基因和/或不相关的肽)获得。可用于控制非特异性染色,排除B细胞可能会减少大部分非特异性背景,我们以HLA-0201和1101阴性的成年志愿者作为阴性对照,加入抗cd19单克隆抗体去除B淋巴细胞。简单地说,正向和侧面散射体被用来门控活细胞群,和CD3+CD19−然后获取细胞以删除B淋巴细胞。接下来,CD3+CD19−CD8+获得CD8细胞+T淋巴细胞,最后是五聚体染色的CD3+CD8+CD19−获取细胞作为靶细胞进行FACS分析。EBV- ctl百分比计算如下:EBV- ctl百分比=(患者EBV- ctl百分比或健康长期EBV携带者EBV- ctl百分比(健康对照组)- EBV- ctl阴性对照组百分比)× 100%。
在单倍体造血干细胞移植后+ 30、+ 60和+ 90天采集患者的血液样本,而健康志愿者的血液样本仅采集一次,分别为HLA-A*0201-或HLA-A*1101阳性和阴性对照。基于ebv特异性CD8的百分比,我们评估了HLA-A*0201/BMLF1-GLC和HLA-A*1101/LMP2-SSC五聚体的性能+四色流式细胞术检测T细胞。所有实验均重复三次。
五聚体染色测定
将FACS溶解液(BD Biosciences)添加到血液样本中溶解红细胞。细胞清洗两次,在含1%胎牛血清(FCS)和0.1%叠氮化钠的磷酸盐缓冲盐水(PBS)中重悬。在显微镜下计数有核细胞的数量,并调整到每管包含1-2 × 106有核细胞。然后将滴定过的五聚体加入样品中。在室温(25°C)无光照下孵育10分钟后,加入滴定的单克隆抗体(分别为PerCP-、FITC-或apc偶联CD3、CD8或CD19)进行表面染色。在4℃无光条件下孵育20 min后,用含1% FCS和0.1%叠氮化钠的PBS洗涤两次,然后在4℃条件下保存于1%多聚甲醛中。样品在6小时内在FACS Calibur仪器(BD Biosciences)上进行分析。至少有5000个活CD3+流式细胞术计数淋巴细胞。使用CellQuest (BD Biosciences)进行分析。五聚体结合CD8的频率+根据CD3的百分比计算T细胞+CD8+CD19−T细胞与五聚体结合。HLA-A*0201-和HLA-A*1101阴性患者的血液样本作为阴性对照。
统计数据
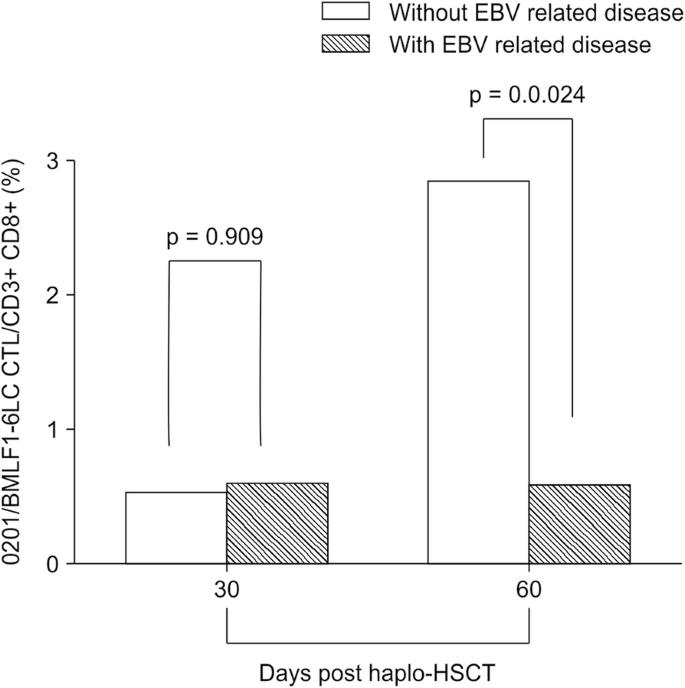
使用SPSS 21.0软件(SPSS, Inc.,芝加哥,伊利诺伊州,美国)进行统计分析。正态分布的定量资料以均数±标准差表示。连续变量和无正态分布的定量数据用中位数和极差表示。采用独立样本比较两组间五聚体的百分比t测试。采用Wilcoxon秩和检验比较有和无ebv相关疾病患者+ 60天HLA-A*0201/BMLF1-GLC五聚体的频率。采用方差分析比较多组间五聚体反应细胞的百分比。所有分析均为双尾和p< 0.05被认为是显著的。