病毒和细胞
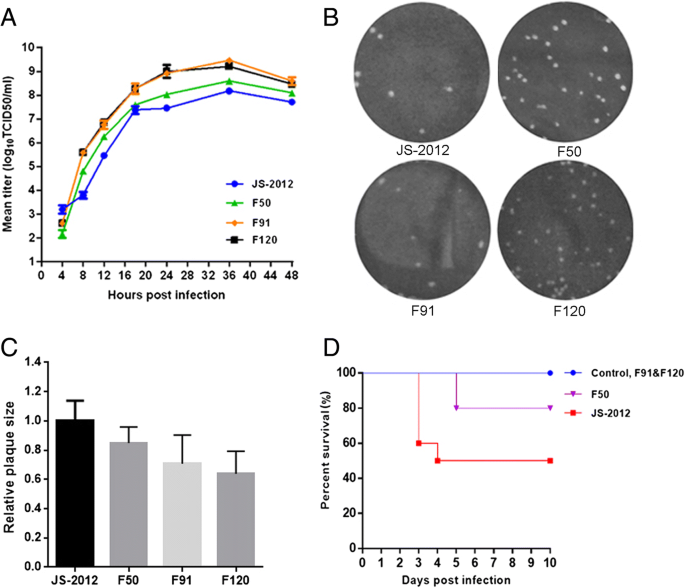
PRV JS-2012是从患病新生仔猪中分离出来的PRV变种。通过37℃下三轮单空斑克隆,从相应的病毒原液中纯化出株JS-2012-F50、-F91和-F120,并根据其各自的文章命名。Vero和PK-15细胞在Dulbecco改良Eagle 's培养基(DMEM) (Gibco,美国)中培养,并添加10%胎牛血清(Gibco,美国)。
小鼠感染
选用6 ~ 8周龄SPF级BALB/c小鼠50只,随机分为5组,每组10只。第1 ~ 4组用含10450%组织培养感染剂量50),分别为JS-2012、F50、F91和F120。第5组小鼠接种100 μL DMEM,作为对照组。在攻毒后的前2天,每12小时观察小鼠的神经症状和生存状况,因为在这段时间内小鼠一般没有表现出明显的症状。在剩余的监测时间内,小鼠逐渐出现神经症状,因此在剩余的8天中,每6小时观察一次,以捕捉每只小鼠的生存状态的变化。同时测定各组小鼠的神经症状评分水平。其中,无神经系统症状的小鼠记0分,轻度神经系统症状如不安、兴奋、偶尔瘙痒记1分,严重神经系统症状(严重瘙痒、自残)记2分。得分为2的小鼠被认为“死亡”,并出于动物福利的原因对其实施安乐死[17].所有动物实验均按照研究所的《实验动物护理和使用指南》进行,并根据机构动物护理和使用委员会批准的协议进行。
Illumina文库制备和测序
JS-2012株全基因组序列(GenBank Accession no.;KP257591)已在前面描述[7].其他菌株的基因组DNA按先前所述制备[15].基因组文库使用Nextera XT DNA样本制备试剂盒(Illumina, USA)制备,测序在Illumina Miseq平台上进行,该平台位于上海马约比奥生物制药科技有限公司(中国上海)。为每个菌株生成的序列读取的数量列在附加文件中1:表S1。
PCR扩增和sanger测序
对HTS无法确定的几个开放阅读框(ORF)区域或需要进一步验证的基因在50 μL反应中进行pcr,反应中含有2 μL模板DNA (50 ng)、25 μL 2 × GC buffer II (Takara)、0.5 μL Ex Taq聚合酶(Takara)、0.5 mM引物、脱氧核苷三磷酸盐和蒸馏水。将预期大小的PCR产物克隆到pMD-18 T载体(Takara)中,每个PCR产物随机选择3个克隆进行Sanger测序。
基因注释及蛋白编码序列分析
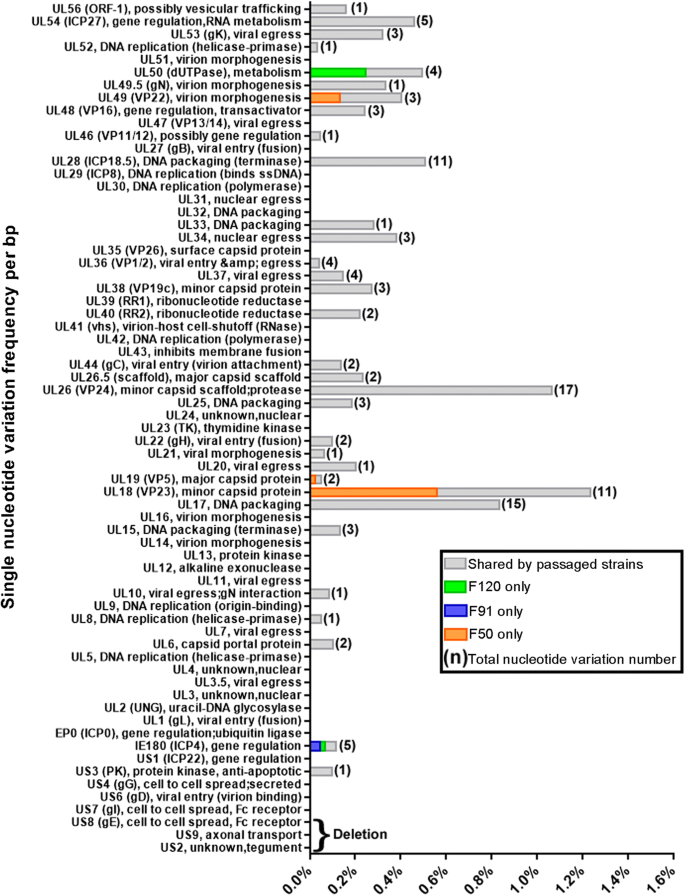
首先用SeqPrep程序对F50、F91和F120的原始Illumina reads进行解适应并合并成单个较长的reads,然后将质量控制的测序片段与参考基因组(GenBank Accession no. 433)进行比对。KP257591)采用BWA软件,然后由genous 8分别进行组装。采用PCR扩增和Sanger测序方法测定间隙。对每个病毒ORF进行BLAST分析,并手动调整JS-2012参考序列,对F50、F91和F120的基因组进行注释。标记的基因组序列存入GenBank序列数据库,登录号为MG551316 (F50)、MG551317 (F91)和MG589642 (F120)。在单核苷酸变异分析中,利用MEGA v.5.0中实现的Muscle (Codons)算法,将三个传代菌株的每个ORF的核苷酸序列与JS-2012进行比对,以确定每个传代菌株中单核苷酸变异的数量和频率[18].同时,表中汇总了F50、F91和F120与JS-2012相比在氨基酸和核苷酸水平上的所有变异1和附加文件2:表S2,帧内和移码索引在表中描述2.
表1 PRV JS-2012的F50、F91和F120传代中发现的氨基酸变异
表2传代毒株与亲代病毒相比鉴定出的变异因子(JS-2012)
cDNA末端3’快速扩增(RACE)
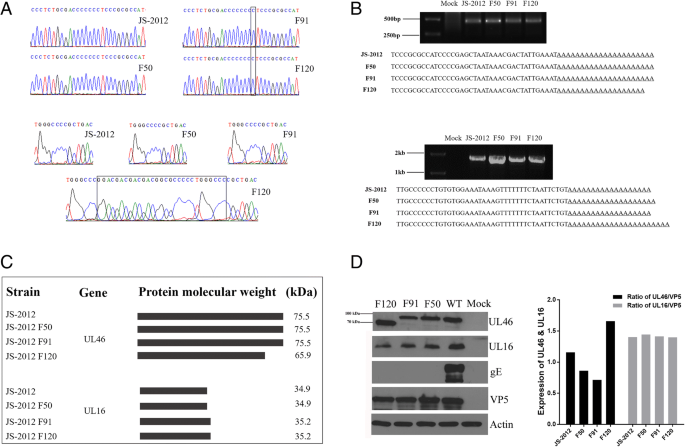
使用RNeasy Mini Kit (Qiagen)提取被指定病毒感染的PK-15细胞的总RNA,用RNase-free DNase I (Ambion)处理,然后用引物Q反转录T3 ' 5 ' -CCAGTGAGCAGAGTGACGAGGACTCGA (t16.1)。将得到的cDNA产物和引物UL16 F597/Q进行PCR反应,获得UL16和UL46的mRNA 3 '端0(5 ' -CGAGTGCCGCGTGGACCAC-3 '和5 ' -CCAGTGAGCAGAGTGACG-3 ')和UL46 F453/Q0(5 ' - gcacccgttcaagcacag -3 '和5 ' -CCAGTGAGCAGAGTGACG-3 ')。UL16 F597和UL46 F453是经过UL16和UL46基因退火的低聚物,Q0Q的锚引物是吗T.将PCR片段亚克隆到TA克隆载体pMD-18 T (Dalian, China)中,进行DNA测序。
Western blot分析
感染24小时后,将细胞收集到冰冷的PBS中,离心,用RIPA缓冲液裂解30分钟,然后在4°C下离心3分钟。收集上清液,煮沸10分钟,在10%聚丙烯酰胺凝胶上SDS-PAGE分离,并使用Bio-Rad半干转移池转移到硝化纤维膜上。用5%的含TBS-T缓冲液的脱脂牛奶阻断膜,用VP5 (UL19)(1:1000)、UL16(1:50)和UL46(1:50)的小鼠多克隆抗体,用稀释在2%含TBS-T缓冲液的脱脂牛奶中的gE单克隆抗体(1:1000)和β-肌动蛋白(1,6000)孵育,然后用稀释在TBS-T缓冲液中的山羊辣根过氧化物酶偶联二抗孵育。使用ImageJ (NIH)凝胶分析仪模块测量蛋白带强度。
含有移码突变的UL46和UL16的ORF分析
UL46和UL16含有移码突变的ORF使用国家生物技术信息中心(https://www.ncbi.nlm.nih.gov/orffinder/),并使用EditSeq (DNASTAR)手动计算每个病毒株对应蛋白质的分子量。