细胞病毒和质粒
DEF细胞取自9 - 11天的特异性无病原体鸭胚胎,如前所述[24],在杜尔贝科改良的Eagle 's培养基中培养。不。8116176;Gibco, Grand Island, NY, USA)补充5%胎牛血清(猫。不。1722658;Gibco)和抗生素(0.1 mg/ml链霉素和0.1 mg/ml青霉素)在37°C的5% CO气氛下2空气/ 95%。DEV株CSC保存于实验室。
为构建GFP-LC3重组质粒,采用引物对LC3F 5’-ATG CAA CCG CCT CTG-3’和LC3R 5’-TCG CGT TGG AAG GCA AAT C-3’从DEF细胞中扩增出与鸭LC3B基因GenBank序列(NW_004676873.1)相对应的LC3基因,并克隆到pEGFP-C1载体中,与GFP蛋白一起表达LC3B蛋白。
病毒感染和药物或小干扰RNA (siRNA)治疗
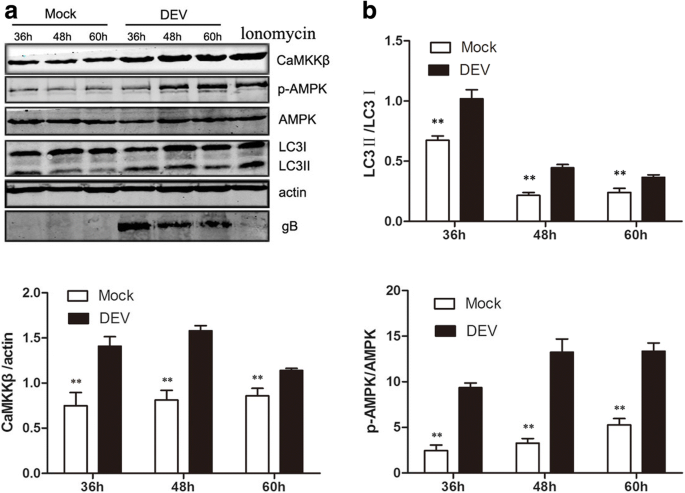
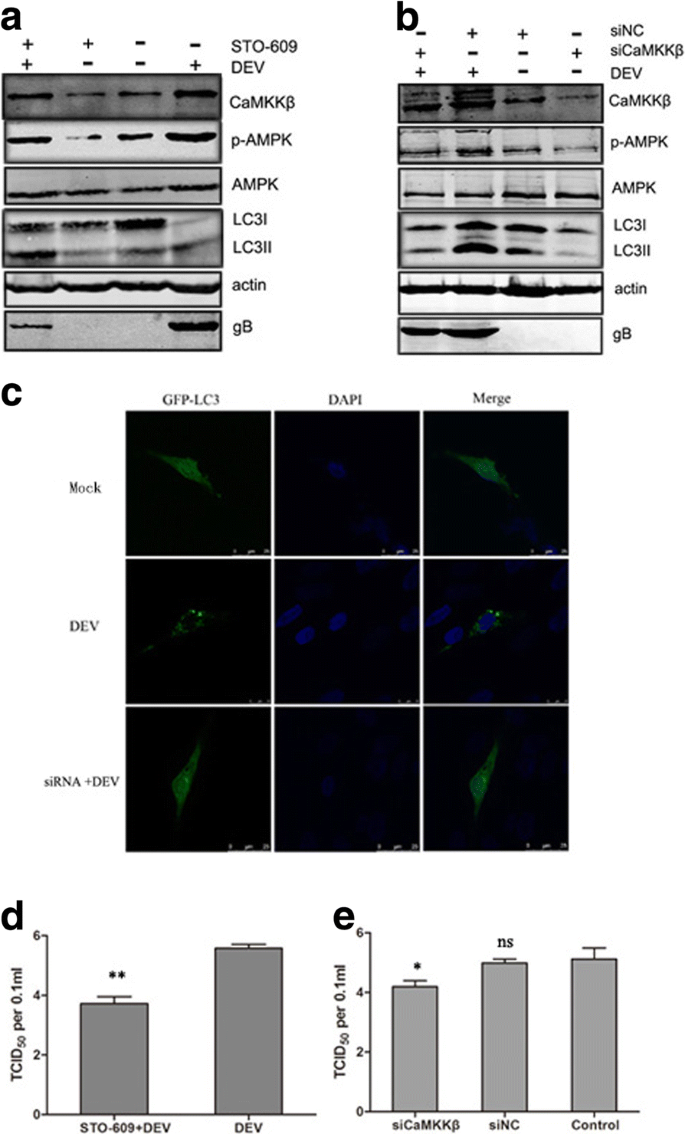
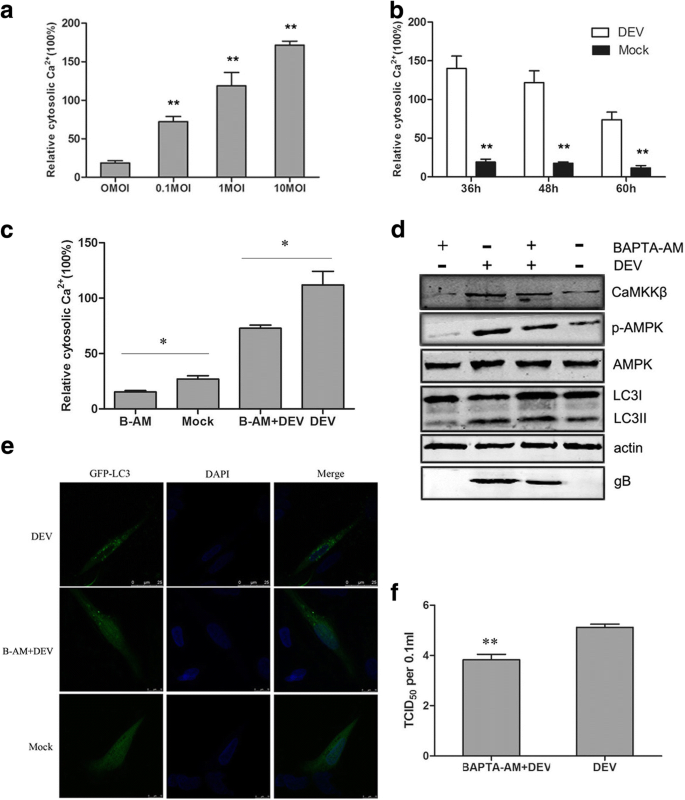
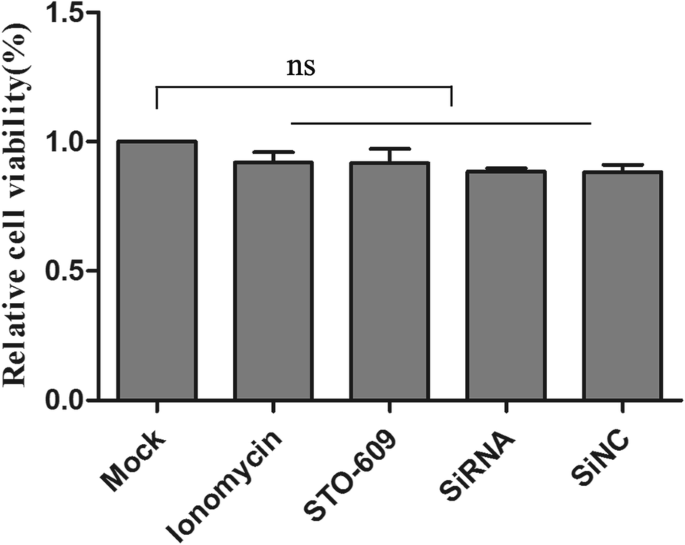
DEF细胞在37°C下用DEV感染2小时,用无菌磷酸盐缓冲盐水(pH 7.4)洗涤三次,然后在添加胎牛血清的培养基中以2%的浓度维持不同时间点,直到收集样本。然后将细胞在添加胎牛血清的2%培养基中培养,在指定的时间内使用或不使用相同的药物进行预处理。本实验的最佳化学试剂浓度为10 mM 1,2-双(2-氨基苯氧基)乙烷-N,N,N ',N-四乙酸(BAPTA-AM;Abcam, Cambridge, UK), 5 μM STO-609 (Merck-Millipore, Darmstadt, Germany),4 μM ionomycin和2.5 μM Fluo-3 AM (Beyotime生物技术研究所,中国海门)。根据制造商的说明,使用WST-1细胞增殖和细胞毒性测定试剂盒(Beyotime)测试药物和sirna的毒性。在感染后36、48和60 h (hpi),收集DEF细胞进行后续分析。
Western blot分析
根据制造商说明书,使用蛋白酶抑制剂苯甲基磺酰氟(Beyotime)免疫沉淀裂解缓冲液(Beyotime)从用药物或sirna处理或感染DEV的细胞中提取蛋白质,然后在5×负载缓冲液中煮沸10分钟,用12%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,转移到硝化纤维膜上(GE Healthcare Life Sciences, Little Chalfont, UK)。用3%牛血清白蛋白(Sigma-Aldrich Corporation, St. Louis, MO, USA)在室温下阻断膜2小时,然后与以下一抗在室温下孵育2小时:兔抗lc3b抗体(Sigma-Aldrich Corporation), mMouse抗camkk β抗体(Sigma-Aldrich Corporation),兔抗p- ampk抗体(Thermo Fisher Scientific, Waltham, MA, USA),小鼠抗ampk抗体(Thermo Fisher Scientific),小鼠抗-β-actin抗体(Sigma-Aldrich Corporation)。然后,用IRDye 800 CW山羊抗小鼠或山羊抗兔免疫球蛋白IgG作为二抗,室温孵育1 h。抗体检测采用奥德赛红外荧光扫描成像系统(LI-COR生物科学公司,林肯,NE,美国)。利用Odyssey红外荧光扫描成像系统应用软件3.0版本,通过在图像上添加矩形直接获得数据,实现对western blot图像强度的定量。
共聚焦荧光显微术
为了检测自噬体,在培养皿中70-80%汇合的DEF细胞用2.5 μg GFP-LC3质粒转染磷酸钙转染试剂盒(cat。不。K2780-01;Invitrogen公司,卡尔斯巴德,CA,美国)。在24 hpi时,化学处理或病毒感染的DEF细胞在不同时间点用无水乙醇固定30分钟,细胞核用4 ' -6-二氨基-2-苯基吲哚(cat。不。D1306;Beyotime)。用Leica SP2共聚焦系统(Leica Microsystems, Wetzlar, Germany)共聚焦激光显微镜观察GFP-LC3的绿色荧光。
CaMKKβ核
为了进一步研究细胞自噬对病毒复制的影响,合成了靶向自噬相关基因beclin-1的siRNA(上海吉纳药业股份有限公司,中国上海)。siRNA序列为GCC UAC AAC GAG GAC GAU ATT(正义)和UAU CGU CCU CGU UGU AGG CTT(反义)。用转染试剂转染siRNA和阴性对照(NC)-siRNA转染六孔板24 h,然后用DEV感染。收集细胞样本检测siRNA的作用。
中位组织培养感染剂量(TCID50)
DEF细胞在96孔板中培养,然后用稀释至10的DEV病毒感染−1到10−8.72hpi时观察细胞并记录病理变化。采用Reed-Muench法测定病毒滴度。
细胞内钙2 +流式细胞仪检测
胞质游离钙2 +使用Fluo-3 AM检测离子。Fluo-3 AM本身不与Ca结合2 +但一旦将染料添加到细胞中,它就可以与Fluo-3 AM杂交,并且Fluo-3 AM在与Ca结合时会发出荧光2 +.DEF细胞用DEV感染或BAPTA-AM处理指定时间,然后用Fluo-3 AM在37°C黑暗中孵育1小时。之后,细胞悬浮在磷酸盐缓冲盐水中。观察荧光,作为细胞内钙的指示物2 +使用流式细胞仪(BD FACSAria™;BD Biosciences, San Jose, CA, USA),激发波长为488 nm。
统计分析
所有实验结果均以三次独立实验的均数±标准差(SD)表示。统计学分析采用Tukey 's检验。概率(p)值< 0.05为有统计学意义。