细胞和病毒
猪肾(PK)-15、Madin-Darby牛肾(MDBK)、非洲绿猴肾(Vero)和人胚胎肾293T (HEK293T)细胞在添加10%胎牛血清的Dulbecco改良Eagle 's培养基(DMEM)中培养。细胞培养在37°C的5% CO中保持2细胞培养箱。JS-2012株(GenBank接入号:KP257591)是在中国分离并保存在我们实验室的PRV变种[21, SC菌株(GenBank Accession No.;KT809429.1)是中国较早的PRV分离株,其UL41基因来源于Bartha疫苗株(属于欧美毒株的毒株的衍生物)[22].
质粒、寡核苷酸和酶试剂
质粒pEGFP-C3购自Clontech(志贺,日本),pMD-18 T购自Takara(中国大连)。用质粒pCMV-3 × Flag (Sigma-Aldrich, St. Louis, MO)表达PRV JS-2012和SC的UL41蛋白,分别生成pCMV-3 × Flag-JS-2012 UL41和pCMV-3 × Flag-SC UL41。本研究中使用的pLentiCRISPRv1是张锋实验室的礼物,之前已经描述过[23].所有低聚物或引物均由Genewiz(中国苏州)合成。T4多核苷酸激酶(PNK),生态房车,BsmBI,生态RI,萨尔I, Gibson Assembly®Master Mix和T4 DNA连接酶购自New England Biolabs (Ipswich, MA)。
供体质粒构建
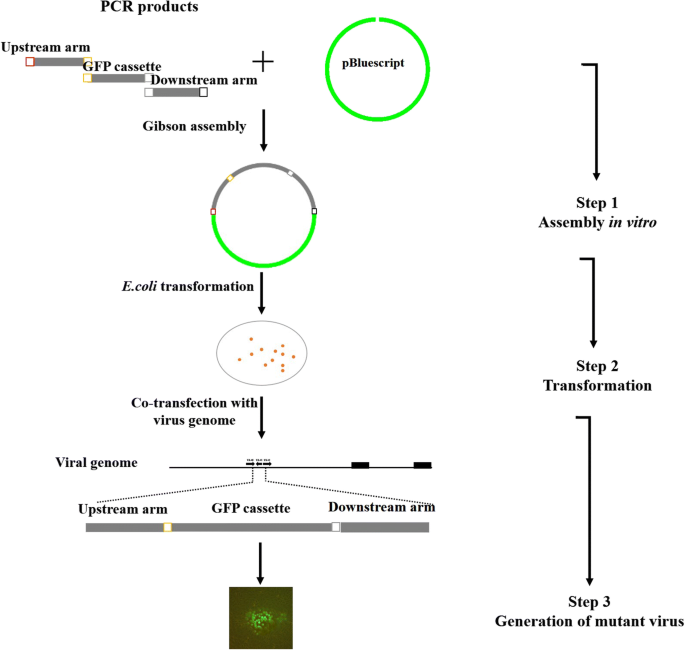
为了将eGFP标记插入到病毒基因组中,我们首先生成了一个供体质粒pBlue-eGFP-linker。简单地说,eGFP盒式磁带片段(附加文件1:图S1)和UL41 ORF序列侧翼的两个片段(附加文件1:图S1)分别从pEGFP-C3和JS-2012基因组中PCR扩增,引物分别为EGFP-F&R、Up arm F&R和Low arm F&R(表1)1).凝胶纯化PCR产物克隆到pMD-18 T中,经DNA测序证实。同时,质粒pBluescript II SK(+)通过消化线性化生态房车。将共10 μL纯化质粒和PCR产物混合物(质粒:各产物摩尔比= 1:5)组装于10 μL Gibson Assembly®Master Mix中,50℃孵卵1 h,用10 μL Gibson反应混合物转化100 μL DH5α残基大肠杆菌遵循标准转换协议的单元。用引物GFP-F&R对eGFP序列进行靶向PCR鉴定阳性克隆1),经DNA测序证实。
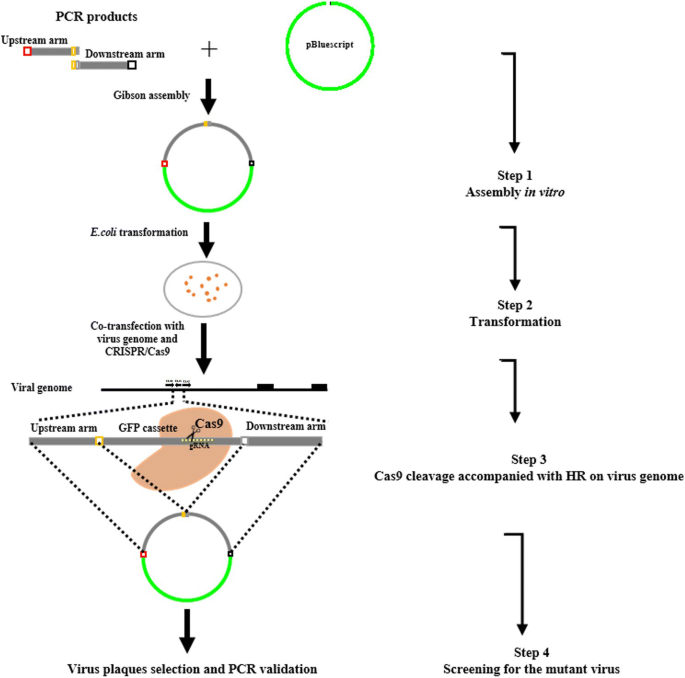
为了通过HR从病毒中删除eGFP盒,构建了另一种供体载体pBlue-linker。两个序列(附加文件1使用Forward arm-F&R和Backward arm-F&R引物从JS-2012的基因组中扩增出UL41 ORF侧翼的HR(表S1)1).同样,要还原病毒基因组上的UL41,需要两个PCR产物(附加文件1采用引物UL41-up- f&r和UL41-down- f&r,从JS-2012基因组中PCR扩增出包含UL41侧翼区和3 '端有框内HA标签的UL41 ORF(表S1)1).然后,使用上述相同的组装方法将相关插入克隆到线性化的pBluescript II SK(+)向量中。阳性克隆经PCR鉴定,DNA测序证实。
pLentiCRISPRv1-gRNA表达载体的构建
切割eGFP编码序列的特定gRNA设计如前所述[24],如表所示1.简而言之,低聚物gRNA-eGFP-F和gRNA-eGFP-R分别在无rnase的水中重悬至最终浓度为100 μM。然后将1 μL合理低聚物(gRNA-eGFP-F)、1 μL反向低聚物(gRNA-eGFP-R)、1 μL 10 × T4 PNK反应缓冲液、0.5 μL T4 PNK和6.5 μL RNase-free水混合。将得到的10 μ l反应混合物进行退火和磷酸化,克隆得到的双链gDNABsmpLentiCRISPR载体经T4 DNA连接酶双酶切。DNA测序进一步验证正确插入。
产生病毒突变体
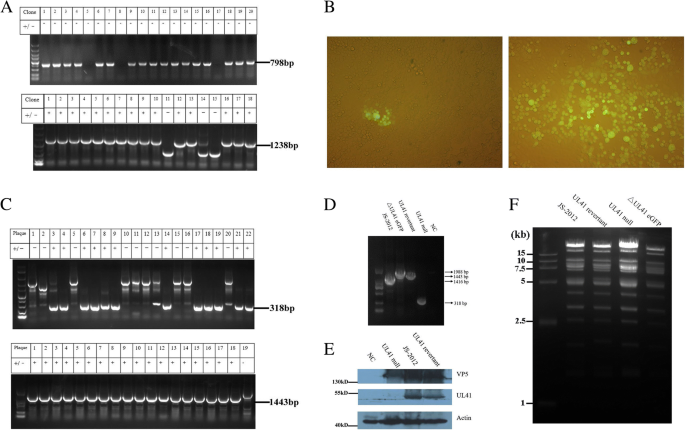
为了生成UL41无病毒,我们首先必须将eGFP盒导入病毒基因组,以HR取代UL41 ORF,并生成ΔUL41 eGFP病毒(图4)。1).然后,将UL41 ORF侧翼的序列和含有帧内HA标记的UL41序列分别克隆到pBluescript II SK(+)中,分别与ΔUL41 eGFP病毒基因组和靶向eGFP的plenticrisprv1 - grna表达载体共转染。在荧光显微镜下选取无荧光信号的斑块,并通过PCR和测序进行验证,以鉴定UL41无病毒和UL41可逆病毒(图。2).
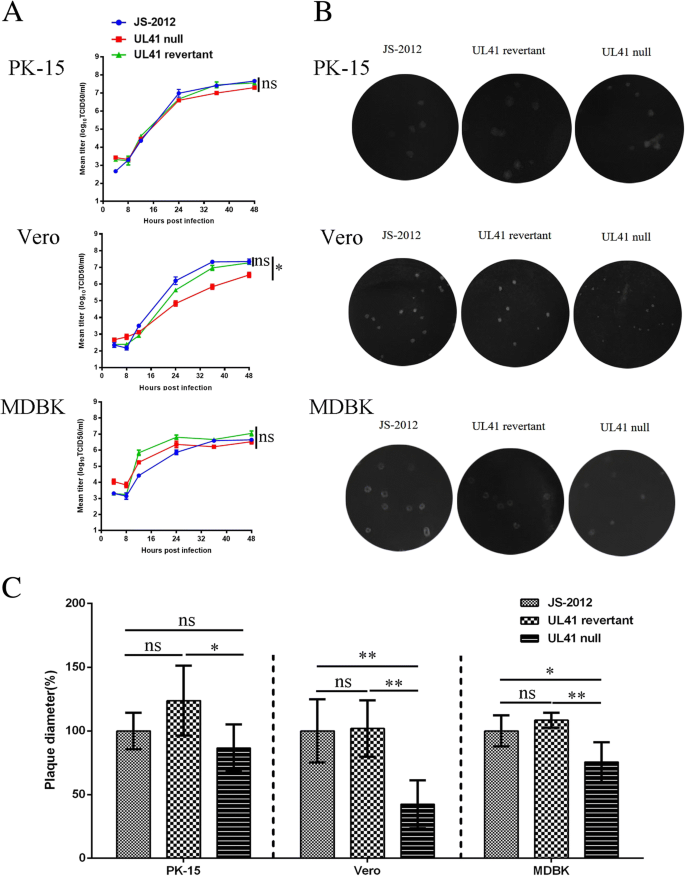
简单地说,如前所述,从受感染的Vero细胞中提取PRV基因组DNA [25].然后,使用FuGENE HD转染试剂(Promega, Madison, WI)将相应的供体质粒(2 μg)和来自j -2012的病毒基因组DNA,或来自ΔUL41 eGFP病毒(6 μg)和pLentiCRISPRv1-gRNA (1 μg)的基因组DNA共转染到Vero细胞中。当观察到大约80%的细胞病变效应时,收获转染的细胞。通过空斑纯化选择重组病毒,通过存在(ΔUL41 eGFP病毒)或不存在(UL41无病毒或UL41逆行病毒)绿色荧光、特异性PCR和Western-blot进行鉴定。经过三轮空斑纯化,获得重组病毒原液。
动物实验
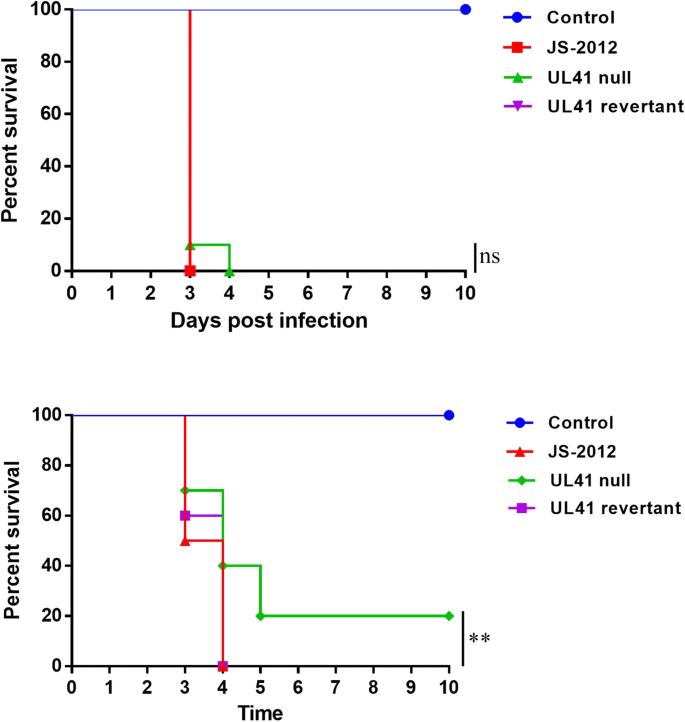
为评价每种病毒对小鼠的致病性,将6 ~ 8周龄SPF级BALB/c小鼠分为7组(每组10只)。1 ~ 3组小鼠鼻内接种10 μL 10550%组织培养感染剂量50)、UL41空病毒和UL41逆行病毒在全麻麻醉下的表达。4 ~ 6组小鼠鼻内接种10 μL 104TCID50在麻醉状态下,分别对PRV JS-2012、UL41空病毒和UL41逆转录病毒进行免疫应答。第7组小鼠在麻醉状态下接种等量DMEM,作为对照组。在10天的时间里,每天对动物进行监测并记录它们的健康状况。感染后每天监测临床症状和死亡人数(表2)2).
表2分别接种JS-2012、UL41零病毒和可逆病毒的小鼠感染情况
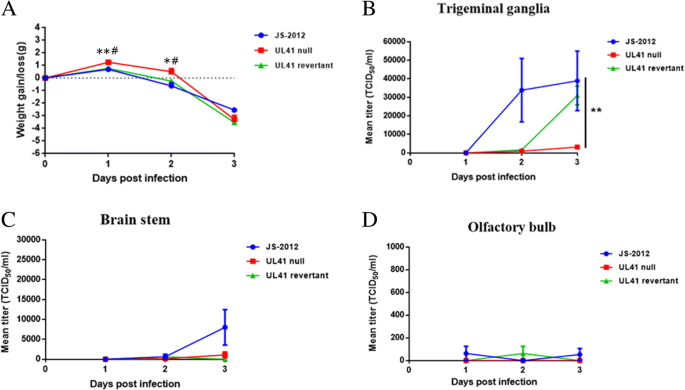
为分析每种病毒对小鼠神经的侵袭性,采用10 μL 10鼻内接种小鼠4TCID50在麻醉下注射PRV JS-2012、UL41零病毒和UL41逆病毒,每日测量感染小鼠的体重变化。然后在指定的时间牺牲幸存的小鼠。采集小鼠三叉神经节、脑干、嗅球、大脑和小脑,80℃冷冻。然后将组织解冻,均质,然后再次冷冻。匀浆被解冻,超声,离心,并用TCID滴定50Vero细胞单层检测。
所有动物实验均按照中国农业科学院上海兽医研究所《实验动物护理与使用指南》进行。
vhs活性的功能测定
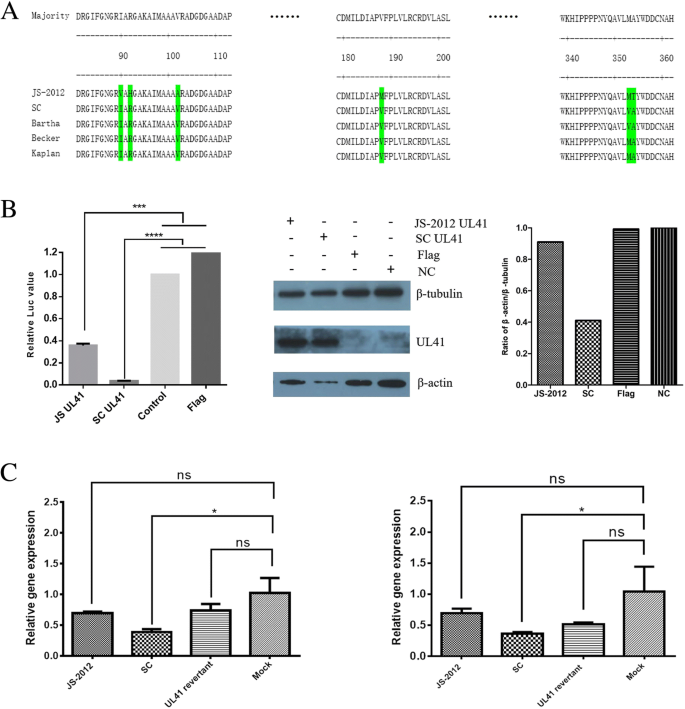
该测定方法是根据以前的一项研究进行的,只是进行了微小的修改[17].简而言之,采用引物PCR扩增了PRV JS-2012的UL41编码序列生态RI-vhs-F (ggaattcaatggggctcttttggcctttta)和萨尔将I-vhs-R (gcgtcgacttattttctcctatgggcgtt)克隆至3 × Flag标记表达载体pCMV-3 × Flag生态RI -萨尔I消化和T4 DNA结扎。采用引物SC-UL41- f (catcgatagctgatagggctcttggcctttta)和SC-UL41- r (gagtcgactggtaccgatttatttttttctcctatgggcgt) pcr扩增PRV SC的UL41编码序列,并将其克隆到线性化的pCMV-3 × Flag中生态Gibson组装反应中的RV裂解。转染前24小时将HEK293T细胞接种到6孔微量滴度板中,然后用200 ng SV40荧光素酶报告基因(pgl3 -对照)单独转染或与pCMV-3 × Flag- j -2012 UL41、pCMV-3 × Flag- sc UL41或pCMV-3 × Flag空载体以2 μg剂量联合转染细胞,使用Lipofectamine™3000试剂(Invitrogen, Carlsbad, CA)。转染36 h后,用200 μL 1 ×被动裂解缓冲液(Promega)裂解细胞,测定荧光素酶含量。用Bradford蛋白测定法(Bio-Rad, Hercules, CA)检测裂解物的总蛋白浓度。每个样品的荧光素酶值归一化到各自的总蛋白量。采用兔单克隆抗flag抗体(Sigma-Aldrich)检测JS-2012 UL41-Flag或SC UL41-Flag的表达;使用单克隆抗-β肌动蛋白抗体(Sigma-Aldrich)检测β-肌动蛋白的表达,以β-微管蛋白作为负荷对照。
RNA提取和RT-qPCR
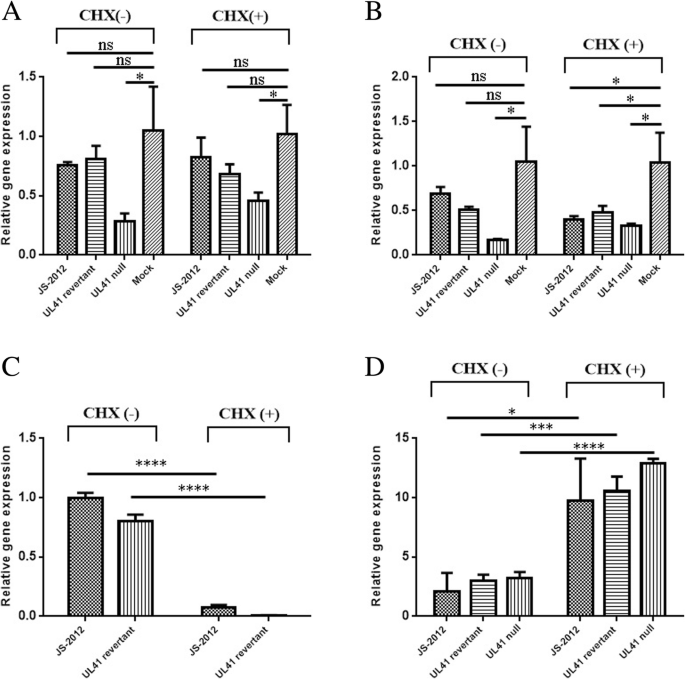
每种PRV株以10倍感染倍数(MOI)模拟感染或感染Vero细胞。另一方面,对于环己亚胺(CHX)分析,Vero细胞在感染前未处理或加100 μg/ml CHX处理。然后在感染后3小时,使用RNeasy Mini Kit (Qiagen, Hilden, Germany)提取每个样本的总RNA。用紫外分光光度法测定RNA收率和质量。
接下来,1 μg总RNA用2u RNase-free DNase I (Ambion, Austin, TX)进行DNase处理。然后使用Superscript III RT-PCR系统(Invitrogen, Carlsbad, CA)根据制造商关于寡核苷酸(dT)引物cDNA合成的说明反转录rna。利用SYBR Premix Ex Taq (Takara)对cDNA进行qPCR,检测宿主基因GAPDH和β-actin的表达,以及病毒基因UL41和IE180的表达;同时,28S rRNA在每次运行中都被用作内参基因。相应引物见表3.由Genewiz合成。qPCR扩增子用Eppendorf (Hamburg, Germany)热循环仪检测,最终体积为25 μL,循环条件为:95°C 2 min, 95°C 15 s, 60°C 30 s,循环40次。每个候选基因的相对数量用ΔΔCt法测定。