摘要
背景
人偏肺病毒(HMPV)被确定为呼吸道感染的病原体之一。迄今为止,很少有报道描述HMPV基因型和/或病毒载量对成人疾病发病机制的影响。本研究旨在确定HMPV遗传多样性和鼻咽病毒载量对门诊成人急性呼吸道感染症状严重程度的作用。
方法
采用四类量表对某教学医院普通感冒患者的普通感冒症状严重程度进行评估,并将其相加得到症状严重程度总分(TSSS)。融合与糖蛋白基因多样性、病毒载量(使用改进的RT-qPCR方法量化)和症状严重程度之间的关系采用双变量和线性回归分析。
结果
在81/3706例HMPV阳性患者中,在不同HMPV基因型/亚谱系之间的人口统计学、症状发作与临床就诊之间的天数、呼吸道症状表现和严重程度方面没有显著差异。令人惊讶的是,老年患者(≥65岁)的症状严重程度(以TSSS表示)低于青年和中年成年人(p= 0.008)。鼻咽病毒载量与HMPV感染的症状严重程度无关,也不能预测。有趣的是,在症状出现后3-5天,基因型a感染者的病毒载量高于基因型B患者(4.4 vs. 3.3 log10RNA拷贝数/μl (p= 0.003)。
结论
总体而言,HMPV遗传多样性和病毒载量不影响成人急性呼吸道感染的症状严重程度。随着时间的推移,基因型之间病毒载量动态的差异可能对病毒传播具有重要意义。
背景
人偏肺病毒(HMPV)是一种负链RNA病毒Pneumoviridae家庭(1].HMPV感染通常伴有轻微的呼吸道症状,但也有严重咳嗽、细支气管炎和肺炎的报告,有时还伴有高烧、肌痛和呕吐[2].目前已确定与成人HMPV感染导致的更严重疾病相关的若干危险因素,包括肺部疾病或充血性心脏病患者、65岁以上的健康老年患者、长期在医院护理机构住院和免疫功能受损患者[3.].
先前的报告试图将HMPV的遗传多样性联系起来,它们被分为基因型A和B(进一步分为亚谱系- A1, A2a, A2b, B1和B2) [4]疾病严重程度[5,6,7].例如,研究发现,与基因型B感染相比,儿童HMPV基因型A感染会导致更严重的疾病(例如,肺炎和氧饱和度< 90%的风险更高,需要住院治疗,重症监护病房住院时间更长)[7].相反,一些研究报道,基因B型感染是严重疾病的危险因素之一[5]与A基因型感染相比,胸片上有更多的病理征象[6].此外,一些关联仍有争议,因为一些研究发现HMPV基因型与疾病严重程度之间没有直接相关性[8,9,10].另一方面,除了病毒遗传多样性外,HMPV病毒载量被认为是与更严重的疾病结局导致住院相关的危险因素[11,12].
虽然HMPV遗传多样性继续被描述并与住院儿童的疾病严重程度有关[6]、小儿科[13]、长者[10]和免疫功能低下患者[3.],关于这种关联的报道在成人门诊环境中有限。最近一项研究显示,HMPV也可引起成人呼吸道疾病的爆发[14]强调了一个事实,即成年人可能在病毒的传播和进化动态中发挥作用,在疫情爆发期间,成年人可能会发生更严重的疾病。
因此,在本研究中,我们试图探讨遗传多样性与成人门诊HMPV感染伴发急性上呼吸道感染(URTI)患者症状严重程度的可能联系[15].使用一种改进的病毒载量定量分子检测方法,我们还评估了鼻咽标本中HMPV病毒载量与症状严重程度的相关性。
方法
样本采集,症状严重程度评估,HMPV基因分型
2012年2月至2014年5月期间,马来西亚吉隆坡马来亚大学医学中心(UMMC)初级保健诊所共招募了3706名表现出急性URTI症状不超过两周的自愿成人门诊患者。在入组期间,对参与者进行了访谈,以确定他们的人口统计数据(年龄、性别和种族)、从症状出现到门诊就诊或入组日期之间的估计天数,以及普通感冒症状的存在和严重程度[16,17].评估的普通感冒症状包括打喷嚏、流鼻涕、鼻塞、咳嗽、喉咙痛、声音沙哑、头痛和肌肉疼痛。每种症状的严重程度然后由以前报告的标准化四类序数量表评定[16,17,18,19]:无症状(0)、轻微症状(1)、中度症状(2)和严重症状(3)。将症状评级进行汇总,以创建每个参与者的总症状严重程度评分(TSSS),从8个症状中得到最高24分[20.],其中症状严重程度越高,得分越高。
从患者身上采集鼻咽拭子,用通用传输介质转移到实验室(Copan Diagnostics, California, USA)。使用NucliSENS easyMAG自动核酸提取系统(bioMérieux, Marcy I 'Etoile,法国)根据制造商的方案进行核酸全纯化[21].使用xTAG呼吸道病毒面板(RVP) FAST多重RT-PCR检测方法(Luminex Molecular,多伦多,加拿大)和Luminex专有的通用标签分选系统(Luminex Corp.,奥斯汀,德克萨斯州,美国)在Luminex 200 IS平台上检测样本中的HMPV [22].hmpv阳性样本的基因型首先通过融合扩增和测序确定(F)及附件(G)基因,如上文所述[15].接下来是使用最大似然(ML)方法进行系统发生树重建,该方法采用启发式推断,使用子树修剪和重新嫁接以及最近邻交换算法,具有一般时间可逆(GTR)核苷酸替代模型,不变位点的比例(+I)和四类伽马率异质性(+Γ)4),已在PAUP 4.0版本中实现[23].采用木村双参数模型,通过1000次自举重复分析其分支顺序的可靠性。
HMPV病毒载量定量
为了改进鼻咽标本中HMPV RNA的定量,使用全面和更新的参考基因组列表设计了一步逆转录-定量聚合酶链式反应(RT-qPCR)定量方法。新设计的引物对和针对高度保守的荧光探针平方米基因(24]基于一套全球HMPV完整基因组,代表所有基因型A1, A2a, A2b, B1和B2 (n= 135)在GenBank中可用(检索于2016年1月31日)。使用基于web的多序列比对程序MAFFT对序列进行密码子比对[25来寻找完整基因组的保守区域。高度保守的正向引物,反向引物和探针,基于全局参考序列的比对,覆盖率分别为99.3,100和99.3%(附加文件)1),使用Primer Express Software v2.0 (Applied Biosystems, California, USA)设计。根据HMPV参考株NC_004148的核苷酸编号,正向引物(编号4730f)、反向引物(编号4919r)和探针(编号4796fp)分别跨越核苷酸位置4730-4754、4919-4893和4796-4814 nt对应的遗传区域。探针在5 '端用6-荧光素酰胺(FAM)标记,在3 '端用非荧光猝灭剂(NFQ)和小槽粘结剂(MGB)标记。设计了具有随机序列的合成单链RNA寡核苷酸,并作为内部对照(IC)来检查潜在的PCR抑制作用。唯一的IC序列(5 ' -ACATCGTAAGGCTCCATGCAAATATGAAGATAGAATGCTTAGGACCATCAGCGAAACTCTACAATAATATCAGGCGCAGGCAGAGAAGTA-3 ')与GenBank中任何已发表的序列相似度< 10%(数据未显示)。IC两侧的序列与新设计的HMPV引物集的引物结合位点相似,并为IC设计了独特的非HMPV探针(VIC-5 ' -TTAGGACCATCAGCGAAAC-3 ' -NFQ-MGB)。单次反应:逆转录酶0.2 μl (40u), 2× One-Step SensiFAST Probe Lo-ROX mix (Bioline, London, UK) 10 μl,引物各0.8 μl (20 μM),探针各1 μl (10 μM), 6.0 × 103.RNA每μl复制IC,最终体积为20 μl。所使用的优化热循环剖面如下:48℃逆转录8 min, 95℃初始变性2 min,随后97℃2 s, 60℃20s,循环40次。该检测的热循环周期短,其中病毒载量定量可在单次运行约50分钟内完成。一种合成的DNA寡核苷酸,含有平方米利用基因序列生成标准浓度为2.0 × 10的10倍稀释系列1至2.0 × 106RNA复制/μl。HMPV定量在ABI ViiA7实时PCR系统(Applied Biosystems, California, USA)中进行。
HMPV qPCR检测的线性动态范围采用6-log进行评估10HMPV稀释系列平方米合成寡核苷酸。利用连续浓度建立了一条针对定量周期(Cq)的标准曲线。根据标准曲线进行线性回归分析,计算PCR效率和相关系数。为了评估HMPV病毒载量定量的实验内和实验间的可变性,使用低(2.0 × 101RNA拷贝数/μl)和中等(2.0 × 103.RNA拷贝数/μl)标准来确定均值、标准差(SD)和方差系数(CV)。
统计分析
不同HMPV基因型(A和B)和亚谱系感染患者的人口统计学(性别、年龄和种族)和临床特征(存在8种常见感冒症状以及从症状出现到登记日期之间的估计天数)首先使用双变量分析(分类变量的皮尔逊卡方,独立样本)进行评估t-检验和连续变量的单向方差分析),类似于先前报道的统计技术[12].症状的总体严重程度通过8个个体症状严重程度评分(TSSS)的总和来衡量,TSSS被建模为一个连续变量。症状严重程度与病毒学因素(不同HMPV基因型和亚谱系的感染,以及log中的病毒载量)的关联10采用双变量分析(独立样本t检验、单因素方差分析和Pearson双变量相关)和线性回归分析。最后,使用上述相似分析比较症状出现后不同入组时期的病毒载量(考虑到不同基因型/亚谱系的感染以及人口统计学和症状严重程度的差异)。一个双边p值< 0.05为有统计学意义。为了控制单因素方差分析(One-way ANOVA)和线性回归(linear regression)等多项统计检验中的假阳性,采用Bonferroni校正降低临界值p显著性值(通过将临界值除以组中对应的级别数的比较次数来实现)[26].所有分析均使用社会科学统计软件包22.0版(SPSS Inc.,纽约,美国)进行。
结果
HMPV的检测与遗传多样性
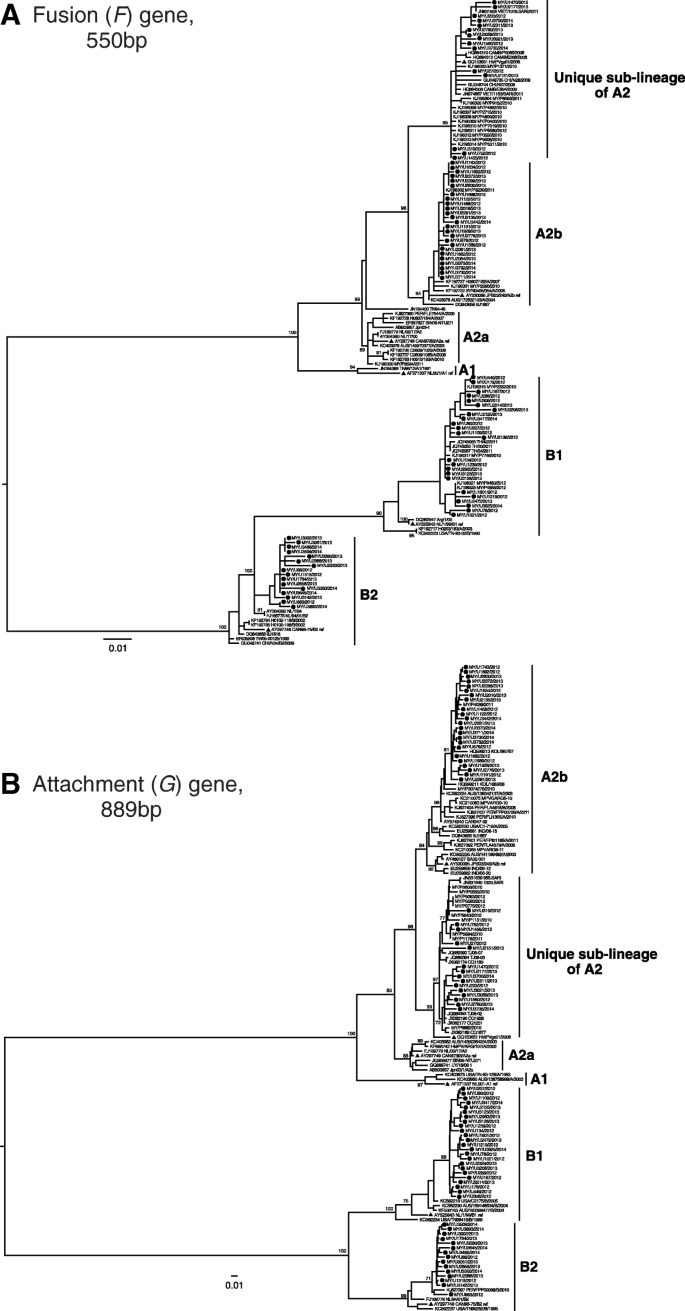
在研究期间,共收集了81/3706(2.2%)鼻咽拭子标本,HMPV检测呈阳性。其中,只有7/81份(8.6%)样本同时感染其他病毒(腺病毒[n= 1],肠病毒/鼻病毒[n= 3]、冠状病毒229E [n = 1]、甲型流感(H3) +肠病毒/鼻病毒[n= 1]和乙型流感[n= 1])。因此,由于HMPV病毒联合感染在成年人群中并不常见,我们在后续分析中纳入了病毒联合检测的患者,并没有被视为本研究的另一个变量。的系统发育分析F而且G基因显示,检测到的HMPV病毒中有40/81(49.4%)属于基因型A, 41/81(50.6%)属于基因型B。1,附加文件2).在基因型A中,25/40(62.5%)被归类为A2b亚谱系,而15/40(37.5%)属于最近描述的A2亚谱系(指定为唯一的A2亚谱系)[15].在基因型B中,分别有25/41(61.0%)和16/41(39.0%)被划分为B1和B2亚谱系。
的系统发育分析一个85融合(F),b) 82附件(G)基因序列。采用PAUP 4.0版本重构最大似然树。通过1000个重复的自举分析来评估分支节点的可靠性。在分支节点上指示引导值大于70%。生成的序列(黑圈)根据隔离国家(马来西亚,MY)、唯一的样本ID和样本收集年份命名。每个基因型/亚谱系(蓝色三角形)发表的HMPV参考菌株包括A1, NL00-1 (GenBank登录号:AF371337.1), A2a, CAN97-83 (AY297749.1), A2b, JPS03-240.1 (AY530095), B1, NL/1/99 (AY525843.1)和B2, CAN98-75 (AY297748.1)。其他已发表的基因序列包括澳大利亚(AUS)、柬埔寨(CAMB)、加拿大(CA)、印度(IND)、日本(JP)、荷兰(NL)、秘鲁(PER)、新加坡(SIN)、泰国(TH)、美国(USA)和越南(VIET)。
HMPV遗传多样性的人口学和临床相关性
81例感染HMPV的门诊患者(男29例,女52例)年龄在19至86岁之间,包括成人和老年人(附加档案)2).其中中青年(< 65岁)组65例,老年(≥65岁)组16例(表2)1).大部份病人为马来人(n= 38),其次是印度人(n= 21),中文(n= 19),以及其他族群(n= 3)。在进行双变量分析时,未观察到HMPV基因型(A和B)或亚谱系(A2b,独特的A2亚谱系,B1和B2)与患者的人口统计学(性别、年龄和种族)之间存在显著相关性。
本研究评估的常见感冒症状(打喷嚏、流鼻涕、鼻塞、咳嗽、喉咙痛、声音沙哑、肌肉疼痛和头痛)由患者自行报告。大部份病人出现咳嗽(n= 80/ 81,98.8%),其次是声音沙哑(n= 72/ 81,88.9%),而肌肉疼痛和打喷嚏(n= 56/81, 69.1%)分别是患者经历最少的1).不同基因型间、不同亚谱系间各症状表现无显著性差异。然而,HMPV基因型B患者明显更多(n= 31/ 41,75.6%),与A基因型患者(n= 23/ 40,57.5%)p= 0.084)。据患者报告,从症状出现到入组日期之间的估计天数从1天到2周不等,其中大多数患者在出现症状3-5天后入组(n= 36/ 81,44.4%)1).虽然在症状发作后的不同入组时间与HMPV基因型或亚谱系之间没有发现显著的相关性,但观察到HMPV基因型a患者在症状发作后(5.15±3.63天)入组时间略晚于基因型B患者(4.12±2.55天)(p= 0.143)。
hmpv感染患者症状严重程度
较高的TSSS表明hmpv感染患者感知到的症状严重程度越高,TSSS是由入组时报告或评估的8个个体症状严重程度评分之和计算得出的[20.].总体而言,感染患者的TSSS平均为12.20±4.58,得分范围为4 ~ 23(最高得分为24)(补充文件)2),显示病人可能会患上一系列轻微至严重的呼吸系统疾病。通过双变量和线性回归分析比较不同HMPV基因型和亚谱系之间的TSSS时,虽然基因B型患者TSSS(12.85±4.67)高于基因A型患者(11.53±4.44),但没有观察到显著差异,其中亚谱系B1患者TSSS最高(13.56±4.42)(表2)2).此外,发病后不同时间段的平均TSSS无显著性差异,以发病后入组天数为连续变量时,TSSS与平均TSSS无相关性。不同性别和种族之间的平均TSSS也没有显著差异,尽管男性患者的TSSS高于女性,而印度族裔患者的TSSS高于其他族裔(表2)2).
年龄方面,< 65岁中青年人群TSSS平均值(12.86±4.55)明显高于≥65岁老年人群(9.50±3.71)(p= 0.008)2).此外,当年龄作为连续变量建模时,与TSSS呈显著负相关(r=−0.335,p= 0.002)。在简单线性回归模型中,年龄每增加一个单位(年),TSSS的单位(分)显著降低0.080。因此,我们的研究结果表明,年龄是TSSS的唯一重要预测因素,在门诊环境中,老年患者的症状比青年和中年成年人的症状更轻。但< 65岁患者(4.58±3.36天)与≥65岁患者(4.81±2.20天)在症状出现后估计入组时间上无显著差异(p= 0.797)。
病毒载量对症状严重程度的影响
改进的一步RT-qPCR检测方法的性能平方米首先用6-log分析HMPV基因10HMPV稀释系列平方米合成寡核苷酸标准品。该方法得到了典型的扩增图和标准曲线,相关系数为0.999,扩增效率为96.78%,决定系数为(R2) 0.996(附加文件3.).在标准范围内估计了分析内和分析间的变异(附加文件)4).78/81例hmpv阳性标本的鼻咽病毒载量被定量,成功率为96.5%(附加文件2).除了能够检测HMPV的所有不同基因型和亚谱系外,该方法的最低可量化浓度估计为13个RNA拷贝/μl,而在我们的样本中记录的最高病毒载量为731,917个RNA拷贝/μl。
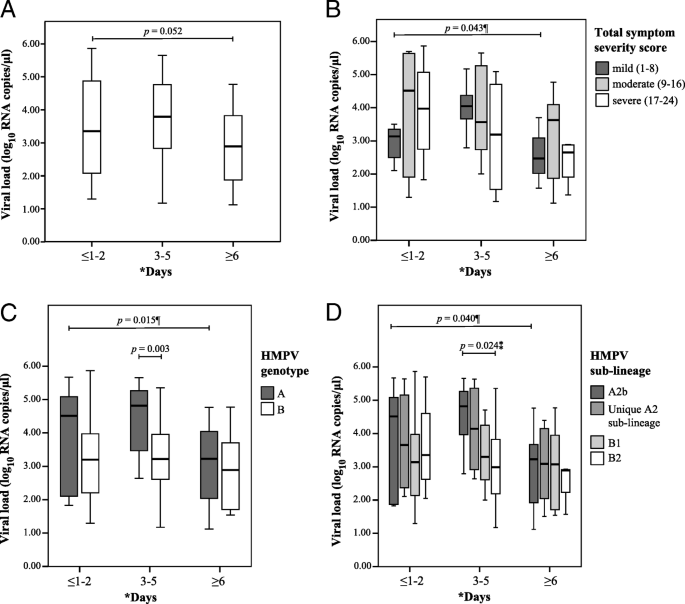
在症状出现后的不同入组期(≤1-2天、3-5天、≥6天),我们观察到入组3-5天的患者病毒载量最高(3.77±1.20 log)10RNA复制/μl,n= 35),而入组时间≤1-2天者(3.55±1.53 log10RNA复制/μl,n≥6天(2.93±1.16 log . log .)10RNA复制/μl,n= 23)。2,附加文件5).尽管没有观察到病毒载量和症状出现后的入组时间之间的双变量关联(p= 0.052),使用Bonferroni程序的事后测试表明,在3-5天内入组的人具有更高的病毒载量(p= 0.048, bonferroni校正时不显著p< 0.0083而不是p< 0.05)与症状出现后≥6天入组的患者进行比较。
但是,通过将估计病毒载量与TSSS进行双变量相关研究病毒载量对症状严重程度的影响,但未观察到显著相关(r=−0.118,p= 0.303)2).考虑到症状出现后的不同入组时期,在这些时期病毒载量与TSSS之间也没有观察到明显的相关性(附加文件5).将患者TSSS分为3类,评分分别为1 - 8,9 - 16和17-24,分别反映轻度、中度和重度的相对症状严重程度[20.(图。2 b),三种症状严重程度间病毒载量差异无统计学意义。然而,在TSSS为1-8(表明症状较轻)的患者组中(n= 19),症状出现后≥6天入组的患者病毒载量显著降低(2.58±1.07 log)10RNA复制/μl,n= 3)与症状出现后3 - 5天入组的患者相比(3.99±0.81 log10RNA复制/μl,n= 9) (p= 0.043),但Bonferroni校正后差异不显著(图;2 b,附加文件5).总的来说,我们的分析表明,鼻咽病毒载量不能预测HMPV感染引起的症状的严重程度,TSSS评分系统也不能预测患者体内的病毒载量,因此在本研究中发现这两个变量不相关。
病毒载量与HMPV遗传多样性和人口学因素的关系
通过比较HMPV的遗传多样性,我们发现在症状出现3-5天后,基因型A患者的病毒载量明显较高(4.44±1.07 log .)10RNA复制/μl,n(3.27±1.07 log .)10RNA复制/μl,n= 20) (p= 0.003)(图2摄氏度,附加文件5).然而,经Bonferroni校正后,亚系间病毒载量差异不显著(p= 0.024),但A2b亚系的病毒载量较高(4.55±0.96 log10RNA复制/μl,n= 11),而B2(3.07±1.33 log10RNA复制/μl,n= 8,p= 0.037)在这3-5天期间的亚谱系(图;二维,附加文件5).另一方面,我们也观察到基因型A患者入组≥6天的病毒载量(Bonferroni校正后)明显低于症状出现后3-5天入组的患者(p= 0.012, Bonferroni程序事后检验)(图;2摄氏度).最后,在症状出现后的三个登记期中,患者的不同人口统计学(性别、种族和年龄)之间没有发现显著的病毒载量差异(附加文件)5).
讨论
评估导致HMPV感染引起疾病负担的遗传多样性和病毒载量等风险因素的研究通常集中在高危人群,如住院儿童[27]或成年病人[28],免疫功能低下的长者[29],或造血细胞移植受者[30.],有急性呼吸道症状的门诊病人报告有限。虽然寻求和接受门诊治疗的个人可能不会出现严重的呼吸道并发症,但他们的疾病对整体疾病负担和病毒向易感人群的传播有重大影响。本研究调查了一般成人门诊人群中HMPV感染引起的急性呼吸道症状的严重程度,并评估了可能与症状严重程度相关的病毒学和人口学因素。
以四类标准的普通感冒症状严重程度评分,作为衡量呼吸道疾病对门诊病人影响的补充指标[16,17,18,19].将所有个别症状的分数加起来[20.],在成人门诊患者中,我们没有观察到HMPV基因型/亚谱系之间有任何显著的症状严重程度差异(或TSSS)2),表明本研究中显示的HMPV的遗传多样性作为门诊患者症状严重程度的预测因子作用有限。此外,感染了最近描述的A2亚谱系的患者,该亚谱系是根据估计的遗传距离确定的F而且G基因,在中国、越南和柬埔寨等国家也有发现[15],并没有表现出比其他亚谱系更严重的症状。先前的几项研究已经报道了HMPV遗传多样性与儿童疾病严重程度的关系。在一份报告中发现,与基因型B感染相比,基因型A感染的儿童经历了更严重的急性呼吸道疾病(基于衡量住院需求、入院时氧饱和度< 90%和重症监护病房住院的评分方法)[7].相比之下,另一项针对幼儿的研究表明,基因B型感染可能导致更高的住院率和更高的临床评分(使用两种评分方法[7,31]与基因型A相比[6].然而,在其他几项研究中,儿童HMPV基因型之间的疾病严重程度或临床表现没有显著差异[8,9,32,33,他们使用了其他的评分方法。这些研究的对比结果突出表明,HMPV遗传多样性与疾病严重程度之间的关系仍然无法检测到,部分原因可能是缺乏针对门诊或住院患者的共识和标准化严重程度评分方法。纳入其他客观评估,包括体温、胸片和呼吸频率,可能有助于改善分析并减少研究之间的不一致结果。此外,HMPV遗传多样性与症状严重程度之间的不确定关联也可能是由于本研究以及其他几项研究中HMPV阳性样本数量较少[7,9],这可能会降低关联的统计效力[34].
在一些研究中,由于对新进化的基因型的短暂免疫或不完全的保护性免疫反应,HMPV再感染可能发生在成年人的生活中[29,35],显示长者同样容易再次感染。此外,老年人可能的免疫失调导致病毒清除能力下降,这将进一步增加他们发生严重症状感染的风险[28]并导致更高的住院率[36,37].然而,与以往研究不同的是,我们发现≥65岁的老年患者与< 65岁的青年和成年患者相比,症状较轻。由于我们的研究是在门诊进行的,有可能有严重呼吸道症状的老年患者选择在住院环境中立即寻求治疗,导致抽样偏差。因此,这种对比观察可能是由于对老年患者的抽样有限,与年轻和成年患者相比,老年患者的症状更严重。同样,尽管与本研究中的其他民族相比,印度民族可能出现更严重的症状(基于更高的TSSS评分)(表2)2),鉴于我们队列中患者数量有限,因此需要谨慎解释这种观察结果。总的来说,宿主人口统计学因素是否会导致HMPV感染更严重的症状结局尚不清楚。
最新的RT-qPCR检测方法的可用性对于敏感、特异性和快速检测和定量HMPV非常重要。以前,用于检测和定量HMPV的检测方法是基于HMPV五个已知遗传谱系/亚谱系的有限基因组序列开发的:A1, A2 (A2a和A2b亚谱系),B1和B2 [37,38].此外,大多数已发表的分析都是针对核蛋白的保守区域(N)基因[39,40,41]因为它是高度转录和保守的基因[24,42],尽管引物/探针组与参考序列之间的核苷酸错配已被报道[28,41,43,44].因此,在本研究中,使用更新的完整参考基因组比对(n= 135),引物/探针被设计用于靶向的保守区域平方米至少覆盖99.3%的全球HMPV序列的基因(附加文件1).除3个hmpv阳性标本外,所有标本的病毒载量均被成功捕获,其可量化浓度最低,估计约为13个RNA拷贝/μl,这比以前发表的方法更敏感[38,43].
高鼻咽HMPV病毒载量被认为是住院儿童出现严重症状的重要危险因素[12,45]或接受紧急护理[46].然而,在本研究中,未观察到成人门诊患者病毒载量与症状严重程度之间的相关性(表2)2,无花果。2和附加文件5).有趣的是,研究发现,在症状出现的3-5天左右,基因A型感染者的峰值病毒载量明显高于基因B型感染者,这表明在此期间,基因A型可能比基因B型具有更好的复制适应度(或复制能力)和更高的传播率。然而,与症状出现后3-5天入组的患者相比,入组时间≥6天的基因型a感染患者的病毒载量显著降低,这是因为他们在感染过程中入组时间较晚,其中大多数病毒已经被免疫清除。有趣的是,我们的发现证实了之前的一份报告,该报告证明了HMPV基因型在体外和体内复制适应度的差异[47].Aerts等人的研究表明,在感染后第4天,在LLC-MK2细胞和BALB/c小鼠的肺中,HMPV基因型A复制的滴度明显高于基因型B,但基因型A的病毒滴度在第4天后比基因型B下降得更快[47].正如在其他病毒基因型/血清型中观察到的那样[48,49],复制能力的差异可能导致HMPV基因型之间的竞争性、传播性和流行病学适应性差异[50],这反过来可能决定了这两种基因型在人类中的传播和进化。
结论
本研究调查了HMPV遗传多样性和病毒载量(使用改进的量化试验估计)对出现急性呼吸道症状的成人门诊队列症状严重程度的影响,发现这两个因素与更严重的症状结局无关。HMPV基因型A和B在感染过程中观察到病毒载量动态的显著差异,这可能是由于病毒适应度的差异,这可能对病毒传播具有重要意义。
缩写
- Cq:
-
量化周期
- 简历:
-
方差系数
- 家人:
-
6-fluorescein amidite
- GTR:
-
一般倒流
- HMPV:
-
人类metapneumovirus
- MGB:
-
小槽粘结剂
- ML:
-
最大似然
- NFQ:
-
荧光冷却器
- RT-qPCR:
-
逆转录-定量聚合酶链反应
- SD:
-
标准偏差
- tss:
-
症状严重程度总分
- URTI:
-
上呼吸道感染
参考文献
Afonso CL, Amarasinghe GK, Bányai K, Bào Y, Basler CF, Bavari S,等。单胞病毒目分类:2016年更新。Arch Virol. 2016; 161:2351-60。
van den Hoogen BG, de Jong JC, Groen J, Kuiken T, de Groot R, Fouchier RA,等。一种新发现的人类肺炎病毒,从患有呼吸道疾病的幼儿中分离出来。中华医学杂志2001;7:719-24。
Haas LE, Thijsen SF, Van Elden L, Heemstra KA。成人偏肺病毒。病毒。2013;5:87 - 110。
van den Hoogen BG, Herfst S, Sprong L, Cane PA, Forleo-Neto E, de Swart RL,等。人偏肺病毒的抗原和遗传变异。新兴感染杂志2004;10:658-66。
帕彭伯格J,哈梅林MÈ,欧霍曼N, Carbonneau J, Ouakki M, Raymond F,等。小儿偏肺病毒与呼吸道合胞病毒疾病严重程度的危险因素比较中国传染病杂志,2012;
Pitoiset C, Darniot M, Huet F, Aho SL, Pothier P, Manoha C.在法国第戎医院进行的一项为期7年的儿童偏肺病毒基因型和疾病严重程度研究。中国医学病毒学杂志。2010;82:1782-9。
Vicente D, Montes M, Cilla G, Perez-Yarza EG, Perez-Trallero E.儿童a、B基因型人偏肺病毒感染临床严重程度的差异。临床感染杂志2006;42:e111-3。
Agapov E, Sumino KC, Gaudreault-Keener M, Storch GA, Holtzman MJ。人偏肺病毒感染的遗传变异性:病毒基因型转移而疾病没有变化的证据。中华传染病杂志,2006;
肖宁,谢志平,张波,袁晓华,宋俊杰,高兴辉,等。人偏肺病毒在中国儿童急性呼吸道感染中的流行、临床和分子特征中华儿科杂志,2010;29(4):344 - 344。
Al-Turab M, Chehadeh W, Al-Nakib W. 2009-2011年科威特住院患者中人偏肺病毒的系统发育分析《感染公共卫生》杂志2015;8:448-57。
Al-Turab M, Chehadeh W, Al-Mulia F, Al-Nakib W.科威特呼吸道感染患者的人偏肺病毒。中国医学病毒学杂志,2011;83:1811-7。
Roussy JF, Carbonneau J, Ouakki M, Papenburg J, Hamelin MÈ, De Serres G,等。人偏肺病毒载量是幼儿疾病严重程度的重要危险因素。中国临床病毒学杂志。2014;60:133-40。
jaguiic M, sloviic A, Ljubin-Sternak S, mlinarii - galinoviic G, forivic D.克罗地亚住院急性呼吸道感染患儿偏肺病毒的遗传多样性。中国医学病毒学杂志,2017;89:1885-93。
Neemuchwala, Duvvuri VR, Marchand-Austin A, Li A, Gubbay JB。加拿大安大略省呼吸道疫情中的人偏肺病毒流行率和分子流行病学。中国医学病毒学杂志,2015;87:269-74。
周文忠,陈玉峰,翁晓霞,吴丽娟,薛乃娥,吴晓东,等。人偏肺病毒的遗传多样性、季节性和传播网络:一个独特的融合和附着基因亚系的鉴定。科学代表2016;6:27730。
Zitter JN, Mazonson PD, Miller DP, Hulley SB, Balmes JR.飞机客舱空气再循环与普通感冒症状。《美国医学协会杂志》上。2002; 288:483-6。
刘凯。紫锥菊治疗普通感冒:一项随机、双盲、安慰剂对照临床试验。2004; 164:1237-41。
Jackson GG, Dowling HF, Spiesman IG, Boand AV.在受控条件下将普通感冒传播给志愿者。I.作为临床实体的普通感冒。美国医学会首席实习医生1958;101:267-78。
Turner RB, Wecker MT, Pohl G, Witek TJ, McNally E, St George R,等。可溶性细胞间黏附分子tremacamra治疗实验性鼻病毒感染的疗效:一项随机临床试验《美国医学协会杂志》上。1999; 281:1797 - 804。
VanWormer JJ, Sundaram ME, Meece JK, Belongia EA.门诊成人流感和其他急性呼吸道疾病症状严重程度的横断面分析。BMC感染疾病2014;14:31。
Loens K, Bergs K, Ursi D, Goossens H, Ieven M.从各种临床标本中自动提取核酸的NucliSens easyMAG的评价。临床微生物学杂志。2007;45:21 - 5。
Pabbaraju K, Wong S, Tokaryk KL, Fonseca K, Drews SJ。Luminex xTAG呼吸道病毒面板与xTAG呼吸道病毒面板快速诊断呼吸道病毒感染的比较中国临床微生物学杂志。2011;49:1738-44。
斯沃福德DL。PAUP*:使用简约(*和其他方法)的系统发育分析,版本4。桑德兰,马萨诸塞州,美国:Sinauer Associates;2003.
德格拉夫M,奥斯特豪斯AD,富希耶RA,霍姆斯EC。人与禽偏肺病毒的进化动态。中华病毒学杂志,2008;89:2933-42。
王志强,王志强,王志强。基于MAFFT的DNA序列多序列比对。方法Mol生物学,2009;537:39-64。
邓恩橙汁。均值之间的多重比较。美国统计学会,1961;56:52-64。
Gerna G, Campanini G, Rovida F, Sarasini A, Lilleri D, Paolucci S,等。连续3个冬春季节儿科住院患者人偏肺病毒毒株和类型循环率的变化中国生物医学工程学报,2005;
Walsh EE, Peterson DR, Falsey AR.成人偏肺病毒感染:另一块拼图。2008; 168:2489-96。
王志刚,王志刚,王志刚。年轻人和老年人的偏肺病毒感染。中华传染病杂志2003;187:785-90。
哈克B, Egger M, Bertz H, Peyerl-Hoffman G, Kern WV, Neumann-Haefelin D,等。一例复发多发性骨髓瘤和快速进展肺癌的造血干细胞移植受者的偏肺病毒感染临床微生物学杂志。2006;44:2300-3。
马蒂内洛,陈MD,魏贝尔C,卡恩JS。呼吸道合胞病毒基因型与疾病严重程度的相关性。中华流行病学杂志,2002;26(2):839 - 42。
魏海燕,曹kc,黄春春,黄玉春,林泰勇。住院患儿人偏肺病毒不同基因型/基因群的临床特征。中华微生物学杂志,2013;46:352-7。
Debur MC, Vidal LR, Stroparo E, Nogueira MB, Almeida SM, Takahashi GA,等。2006-2008年巴西南部地区人偏肺病毒感染对住院和门诊病人的影响中华医学会医学研究所,2010;
统计功率分析。精神科学,1992;1:98-101。
Boivin G, De Serres G, Hamelin ME, Côté S, Argouin M, Tremblay G,等。在一家长期护理机构爆发了由人偏肺病毒引起的严重呼吸道感染。临床感染杂志2007;44:1152-8。
王伟,朱勇,王伟。老年人呼吸道合胞病毒、人偏肺病毒和流感病毒的住院率中国传染病杂志,2012;
Falsey AR, hennesssey PA, Formica MA, Criddle MM, Biear JM, Walsh EE。成人对偏肺病毒感染的体液免疫疫苗。2010;28:1477 - 80。
Choudhary ML, Anand SP, Sonawane NS, Chadha MS.印度浦那地区人偏肺病毒实时RT-PCR检测及流行毒株遗传分析的建立(2009-2011)《寄生虫学》,2014;159:217-25。
Côté杨晓明,杨晓明,杨晓明,等。人偏肺病毒实时荧光定量PCR检测方法的比较研究。临床微生物学杂志。2003;41:3631-5。
Mackay IM, Jacob KC, Woolhouse D, Waller K, Syrmis MW, whey DM,等。人偏肺病毒的分子检测方法。临床微生物学杂志。2003;41:100-5。
Maertzdorf J, Wang CK, Brown JB, Quinto JD, Chu M, de Graaf M,等。实时逆转录酶PCR检测所有已知遗传谱系的人偏肺病毒。临床微生物学杂志,2004;
Collins PL, Wertz GW。人呼吸道合胞病毒基因组9个多聚腺苷酸rna的cDNA克隆及转录定位。自然科学进展,2003;30(3):388 - 388。
Klemenc J, Asad Ali S, Johnson M, Tollefson SJ, Talbot HK, Hartert TV等。实时逆转录酶PCR检测方法改进人偏肺病毒检测。中国临床病毒学杂志,2012;54:371-5。
Kodani M, Yang G, Conklin LM, Travis TC, Whitney CG, Anderson LJ,等。TaqMan®低密度阵列同时检测多种呼吸道病原体的应用临床微生物学杂志。2011;49:2175-82。
王志刚,王志刚,王志刚。呼吸道合胞病毒或人偏肺病毒感染儿童的临床疾病及病毒载量中华微生物学杂志,2008;42(2):382 - 382。
Bosis S, Esposito S, Osterhaus AD, Tremolati E, Begliatti E, Tagliabue C,等。人偏肺病毒感染患儿高鼻咽病毒载量与疾病严重程度的关系中国临床病毒学杂志。2008;42:286-90。
李文杰,李文杰,李文杰,刘文杰,Rhéaume C,李文杰,等。体外合胞体形成对小鼠偏肺病毒病严重程度的影响科学通报。2015;10:e0120283。
Ariën KK, Abraha A, quinons - mateu ME, Kestens L, Vanham G, Arts EJ。原发性人类免疫缺陷病毒1型(HIV-1) M组、HIV-1 O组和HIV-2分离株的复制适应度中国病毒学杂志,2005;29(4):349 - 349。
Schaap-Nutt A, Liesman R, Bartlett EJ, Scull MA, Collins PL, Pickles RJ,等。人副流感病毒血清型在人气管支气管气道上皮的复制和细胞因子分泌动力学不同。病毒学。2012;433:320-8。
Wargo AR, Kurath G.病毒适应度:定义,测量和当前的见解。《中国医学杂志》2012;2:538-45。
确认
我们要感谢Nyoke Pin Wong, Nur Ezreen Syafina和See Wie Teoh的协助和支持。
资金
这项工作由马来西亚教育部资助:高影响研究UM.C/625/1/HIR/MOE/CHAN/02/02和研究生研究基金PG084-2015A和PG097-2015A给予KKT。资助者在研究设计、数据收集和分析、发表决定或手稿准备中没有任何作用。本研究没有获得额外的外部资助。
数据和材料的可用性
本研究中产生或分析的所有数据均包含在本文中。
作者信息
作者及隶属关系
贡献
设计实验:XYO、JBC、KKT;进行实验:XYO、JBC、KTN、WZC;分析数据:XYO, JBC, KTN, WZC, KGC, NSH, YKP, YFC, AK, KKT。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
这项研究得到了马来亚大学医学中心(UMMC)医学伦理委员会(MEC890.1)的批准。使用了医学伦理委员会允许的标准多语言同意书,并获得了所有研究参与者的书面同意。所有实验都按照批准的指导方针和规定进行。
发表同意书
我们已获得参加者的书面同意,可以发表有关资料。
相互竞争的利益
作者宣称他们之间没有利益冲突。
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
吴晓燕,许志强,吴嘉棠,吴志强et al。人偏肺病毒遗传多样性和鼻咽病毒载量对成人症状严重程度的作用性研究J15, 91(2018)。https://doi.org/10.1186/s12985-018-1005-8
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12985-018-1005-8
关键字
- 人偏肺病毒
- 遗传多样性
- 病毒载量
- 症状严重程度
- 急性呼吸道感染