- 短论文gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
博纳病病毒核蛋白核输出信号在核输出活性和与病毒磷酸化蛋白结合中的双重功能gydF4y2Ba
病毒学杂志gydF4y2Ba体积gydF4y2Ba14gydF4y2Ba、物品编号:gydF4y2Ba126gydF4y2Ba(gydF4y2Ba2017gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
博纳病病毒(BoDV)具有负义单链RNA基因组,可引起细胞核内的持续感染。由128和131位亮氨酸和133和136位异亮氨酸组成的病毒核蛋白(N)的核输出信号(NES)与病毒磷蛋白(P)的两个预测结合位点之一重叠。先前的研究表明,BoDV-P的高表达抑制N的核输出;然而,N - NES在与P相互作用中的作用尚不清楚。我们检测了BoDV-N NES突变体的亚细胞定位、病毒聚合酶活性和p结合能力。我们还鉴定了一种含有N的NES突变的重组BoDV (rBoDV)。gydF4y2Ba
结果gydF4y2Ba
在NES的亮氨酸和异亮氨酸残基上进行4个丙氨酸取代的BoDV-N破坏了其细胞质定位,并破坏了聚合酶活性和p结合能力。尽管根据微小基因组测定,131位的丙氨酸取代显著增强了病毒聚合酶活性,但与野生型rBoDV相比,携带该突变的rBoDV表现出病毒rna和蛋白质的表达。gydF4y2Ba
结论gydF4y2Ba
我们的研究结果表明,BoDV-N NES在BoDV复制中具有双重功能,即细胞核输出N和与P相互作用,影响细胞核内病毒聚合酶的活性。gydF4y2Ba
背景gydF4y2Ba
博纳病病毒(BoDV)是一种包膜病毒,具有非节段的负链RNA基因组[gydF4y2Ba1gydF4y2Ba]并在宿主细胞核中建立持续感染[gydF4y2Ba2gydF4y2Ba]。BoDV核糖核蛋白(vRNP)由病毒基因组RNA (vRNA)、核蛋白(N)、大蛋白(L)、磷酸化蛋白(P)和基质蛋白(M)组成,BoDV-N通过病毒RNA包封形成N-vRNA复合物[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba]。BoDV-L是一种依赖RNA的RNA聚合酶,与P一起作用于病毒转录和复制[gydF4y2Ba5gydF4y2Ba]。BoDV-P通过与N和L结合而成为vRNP形成的枢纽[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba]。虽然BoDV-M对病毒聚合酶活性没有影响,但它可能通过与病毒RNA和P结合在vRNP的转运中发挥作用[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba]。当BoDV vRNP进入细胞质后被释放,vRNP被转运到细胞核中,在细胞核中发生BoDV转录和复制[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba11gydF4y2Ba]。新合成的N、L和P也被转运到细胞核中形成vRNP。子代vRNP作为子代病毒粒子被宿主质膜和芽包裹[gydF4y2Ba12gydF4y2Ba]。通过这种方式,BoDV vRNP在其复制过程中穿梭于细胞质和细胞核之间。N、L、P中的核定位信号(NLS)和N、P中的核输出信号(NES)在BoDV vRNP的核质转运中发挥重要作用[j]。gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba]。gydF4y2Ba
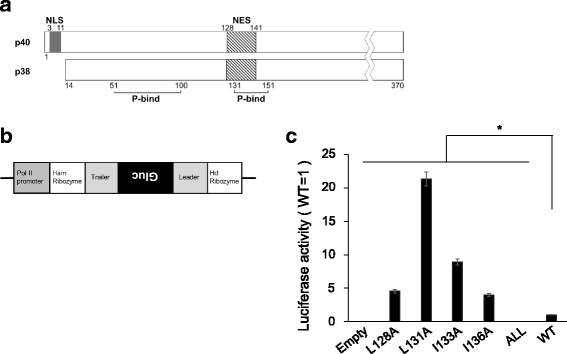
BoDV-N在感染细胞中以p40(全长)和p38两种亚型存在。p38从第N个开放阅读框的第二个起始密码子翻译而来,因此在其N端不包含NLS(图2)。gydF4y2Ba1gydF4y2Ba) [gydF4y2Ba17gydF4y2Ba]。当BoDV-N的p40或p38单独在细胞中表达时,p40和p38分别在细胞核和细胞质中观察到[gydF4y2Ba13gydF4y2Ba,gydF4y2Ba17gydF4y2Ba]。相比之下,p40和p38的共表达导致它们在细胞核和细胞质中都有定位[gydF4y2Ba13gydF4y2Ba]。BoDV-N NES(在128-141的位置)与BoDV-P的一个结合位点(131-158)重叠[gydF4y2Ba18gydF4y2Ba(图。gydF4y2Ba1gydF4y2Ba),而NES的活动受与P [gydF4y2Ba13gydF4y2Ba]。BoDV-N核胞质穿梭受其两种同工异构体和p的表达水平调控。先前的研究通过使用N突变体或与GFP融合的NES来评估BoDV-N的核输出活性,但BoDV-N NES在病毒复制中的作用尚不清楚。为了确定BoDV-N NES是否直接参与病毒复制,我们利用N NES突变体分析了其与BoDV-P和病毒聚合酶活性的相互作用,并对含有NES突变的rBoDV进行了表征。gydF4y2Ba
bodv - nnes突变体的微基因组分析。BoDV-N (gydF4y2Ba一个gydF4y2Ba)和BoDV微小基因组(gydF4y2BabgydF4y2Ba)。gydF4y2BacgydF4y2Ba.利用BoDV-N NES突变体进行微基因组分析。用pC-BoDV-MG-Gluc、pC-BoDV-N、pC-BoDV-L和pCXN2-P转染293 LTV细胞。转染后48 h,测定荧光素酶活性。实验分别独立进行了三次。数据用Student 's进行分析gydF4y2BatgydF4y2Ba以及。柱状图为平均值±标准差(SD) (*;gydF4y2BapgydF4y2Ba值< 0.05)gydF4y2Ba
结果与讨论gydF4y2Ba
BoDV-N的核输出通过依赖crm1的途径发生[gydF4y2Ba13gydF4y2Ba]。BoDV-N的典型NES由两个亮氨酸(位置128和131)和两个异亮氨酸(位置133和136)残基组成gydF4y2Ba1gydF4y2Ba)。我们在NES的四个氨基酸残基上分别或全部引入了丙氨酸取代(表1)gydF4y2Ba1gydF4y2Ba),并使用pCAGGS生成BoDV-N NES突变体的表达质粒[gydF4y2Ba19gydF4y2Ba]。gydF4y2Ba
为了评估病毒聚合酶活性,我们使用了先前报道的改良的小基因组测定方法[gydF4y2Ba20.gydF4y2Ba]。简单地说,BoDV微小基因组RNA是由Pol II从编码Gaussia luciferase (Gluc)的反义开放阅读框的cDNA中转录而来的,Gluc是一个分泌的报告基因,插入在BoDV的5 '尾部和3 '先导序列之间(图2)。gydF4y2Ba1 bgydF4y2Ba)。该结构体被用作转录和复制的模板。接下来,1 × 10gydF4y2Ba5gydF4y2Ba293 LTV细胞(Cell Biolabs, Inc., San Diego, CA, USA)转染0.125 μg的BoDV微小基因组(pC-BoDV-MG-Gluc)、BoDV- n和L表达质粒(pC-BoDV-N和pC-BoDV-L)和0.0125 μg的P表达质粒(pCXN2-P) [gydF4y2Ba20.gydF4y2Ba]使用Lipofecatmine®2000 (Thermo Fisher Scientific, Waltham, MA, USA)。转染后48小时,收集培养上清液,使用BioLux®Gaussia荧光素酶测定试剂盒(New England BioLabs, Ipswich, MA, USA)测定荧光素酶活性。当用BoDV微小基因组转染BoDV- n表达质粒(其中NES中的所有亮氨酸和异亮氨酸残基都被丙氨酸取代)时,病毒聚合酶活性完全丧失(图2)。gydF4y2Ba1 cgydF4y2Ba),表明NES序列对病毒聚合酶活性至关重要。令人惊讶的是,与野生型BoDV-N相比,在NES的四个残基中,尤其是L131A突变体,每一个残基上都有一个单一的丙氨酸取代,显著提高了病毒聚合酶的活性(图2)。gydF4y2Ba1 cgydF4y2Ba)。gydF4y2Ba
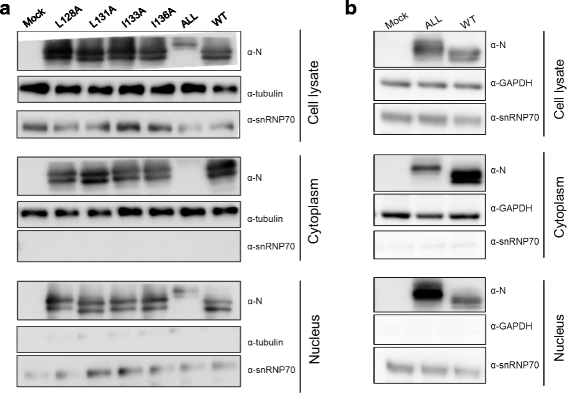
接下来,我们使用生化分离试验评估了BoDV-N突变体的亚细胞定位[gydF4y2Ba21gydF4y2Ba]。用pC-BoDV-MG-Gluc、pC-BoDV-N、pC-BoDV-L和pCXN2-P以相同的比例转染6孔板中的293 T细胞,使用Lipofecatmine®2000进行微量基因组测定。转染后48 h,细胞悬浮于500 μL HMKE缓冲液(20 mM HEPES [pH 7.2], 10 mM KCl, 5 mM MgCl)中gydF4y2Ba2gydF4y2Ba1 mM EDTA, 250 mM蔗糖),含400 μg/mL洋地黄苷(Nacalai Tesque,京都,日本)。细胞悬液在冰上孵育20分钟,每2分钟旋转一次,500倍离心gydF4y2BaggydF4y2Ba在4°C下放置10分钟。采用5-20%梯度凝胶(ATTO, Tokyo, Japan)对上清(细胞质部分)和颗粒(核部分)进行SDS-PAGE检测。分别使用抗BoDV-N HN132单克隆抗体和抗snRNP70多克隆抗体(Sigma-Aldrich, St. Louis, MO, USA)、抗β-微管蛋白单克隆抗体(Sigma-Aldrich)和抗GAPDH单克隆抗体(Santa Cruz Biotechnology, Santa Cruz, CA, USA), western blotting检测BoDV-N和细胞核、snRNP70和细胞质的标记蛋白,以及β-微管蛋白或甘油醛-3-磷酸脱氢酶(GAPDH)。如图所示。gydF4y2Ba2gydF4y2Ba结果表明,所有亮氨酸和异亮氨酸残基均被丙氨酸取代的NES突变体主要存在于细胞核部分。相比之下,与野生型BoDV-N相比,其他突变体在细胞内定位方面没有差异。为了确保BoDV-N ALL突变体的蛋白表达水平与野生型相当,我们进行了分离实验,转染质粒的量调整为:pC-BoDV-N (WT)为87 ng, pC-BoDV-N- nes - a (ALL)为2.1 g。因此,BoDV-N ALL突变体的蛋白表达水平升高并不影响其细胞定位(图2)。gydF4y2Ba2 bgydF4y2Ba)。Phyre2分析[gydF4y2Ba22gydF4y2Ba]预测了丙氨酸在NES中的取代增加了氨基酸(aa) 130-149到aa 128-149的α-螺旋结构位置,导致了NES突变体之间电泳迁移率的差异(图2)。gydF4y2Ba2gydF4y2Bab).这些结果表明,即使在BoDV-P存在的情况下,替代突变体也不能输出到细胞质中,并且核输出N对于有效的病毒聚合酶活性很重要。gydF4y2Ba
BoDV-N NES突变体的亚细胞定位。gydF4y2Ba一个。gydF4y2Ba用pC-BoDV-MG-Gluc、pC-BoDV-N、pC-BoDV-L和pCXN2-P转染293 T细胞。gydF4y2Bab。gydF4y2Ba用pC-BoDV-MG-Gluc、pC-BoDV-L、pCXN2-P和87 ng pC-BoDV-N (WT)或2.1 g pC-BoDV-N- nes - a (ALL)转染293 T细胞。gydF4y2Ba一个gydF4y2Ba和gydF4y2Bab。gydF4y2Ba转染后48 h,对细胞进行生化分离。用抗BoDV-N HN132单克隆抗体和抗snRNP70多克隆抗体、抗β-微管蛋白单克隆抗体、抗GAPDH单克隆抗体分别检测BoDV-N和部分标记蛋白(细胞核snRNP70和细胞质β-微管蛋白或GAPDH)gydF4y2Ba
先前的研究在N序列中发现了两个p结合区(图2)。gydF4y2Ba1gydF4y2Ba),并证明P的高表达通过掩盖NES抑制N的核输出,从而导致细胞核内病毒复制的调节[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba16gydF4y2Ba]。然而,尚不清楚nnes是否在与p的相互作用中起直接作用,因此,我们评估了NES突变体与BoDV-P的相互作用。为了评估BoDV-N和BoDV-P之间的相互作用,在N端分别用3× FLAG标记的N和HA标记的P进行免疫沉淀(IP)实验。用pC-FLAG-BoDV-N、pC-BoDV-L和pCNX2-HA-BoDV-P转染293 T细胞。转染后48小时,用裂解缓冲液(20 mM Tris-HCl, 150 mM NaCl, 1 mM EDTA, 1% Triton X-100, 1 U蛋白酶抑制剂cOmplete [Sigma-Aldrich])收获细胞。用抗flag M2抗体偶联的Dynabeads Protein G (Thermo Fisher Scientific)对细胞裂解物进行IP检测。用1.5 μg的3× FLAG肽(Sigma-Aldrich)洗脱IP产物,进行western blotting。结果表明,虽然BoDV-N NES的单丙氨酸取代突变体与BoDV-P共沉淀,但包含所有必需氨基酸取代的突变体不与P相互作用(图2)。gydF4y2Ba3gydF4y2Ba)。尽管BoDV-N突变体保留了预测的主要P结合位点aa 51-100,但所有的丙氨酸替代突变体都完全消除了与BoDV-P的相互作用,这表明BoDV-N NES中的四个残基对于与P的相互作用是必不可少的。考虑到细胞核中N的数量受与P的相互作用的调节,并且对病毒复制很重要,因此很可能在BoDV复制过程中,nnes在核输出活动和p结合中具有双重功能。gydF4y2Ba
BoDV-N NES突变体与BoDV-P的相互作用。gydF4y2Ba一个gydF4y2Ba.用pC-FLAG-BoDV-N、pC-BoDV-L和pCNX2-HA-BoDV-P转染293 T细胞。转染后48 h,用抗flag M2单克隆抗体对细胞进行IP检测。用抗flag M2多克隆抗体和抗ha单克隆抗体进行免疫印迹分析。gydF4y2BabgydF4y2Ba.含有L131A突变的BoDV-Np40的核定位。用表达BoDV-Np40-或BoDV-Np40- l131的质粒转染OL细胞。转染后48 h,用抗bodv -N HN132单克隆抗体进行IFA处理,计算细胞核中仅表达N的细胞百分比。在10个场中共计数150个细胞。实验分别独立进行了三次。数据用Student 's进行分析gydF4y2BatgydF4y2Ba以及。柱状图为平均值±标准差(SD) (*;gydF4y2BapgydF4y2Ba值< 0.05)gydF4y2Ba
为了进一步评估BoDV-N NES在病毒复制中的功能意义,我们接下来将重点放在突变体L131A上,该突变体在小基因组分析中显示出最高的聚合酶活性(图2)。gydF4y2Ba1 cgydF4y2Ba)。为了准确评估BoDV-N L131A突变体的核输出活性,我们构建了BoDV-Np40结构体,当N的第二个起始密码子被丙氨酸(M14A)取代时,该结构体不表达p38亚型。在M14A突变体的基础上,我们还构建了含有L131A的BoDV-Np40突变体,BoDV-Np40-L131A。将表达质粒转染到少突胶质细胞中。转染后48 h,使用抗BoDV-N单克隆抗体,采用间接荧光法(IFA)评估BoDV-N定位于细胞核或细胞核和细胞质的细胞数量。如图所示。gydF4y2Ba3 bgydF4y2Ba与BoDV-Np40相比,BoDV-Np40- l131a中N定位于细胞核的细胞数量略有但显著增加。gydF4y2Ba
上述结果表明,L131A突变体轻度损害了N的核质穿梭效率,导致微基因组测定中聚合酶活性增强。为了证实这一点,我们通过之前描述的反向遗传学方法挽救了rBoDV P/M-GFP,其中包含P和M基因之间的GFP序列,以及rBoDV P/M-GFP-L131A,其中包含N基因中的L131A突变[gydF4y2Ba23gydF4y2Ba]。共计5.0 × 10gydF4y2Ba5gydF4y2Ba以2 μg pC-BoDV P/M-GFP + L131A转染293 T细胞,0.25 μg pC-BoDV- l, 0.025 μg pCXN2-P, 0.25 μg pC-BoDV-N-L131A。同时,我们挽救了rBoDV P/M-GFP-WT。转染72 h后,293 T细胞以4 × 10共培养gydF4y2Ba5gydF4y2Ba每3天用1 μg/mL嘌呤霉素传代一次,去除转染的293 T细胞。经过几次传代,我们基于rBoDV和病毒蛋白在两种细胞中相当水平的表达证实了持续感染的Vero细胞的建立(图2)。gydF4y2Ba4gydF4y2Ba)。采用5-20%梯度凝胶,采用SDS-PAGE进行免疫印迹,采用抗BoDV- n HN132单克隆、抗BoDV- p多克隆和BoDV- x多克隆抗体检测BoDV蛋白。gydF4y2Ba
rBoDV P/M-GFP-L131A的表征gydF4y2Ba一个gydF4y2Ba.病毒蛋白在感染细胞中的表达水平。采用抗bodv - n HN132单克隆、抗bodv - p多克隆、BoDV-X多克隆和抗β-微管蛋白单克隆(Sigma-Aldrich)抗体进行Western blotting。基因组RNA的表达水平(gydF4y2BabgydF4y2Ba)和病毒mRNA (gydF4y2BacgydF4y2Ba)感染细胞从感染细胞中提取总RNA,进行RT-qPCR。实验分别独立进行了三次。数据用Student 's进行分析gydF4y2BatgydF4y2Ba以及。柱状图表示平均值±SD。gydF4y2BadgydF4y2Ba.rBoDV P/M-GFP-L131A生长动力学用rBoDV P/M-GFP-L131A (L131A)或rBoDV P/M-GFP (WT)感染OL细胞,感染倍数为1。在感染后第3、15、20、30、40和50天,使用Tali图像细胞仪(Thermo Fisher Scientific)对gfp阳性细胞进行计数。实验分别独立进行了三次。柱状图表示平均值±SDgydF4y2Ba
为了评估N L131A突变体是否增强了复制能力病毒的聚合酶活性,采用实时荧光定量pcr方法定量了rbodv感染细胞的转录和复制活性。从病毒感染细胞中提取的RNA使用Verso cDNA Synthesis Kit (Thermo Fisher Scientific)使用寡核苷酸dT引物或病毒基因特异性引物(5 ' -GTT GCG TTA ACA ACA AAC CAA TCA T-3 ')进行逆转录。采用THUNDERBIRD™SYBR®qPCR MIX (Toyobo, Osaka, Japan)对cDNA进行实时PCR。采用引物(5 ' -ATG CAT TGA CCC AAC CGG TA-3 '和5 ' -ATC ATT CGA TAG CTG CTC CCT TC-3 ')进行实时荧光定量pcr扩增病毒mRNA和基因组RNA。引物(5 ' -ATC TTC TTT TGC GTC GCC AG-3 '和5 ' -ACG ACC AAA TCC GTT GAC TCC-3 ')扩增GAPDH mRNA。实时荧光定量pcr结果显示,rBoDV P/ m - gfp - l131a感染细胞中病毒mRNA和基因组RNA的表达水平与rBoDV P/ m - gfp - wt感染细胞中相似(图2)。gydF4y2Ba4 bgydF4y2Bac),提示在感染细胞中,通过与其他病毒蛋白(如X和L)的相互作用,可以克服N在核细胞质穿梭中的轻微损伤。gydF4y2Ba
为了进一步评价ne中131位亮氨酸的丙氨酸取代对病毒生长的影响,我们对rBoDV P/M-GFP-L131A的生长动力学进行了评估。用rBoDV P/M-GFP-L131A或rBoDV P/M-GFP-WT感染OL细胞,感染倍数为1,在感染后3、15、20、30、40和50天使用Tali图像细胞仪(Thermo Fisher Scientific)计数gfp阳性细胞的百分比。虽然rBoDV P/M-GFP-L131A的生长速度比rBoDV P/M-GFP-WT慢,但在感染后第50天,两种病毒的感染率均达到100%(图2)。gydF4y2Ba4 dgydF4y2Ba),这表明在NES中131位亮氨酸的丙氨酸替代略微损害了病毒的生长。gydF4y2Ba
我们发现,在小基因组分析中,BoDV-N的NES中131位亮氨酸的丙氨酸替代增加了病毒聚合酶的活性,但在rBoDV的复制周期中没有发挥关键作用。类似地,以前曾报道过人类副流感1型病毒2型(hPIV2)的N中有一个氨基酸突变,该病毒与BoDV -属于同一目gydF4y2BaMononegaviralesgydF4y2Ba,在小基因组试验中,聚合酶活性明显增强,但含有突变的重组hPIV2无法获救[gydF4y2Ba24gydF4y2Ba]。这表明,尽管小基因组测定因其方便而经常被使用,但它并不能准确反映实际病毒的聚合酶活性。gydF4y2Ba
我们在这里证明了BoDV- n NES中的亮氨酸和异亮氨酸残基在核输出活性和p结合中具有双重功能,这是BoDV复制所必需的。我们的发现增加了对细胞核内持续感染BoDV的机制的理解。gydF4y2Ba
缩写gydF4y2Ba
- aa:gydF4y2Ba
-
氨基酸gydF4y2Ba
- BoDV:gydF4y2Ba
-
博纳病病毒:核输出信号gydF4y2Ba
- GAPDH:gydF4y2Ba
-
Glyceraldehyde-3-phosphate脱氢酶gydF4y2Ba
- Gluc:gydF4y2Ba
-
Gaussia荧光素酶gydF4y2Ba
- hPIV2:gydF4y2Ba
-
人类副流感病毒2型gydF4y2Ba
- 知识产权:gydF4y2Ba
-
免疫沉淀反应gydF4y2Ba
- NLS:gydF4y2Ba
-
核定位信号gydF4y2Ba
- OL:gydF4y2Ba
-
少突神经胶质瘤gydF4y2Ba
- vRNA:gydF4y2Ba
-
病毒RNAgydF4y2Ba
- vRNP:gydF4y2Ba
-
核糖核蛋白gydF4y2Ba
参考文献gydF4y2Ba
李建平,李建平,李建平,等。博纳病病毒的基因组组织。科学通报,1994;31(1):362 - 362。gydF4y2Ba
李建军,李建军,李建军,李建军。博纳病病毒是一种负链RNA病毒,在感染细胞的细胞核中进行转录。中国科学d辑,1992;39(1):1 - 9。gydF4y2Ba
霍克M, Kraus I, Schoehn G, Jamin M, Andrei-Selmer C, Garten W,等。博纳病病毒核蛋白的RNA诱导聚合。病毒学。2010;397:64 - 72。gydF4y2Ba
鲁道夫M, Kraus I, Dickmanns A, Eickmann M, Garten W, Ficner R.博纳病病毒核蛋白晶体结构。结构。2003;11:1219-26。gydF4y2Ba
Walker MP, Jordan I, Briese T, Fischer N, Lipkin WI。博纳病病毒聚合酶的表达与鉴定。中华病毒学杂志,2000;44(4):444 - 444。gydF4y2Ba
施磊,李春华,李春华,李金伟。博纳病病毒P、N和X蛋白的相互作用及其功能意义中国生物医学工程学报。1998;27(3):391 - 391。gydF4y2Ba
施耐德,李春华,李春华,等。博尔纳病病毒P蛋白磷酸化位点的功能分析。中国生物医学工程学报,2007;31(1):597 - 597。gydF4y2Ba
Schneider U, Blechschmidt K, Schwemmle M, Staeheli P.相互作用域的重叠表明P蛋白在博纳病病毒聚合酶复合体的组装和调控中起核心作用。生物化学学报,2004;39(2):593 - 593。gydF4y2Ba
Neumann P, Lieber D, Meyer S, Dautel P, Kerth A, Kraus I,等。博纳病病毒基质蛋白(BoDV-M)的晶体结构揭示了ssRNA结合特性。科学通报,2009;26(6):391 - 391。gydF4y2Ba
蔡思G, Mayer D, Hildebrand A, Frank R, Hayashi Y, Tomonaga K等。博纳病病毒基质蛋白是病毒核糖核蛋白复合物的一个组成部分,不干扰聚合酶的活性。中国生物医学工程学报,2007;31(1):444 - 444。gydF4y2Ba
夏立文,吴勇,Allart S, Malnou CE, Schwemmle M, Gonzalez-dunia D.利用病毒编码四胱氨酸标记P蛋白分析博纳病病毒在感染细胞中的转运。中华病毒学杂志,2013;37(2):1239 - 1248。gydF4y2Ba
高崎T,高野T,盛田C,中谷T, Ikuta K,等。博纳病病毒的精细结构和形态发生。[J] .中国生物医学工程学报,1999;33(3):769 - 769。gydF4y2Ba
小林天,王敬伟,张刚,等。博纳病病毒核蛋白需要核定位和输出活动才能进行病毒核胞质穿梭。中国生物医学工程学报,2009;25(5):391 - 391。gydF4y2Ba
沃克议员,利普金议员。博纳病病毒聚合酶核定位信号的研究。中华病毒学杂志,2002;16(6):864 - 867。gydF4y2Ba
柳井辉,小林涛,林林英,张刚,德杰杰,等。一个富含蛋氨酸的结构域介导博纳病病毒磷酸化蛋白依赖crm1的核输出活性。中华微生物学杂志,2006;32(1):1 - 9。gydF4y2Ba
李建军,李建军,李建军,等。博纳病病毒感染中病毒蛋白的胞质穿梭。病毒。2013;5:1978 - 90。gydF4y2Ba
pyp JM。Gartner。博纳病病毒38和39千道尔顿结构蛋白差异亚细胞定位的分子基础中华病毒学杂志。1997;32(1):1 - 4。gydF4y2Ba
张建军,张建军,张建军,等。博纳病病毒p40蛋白与p23蛋白相互作用的两个结构域。中华病毒学杂志,1998;39(2):391 - 391。gydF4y2Ba
杨建一,杨建一,李军一,等。一种新型真核表达载体的高效筛选。基因。1991;108:193-9。gydF4y2Ba
Yanai H, Hayashi Y, Watanabe Y, Ohtaki N, Kobayashi T, Nozaki Y,等。利用RNA聚合酶II启动子和SV40核输入信号建立新型博纳病病毒反向遗传系统。微生物学报,2006;8:1522-9。gydF4y2Ba
张建军,张建军,张建军,等。稀土稀土核配合物中核局部化特征的研究。生物医学进展,2004;29(1):1 - 3。gydF4y2Ba
Kelley LA, Mezulis S, Yates CM, Wass MN, Sternberg MJE。用于蛋白质建模、预测和分析的Phyre2门户网站。Nat protocol . 2015; 10:845-58。gydF4y2Ba
Daito T, Fujino K, Honda T, Matsumoto Y, Watanabe Y, Tomonaga K.一种新型的从顺子间非编码区稳定表达外源蛋白的病毒载体系统。中国生物医学工程学报,2011;35(5):591 - 591。gydF4y2Ba
Matsumoto Y, Ohta K, Kolakofsky D, Nishio M.人副流感病毒2型核蛋白rna结合域的点突变引起聚合酶活性异常增强。中华微生物学杂志。2017;doi:gydF4y2Ba10.1128 / JVI.02203-16gydF4y2Ba.gydF4y2Ba
致谢gydF4y2Ba
本研究得到了jpsps KAKENHI资助号JP26253027, JP26670225 (KT)和JP16K19069 (AM), MEXT KAKENHI资助号JP16H06429, JP16K21723和JP16H06430 (KT), MEXT核心到核心计划A,高级研究网络(KT)以及日本医学研究与开发机构(AMED)的创新生物医学基础科学和平台技术计划(KT)的部分支持。gydF4y2Ba
资金gydF4y2Ba
资助机构在研究的设计和是否提交论文发表的决定中没有发挥任何作用。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
本研究中使用和分析的数据集可应通讯作者的合理要求向其提供。gydF4y2Ba
作者信息gydF4y2Ba
作者及单位gydF4y2Ba
贡献gydF4y2Ba
我做了所有的实验并分析了数据。ms支持拯救重组博纳病病毒。A.M.和K. T写的论文。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
不适用。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们没有竞争利益。gydF4y2Ba
出版商的注意gydF4y2Ba
伟德体育在线施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),它允许在任何媒体上不受限制地使用、分发和复制,前提是您要适当地注明原作者和来源,提供到知识共享许可协议的链接,并注明是否进行了修改。创作共用公共领域免责声明(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文中提供的数据,除非另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
柳井,M.,酒井,M.,牧野,A。gydF4y2Baet al。gydF4y2Ba博纳病病毒核蛋白核输出信号在核输出活性和与病毒磷酸化蛋白结合中的双重功能。gydF4y2Ba性研究JgydF4y2Ba14gydF4y2Ba, 126(2017)。https://doi.org/10.1186/s12985-017-0793-6gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12985-017-0793-6gydF4y2Ba
关键字gydF4y2Ba
- 博纳病病毒gydF4y2Ba
- 核质穿梭gydF4y2Ba
- 核出口信号gydF4y2Ba
- Nucleoprotein-phosphoprotein交互gydF4y2Ba
- 聚合酶的活动gydF4y2Ba