摘要
背景
小反刍动物鼠疫(PPR)是一种具有重要经济意义的、国际兽疫局(OIE)必须通报的、发生在绵羊和山羊等小反刍动物身上的跨界病毒性疾病。小反刍动物疫病病毒(PPR virus, PPRV)是一种负性单链RNA病毒,是小反刍动物疫病的病原。因此,灵敏、特异、快速的诊断方法检测小反刍兽疫是准确、及时诊断小反刍兽疫疑似病例的必要条件。
方法
本研究采用实时荧光检测(real-time RT-RPA法)和横向流动条带检测(LFS RT-RPA法),建立了针对PPRV N基因的逆转录重组酶聚合酶扩增方法。
结果
所建立的实时RT-RPA方法在40℃下,7 min内每次反应灵敏度低至100份,可靠性为95%;而所开发的LFS RT-RPA方法在39°C条件下25分钟内每次反应的灵敏度低至150个拷贝。在这两种试验中,与绵羊和山羊痘病毒、口蹄疫病毒和Orf病毒均无交叉反应。
结论
这些特点使得RPA检测有希望在现场使用或作为一种定点诊断技术。
背景
小反刍动物鼠疫(PPR)是小反刍动物传染性最强的疾病之一,在非洲、中东、南亚和中国大部分地区仍然流行。[1- - - - - -3.].小反刍动物疫病的发病率和死亡率高达90%,对流行国家贫困和边缘农民的生计造成毁灭性影响。在全球成功消灭牛牛瘟后,小反刍兽疫已成为优先考虑的动物疾病之一,全球控制和消灭以实现减贫。为了实现这一目标,快速准确地诊断小反刍兽疫是非常重要和迫切需要的。
病原体小反刍兽疫病毒(PPRV)是该病科麻疹病毒属的一个代表性成员副黏液病毒科。PPRV的基因组长度为15,948个核苷酸,其中包含6个转录单位,编码6个相邻且不重叠的蛋白质[4].PPRV的基因排列顺序为3 ' -N-P/C/V-M-F-HN-L-5 ' [5],每个基因由一个可变长度的基因间区分开[6].与其他负链RNA病毒一样,基因组RNA被核蛋白(N)包装,与磷蛋白(P)和大蛋白(L)一起形成核衣壳,N蛋白是病毒中产量最高的主要病毒蛋白。根据N基因,PPRV分离株可分为4个不同的谱系,即谱系I和II仅出现在非洲,谱系III出现在非洲和中东,第四种在非洲和亚洲均存在[1,5].N蛋白也被广泛应用于小反刍兽疫诊断方法的开发。
根据临床症状,小反刍兽疫可能会与其他疾病混淆,如羊痘、口蹄疫和Orf,这些疾病也会影响小反刍动物。因此,必须进行实验室检测以明确诊断小反刍兽疫。不同的细胞系已被用于分离PPRV,但成功有限[7,8].因此,开发了一种检测病毒核蛋白的ELISA方法,作为病毒分离的替代方法[9].然而,这些方法是费力和耗时的,并不能用作笔侧测试。近年来,人们开发了一种快速检测PPRV的免疫层析方法,但其灵敏度尚不足以检测低病毒载量的临床样本[10].血清抗体检测也是无效的,因为所有基于PPRV抗体检测的检测方法都不能将感染动物与接种动物区分开来[11- - - - - -13].传统的逆转录聚合酶链反应(rt - pcr)由于其快速、准确和敏感的特性,被广泛用于检测PPRV基因组物质[14,15].但这些常规RT-PCR检测方法也存在劳动强度大、耗时长、交叉污染风险大等缺点[16].实时RT-PCR方法已比传统RT-PCR方法得到广泛采用,并被开发用于检测和定量临床样本中存在的PPRV [16- - - - - -20.].但实时RT-PCR检测仍然依赖于专门的、昂贵的保温瓶循环机,难以作为“笔侧”检测和在资源匮乏的流行地区使用。环介导等温扩增(LAMP)提供了一种不需要特定热循环器的等温扩增病毒RNA的方法。LAMP反应可采用水浴法进行,反应结果可通过肉眼颜色变化直接区分。LAMP可适用于不同形式的扩增产物检测,如琼脂糖凝胶、横向流动分析(视觉监测)和实时荧光分析[21,22].然而,RT-LAMP检测需要6个引物,在检测高变异病毒时可靠性不理想[21].近年来,研究人员开发了一种重组酶聚合酶扩增(RPA)方法,用于快速检测具有兽医重要性的不同病毒,如口蹄疫病毒(FMDV) [23], Orf病毒(ORFV) [24]、施马伦贝格病毒(SBV)及牛病毒性腹泻病毒(BVDV) [21].这些研究表明,RPA检测具有较高的敏感性、良好的诊断特异性和快速性,有望成为一种快速检测病原体的笔侧检测方法。RPA的扩增依赖于重组酶、单链结合蛋白和链置换DNA聚合酶的特定组合。Twist Amp®exo探针用于实时荧光探针的RPA检测,荧光信号的产生依赖于Twist Amp®exo探针使用DNA修复酶Exonuclease III分离内部基性位点模拟物(四氢呋喃,THF)上的荧光基团和淬灭剂。利用荧光检测设备对实时荧光信号进行测量。对于基于横向流条带(LFS)的RPA检测,需要Twist Amp®nfo探针。本研究基于PPRV N基因建立了逆转录RPA实时荧光检测(real-time RT-RPA assay)和横向流动条带检测(LFS RT-RPA assay)。结果表明,所建立的PPRV实时检测方法和LFS RT-RPA检测方法均具有较高的灵敏度和特异性。
方法
病毒株
本研究中使用的所有病毒都保存在我们的实验室中:尼日利亚小反刍动物鼠疫病毒(PPRV) 75/1;口肠病毒(ORFV)/疫苗/CHA;山羊痘病毒(GPV) AV40、羊痘病毒(SPV) Gulang2009;口蹄疫病毒/O/CHA;FMDV/A/CHA和FMDV/Asia I/CHA。
样品制备
制备加入pprv的组织裂解物,肝脏、肺、胃、肾、淋巴结和皮肤的无pprv组织样本(n= 18个,每个组织3个),取自3只健康绵羊。将10% (w/v)的组织悬浮液(1毫克组织样品用9体积PBS均质,使用MP FastPrep-24)在PBS中均质。在短暂离心后,均质组织样本加入104TCID50PPRV尼日利亚75/1和储存在-80°C直到使用。已知PPRV阳性样本(n= 14)和已知负样本(n= 10)经实时RT-qPCR检测确认[19].采用新开发的RT-RPA方法检测了甘肃省小反刍兽疫疑似病例的32份临床样本和健康绵羊的5份样本,这些样本均经RT-qPCR方法筛选,以确定是否存在PPRV-RNA。
病毒RNA提取
按照厂家说明书使用高纯病毒核酸试剂盒(High Pure Viral Nucleic Acid kit, Roche)从样品中提取总RNA,最终体积为40 μL洗脱。提取的RNA保存在-80°C,直到进一步用于本研究中的所有分析。
RNA标准的生成
由Genewiz公司(中国苏州)合成PPRV N基因片段(354 bp,从X74443的528 bp到881 bp),并克隆到T7启动子下游的pUC57载体中,命名为pPPRV/RPA。使用plasmid Mini kit I (Promega, USA)提取pPPRV/RPA质粒,质粒在PPRV N基因片段下游线性化。按照制造商的说明,共1 μg线性化产物用于体外转录(Megascript®kit, Ambion, USA)。根据制造商的说明,使用RNA清理方案(RNeasy Mini KIT, Qiagen, Germany)对转录RNA进行DNase处理和纯化。纯化的RNA通过Nanovue (GE生命科学,美国)进行定量,并在-80°C保存直到使用。
RPA引物和探针的设计和优化
PPRV特异性RPA引物和探针基于PPRV N基因,根据TwistDx (Cambridge, uk)的RPA指南(Twist Amp®DNA扩增试剂盒组合说明书)设计。引物和探针分别与X74443 (LII,尼日利亚)、L39878 (LII,尼日利亚)、EU267274 (LII,尼日利亚)、EU267273 (LI,科特迪瓦)、AJ849636 (LIV,土耳其)、FJ905304 (LIV,中国西藏)、AY560591 (LIV,印度Sungri)、AJ563705 (LIV,土耳其)、KJ867543 (LIII,乌干达)、KJ867544 (LIII,阿曼)的N基因序列一致。以上所有PPRV N基因序列均从GenBank检索,根据TwistDx (Cambridge, UK)的推荐,基于PPRV N基因手工设计基因序列的多重序列比对。所有引物和探针均由生工生物技术(上海)有限公司合成。引物和探针的序列见表1.为了确定PPRV实时RT-RPA检测最有效的引物对,在对PPRV N基因所有可用序列比对的基础上,设计了3个针对N基因不同区域的正向引物(Fe1 N - Fe3 N)和反向引物(Re1 N - Re3 N)1).9种不同的引物组合(即Fe1 N/Re1 N;Fe1 N/Re2 N;Fe1 N/Re3 N;Fe2 N/Re1 N;Fe2 N/Re2 N;Fe2 N/Re3 N;Fe3 N/Re1 N;Fe3 N/Re2 N;在PPRV实时RT-RPA法中,用探针(Pe)检测Fe3 N/Re3 N。
实时RT-qPCR检测
实时RT-qPCR检测采用Agilent Technologies Stratagene Mx3005P热循环仪(Life Technologies, USA),使用Superscript III/Platinum Taq一步RT-qPCR试剂盒(Invitrogen, USA) [19].反应制备为25 μL反应体积,包含2 μL提取RNA, 12.5 μL Superscript III/Platinum Taq一步RT-qPCR反应混合物,1 μL Superscript III/Platinum Taq一步RT-qPCR酶混合物,0.5 μL ROX参比染料作为被动参比,5 pmol Taqman探针,10 pmol正向引物和反向引物。使用以下热剖面:45°C初始逆转录30分钟,95°C 10分钟,40次扩增循环(94°C 15秒,60°C 1分钟)。采用Mx3005P System软件对数据进行分析。
实时RT-RPA检测
实时RT-RPA检测采用Twist Amp®exo RT试剂盒(TwistDx, Cambridge, uk),在50 μL体积下进行,该试剂盒由29.5 μL补液缓冲液、2 μL模板RNA、2.1 μL正向和反向引物(10 μM, Beijing Genomics Institute, China)、0.3 μL RPA exo探针(10 μM, Sangon Biotech, China)、11.8 μL ddH组成2O和2.5 μL醋酸镁(280 mM)。通过不同的孵育温度(39 ~ 42℃)、不同浓度的模板(0.5 μL ~ 2 μL)和乙酸镁(1 μL ~ 2.5 μL),确定了最佳反应条件。使用FAM通道在优化温度(40°C)下进行20分钟的荧光测量。FAM荧光强度每20 s测定一次。如果在规定的时间范围内(即扩增19至20分钟后),所有重复均高于背景3.5个标准差(3.5 SD),则样品被视为阳性。阈值时间范围为0到4分钟,30秒。
横向流动条带RT-RPA法
横向流动条带RT-RPA检测(LFS RT-RPA检测)使用TwistDx (Cambridge, United Kingdom)的Twist Amp®nfo试剂盒,按照制造商说明进行。简单地说,使用了带有5 ' -生物素标签的反向引物。探针由上游延伸段(30 bp)组成,携带5 ' -FAM抗原标签,通过THF间隔体连接到相邻的下游寡核苷酸(15 bp),在其3 '端携带c3间隔体(聚合酶延伸阻断基团)。本研究中所有寡核苷酸均由生工生物技术公司(中国上海)合成。将提取的PPRV RNA先逆转录为cDNA,再用Twist Amp®nfo试剂盒进行RPA反应,因为该试剂盒不含逆转录酶。按照制造商说明,使用转录子first Strand cDNA Synthesis kit (Roche, Germany),在20 μL反应中进行cDNA合成。简单地说,在12 μL纯化RNA中加入1 μL锚定寡核苷酸引物。65°C孵育10 min后,立即置于冰上2 min,加入含有4 μL RT buffer (5×)、0.5 μL Protector RNase inhibitor、2 μL Deoxynucleotide Mix和0.5 μL transcriptor逆转录酶的混合物。在50℃60 min和85℃5 min条件下进行PPRV RPA nfo反应。PPRV RPA nfo反应采用Twist Amp®nfo试剂盒(TwistDx, UK),该试剂盒含有420 nM nfo RPA引物、15 nM RPA探针、2.5 μL 280 mM MgAc、2 μL cDNA模板和1×复水缓冲液,体积为50 μL。RPA反应在优化温度(39°C)加热区中进行20 min,然后使用Hybridetect 2 T横向流动条带(LFS) (Milenia Biotec GmbH, Germany)试纸棒检测扩增子。 One μL of the amplified product was diluted in 99 μL of the assay buffer (Tris-buffered saline). The strips were then placed into the mixture and incubated at an upright position. The final result was read visually after incubation for 2 min at room temperature. A testing sample was considered positive when both the detection line (sample testing line) and the control line (anti-rabbit antibody line) were visible. A testing sample was considered negative when only the control line was visible. The amplicons could also been analyzed on 2% agarose-gel electrophoresis (Agarose Broad Range, Germany) stained with ethidium bromide after being purified with PCR clean-up Kit (Qiagen, Germany) to further confirm the testing result.
PPRV实时RT-RPA和LFS RT-RPA检测的敏感性和特异性
为了测试PPRV实时RT-RPA检测的动态范围,用ddH将pPPRV/RPA质粒转录的标准RNA体外稀释10倍2O,取值范围为106到101然后用PPRV实时RT-RPA法检测每个反应的基因组拷贝。每组重复6次。用上述加标样品进一步评价PPRV实时RT-RPA检测的敏感性。PPRV LFS RT-RPA法的灵敏度通过10倍连续稀释(106到101每个反应复制基因组)的标准RNA。此外,PPRV LFS RT-RPA反应中的扩增产物也通过琼脂糖凝胶电泳进行了随后的可视化测试。采用FMDV O、A、Asia 1血清型、ORFV、GPV、SPV,对PPRV实时RT-RPA和LFS RT-RPA法的特异性进行了评价,结果表明小反刍动物的临床表现与PPR相似。
统计分析
采用PRISM 5.0软件(GraphPad software, USA)对PPRV实时RT-RPA法灵敏度进行半对数回归分析,采用Statistica软件(StatSoft, Hamburg, Germany)进行probit分析。采用Excel软件进行线性回归分析,比较实时RT-RPA阈值时间与实时RT-qPCR周期阈值之间的差异。
结果
PPRV实时RT-RPA检测的敏感性和特异性
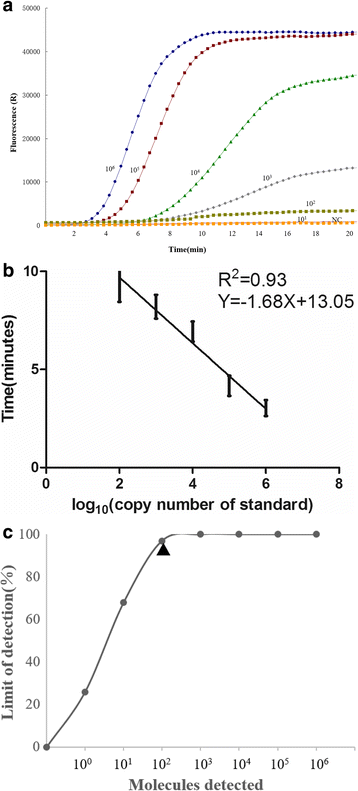
RT-RPA分析结果表明,引物组Fe2 N/Re2 N扩增效率最高(附加文件1:图S1)。因此,将该引物应用于PPRV RT-RPA检测中进行进一步验证。如图所示。1,该方法的动态检测范围为5个日志,每个反应6到2个日志副本,对应的阈值时间为3分钟,在106每反应复制7分钟,102在40°C下每个反应复制数。这一结果表明,在PPRV实时RT-RPA检测中,靶标RNA的定量存在很大的动态范围(图2)。1a和b).PPRV实时RT-RPA法95%概率的检出限为102每个反应的拷贝数(probit分析,p≤0.05)(图1 c).PPRV实时RT-RPA检测的特异性是通过交叉检测感染绵羊和山羊上皮细胞或粘液的其他病毒,包括O、A和亚洲1型FMDV, ORFV和capricpox病毒。未观察到交叉检测,表明该测定方法是针对PPRV的2).
开发的PPRV实时RT-RPA检测然后使用PPRV添加的组织裂解物样本进一步测试(n= 18)。结果显示,所有病毒标记的组织样本检测为PPRV阳性。尽管阈值时间超过30分钟,但在非病毒加标样品中未检测到扩增子。这些结果与PPRV实时RT-qPCR检测结果一致。两种检测方法在上述样品上表现出相同的性能,并且周期阈值(RT-qPCR)与阈值时间(RT-RPA)之间存在相关性(R方0.83,图。2).
PPRV LFS RT-RPA检测的敏感性和特异性
为了确定RT-RPA反应的最佳温度,测试了PPRV LFS-RT-RPA法扩增10的能力4在20℃至50℃的温度范围内,将PPRV RNA的拷贝作为模板。首先,我们在30分钟的孵育时间下评估了这个温度范围。如图。3,在<37℃和50℃条件下均未观察到扩增产物。37、39、40、42和45℃时扩增无差异(图2)。3).因此,随机选择39℃作为PPRV LFS RT-RPA检测标准温度。PPRV LFS-RT-RPA检测在39°C下孵育0、1、5、10、15、20、25和30分钟。如图所示。3 b当孵育时间从15分钟增加到30分钟时,检测性能有所提高,且15分钟和30分钟孵育反应的扩增量无差异,因此随机选择20分钟作为PPRV LFS RT-RPA检测的标准孵育时间。PPRV LFS RT-RPA法的检测限采用cDNA稀释序列(对应106出现1每次反应复制RNA)。试验结果表明,PPRV LFS RT-RPA法在每个反应150份的浓度下给出了明确的阳性信号(图2)。4),琼脂糖凝胶电泳证实了这一结果(图。4 b).在评估PPRV LFS RT-RPA方法的特异性时,未观察到与FMDV血清型O、A和Asia 1、ORFV、SPV和GPV的交叉反应(图5)。5),经琼脂糖凝胶电泳证实(图。5 b).已知阳性样本进一步验证了PPRV LFS RT-RPA检测的特异性(n= 14)和阴性样本(n= 10),经PPRV real-time RT-qPCR检测证实。结果发现,PPRV LFS RT-RPA法能够正确识别所有被检样品。上述结果表明,LFS RT-RPA法对PPRV的检测具有特异性。
PPRV实时RT-RPA法和LFS RT-RPA法在临床样品中的应用
对PPRV实时RT-RPA和LFS RT-RPA检测方法进行了进一步的临床样本评估,其中包括32份来自PPR疑似病例的样本和5份来自健康绵羊的样本。结果与PPRV real-time RT-qPCR检测结果进行比较。即使阈值时间(min)超过30分钟,从健康绵羊中采集的5个样本中,PPRV实时和LFS RT-RPA检测均未检测到扩增。从疑似PPR病例中采集的32个样本中,通过实时PPRV RT-qPCR检测发现20个样本呈阳性(CT值为16至33)。在这些样本中,18个样本通过PPRV实时RT-RPA法(阈值时间为5 ~ 7.6 min)和PPRV LFS RT-RPA法检测阳性。PPRV实时RT-qPCR方法的检出限为10 copies /反应,CT平均值为34.08;而LFS实时RT-RPA方法的检出限为150 copies /反应,CT平均值为30.76。PPRV real-time RT-RPA和LFS RT-RPA检测均为阴性的2份样品,RT-qPCR检测值的CT值分别为33和31,均超出PPRV LFS RT-RPA检测限。基于对37份临床样本的检测,与PPRV实时RT-qPCR相比,PPRV实时RT-qPCR检测的敏感性和特异性分别为90%和100%(表2)2而且3.).
讨论
基于PPRV N基因序列建立了基于F2 N/R2 N引物的PPRV实时RT-RPA和LFS RT-RPA检测方法,能够灵敏、特异地检测样品中存在的PPRV。值得一提的是,所开发的RPA分析的最大运行时间小于25分钟,无论样品中的病毒浓度如何,只要高于检测限(即每个反应> 100拷贝)。本研究结果表明,所开发的PPRV real-time RT-RPA和LFS RT-RPA检测方法对PPRV的检测均具有较高的特异性,与GPV、SPV、FMDV和ORFV无交叉反应,可能引起与小反刍动物PPRV相似的临床症状,有可能成为一种新型的鉴别诊断检测工具。RPA对PPRV检测的高特异性是由于RPA使用了特定的检测探针,就像实时qPCR检测一样。虽然RPA的灵敏度低于RT-qPCR,但RT-RPA的一些优点使其具有吸引力。首先,反应混合物是预先制成的颗粒,并在真空密封袋中提供,可以在室温下保存几天。这将节省冷却成本,并便于现场诊断PPR。其次,该反应可在37°C至45°C的水浴中进行20分钟。第三,RPA提供了不同类型的端点检测格式(如Twist Amp®basic kit、Twist Amp®exo kit和Twist Amp®nfo kit),可用于不同的实验室,因此RPA适用于设备齐全的实验室、流动实验室或没有昂贵诊断仪器的农村地区。
RT-RPA反应与RT-LAMP试验一样,也可以采用水浴法进行,通过LFS装置可以肉眼直接辨别反应结果。然而,所开发的RT-RPA试验比RT-LAMP试验快(RT-RPA试验在20分钟内,RT-LAMP试验在60分钟内)。此外,RT-RPA检测需要一对引物结合探针和较低的温度(39℃),而RT-LAMP至少需要三对引物和较高的温度(62℃)。然而,RPA作为一种相对较新的技术,还没有应用于现场诊断。像其他分子分析,包括LAMP [22,25,26],用于RPA分析的RNA已从样品中提取,这是费力和耗时的。为了实现作为笔位点分子诊断工具,需要简化RNA或DNA的提取。我们成功使用市售的innuPREP MP基础试剂盒a (Jena Analytik, Jena, Germany)和结合蛋白酶K的磁珠分离架从所有样品中提取核酸。提取的核酸可直接用于PCR和RPA检测。我们使用innuPREP MP basic kit A对上述32份临床样本进行的检测结果表明,与德国Roche公司的High Pure Viral Nucleic Acid试剂盒相比,在RT-RPA检测和RT-qPCR检测中表现相同。目前,PPRV RPA检测仍然比LAMP检测和RT-qPCR检测昂贵,但RPA有一些独特的优势,如上所述。随着技术的发展和广泛应用于疾病诊断,RPA的成本应该会逐渐下降。事实上,我们已经成功地将反应体积从原来的50 μL减少到25 μL,从而降低了成本。
结论
所述的PPRV实时RT-RPA和LFS RT-RPA方法在20分钟内快速检测PPRV是敏感和特异性的。使用从临床样本中提取的RNA进行评估表明,与PPRV实时RT-qPCR方法相比,这两种方法的灵敏度约为90%,特异性为100%。结果令人鼓舞,但在考虑将这种测定方法用于常规诊断使用之前,还需要进一步分析来自感染PPRV的动物的大量样本以及不同PPRV谱系II、III、IV分离株。
缩写
- LFS RT-RPA法:
-
逆转录重组酶聚合酶扩增试验与横向流动条带组合
- PPRV:
-
小反刍兽疫病毒
- 实时RT-RPA法:
-
逆转录重组酶聚合酶扩增检测实时荧光检测
- 战:
-
重组酶聚合酶扩增
- RT-LAMP:
-
逆转录环介导的等温扩增
- RT-qPCR:
-
逆转录定量PCR
参考文献
Diallo A, Minet C, Le Goff C, Berhe G, Albina E, Libeau G, Barrett T.小反刍动物害虫的威胁:疾病控制疫苗开发的进展。疫苗。2007;25:5591-7。
Shaila MS, Shamaki D, Forsyth MA, Diallo A, Goatley L, Kitching RP, Barrett T.小反刍动物鼠疫病毒的地理分布与流行病学研究。病毒决议1996;43:149-53。
勒费夫尔PC, Diallo A.小反刍动物。科学通报。1990;9:935-81。
Bailey D, Banyard A, Dash P, Ozkul A, Barrett T.小反刍兽疫病毒全基因组序列,一种麻疹病毒属病毒。病毒决议2005;110:119-24。
李波,李志强。小反刍动物鼠疫病毒传播的进化遗传学研究。动物前沿,2014;4:14-20。
麻疹病毒群:基因组组织和蛋白质。兽医微生物,1990;23:155-63。
Fakri F, Elarkam A, Daouam S, Tadlaoui K, fassii - fihri O, Richardson CD, Elharrak M. VeroNectin-4是一种高敏感性细胞系,可用于小反刍动物鼠疫病毒的分离和滴定。中国生物防治杂志。2016;228:135-9。
Adombi CM, Lelenta M, Lamien CE, Shamaki D, Koffi YM, Traore A, Silber R, Couacy-Hymann E, Bodjo SC, Djaman JA,等。表达绵羊-山羊SLAM蛋白的猴CV1细胞系:从病理标本中分离小反刍动物鼠疫病毒的高敏感细胞系中国病毒学杂志,2011;173:306-13。
Libeau G, Diallo A, Colas F, Guerre L.牛瘟和小反刍动物鼠疫的免疫捕获ELISA快速鉴别诊断。兽医娱乐1994;134:300-4。
Baron J, Fishbourne E, couaccy - hyman E, Abubakar M, Jones BA, Frost L, Herbert R, Chibssa TR, Van't Klooster G, Afzal M,等。小反刍兽疫病毒现场诊断试验方法的研制与试验。跨界新兴杂志,2014;61:390-6。
Dechamma HJ, dige V, Kumar CA, Singh RP, Jagadish M, Kumar S. PPRV核衣壳蛋白高变区t辅助性和线性B表位的鉴定及其在特异性抗体检测病毒抗原中的应用兽医微生物学,2006;118:201-11。
崔KS,罗俊杰,崔CU,高玉杰,孙海杰,Libeau G,姜思成,朱ys。基于单克隆抗体的竞争性ELISA法同时检测牛瘟病毒和小反刍动物鼠疫病毒抗体。兽医微生物学杂志,2003;96:1-16。
王志强,王志强,王志强,等。小反刍动物鼠疫(PPR)病毒单克隆抗体竞争性elisa检测方法的建立。兽医微生物学杂志2004;98:3-15。
李志刚,李志刚,李志刚。小反刍动物鼠疫病毒的聚合酶链反应检测。中华病毒学杂志,2002;10:17 - 25。
Balamurugan V, Sen A, Saravanan P, Singh RP, Singh RK, Rasool TJ, Bandyopadhyay SK.小反刍动物鼠疫病毒的一步式多重RT-PCR检测方法。兽医文献,2006;30:655-66。
鲍健,李林,王震,Barrett T,索林,赵伟,刘勇,刘超,李娟。小反刍动物鼠疫病毒一步实时RT-PCR检测与定量方法的建立。中国病毒学杂志,2008;148:232-6。
Kwiatek O, Keita D, Gil P, Fernandez-Pinero J, Jimenez Clavero MA, Albina E, Libeau G.快速检测PPRV四种基因型的定量一步实时RT-PCR。中国病毒学杂志,2010;
刘志强,李志强,李志强,等。基于SYBR Green I的小反刍动物鼠疫病毒实时RT-PCR检测方法的建立。BMC Vet Res. 2014;10:22。
Batten CA, Banyard AC, King DP, Henstock MR, Edwards L, Sanders A, Buczkowski H, Oura CC, Barrett T.小反刍动物鼠疫病毒的实时RT-PCR检测方法。中国病毒学杂志,2011;171:401-4。
杨晓东,王晓明,王晓明,等。基于SYBR Green I的小反刍动物鼠疫病毒实时RT-PCR检测方法的建立。中国病毒学杂志,2014;209:25-9。
Aebischer A, Wernike K, Hoffmann B, Beer M. Schmallenberg病毒和牛病毒性腹泻病毒基因组的等温扩增和高速实时逆转录酶PCR快速检测中华临床微生物学杂志。2014;52:1883-92。
李玲,鲍娟,吴旭,王铮,王娟,龚敏,刘超,李娟。反转录环介导等温扩增法快速检测小反刍动物鼠疫病毒。中国病毒学杂志,2010;17:37 - 41。
Abd El Wahed A, El- deeb A, El- tholoth M, Abd El Kader H, Ahmed A, Hassan S, Hoffmann B, Haas B, Shalaby MA, Hufert FT, Weidmann M.一种便携式逆转录重组酶聚合酶扩增法快速检测口蹄疫病毒。科学通报。2013;8:e71642。
杨艳,秦晓,王刚,张勇,尚勇,张震。基于荧光探针的Orf病毒重组聚合酶扩增快速检测方法的建立。病毒学报,2015;
沃特斯RA,福勒VL,阿姆森B,尼尔森N,格洛斯特J,帕顿DJ,国王DP。利用反转录环介导的等温扩增结合简单的横向流动检测装置在临床样本中直接检测口蹄疫病毒的初步验证科学通报。2014;9:e105630。
Reid SM, Mioulet V, Knowles NJ, Shirazi N, Belsham GJ, King DP。开发定制的实时RT-PCR检测方法,用于检测和区分在中东流行的O型、A型和亚洲-1型口蹄疫病毒谱系。中国病毒学杂志,2014;207:146-53。
致谢
中国农业科学院创新基金项目和国家研究与发展计划项目(2016YFD0500907)资助。我们感谢伦敦大学学院医学院的张元在编辑方面的帮助。
本文内容仅为作者负责,不代表中国农科院或国家重点研发计划。
作者的贡献
YY、XDQ、ZZ共同构思设计该项目。YY负责研究并撰写稿件,YMS、WZ、YXD、GWH参与样品制备。XDQ、YML、ZZ对稿件进行了修改。ZZ是这个项目的负责人。所有作者都阅读并批准了最终的手稿。
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者信息
作者及隶属关系
相应的作者
额外的文件
附加文件1:图S1。
用3个正向引物(fe1n ~ fe3n)、3个反向引物(re1n ~ re3n)和1个探针(Pe)筛选出扩增量最高的最佳组合。9种不同组合的扩增结果如图所示。(pptx126kb)
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
杨,Y,秦,X,宋,Y。et al。快速检测小反刍动物鼠疫病毒实时和横向流动条形反转录重组酶扩增方法的建立。性研究J14, 24(2017)。https://doi.org/10.1186/s12985-017-0688-6
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12985-017-0688-6
关键字
- 逆转录重组酶聚合酶扩增试验
- RT-RPA
- 横向流条
- PPRV
- 小反刍动物