- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
鸡浮顶出肠的时间转录组分析表明其稳定性和可重复性gydF4y2Ba
兽医研究gydF4y2Ba体积gydF4y2Ba54gydF4y2Ba、物品编号:gydF4y2Ba12gydF4y2Ba(gydF4y2Ba2023gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
类肠是微型自组织三维(3D)组织培养物,复制了肠上皮的许多复杂性。我们最近开发了一个顶出的含白细胞的鸡肠道模型,为探索禽肠道中宿主-病原体相互作用提供了一种新的生理学相关的体外工具。然而,在转录物水平上,复制一致性和培养稳定性尚未得到充分的探索。此外,无法通过顶出小肠的原因尚未确定。在这里,我们报告了鸡胚肠绒毛和鸡肠样培养物的转录谱分析使用大量RNA-seq。生物复制和技术复制肠样培养的转录组比较证实了它们的高可重复性。细胞亚群和功能标记的详细分析表明,成熟的肠样细胞从胚胎后期的肠绒毛分化而来,重现了禽类肠道中存在的许多消化、免疫和肠道屏障功能。这些转录组学结果表明,鸡类肠培养具有很高的可重复性,并且在培养的第一周内,它们在形态上成熟到与体内肠道相似,因此代表了鸡肠的生理相关的体外模型。gydF4y2Ba
介绍gydF4y2Ba
类器官弥合了传统细胞系和体内研究之间的差距,促进了多细胞生物学机制的研究。肠样细胞的转录分析为这些体外培养模型的成熟阶段、功能和反应提供了更好的理解,并为研究罕见的细胞类型提供了机会[gydF4y2Ba1gydF4y2Ba]。一些描述哺乳动物凝胶嵌入类肠的RNA-seq数据集已经发表[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba],但缺乏对禽类肠道培养物转录组的详细分析。大多数对鸡肠道的RNA-seq研究都集中在与能量和营养物质的消化和吸收有关的功能相关基因上[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba]和宿主-病原体反应[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba在成熟的鸟类中。然而,胚胎后期到孵化后的肠道在生长、代谢和发育方面发生了巨大的变化。分析这些关键生命阶段过程中的转录变化有助于找到改善孵化后雏鸡营养和肠道屏障功能的新方法[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba]。gydF4y2Ba
通常,凝胶包埋的肠隐窝进入中央功能性管腔,并由单层高度极化的上皮细胞排列。上皮细胞的顶端刷状边缘面向管腔,基底面与细胞外基质支架接触[gydF4y2Ba3.gydF4y2Ba]。这种“基底向外”的方向意味着不能直接进入与营养物质、毒素和微生物相互作用的管腔表面。Co等。[gydF4y2Ba13gydF4y2Ba研究表明,通过去除细胞外基质,它们可以逆转肠样细胞的上皮极性,使其更容易进入根尖表面。他们的“顶出”方法包括一个初始的包埋步骤,在将人类和小鼠肠道置于Matrigel(一种由恩格尔布雷思-霍姆斯-蜂群小鼠肉瘤细胞分泌的可溶解的细胞外基质)中7-20天,然后将它们放入悬浮液中。第一步似乎是哺乳动物肠道在悬浮液中成功保持其结构完整性所必需的。在悬浮培养中,哺乳动物的肠状体没有存活超过5天,并且在这个方向上通过肠状体的能力似乎不可能。这项技术也在猪肠道中重复,与人类和小鼠培养相似,约20%的肠道没有逆转其极化[gydF4y2Ba14gydF4y2Ba]。这引起了对这些悬浮培养的可重复性的关注,并且在几天后肠道活力丧失,限制了该技术的长期使用(参见[gydF4y2Ba15gydF4y2Ba])。gydF4y2Ba
我们最近发表了一项方案,直接从胚胎肠绒毛尖端培养漂浮的鸟肠,并表明它们反映了鸡肠上皮的细胞多样性和屏障功能[gydF4y2Ba16gydF4y2Ba]。在培养过程中,尖端的上皮被封闭,包围了固有层的内核,这可能提供了许多干细胞生态位因子。这个内核也有助于独特的功能性上皮内和固有层白细胞的存在。这些鸟类肠道发育速度比哺乳动物肠道发育速度快,在培养过程中可存活长达2周。我们也从成熟的鸟类身上培育出了肠道,然而,与从胚胎组织中培育出的肠道相比,它们的寿命和萌芽时间都缩短了,因此我们没有详细探索这些培养物[gydF4y2Ba16gydF4y2Ba]。gydF4y2Ba
为了证明顶出鸡小肠是一种健壮且可重复的细胞培养模型,有必要提供生物重复和实验重复之间转录同质性的证据。使用相同品种和年龄的起始材料(胚胎)和一致的培养条件有助于减少肠道培养物之间的生物变异。然而,不确定个体胚胎之间的遗传和环境变异是否会导致个体生物复制高度异质。由于这些类肠培养物可能是多种营养、药物和宿主-病原体研究的重要体外系统,因此也有必要详细了解它们与体内禽肠的细胞和转录相似性。就像顶端向外的哺乳动物肠道培养一样,尽管进行了许多传代技术和补充生长因子试验,但漂浮的鸡肠道无法无限繁殖。对肠样转录组进行详细的时间顺序研究也可以确定限制其长期培养的分子机制。gydF4y2Ba
在目前的研究中,我们使用从胚胎第18天(ED18)鸡肠绒毛中提取的漂浮的顶端向外的禽类肠道,深入分析了它们在7天培养期间的转录反应。最初的目的是评估重复之间的均匀性,以证明这种培养方法的高度重复性一致性。这些数据还用于确定基因在培养物中稳定表达的时间,并确定实验研究的最佳时间窗口。我们还试图在转录水平上描述类肠的功能成熟与体内肠道孵化后的功能成熟。我们的最终目的是确定浮动的顶端向外的肠状体中可能存在的转录变化,这可能是它们无法无限繁殖的原因。结果表明,鸡样肠培养物具有较高的转录可重复性,在培养的第一周内,样肠在形态上与鸡的肠道相似。因此,鸡的尖向外肠代表了鸡肠的生理相关的体外模型。gydF4y2Ba
材料与方法gydF4y2Ba
动物gydF4y2Ba
肠样试验采用ED18海兰褐鸡(gydF4y2Ba背带吊裤带gydF4y2Ba;孵化前3天),来自英国爱丁堡国家鸟类研究机构。另外,以8周龄海兰褐鸡为对照研究对象。该品种和年龄的成鸡与3r一致,因为它们同时被其他组使用。获得了罗斯林研究所和爱丁堡大学动物福利伦理审查委员会的伦理批准。所有动物都被饲养在英国内政部许可的场所,完全符合1986年动物(科学程序)法的要求,并得到罗斯林研究所动物福利伦理审查委员会的批准。gydF4y2Ba
绒毛分离和肠样培养gydF4y2Ba
分离含有干细胞的禽类ED18肠绒毛并生成漂浮的鸡肠样,方法如前所述[gydF4y2Ba16gydF4y2Ba]。简而言之,死后切除小肠(从十二指肠到回盲结),切成5毫米的切片,在Ca中清洗gydF4y2Ba2 +gydF4y2Ba-和MggydF4y2Ba2 +gydF4y2Ba无磷酸盐缓冲盐水(PBS)。组织在Dulbecco 's Modified Eagle 's Medium (DMEM) (Thermo Fisher Scientific (TFS))中用0.2 mg/mL的胶原酶消化gydF4y2Bahistolyticum梭状芽胞杆菌gydF4y2BaIA型(默克),37°C, 50分钟。大力摇动试管,收集上清,重复这些步骤,产生4个馏分。馏分在100℃下离心gydF4y2BaggydF4y2Ba4分钟后,隐窝/绒毛涂于含有10 mM HEPES (TFS)、2 mM l -谷氨酰胺(TFS)、50 U/mL青霉素/链霉素(默克)和2% B27补充剂(50X)的Advanced DMEM/F12 (TFS)中。TFS)。在37°C, 5% CO条件下进行禽类肠道培养gydF4y2Ba2.gydF4y2Ba
RNA-seq实验设计gydF4y2Ba
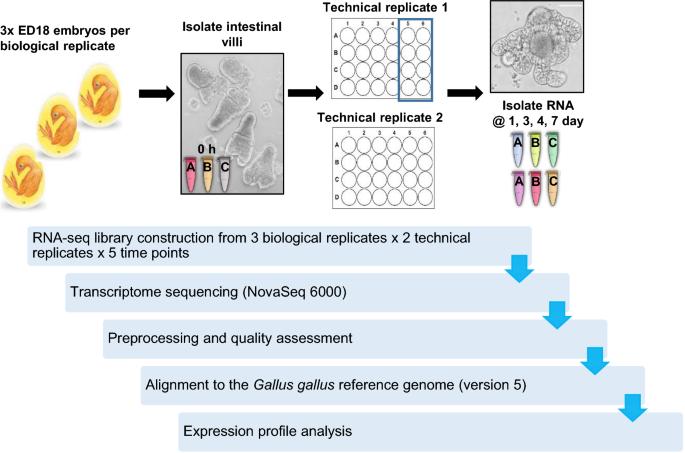
采用3个生物重复(每个培养由3 × ED18 hyline鸡组成)进行RNA-seq分析。这是为了在每个时间点为每个技术复制提供足够的ED18肠样样本。从每个生物重复中分离的绒毛(100绒毛/孔)播种在两个相同的24孔组织培养板上,在相同的条件下培养。每个培养板作为一个技术重复,因此每个生物重复有2个技术重复。收集样本时,在每个时间点(培养0小时、1天、3天、4天和7天的新鲜分离绒毛)收集每板8孔,并汇集成一个样本进行转录组学分析。gydF4y2Ba
RNA测序与分析gydF4y2Ba
提取肠样总RNA,评估其质量和浓度。通过磁带站对样品进行技术验证,证实其具有良好的RNA完整性(RIN 6.1-9.6)和浓度(104-427 ng/µL)(附加文件)gydF4y2Ba1gydF4y2Ba).如前所述,对文库进行测序,对reads进行修剪和对齐[gydF4y2Ba16gydF4y2Ba]。简而言之,使用Cutadapt对获得的reads进行修剪以保证质量,并去除接头序列。修剪后的读数要求至少长度为50个碱基。来自Illumina测序的成对末端reads与gydF4y2Ba背带吊裤带gydF4y2Ba基因组(Gallus_gallus-5.0)用于计数的注释是该引用的标准gtf格式注释(注释v91)。使用featurecots软件(v1.5.2)获得每个注释基因的原始计数。gydF4y2Ba
主成分分析(PCA)是使用从未合并的技术复制规范化和过滤的表达数据构建的。gydF4y2BaPgydF4y2Ba-值通过方差分析(ANOVA)检验获得,该检验评估了主成分连续值范围与分类实验变量(组、池和时间)之间的关联。差异基因表达分析如前所述[gydF4y2Ba16gydF4y2Ba],在Bioconductor edgeR软件包(v3.16.565)中进行简短的差异基因表达分析。培养后0 ~ 7 d的胚胎肠样转录组比较显示,技术重复之间无差异表达基因(FDR < 0.05),证明了肠样系统的一致性和可重复性。EdgeR中的sumTechReps函数用于合并技术复制。对原始计数表进行过滤,去除主要由接近零计数组成的基因,对每百万计数(CPM)进行过滤,以避免由于文库深度造成的伪影。采用似然比检验对差异表达进行统计学评价。差异表达基因定义为FDR < 0.05, logFC > 2。使用热图包(v1.0.1066)在R中构建热图。gydF4y2Ba
将带注释的新鲜分离绒毛(0 h)和肠样RNA序列归一化数据集导入生物信息学工具Graphia (Kajeka, Edinburgh, UK) [gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba],并按前面描述的方法计算成对转录本到转录本的Pearson相关矩阵[gydF4y2Ba2gydF4y2Ba]。在这部分分析中,合并了技术重复(由于没有COB_2_168小时样本,因此取平均值而不是求和)。Pearson相关系数的截止阈值为gydF4y2BargydF4y2Ba选择≥0.95。使用Markov聚类算法,以膨胀值2.2(决定聚类粒度)对结果图进行聚类。人工将前50个聚类(按基因数量)按培养时间点划分为相似的基因表达谱,并在网络图上确定每个聚类的位置。gydF4y2Ba
为了能够对集群进行功能性注释和解释,使用分子特征数据库(Molecular Signatures Database)识别每个表达谱组中前20个显著过度代表的基因本体(GO) [gydF4y2Ba20.gydF4y2Ba]。为了被认为是重要的,一个过度代表的GO术语需要一个超几何的gydF4y2BaPgydF4y2Ba< 0.05, FDR < 0.05。当相同的基因在集群中代表几个GO术语时,只选择最重要的基因进行进一步考虑。使用文献综述、京都基因与基因组百科全书(KEGG)通路数据库和GeneCards数据库,还评估了RNA-seq规范化数据集中相关的单个基因的细胞功能和活性。使用phatmap包(v. 1.0.10)在R中构建热图[gydF4y2Ba21gydF4y2Ba]。gydF4y2Ba
RT-qPCRgydF4y2Ba
提取肠样总RNA,评估其质量和浓度。使用SuperScript IV反转录试剂盒(Invitrogen)根据制造商的说明进行第一链cDNA合成。qPCR和qPCR引物设计参照Borowska等人的描述。[qh]gydF4y2Ba22gydF4y2Ba]。在附加文件中描述了引物gydF4y2Ba2gydF4y2Ba。gydF4y2Ba
透射电子显微镜gydF4y2Ba
肠样和绒毛在3%戊二醛中固定,0.1 M钙酸钠缓冲液pH 7.3,固定2小时,并按上述方法处理[gydF4y2Ba16gydF4y2Ba]。超薄切片(60 nm)用醋酸铀酰和柠檬酸铅染色,使用JEOL JEM-1400 Plus TEM成像,并使用ImageJ (v1.52e, Fiji)进行分析。gydF4y2Ba
全载免疫组化染色gydF4y2Ba
用于免疫组织化学的一抗和二抗的来源、克隆数和浓度的详细信息在附加文件中提供gydF4y2Ba3.gydF4y2Ba。如前所述,小肠固定、阻塞、染色和安装[gydF4y2Ba16gydF4y2Ba]。使用LSM710或LSM880共聚焦显微镜(蔡司)观察样品,使用ImageJ v1.52e进行处理。gydF4y2Ba
增殖通过5-乙基-2 ' -脱氧尿苷(EdU)掺入试验进行评估,如前所述[gydF4y2Ba16gydF4y2Ba]。gydF4y2Ba
统计和可重复性gydF4y2Ba
图例提供了样本量、重复、重复次数和统计数据的大部分细节。除非另有说明,实验数据至少代表3个独立培养,每个培养包含2-3个胚胎。每个组织学样本使用4个池孔,每孔约100个肠样。所有的测量数据都是从不同的样品中记录的。gydF4y2Ba
在RNA-seq数据中,每个RNA样本由8个池孔组成,每个孔含有约100个肠样。采用方差分析检验比较主成分连续值范围与分类实验因素之间的相关性。使用准似然f检验对RNA-seq差异表达数据进行统计评估,该检验解释了估计每个基因分散的不确定性。在RNA-seq网络分析中,使用Pearson相关系数来衡量基因/转录本之间线性关系的强度和方向。gydF4y2Ba
数据记录gydF4y2Ba
本研究的mRNA表达数据集已在EMBL-EBI的欧洲核苷酸档案(ENA)中保存,登录号为PRJEB37491和PRJEB51227。gydF4y2Ba
结果gydF4y2Ba
转录组学分析表明肠样培养具有很高的可重复性gydF4y2Ba
肠样培养物是由单个胚胎的分离绒毛制备的,如[gydF4y2Ba16gydF4y2Ba],将3个独立的培养物合并成1个生物重复,每个培养物在分离绒毛后分成2个技术重复(图2)gydF4y2Ba1gydF4y2Ba).在培养0 h(新鲜分离的ED18肠绒毛)和培养1、3、4和7 d时收集转录组分析样本。选择第1天的时间点是因为它代表了肠样最初快速和主要形态变化的时间,选择第3天和第4天的时间点是因为此时培养物在形态上更加稳定,而7天的时间点是感兴趣的,因为这个时间点通常用于基底外肠样的传代。gydF4y2Ba
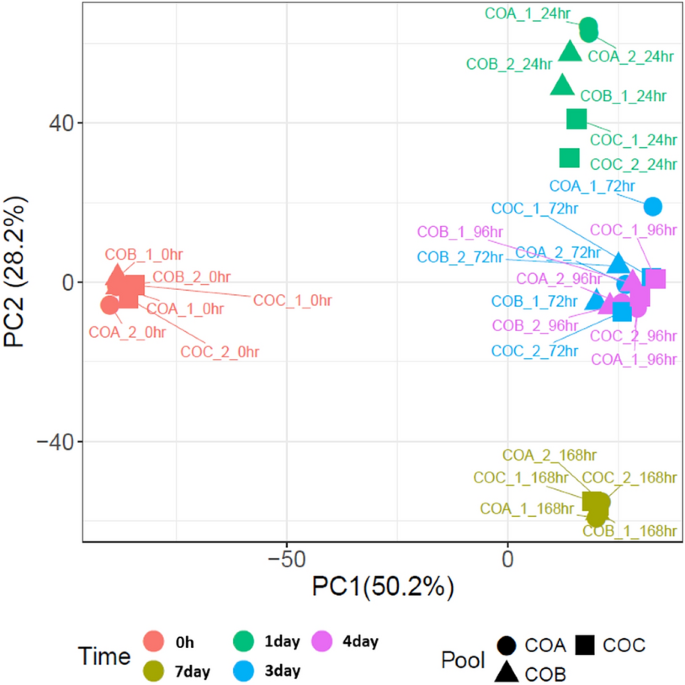
为了评估培养的可重复性,使用PCA比较了生物和技术复制全球转录谱的异质性程度。这表明生物复制和技术复制在时间点上紧密聚集(图2)gydF4y2Ba2gydF4y2Ba),证实肠道培养复制的整体转录组高度一致。在PC1和2图中,每个时间点和时间的技术重复是样本之间差异的主要驱动因素,显示每个时间点的生物重复和技术重复在图上的独立位置聚集,除了3天和4天的重复占据相同的区域,这表明它们共享相似的全球转录谱。然而,ED18肠绒毛(0 h)聚集在左侧,肠样时间点(1-7天)聚集在PC1轴右侧,这可能代表了从体内生长到体外培养的初始变化。gydF4y2Ba
早期肠道培养继续快速发展,如在小鸡中所见gydF4y2Ba
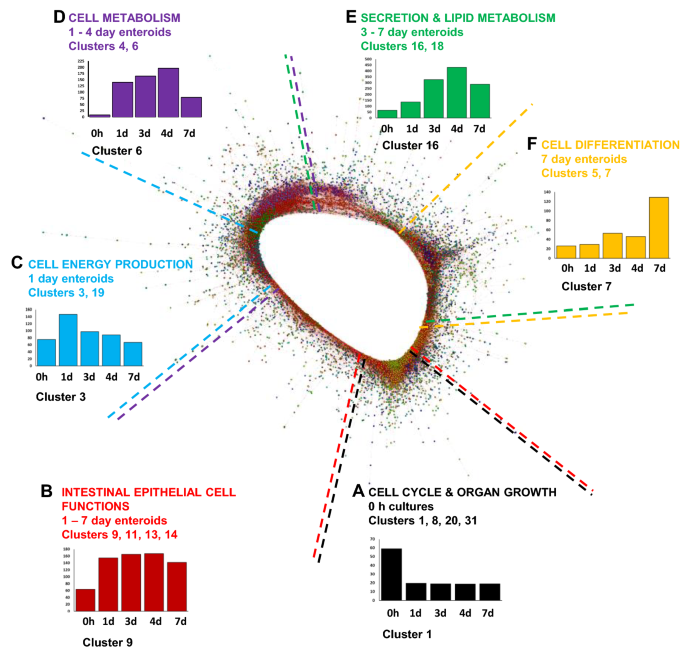
接下来,利用生物信息学工具Graphia创建了基因-基因相关网络图,以探索培养过程中肠样的功能成熟。使用Pearson相关阈值r≥0.95计算每个mRNA-seq数据集上每个转录本的基因-基因相关矩阵。得到的网络图如图所示gydF4y2Ba3.gydF4y2Ba包含在所有数据集中具有相似共表达谱的基因组(簇),r≥0.95。前50个基因簇(包含≥17个基因)中的基因在附加文件中显示gydF4y2Ba4gydF4y2Ba。具有相似平均表达谱的聚类通常占据网络图的相似区域。这些簇主要在0 h表达(图2)gydF4y2Ba3.gydF4y2BaA)与细胞周期和器官生长相关,而集群主要在1-7天的肠道中以较高水平表达(图2)gydF4y2Ba3.gydF4y2BaB)与肠上皮细胞特异性功能相关。与细胞能量产生和细胞代谢相关的簇在培养1 - 4天主要表达,而在培养细胞3-7天主要表达的簇在培养1 - 7天与分泌和脂质代谢相关(图2)gydF4y2Ba3.gydF4y2Ba一部)。簇主要在7天肠道中表达(图2)gydF4y2Ba3.gydF4y2BaF)主要与细胞分化有关。gydF4y2Ba
网络图中最大的50个聚类的平均基因表达谱和代表性的人类GO术语富集注释在附加文件中提供gydF4y2Ba5gydF4y2Ba和gydF4y2Ba6gydF4y2Ba。为了便于参考,我们创建了一份来自精选集群的氧化石墨烯术语富集注释摘要,其中突出了肠道培养时间点内细胞周期、组织发育和细胞功能的过程和功能(表1)gydF4y2Ba1gydF4y2Ba和gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
0小时时间点(新分离的绒毛)表示胚胎肠后期的快速发育阶段,因此与组织发育相关的GO术语在绒毛相关的集群中占主导地位,包括细胞分化、器官生长和细胞周期的调节(表1)gydF4y2Ba1gydF4y2Ba).更详细地分析细胞周期相关的簇1,多个个体基因也在KEGG中表现出来gydF4y2Ba背带吊裤带gydF4y2Ba细胞周期通路图,如细胞周期蛋白依赖性激酶1 (gydF4y2BaCDK1gydF4y2Ba),gydF4y2BaWEE1gydF4y2Ba,细胞分裂周期25A (gydF4y2BaCDC25AgydF4y2Ba),真核生物翻译终止因子1 (gydF4y2BaERF1gydF4y2Ba)(图gydF4y2Ba4gydF4y2Ba、附加文件gydF4y2Ba4gydF4y2Ba).与细胞周期相关的氧化石墨烯术语也在1-4天的肠样细胞群中发现(表2)gydF4y2Ba2gydF4y2Ba).此外,许多在0 h和1 d肠道中富集的基因也在与转录和翻译调控相关的GO术语中表示,包括翻译起始、肽生物合成过程和RNA加工(表1)gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
在1天肠道内高度表达的簇3包含与细胞能量产生相关的氧化石墨烯相关的基因,如前体代谢物和能量的产生以及三磷酸腺苷(ATP)代谢过程(表1)gydF4y2Ba2gydF4y2Ba).这一转录分析证实,正如预期的那样,细胞增殖在肠道培养的最初几天尤为普遍,这一时间框架也反映了孵化后小鸡肠道在体内的快速发育。与转录分析一致,类肠培养物的EdU +染色显示增殖细胞的百分比从14小时的近10%下降到培养7天后的5%(附加文件)gydF4y2Ba7gydF4y2Ba, (gydF4y2Ba16gydF4y2Ba])。gydF4y2Ba
肠样细胞培养表明肠道干细胞稳态途径的表达延长gydF4y2Ba
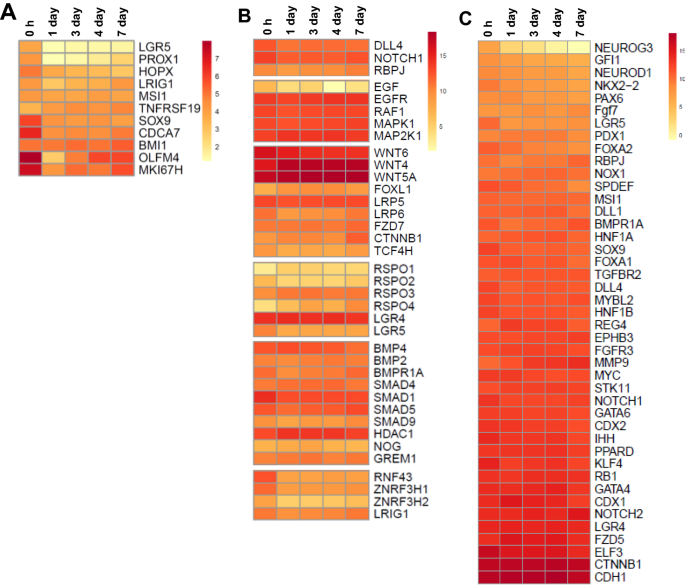
肠干细胞(ISC)的维持对于肠样培养至关重要,并且在很大程度上依赖于无翼相关整合位点(WNT)信号通路。绒毛分离后不久,一些ISC相关基因的表达比1天肠道高,这很可能反映了ED18绒毛中ISC的相对丰度(图2)gydF4y2Ba5gydF4y2BaA、附加文件gydF4y2Ba8gydF4y2Ba).此外,许多ISC和WNT信号通路基因在肠道中稳定表达,包括gydF4y2BaWNT4gydF4y2Ba和gydF4y2BaWNT5a,gydF4y2Ba两者均由小鼠间充质细胞表达(图2)gydF4y2Ba5gydF4y2BaB、附加文件gydF4y2Ba8gydF4y2Ba, (gydF4y2Ba23gydF4y2Ba])。阴性WNT调节因子(如锌和无名指3h1)下调7-17倍(gydF4y2BaZNRF3H2 ZNRF3H1),gydF4y2Ba无名指蛋白43 (gydF4y2BaRNF43gydF4y2Ba),与0小时相比(图gydF4y2Ba5gydF4y2BaB).然而,几个ISC标记,如gydF4y2BaOLFM4gydF4y2Ba和体内平衡因素,比如gydF4y2BaWNT6gydF4y2Ba通常由小鼠隐窝中的Paneth细胞产生[gydF4y2Ba24gydF4y2Ba],与0 h相比,肠样蛋白明显下调(图gydF4y2Ba5gydF4y2BaA和B;额外的文件gydF4y2Ba9gydF4y2Ba).这种表达减少很可能反映了肠样细胞在培养中成熟时绒毛干细胞群的稀释,但也可能表明活性降低。然而,大多数这些ISC基因和相关的稳态因子的表达随后在后来的培养时间点保持稳定。gydF4y2Ba
类肠培养可复制肠上皮细胞的多样性gydF4y2Ba
在整个培养过程中,在肠样细胞中发现了与哺乳动物潘氏细胞、杯状细胞、肠细胞、肠内分泌、转运扩增、肠干和簇状细胞相关的特征性基因集的表达。此外,大多数上皮细胞类型的转录组在此期间保持相对稳定。然而,与肠内分泌细胞分化相关的基因表达减少,包括神经原素3 (gydF4y2BaNEUROG3gydF4y2Ba;15倍)和叉头箱A2 (gydF4y2BaFOXA2gydF4y2Ba;双重的)(图gydF4y2Ba5gydF4y2BaC)gydF4y2Ba。gydF4y2Ba此外,上皮分化标志物碱性磷酸酶(gydF4y2BaALPPgydF4y2Ba)随着时间的推移而减少。总之,转录组分析表明,类肠培养物的细胞多样性与胚胎肠相似。gydF4y2Ba
肠样培养物形成刷状边界gydF4y2Ba
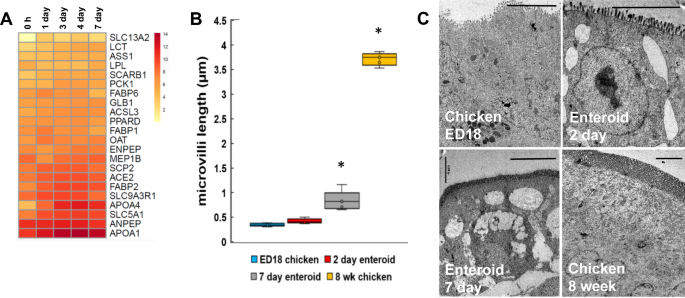
为了证实这种体外肠道模型是否代表了体内功能的典型阵列,我们还研究了转录组在基因水平上的吸收和消化证据。与0小时(新鲜分离的绒毛)相比,在肠样数据集中主要表达的基因表达簇显著富集了与细胞脂质代谢过程、乳糜微粒组装、细胞蛋白质分解代谢过程和甘油脂代谢过程相关的氧化石墨烯基因(表1)gydF4y2Ba2gydF4y2Ba).更详细地观察肠样中小肠消化相关基因,在样本时间点上,许多基因的表达相对稳定,包括刷状边界酶,如乳糖酶(gydF4y2Ba临床上gydF4y2Ba)和溶质载体族gydF4y2BaSLC13A1gydF4y2Ba,以及参与脂肪代谢的蛋白质,如载脂蛋白gydF4y2BaAPOA1gydF4y2Ba和gydF4y2BaAPOA4gydF4y2Ba(脂质转运),脂肪酸结合蛋白gydF4y2BaFABP2gydF4y2Ba(脂肪酸运输)和甾醇载体蛋白gydF4y2BaSCP2gydF4y2Ba(胆固醇摄取和运输)(图gydF4y2Ba6gydF4y2Ba) (gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba]。gydF4y2Ba
肠样培养物发育和功能的单基因分析gydF4y2Ba。的表达gydF4y2Ba一个gydF4y2Ba采用RNA测序法分析培养1、3、4、7 d时ED18肠绒毛(0 h)和肠样中消化相关基因。热图显示平均相对表达水平(loggydF4y2Ba2gydF4y2Ba一系列哺乳动物基因集的每百万次读取数。RNA测序数据代表3个独立实验,每个实验包括2个技术重复,每个重复包含3个胚胎gydF4y2Ba。gydF4y2BaBgydF4y2BaTEM图像定量测定ED18肠、3、7日龄肠和8周龄鸡肠的微绒毛长度平均3次培养,含2-3个胚胎。*gydF4y2BaPgydF4y2Ba< 0.05,未配对学生gydF4y2BatgydF4y2Ba-测试和ED18的比较。gydF4y2BaCgydF4y2Ba具有代表性的TEM图像显示了ED18肠、2日龄和7日龄鸡肠以及8周龄鸡肠的微绒毛长度。比例尺:4µm。gydF4y2Ba
在7天的肠道中,与氧化石墨烯术语“细胞投射组织”相关的基因表达可能反映了微绒毛的发育,微绒毛是增加肠上皮分泌和吸收表面积的必要结构。为了确认顶端向外的小肠微绒毛是否在体外继续发育,在透射电镜图像中测量了它们在培养期间的长度。该分析显示,与ED18肠道相比,培养7天后肠样细胞表面的微绒毛增加了一倍(图2)gydF4y2Ba6gydF4y2BaB和C)。这种形态分析以及转录组数据表明,在培养过程中,肠样体在孵化后具有消化功能。gydF4y2Ba
综合固有层组件的开发gydF4y2Ba
ED18绒毛的分离和漂浮培养条件导致了具有固有层核心的尖向外的肠样表型[gydF4y2Ba16gydF4y2Ba]。在体内,固有层由多种成分组成,包括免疫活性细胞、肠神经系统成分(胶质细胞和神经元轴突)和间充质细胞。与此相一致的是,与免疫系统发育和功能相关的氧化石墨烯术语在整个培养期间都被表示出来(表1)gydF4y2Ba1gydF4y2Ba和gydF4y2Ba2gydF4y2Ba).在所有的时间点上都有代表几种淋巴细胞群的基因,包括T细胞、B细胞、巨噬细胞、树突状细胞和NK细胞gydF4y2Ba10gydF4y2Ba),与肠样细胞中CD45 +淋巴细胞的检测一致(附加文件gydF4y2Ba10gydF4y2Ba).随着时间的推移,与先天免疫功能相关的基因表达也相对稳定,尽管在培养过程中,随着时间的推移,有些基因增加,有些基因减少(图2)gydF4y2Ba7gydF4y2Ba一个;额外的文件gydF4y2Ba9gydF4y2Ba),例如模式识别受体(toll样受体3 (gydF4y2BaTLR3gydF4y2Ba)增加,而细胞因子受体基因gydF4y2BaIL20RBgydF4y2Ba减少,gydF4y2BaIL1BgydF4y2Ba抗微生物酶亲和素(gydF4y2BaAVDgydF4y2Ba)增加。gydF4y2Ba
鸡肠固有层细胞类型鉴定gydF4y2Ba。的表达gydF4y2Ba一个gydF4y2Ba先天免疫功能相关基因;gydF4y2BaBgydF4y2Ba神经胶质细胞,gydF4y2BaEgydF4y2Ba间充质细胞,gydF4y2BaJgydF4y2Ba平滑肌基因gydF4y2BaKgydF4y2Ba采用RNA测序方法比较新鲜分离绒毛(0 h)、1、3、4和7 d鸡肠道发育基因集。热图显示平均相对表达水平(loggydF4y2Ba2gydF4y2Ba一系列哺乳动物基因集的每百万次读取数。RNA测序数据代表3个独立实验,每个实验包括2个技术重复,每个重复包含3个胚胎。gydF4y2BaCgydF4y2Ba- - - - - -gydF4y2BaDgydF4y2Ba,gydF4y2BaFgydF4y2Ba- - - - - -gydF4y2Ba我gydF4y2Ba鸡小肠固有层细胞群标记(绿色)和DAPI(蓝色)和Phalloidin(红色)反染的共聚焦图像。培养2天后肠样染色(gydF4y2BaCgydF4y2Ba,gydF4y2BaDgydF4y2Ba) HuC/HuD(绿色,胶质细胞),(gydF4y2BaFgydF4y2Ba,gydF4y2BaGgydF4y2Ba)静脉蛋白(绿色,间充质细胞),(gydF4y2BaHgydF4y2Ba,gydF4y2Ba我gydF4y2Ba) β iii -微管蛋白(绿色,间充质细胞)。比例尺:20µm。图像代表了至少3个独立培养的数据,每个培养包含2-3个胚胎。gydF4y2Ba
肠道神经系统和肌层粘膜的发育在0小时的转录组中得到了体现,许多与神经元投射、突触和肌肉细胞增殖相关的氧化石墨烯基因的表达,这是胚胎成熟后期的预期结果(表1)gydF4y2Ba1gydF4y2Ba).对绒毛相关簇20内基因的进一步分析证实,存在许多基因编码与突触信号传导、神经传递、神经元生长相关的蛋白质,以及一些基因编码配体或电压门控离子通道gydF4y2Ba1gydF4y2Ba,集群20)gydF4y2Ba。gydF4y2Ba胶质细胞标记基因在肠样中稳定表达(图2)gydF4y2Ba7gydF4y2BaB),并通过HuC/HuD染色进一步证实肠神经系统的存在,HuC/HuD是一种泛神经元标记物,用于标记神经元和胶质细胞。多个HuC/HuD +细胞被鉴定为分散的个体(图2)gydF4y2Ba7gydF4y2BaC)或群集(图gydF4y2Ba7gydF4y2BaD)贯穿2天肠道的中央核心。由于固有层中不存在神经元细胞体,因此这些可能是胶质细胞群,反映了细胞和组织的特征空间分布模式[gydF4y2Ba27gydF4y2Ba]。gydF4y2Ba
Vimentin是间充质细胞的主要细胞骨架成分,与其他间充质标记物一起在肠样培养物中高度表达(图2)gydF4y2Ba7gydF4y2BaE)。因此,Vimentin阳性染色细胞仅限于肠固有层核心(图2)gydF4y2Ba7gydF4y2BaF和G)。β iii -微管蛋白通常被用作神经元分化标志物,但也被证明在其他细胞类型中表达,包括间充质干细胞和血管周围细胞[gydF4y2Ba28gydF4y2Ba,gydF4y2Ba29gydF4y2Ba]。由于肠道神经元体位于粘膜下神经节[gydF4y2Ba30.gydF4y2Ba],类肠核心散乱分布的β iii -微管蛋白+细胞很可能是典型核周染色的间充质干细胞的代表(图2)gydF4y2Ba7gydF4y2BaH和I)。gydF4y2Ba
平滑肌纤维、血液和淋巴管通常存在于绒毛核心内(图2)gydF4y2Ba7gydF4y2BaJ)。在培养的第7天,与血管形态发生和上皮或内皮管发育相关的氧化石墨烯术语高度富集(表1)gydF4y2Ba2gydF4y2Ba).血管生成、血管生成和内皮细胞生长的主要因素是血管内皮生长因子A (gydF4y2BaVEGFAgydF4y2Ba),它由包括巨噬细胞在内的许多细胞类型产生,其转录水平在类肠培养物中稳定表达(图2)gydF4y2Ba7gydF4y2Ba对肠道发育特异性相关基因的分析表明,许多基因通过类肠培养具有稳定的转录水平(图2)gydF4y2Ba7gydF4y2BaK) (gydF4y2Ba26gydF4y2Ba]。这项工作为肠道核心提供了彻底的转录组学验证,并为未来在转录组学、蛋白质组学和功能水平上确定肠道细胞群体的完整多样性奠定了基础。gydF4y2Ba
7天肠样无上皮-间质转化迹象gydF4y2Ba
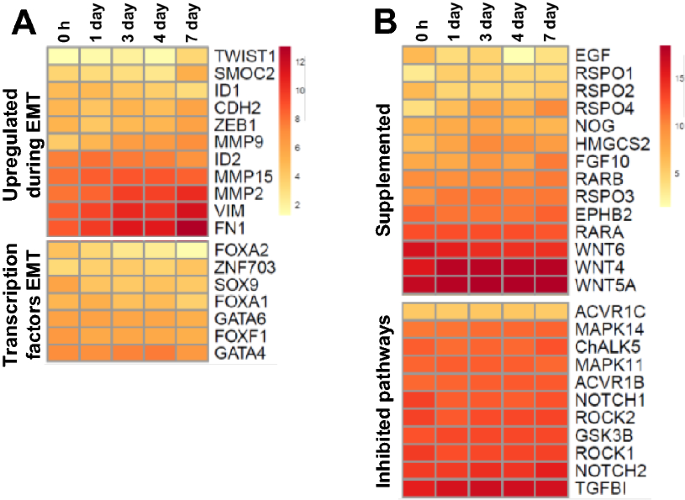
虽然漂浮的鸡肠样培养物在没有外部补充的情况下发育出大量的绒毛样结构,但它们不是长期可行的。我们之前的研究表明,这些肠道培养没有显示出细胞应激相关基因的普遍增加,这表明培养条件不会导致过度的细胞凋亡或坏死[gydF4y2Ba16gydF4y2Ba]。因此,肠道寿命缩短的一个可能原因可能是细胞类型和功能的改变。在上皮-间充质转化(EMT)过程中,上皮细胞获得间充质成纤维细胞样特性,失去顶基极性,削弱细胞-细胞连接,重新排列细胞骨架并获得增加的能动性。gydF4y2Ba31gydF4y2Ba])。EMT会发生在一些哺乳动物的基底外肠中,除非有特异性抑制转化生长因子β (TGFβ)和p38丝裂原活化蛋白激酶(MAPK)途径来阻断这种活性。因此,我们比较了7天和4天肠道中的差异表达基因(FDR < 0.05,最小logFC > 1),以确定与EMT和上皮迁移相关的基因是否存在显著上调。该分析显示成纤维细胞活化蛋白(gydF4y2BaFAPgydF4y2Ba)、肝细胞生长因子(gydF4y2BaHGFgydF4y2Ba)和整合素亚基A4 (gydF4y2BaITGA4gydF4y2Ba)(附加文件gydF4y2Ba9gydF4y2Ba).对EMT期间普遍上调的基因的分析显示,在肠样时间点上表达稳定,尽管一些基因的表达存在显著差异,但时间点之间的折叠变化很低(图2)gydF4y2Ba8gydF4y2BaA和附加文件gydF4y2Ba9gydF4y2Ba).emt相关转录因子也有类似的稳定表达(图2)gydF4y2Ba8gydF4y2BaA、附加文件gydF4y2Ba9gydF4y2Ba),在培养的第7天,上皮的持续发育,包括微绒毛的延长和消化功能仍然很明显(图2)gydF4y2Ba5gydF4y2BaC和gydF4y2Ba7gydF4y2Baa - c)。这表明,缺乏长期生存能力和通过肠道的能力不太可能是由EMT介导的。gydF4y2Ba
为了确定补充生长因子和/或抑制分子(哺乳动物培养物中的典型目标)的缺乏是否可能是培养物寿命缩短的原因,比较了0 h(新鲜分离的绒毛)和鸡肠样蛋白之间编码关键因子的基因表达(图1)gydF4y2Ba8gydF4y2BaB)。除表皮生长因子(表皮生长因子)(gydF4y2Ba表皮生长因子gydF4y2Ba),gydF4y2BaWNT6gydF4y2Ba和r -反应蛋白2 (gydF4y2BaRSPO2gydF4y2Ba),与0小时相比,肠样蛋白下调。值得注意的是gydF4y2BaMAPK14gydF4y2Ba和gydF4y2BaMAPK11gydF4y2Ba哪些是p38mapk抑制剂的靶点gydF4y2BaTGFB1gydF4y2Ba和含有蛋白激酶1 (gydF4y2BaROCK1gydF4y2Ba)也稳定表达。总之,EMT和生长因子缺乏都不太可能导致小肠无法通过,需要进一步的研究来确定原因和缓解这一长寿问题的潜在解决方案。gydF4y2Ba
讨论gydF4y2Ba
通过对漂浮禽肠样和ED18肠绒毛(0 h)样本的转录组分析,证明了基因表达在培养物内部和培养物之间的可重复性,显示了胚胎肠样在培养物中成熟到孵化后的功能,并探讨了顶朝外的肠样培养物面临的繁殖问题。gydF4y2Ba
为了支持基于细胞的实验的可重复性,任何组织培养模型的理想特性是培养一致性。这在多细胞复杂类器官模型中尤为重要。肠样RNA-seq分析表明,样品转录组差异的主要原因是培养时间,技术复制和生物复制之间的总体转录活性高度相似。正如自然变异的生物不同样本所期望的那样,PCA中鉴定的生物复制转录组存在细微差异[gydF4y2Ba32gydF4y2Ba]。供体基因型、微生物组和疾病状态的个体差异已被证明会影响类肠培养物的上皮表型[gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba]。与野鸡品种相比,商品蛋鸡品系的基因型多样性相当低,因此基因型变异对hyline鸡类肠培养物的影响应该很小[gydF4y2Ba36gydF4y2Ba]。虽然有些禽流感病毒可以垂直传播,但利用胚胎后期绒毛培养肠道培养物也减少了供体感染影响培养物表型的机会[gydF4y2Ba37gydF4y2Ba]。微生物组对培养物的影响将是有限的,因为禽肠大多是在孵化后定植的,因此可以使用类肠进行微生物组-宿主相互作用的研究。然而,确保肠样试验中有足够数量的生物重复将提高统计检验的效率。gydF4y2Ba
ED18肠绒毛和肠样样本向PC1轴两侧的分化,凸显了它们在整体基因表达谱上的显著差异。这种差异可能部分是由于对体外培养环境的适应,体外培养环境不能复制影响肠道发育和成熟的所有体内因素,包括正在发育的微生物组。此外,部分原因可能是由于胚胎绒毛迅速发育出芽肠。在孵化后的最初24小时内,鸡小肠粘膜形态发生了显著变化,包括密集的隐生和绒毛长度的急剧增加[gydF4y2Ba10gydF4y2Ba,gydF4y2Ba38gydF4y2Ba]。生长中的鸡肠也表现出类似的形态变化,绒毛片段在出膜后数小时内迅速闭合,并在1天内发育出多个芽,在接下来的几天内继续延长[gydF4y2Ba16gydF4y2Ba]。随着快速生长,1天肠样转录组表明许多参与发育、增殖和分化的基因上调。体外模型的可重复性对于稳健的分析非常重要,并且肠样细胞在培养的前7天内显示出稳定的细胞分化转录谱和大多数ISC稳态基因集,其中3-4天特别稳定[gydF4y2Ba39gydF4y2Ba]。然而,尽管在培养期间观察到稳定的表达,但与培养的肠相比,新鲜分离的绒毛中ISC基因的基因表达明显减少。这是否与分离步骤、增殖过程中基因表达的稀释或干细胞的减少有关,还需要进一步研究。张及黄[gydF4y2Ba40gydF4y2Ba在0-7日龄的孵化后雏鸡中,OLFM4的表达增加,表明这种ISC标记物可能在肠道成熟中发挥作用。gydF4y2Ba
作为一个早熟的物种,在形态变化的同时,鸡的肠道消化和吸收营养的能力也迅速增强,使鸡在孵化后不久就有了一个几乎完全成熟的肠道[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba38gydF4y2Ba,gydF4y2Ba41gydF4y2Ba]。例如,在孵化后的鸡体内,刷边酶的活性迅速增加,肠道也反映了这一点,某些刷边酶基因的表达增加[gydF4y2Ba38gydF4y2Ba]。肠内营养物质的消化和吸收主要集中在脂类,而不是其他大量营养物质。这反映了孵化后的小鸡肠道,在这个年龄,由于蛋黄是孵化后72小时内重要的营养来源,因此脂肪酸的摄取比葡萄糖或氨基酸有选择性的层次结构[gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba]。尽管转录差异并不一定等同于功能意义,但鸡小肠中消化相关基因和相关通路的强烈表达强烈表明,体外条件包含孵化后成熟的重要线索,并与孵化后小肠的转录组学分析相对应[gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba]。gydF4y2Ba
尽管有能力连续传递凝胶包埋的鸡肠球(用这种技术观察到的分化差的球形结构的类器官命名法),但目前没有证据表明有能力传递漂浮的肠样培养物[gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba46gydF4y2Ba,gydF4y2Ba47gydF4y2Ba]。在漂浮的鸡肠道中进行了各种试验,但没有发现通过后还会继续发芽[gydF4y2Ba16gydF4y2Ba]。阻断p38MAPK和TGF-β通路在人、牛和猪凝胶包埋的肠样培养物中是必要的,部分是为了帮助保护其中的细胞免受EMT的影响。gydF4y2Ba4gydF4y2Ba,gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba,gydF4y2Ba50gydF4y2Ba]。然而,p38MAPK和TGF-β分子抑制剂在漂浮鸡肠样培养基中的试验并未显示出传代后生长或出芽的改善[gydF4y2Ba16gydF4y2Ba]。小鼠肠道培养需要主动补充TGF-β,以诱导EMT模型,表明这些途径的物种特异性差异,可能也存在于鸡中[gydF4y2Ba51gydF4y2Ba]。gydF4y2Ba
通过对鸡尖向外肠样和ED18肠绒毛样本的转录组比较,我们构建了发育中的鸡肠样和晚胚鸡肠中基因表达模式的详细图谱。这证明了该培养模型的一致性,并确定了消化功能和器官发育等多个关键肠道功能属性的特征。肠样已被证明具有转录稳定的时间框架,在此期间它们在形态上成熟,这表明了进行生理学相关实验的有用培养阶段。虽然类肠不具有繁殖能力,但这些结果表明,这种独特的模型是孵化后鸡肠道研究的适当体外工具,例如宿主-病原体相互作用,以前不可培养的微生物的生长,品种表型和营养研究,以及饲料添加剂和热应激试验(参见[gydF4y2Ba52gydF4y2Ba])。向更广泛的科学界介绍鸡小肠和鸡肠绒毛ED18转录组,将为未来的禽类肠道研究提供宝贵的资源。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
本研究的mRNA表达数据集已在EMBL-EBI的欧洲核苷酸档案(ENA)中保存,登录号为PRJEB37491和PRJEB51227。本研究中使用和/或分析的数据集可根据通讯作者的合理要求提供。gydF4y2Ba
参考文献gydF4y2Ba
Grun D, Lyubimona A, Kester L, Wiebrands K, Basak O, Sasaki N, Clevers H, Van Oudenaarden A(2015)单细胞信使RNA测序揭示肠道细胞类型。自然525:251 - 255gydF4y2Ba
杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军(2018)牛小肠隐窝类肠的体外培养。箴言49:54gydF4y2Ba
陈建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军,陈建军。(2011)人结肠、腺瘤、腺癌上皮类器官的长期扩增。胃肠病学141:1762 - 1772gydF4y2Ba
陈晓明,陈晓明,陈晓明,陈晓明,陈晓明,陈晓明,陈晓明,陈晓明(2009)Lgr5干细胞体外培养隐窝-绒毛结构的研究。自然459:262 - 265gydF4y2Ba
刘锐,刘健,赵刚,李伟,郑敏,王健,李强,崔海,文杰(2019)利用十二指肠转录组分析揭示肉鸡肠道健康相关途径与残采食量的相关性。家禽科学98:1102-1110gydF4y2Ba
Sabino M, Cappelli K, Capomaccio S, Pascucci L, Biasato I, Verini-Supplizi A, Valiani A, Trabalza-Marinucci M,(2018)饲粮中添加橄榄厂废水对鸡空肠上皮细胞转录组的影响及空肠形态的调控。BMC Genomics 19:576gydF4y2Ba
肖超,邓杰,曾磊,孙涛,杨震,杨鑫(2021)夏岩鸡饲料效率相关基因转录组分析及信号通路。前厅12:60 . 7719gydF4y2Ba
王慧,李生,齐凯,薛涛,涂健,周旭,刘宏(2016)应用RNA-Seq技术筛选鸡小肠细胞受禽致病性影响的差异表达基因gydF4y2Ba大肠杆菌gydF4y2Ba。中华预防兽医杂志38:111-115gydF4y2Ba
Truong AD, Hong YH, Lillehoj HS(2015)高通量测序揭示了两个近交系患坏死性肠炎的肠道黏膜的不同免疫反应。免疫病理学杂志166:116-124gydF4y2Ba
Geyra A, Uni Z, Sklan D(2001)育后雏鸡肠细胞动力学和粘膜发育。家禽科学80:776-782gydF4y2Ba
Uni Z, Tako E, Gal-Garber O, Sklan D(2003)鸡小肠的形态、分子和功能变化。家禽科学82:1747-1754gydF4y2Ba
陈建军,陈建军,陈建军,陈建军(2005)雏鸡小肠发育:隐窝形成和肠细胞增殖与迁移。家禽科学41:544-551gydF4y2Ba
郭志刚,郭志刚,李晓明,郭志刚,郭志刚,郭志刚(2019)宿主-病原体相互作用的肠样细胞模型研究。Cell Rep 26:2509-2520gydF4y2Ba
李艳,杨宁,陈健,黄霞,张宁,杨松,刘刚,刘刚(2020)猪肠道病毒感染的新一代猪肠道类器官模型及其免疫应答研究。中华微生物学杂志[J]gydF4y2Ba
张建军,张建军,张建军,张建军,张建军,张建军。(2013)畜禽肠道类器官的研究进展。箴言52:33gydF4y2Ba
Nash TJ, Morris KM, mabbot NA, Vervelde L(2021)以白细胞成分为模型研究宿主-病原体相互作用的鸡肠内-外模型。圣经4:377gydF4y2Ba
Freeman TC, Goldovsky L, Brosch M, Van Dongen S, Maziere P, Grocock RJ, Freilich S, Thornton J, Enright AJ(2007)基因芯片表达数据转录网络的构建、可视化和聚类(转录组学数据的网络分析)。《公共科学图书馆·比较生物学》3:2032-2042gydF4y2Ba
Athanasios T, van Stijn D, Anton JE, Tom CF(2009)基于BioLayout Express3D的基因表达数据网络可视化和分析。Nat协议4:15 . 35gydF4y2Ba
马雅娟,刘建军,刘建军,胡梅(2013)人类原代细胞的基因表达图谱:基于共表达网络的基因功能推断。BMC Genomics 14:632gydF4y2Ba
陈建军,张建军,张建军,张建军,张建军,张建军,张建军,张建军(2005)基因集富集分析:基于知识的全基因组表达谱分析方法。美国科学进展,102:15545gydF4y2Ba
(2019)热图:漂亮的热图gydF4y2Bahttps://CRAN.R-project.org/package=pheatmapgydF4y2Ba
Borowska D, Kuo R, Bailey RA, Watson KA, Kaiser P, Vervelde L, Stevens MP(2019)基于高度多路定量pcr的鸡免疫反应评估平台。PLoS One 14:e0225658gydF4y2Ba
Lickert H, Kispert A, Kutsch S, Kemler R (2001) Wnt基因在小鼠肠道发育中的表达模式。机甲发展105:181-184gydF4y2Ba
张建军,张建军,张建军,等(2018)Wnt信号转导在胃肠道上皮干细胞中的应用。基因9:178gydF4y2Ba
Workman MJ, Mahe MM, Trisno S, Poling HM, Watson CL, Sundaram N, Chang C-F, Schiesser J, Aubert P, Stanley EG, Elefanty AG, Miyaoka Y, Mandegar MA, Conklin BR, Neunlist M, Brugmann SA, Helmrath MA, Wells JM(2017)人类多能干细胞来源肠道组织的功能肠神经系统。Nat Med 23:49-59gydF4y2Ba
Finkbeiner SR, Hill DR, Altheim CH, Dedhia PH, Taylor MJ, Tsai Y-H, Chin AM, Mahe MM, Watson CL, Freeman JJ, Nattiv R, Thomson M, Klein OD, Shroyer NF, Helmrath MA, Teitelbaum DH, Dempsey PJ, Spence JR(2015)转录组分析揭示了体外和体内人类肠道发育和成熟的特征。干细胞报告4:1140-1155gydF4y2Ba
Boesmans W, Hao MM, Fung C, Li Z, Van Den Haute C, Tack J, Pachnis V, Vanden Berghe P(2019)肠神经系统神经胶质细胞单位的结构定义信号。神经胶质67:1167 - 1178gydF4y2Ba
李MK,李仁春,李仁春,Cleveland DW, Frankfurter A(1990)鸡胚发育过程中神经元特异性β -微管蛋白的表达和翻译后修饰。细胞骨架17:18 - 132gydF4y2Ba
Powell DW, Pinchuk IV, Saada JI, Chen X, Mifflin RC(2011)肠固有层间充质细胞。物理学报73:213-237gydF4y2Ba
fouah D, Monfrini M, Donzelli E, Niada S, Brini AT, Orciani M, Tredici G, Miloso M(2014)不同来源间充质样干细胞未分化神经标志物的表达。中国生物医学工程学报,2014 (4):444 - 444gydF4y2Ba
Kalluri R, Weinberg RA(2009)上皮-间质转化的基础。[J] .临床投资杂志(19):1420 - 1428gydF4y2Ba
Blainey P, Krzywinski M, Altman N(2014)显著性点:复制。Nat Methods 11:879-880gydF4y2Ba
Noben M, verstockb, De Bruyn M, Hendriks N, Van Assche G, Vermeire S, Verfaillie C, Ferrante M,(2017)溃疡性结肠炎和克罗恩病患者上皮类器官培养:炎性肠病分子基础的真正长期模型研究?肠道66:2193 - 2195gydF4y2Ba
王晓明,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明(2020)肠道干细胞分化调控因子-1对肠道干细胞增殖和再生的影响。新约圣餐11:513gydF4y2Ba
范德喜,王晓明,王晓明,等。(2020)成体干细胞衍生空肠类器官与原始组织转录序列的一致性。《Front Cell Dev Biol》8:375gydF4y2Ba
Malomane DK, Simianer H, Weigend A, Reimer C, Schmitt AO, Weigend S (2019) SYNBREED鸡多样性小组:高基因组分辨率评估鸡多样性的全球资源。BMC Genomics 20:34gydF4y2Ba
Guy JS(1998)家禽胃肠道病毒感染。家禽科学77:1166-1175gydF4y2Ba
李春华,李春华,李春华,等(1999)鸡小肠功能发育的研究。家禽科学78:215-222gydF4y2Ba
Van de Flier LG, Haegebarth A, Stang de, Van de Wetering M, Clevers H (2009) OLFM4是人类肠道干细胞的强大标记物,并标记结直肠癌细胞的一个亚群。胃肠病学137:15-17gydF4y2Ba
张慧,黄娥(2018)卵黄囊和小肠中表达OLFM4和LGR5 mRNA的原位杂交鉴定。家禽科学97:628-633gydF4y2Ba
Sklan D(2001)家禽消化道的发育。世界家禽科学[J] 57:15 - 428gydF4y2Ba
王志强,李志强,李志强(1996)蛋鸡卵黄利用途径的研究。家禽科学37:987-996gydF4y2Ba
Noble R, Moore J(1964)鸡胚脂质代谢的研究。[J] .生物化学学报42 (2):1729 - 1741gydF4y2Ba
龚慧,王婷,褚强,吴敏,郎伟,兰慧,朱丽,周勇,文强,郑旭(2022)鸡胚小肠形态发生相关基因转录组分析及其途径。[j]家禽科学,63 (3):194 - 201gydF4y2Ba
Schokker DJ, Hoekman AJW, Smits MA, Rebel JMJ(2009)鸡空肠发育的基因表达模式。Dev comimmunol 33:1156-1164gydF4y2Ba
Oost MJ, Ijaz A, van Haarlem DA, Summeren KV, Velkers FC, Kraneveld AD, Venema K, Jansen CA, Pieters RHH, Ten Klooster JP(2022)鸡源性RSPO1和WNT3有助于维持鸡肠道类器官培养物的寿命。科学通报12:10 . 563gydF4y2Ba
Powell RH, Behnke MS (2017) WRN条件培养基足以用于大型农场和小型伴侣动物肠道类器官的体外繁殖。生物学杂志:698 - 705gydF4y2Ba
谢碧,吴文华(2016)结直肠癌患者源性组织分离细胞的类器官培养。中华医学杂志129:2469-2475gydF4y2Ba
李慧,刘霞,陈峰,左坤,吴超,闫燕,陈伟,林伟,谢强(2018)禽流感病毒H9N2亚型对鸡回肠肠道菌群、屏障结构损伤和炎症性肠道疾病的影响。病毒10:270gydF4y2Ba
王志强,王志强,等(2007)胚胎发生过程中上皮-间充质转化的信号网络。癌症科学98:1512-1520gydF4y2Ba
Hahn S, Nam M-O, Noh JH, Lee DH, Han HW, Kim DH, Hahm KB, Hong SP, Yoo JH, Yoo J .(2017)基于类器官的上皮细胞向间质转化(OEMT)模型:基于肠道纤维化的视角。科学报告7:24 . 35gydF4y2Ba
Nash T, Vervelde L(2022)禽类肠道体外模型的研究进展、挑战和未来应用。禽病杂志51:37 17 - 329gydF4y2Ba
致谢gydF4y2Ba
我们感谢A. de Groof博士和P. Vermeij博士(MSD动物卫生,荷兰)的支持和富有成果的讨论。RNA测序、质量过滤、PCA、ANOVA检验和差异分析由Edinburgh Genomics (Edinburgh, UK)进行。gydF4y2Ba
资金gydF4y2Ba
这项研究得到了生物技术和生物科学研究委员会(BBSRC)与MSD动物卫生(BB/MO14819)合作的iCase奖学金和BBSRC (BBS/E/D/10002071)的研究所战略计划资助。资助机构在研究的设计和收集、数据分析以及撰写手稿方面没有任何作用。gydF4y2Ba
作者信息gydF4y2Ba
作者及单位gydF4y2Ba
贡献gydF4y2Ba
LV设计了这个项目。TJN, NAM & LV参与了研究的设计和分析。TJN进行实验,收集数据,制作图表。KMM和TJN在NAM的支持下分析RNA-seq数据,TJN和LV在NAM和KMM的输入下撰写论文。LV和NAM获得了资助。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
获得了罗斯林研究所和爱丁堡大学动物福利伦理审查委员会的伦理批准。所有动物都被饲养在英国内政部许可的场所,完全符合1986年动物(科学程序)法的要求,并得到罗斯林研究所动物福利伦理审查委员会的批准。gydF4y2Ba
发表同意书gydF4y2Ba
为了开放获取的目的,作者已经对任何作者接受的来自此提交的手稿版本应用了CC-BY公共版权许可。gydF4y2Ba
相互竞争的利益gydF4y2Ba
博士研究支持和决定由MSD动物健康出版。MSD-AH在研究设计、数据收集和分析中没有发挥作用。未决的专利;爱丁堡大学,L. Vervelde教授和T. Nash博士,PCT/GB2020/051607(优先编号1909655.1),申请于2020年7月提交,标题为“Avian enteroid”。gydF4y2Ba
额外的信息gydF4y2Ba
执行编辑:文森特·巴姆林格gydF4y2Ba
出版商的注意gydF4y2Ba
伟德体育在线施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1。采集RNA样本进行转录组测序。gydF4y2Ba
提交RNA测序的ED18肠绒毛和鸡肠样RNA样品描述。gydF4y2Ba
13567 _2023_1144_moesm2_esm.docxgydF4y2Ba
附加文件2。用于RT-qPCR的引物和探针。gydF4y2Ba
13567 _2023_1144_moesm3_esm.docxgydF4y2Ba
附加文件3。用于免疫组织化学的一抗。gydF4y2Ba
附加文件4。在最大的50个共表达簇中发现的基因来自RNA-seq分析数据gydF4y2Ba
。表格提供了根据RNA-seq分析数据得出的网络图中每个共表达簇中发现的基因列表。gydF4y2Ba
附加文件5。最大的50个共表达簇中每个基因的平均表达谱。gydF4y2Ba
在最大的50个共表达簇中,每个基因的个体平均表达谱来自网络图。的gydF4y2BaxgydF4y2Ba轴显示按培养时间排序的样品。的gydF4y2BaygydF4y2Ba轴表示集群的平均表达强度(转录本/百万读取,TPM)。gydF4y2Ba
附加文件6。最大的50个共表达簇中基因的GO术语富集注释。gydF4y2Ba
表列出了网络图中最大的50个共表达簇中基因的代表性GO术语富集注释。注意,Entrez基因id是针对人类同源基因的。gydF4y2Ba
附加文件7。肠样增生。gydF4y2Ba
该图显示了培养7天内肠内增殖(EdU+)细胞的百分比,以及14小时内肠内增殖(EdU+)细胞的z堆叠图像。gydF4y2Ba
附加文件8。鸡肠样培养细胞型基因的表达。gydF4y2Ba
干细胞、潘氏细胞、肠内分泌细胞、杯状细胞和肠细胞基因在1 d鸡类肠培养中的表达。培养2天的鸡肠样共聚焦图像染色。gydF4y2Ba
附加文件9。差异表达基因综述。gydF4y2Ba
表列出了deg (logFC,gydF4y2BaPgydF4y2Ba-value, FDR)从相邻的文化时间点。gydF4y2Ba
附加文件10。鸡肠固有层中发现白细胞。gydF4y2Ba
RNA测序分析免疫细胞群基因集的表达。培养2天后鸡小肠共聚焦图像CD45染色。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba。创作共用公共领域免责声明(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文中提供的数据,除非在数据的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
纳什,t.j.,莫里斯,k.m.,玛伯特,N.A.gydF4y2Baet al。gydF4y2Ba鸡浮顶出肠的时间转录组分析表明其稳定性和可重复性。gydF4y2Ba兽医ResgydF4y2Ba54gydF4y2Ba, 12(2023)。https://doi.org/10.1186/s13567-023-01144-2gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s13567-023-01144-2gydF4y2Ba
关键字gydF4y2Ba
- 鸡gydF4y2Ba
- 3 d瀑样gydF4y2Ba
- apical-outgydF4y2Ba
- 转录组gydF4y2Ba
- 肠gydF4y2Ba
- 干细胞gydF4y2Ba