细菌
LM 10403和LI PAM55由沈浩博士(宾夕法尼亚大学佩雷尔曼医学院微生物学系)提供。质粒pCW619, pCW620(其中含有lacZ)和pCW621(它的端口是他)是我们小组建造的。质粒pCW620电穿孔进入LI和菌株LIΔ国际劳工组织::lacZ由同源重组[19].质粒pCW619和pCW621电穿孔到LIΔ国际劳工组织::lacZ构建菌株LIΔ国际劳工组织和李Δ国际劳工组织::他,分别。目标质粒pCW619、pCW620和pCW621以及重组菌株的示意图见附加文件1。
LLO和ILO的生物信息学分析
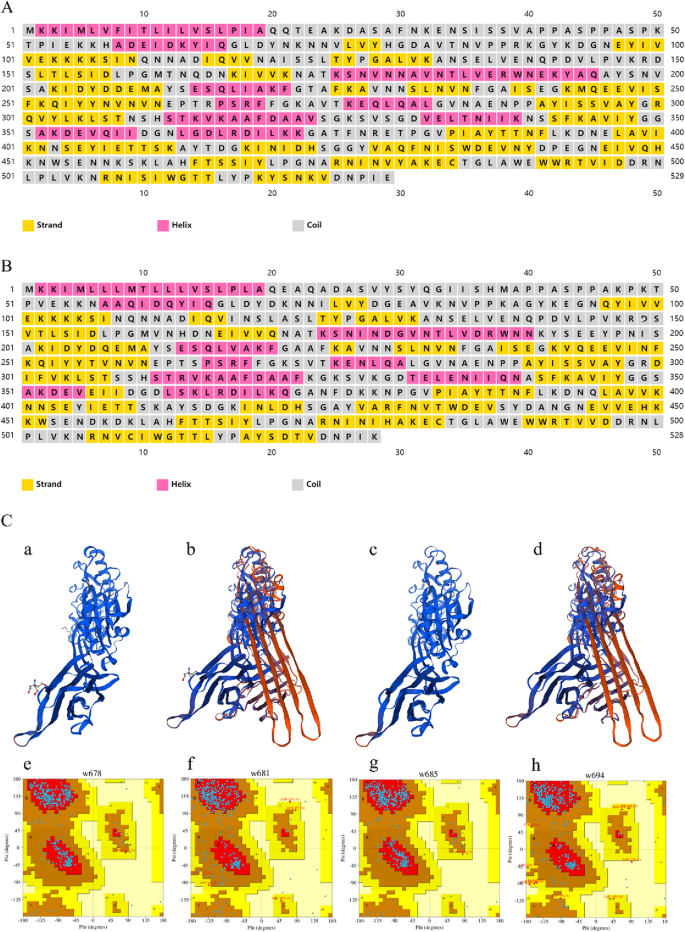
序列克隆软件用于比较LLO蛋白编码基因的核苷酸序列他(GenBank: DQ054589.1)和ILO蛋白编码基因国际劳工组织(基因库:X60461.1)。使用DNASTAR软件和Expasy Translate工具预测翻译和开放阅读框,使用DNAMAN软件比较氨基酸序列。使用ProtParam和Compute pI/Mw工具预测pI、Mw、不稳定性指数和脂肪族指数。二级结构预测使用Predict Protein, SOPMA和PSIPRED软件。三级构造采用Swiss-Model进行预测,并采用PDBsum Generate进行分析。亲水性和疏水性用ProtScale进行预测。跨膜结构预测使用TMHMM Server v. 2.0。用CDD预测功能域。有关数据库、生物信息学分析软件和网站的信息见表1。
LI的原核转录组测序,LIΔ国际劳工组织,和李Δ国际劳工组织::他菌株
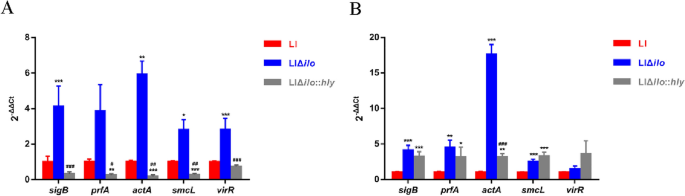
使用TRIzol试剂(Invitrogen Life Technologies, USA)分离总RNA。测序文库在上海个人生物科技有限公司的NextSeq 500平台(Illumina, USA)上测序。通过转录组测序分析得到的DEGs通过RT-qPCR进行验证。RT-qPCR反应体系和条件按照生产商说明书(SsoFast EvaGreen Supermix, Bio-Rad,中国)进行。以16s rRNA万能引物作为内参,用2计算各基因相对转录水平——ΔΔCt方法。
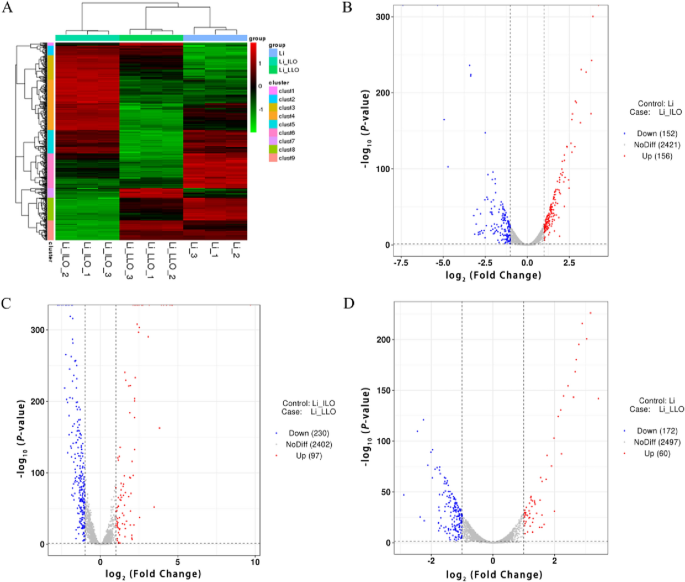
对所有组和样本中所有差异表达基因(DEGs)的并集进行双向聚类分析。根据不同样本中同一基因的转录水平和同一样本中不同基因的表达模式进行聚类分析。采用欧几里得方法计算距离,采用层次聚类方法(完全链接)进行聚类。
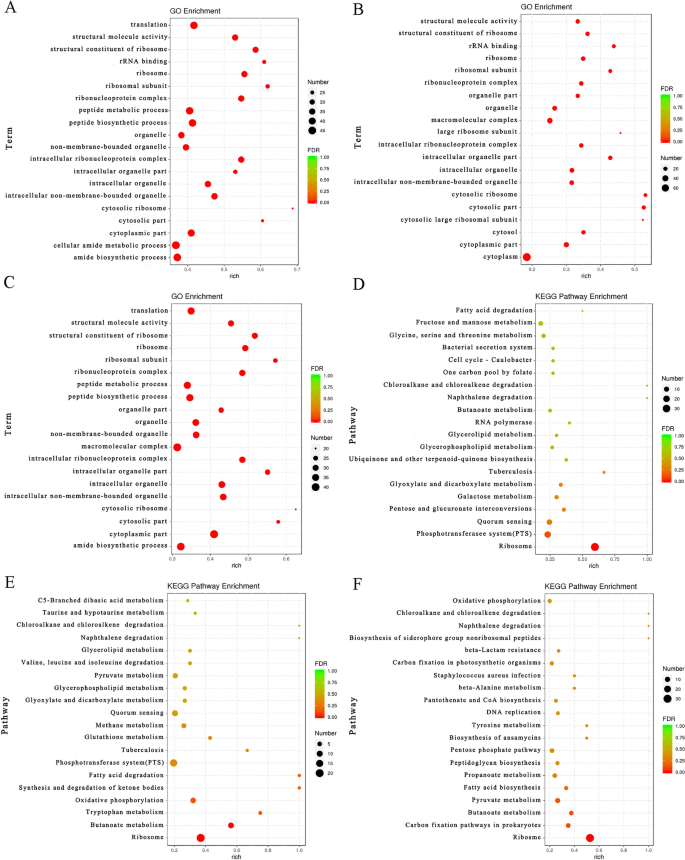
差异通路的表型分析
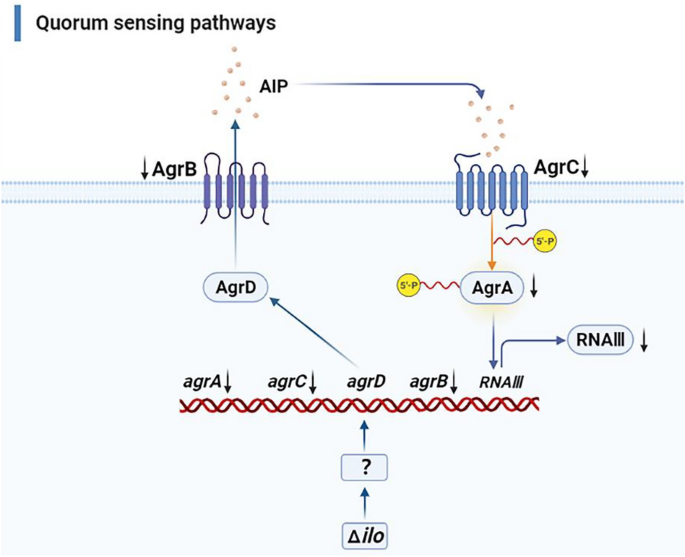
群体感应途径-生物膜形成
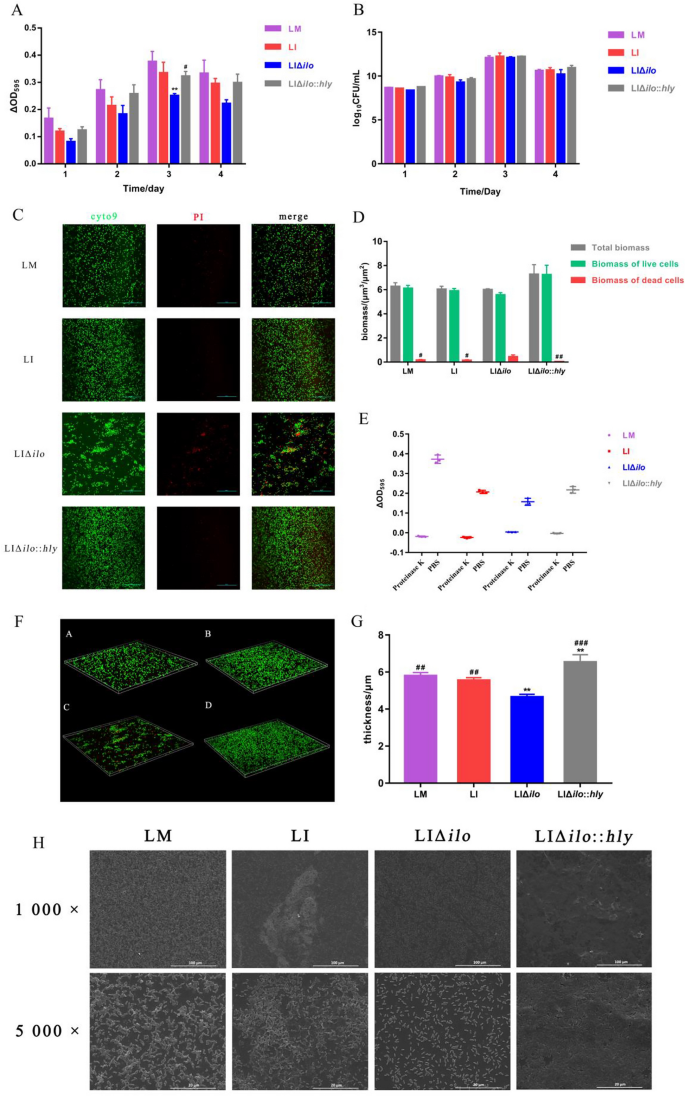
生物膜按照前面描述的方法培养[18],略有改动。1毫升BHI肉汤培养液(兰桥,中国)含有1 × 107CFU/mL LM, LI, LIΔ国际劳工组织、LIΔ国际劳工组织::他分别添加到24孔PVC板(美国康宁公司)的每孔中,在37℃下培养1、2、3和4天。去除培养基,用PBS冲洗孔两次,风干得到生物膜。立即或在37℃下加入0.1 mg/mL蛋白酶K (Solarbio, China) 3小时后进行结晶紫染色。结晶紫染色如下。每孔加入甲醇(1ml)固定15分钟。除去甲醇,加入1ml 0.1%结晶紫(Solarbio, China) 10分钟。除去结晶紫,每孔用PBS洗涤三次,干燥,并在1ml 33%醋酸中重悬。将上清液转移到新板上,使用微孔板阅读器(美国赛默飞世尔科学公司)测量595 nm处的光密度。
除结晶紫染色外,还测定了生物膜中的活菌。每孔加入1毫升PBS,使用Elmasonic P仪(Elma,德国)在37千赫工作5分钟进行超声处理。将20微升悬浮液添加到BHI (Landbridge,中国)培养皿中,在37°C培养48小时。计数菌落,以CFU表示活菌数。
1毫升BHI肉汤培养液(兰桥,中国)含1 × 107CFU/mL LM, LI, LIΔ国际劳工组织、LIΔ国际劳工组织::他被添加到24孔PVC板(康宁,美国)的每孔中,每孔中放置无菌载玻片。在37°C孵育3天后,取出载玻片,用去离子水洗涤两次。
将载玻片置于2.5%戊二醛溶液中12 h,分别用浓度梯度为30%、50%、70%、90%、100%的乙醇溶液脱水10 min,取出临界点干燥。玻片被喷金,然后用扫描电镜观察(Inspect F, FEI,荷兰)。
200微升细胞膜染色工作液(LIVE/DEAD BacLight™细菌活力试剂盒;Invitrogen, USA)被添加到幻灯片中。活菌用细胞9染色标记,死菌用PI染色标记。载玻片在37°C黑暗中孵育15分钟,用去离子水洗涤三次,取出,放在玻片上。载玻片安装后,采用A1R模型进行LSCM观察+显微镜(尼康,日本)。利用NIS Elements和ImageJ软件对生物膜厚度和荧光强度进行成像和计算。
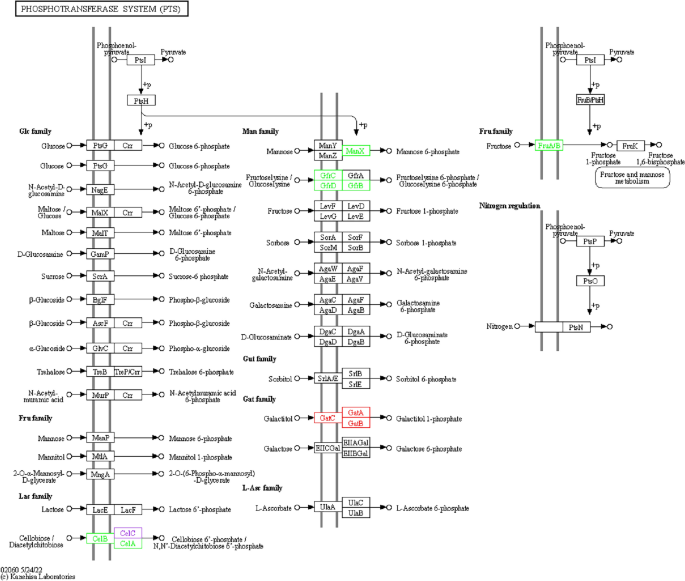
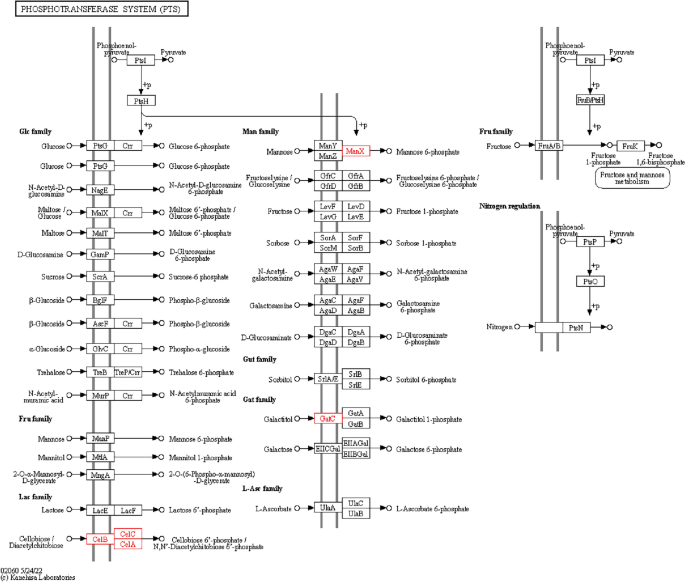
PTS途径-毒力基因转录
李,李Δ国际劳工组织、LIΔ国际劳工组织::他分别接种到以0.5%葡萄糖或0.5%纤维素为唯一碳源的TSB培养基(aladdin, China)中,37°C孵育。将细菌培养到600 nm 0.4-0.5的光密度。然后,使用RNAprep pure Cell/Bacteria Kit (Tigen,中国)提取细菌RNA。使用TransScript One-Step gDNA Removal和cDNA Synthesis SuperMix (Transgen, China)将RNA逆转录为cDNA。
统计分析
数据使用SPSS 21.0 (IBM,美国)进行处理。正态分布以均数±标准差表示。参数检验采用单因素方差分析,组间两两比较采用LSD检验。P< 0.05为差异有统计学意义。