Leal Zimmer FMA, Paes JA, Zaha A, Ferreira HB (2020)支原体hyopneumoniae.毒性11:1600 - 1622
文章中科院PubMed公共医学中心谷歌学者
熊强,魏勇,冯志,甘勇,刘震,刘明,白峰,邵刚(2014)一种减毒活毒株的保护作用支原体hyopneumoniae猪用iscom基质佐剂疫苗。兽医杂志199:268-274
文章中科院PubMed谷歌学者
于艳,刘敏,华玲,邱敏,张伟,魏颖,甘艳,冯志,邵刚,熊强(2018)植物核心基因编码的果糖-1,6-二磷酸醛缩酶支原体hyopneumoniae有助于宿主细胞粘附。兽医决议49:14
文章中科院PubMed公共医学中心谷歌学者
Dos Santos LF, Sreevatsan S, Torremorell M, Moreira MA, Sibila M, Pieters M (2015)支原体hyopneumoniae来自不同地理区域的猪群。兽医微生物175:374-381
文章PubMed谷歌学者
Raymond BBA, Jenkins C, Turnbull L, Whitchurch CB, Djordjevic SP(2018)基因组减少病原体的细胞外DNA释放支原体hyopneumoniae是非生物表面形成生物膜所必需的。科学报告8:10373
文章PubMed公共医学中心谷歌学者
Peters T, Bertrand S, Bjorkman JT, Brandal LT, Brown DJ, Erdosi T, Heck M, Ibrahem S, Johansson K, Kornschober C, Kotila SM, Le Hello S, Lienemann T, Mattheus W, Nielsen EM, Ragimbeau C, Rumore J, Sabol A, Torpdahl M, Trees E, Tuohy A, de Pinna E (2017沙门氏菌血清肠炎型。欧洲监测22:30477
文章PubMed公共医学中心谷歌学者
尤琪,Eidt J, Bell-Rogers P, Cai HY (2020)支原体hyopneumoniae来自加拿大安大略省猪的菌株。美国兽医诊断杂志32:128-131
文章PubMed谷歌学者
de Castro LA, Rodrigues Pedroso T, Kuchiishi SS, Ramenzoni M, Kich JD, Zaha A, Henning Vainstein M, Bunselmeyer Ferreira H (2006支原体hyopneumoniae菌株。兽医微生物116:258-269
文章PubMed谷歌学者
Stakenborg T, Vicca J, Maes D, pepeters J, de Kruif A, Haesebrouck F, Butaye P(2006)分子分型技术的比较支原体hyopneumoniae隔离。微生物学杂志66:263-275
文章中科院谷歌学者
Minion FC, Adams C, Hsu T (2000) P97的R1区域介导粘附支原体hyopneumoniae到猪的纤毛。感染Immun 68:3056-3060
文章中科院PubMed公共医学中心谷歌学者
Stakenborg T, Vicca J, Maes D, pepeters J, de Kruif A, Haesebrouck F, Butaye P(2006)分子分型技术的比较支原体hyopneumoniae隔离。《微生物学杂志》66:263-275
文章中科院PubMed谷歌学者
Charlebois A, Marois-Crehan C, Helie P, Gagnon CA, Gottschalk M, Archambault M (2014)支原体hyopneumoniae屠宰场猪分离株。兽医微生物168:348-356
文章中科院PubMed谷歌学者
Soltani S, Arshadi M, Getso MI, Aminharati F, Mahmoudi M, Pourmand MR(2018)伊朗阿瓦士VRE粪分离株毒力基因的流行及其与生物膜形成的关系。J infection Dev国别12:970-977
文章中科院PubMed谷歌学者
杜本speck JM,杜维格K(2007)生物膜形成的随机机制支原体pulmonis.细菌杂志189:1905-1913
文章中科院PubMed谷歌学者
沃尔G,蒙特隆戈-约雷吉D,维达尔·博尼法西奥B,洛佩兹-里博特JL,乌普鲁里P (2019)白色念珠菌生物膜生长和扩散:对发病机制的贡献。Curr Opin微生物52:1-6
文章中科院PubMed公共医学中心谷歌学者
金洪辉,李丹,严玉斌(2018)celastrol抗生物膜及抗毒力作用Stenotrophomonas maltophilia.国际医学科学15:617-627
文章中科院PubMed公共医学中心谷歌学者
潘Y, Subhadra B, Sandal I, Dickerman A, Inzana TJ (2021) uspE在毒力和生物膜形成中的作用Histophilus somni.兽医微生物263:109267
文章中科院PubMed谷歌学者
Wang S, Kang OH, Kwon DY(2021)双去甲氧基姜黄素降低甲氧西林耐药性金黄色葡萄球菌毒力相关外蛋白的表达及抑制生物膜的形成。毒素13:804
文章PubMed公共医学中心谷歌学者
闫建新,李艳红,郭晓强,王晓春,刘旭峰,李安,曹斌(2021)ArcA对黄曲霉生长、活力、生物膜形成及毒力的影响邻单胞菌属shigelloides.BMC微生物21:266
文章中科院PubMed公共医学中心谷歌学者
王勇,张伟,吴泽峰,陆春平(2011)毒力降低是生物膜感染的一个重要特征猪链球菌.FEMS Microbiol Lett 316:36-43
文章中科院PubMed谷歌学者
Zielinski GC, Ross RF(1990)细胞培养和菌株生长对毒力的影响支原体——hyopneumoniae猪。Am J兽医Res 51:344-348
中科院PubMed谷歌学者
刘伟,冯志,方林,周震,李强,李松,罗蓉,王林,陈辉,邵刚,肖松(2011)支原体hyopneumoniae168菌株。细菌杂志193:1016-1017
文章中科院PubMed谷歌学者
Garcia-Morante B, Dors A, Leon-Kempis R, Perez de Rozas A, Segales J, Sibila M (2018在体外非致病性J和致病性11和232的生长动力学和动力学支原体hyopneumoniae菌株。兽医决议49:45
文章PubMed公共医学中心谷歌学者
Vasconcelos AT, Ferreira HB, Bizarro CV, Bonatto SL, Carvalho MO, Pinto PM, Almeida DF, Almeida LG, Almeida R, Alves-Filho L, Assuncao EN, Azevedo VA, Bogo MR, Brigido MM, Brocchi M, Burity HA, Camargo AA, Camargo SS, Carepo MS, Carraro DM, de Mattos Cascardo JC, Castro LA, Cavalcanti G, Chemale G, Collevatti RG, Cunha CW, Dallagiovanna B, Dambros BP, Dellagostin OA等(2005)猪和家禽病原体的全基因组序列支原体hyopneumoniae还有一种支原体synoviae.细菌杂志187:5568-5577
文章中科院PubMed公共医学中心谷歌学者
Siqueira FM, Thompson CE, Virginio VG, Gonchoroski T, Reolon L, Almeida LG, da Fonseca MM, de Souza R, prodocimi F, Schrank IS, Ferreira HB, de Vasconcelos AT, Zaha A(2013)比较基因组分析对猪呼吸道支原体生物学的新见解。BMC Genomics 14:17
文章中科院PubMed公共医学中心谷歌学者
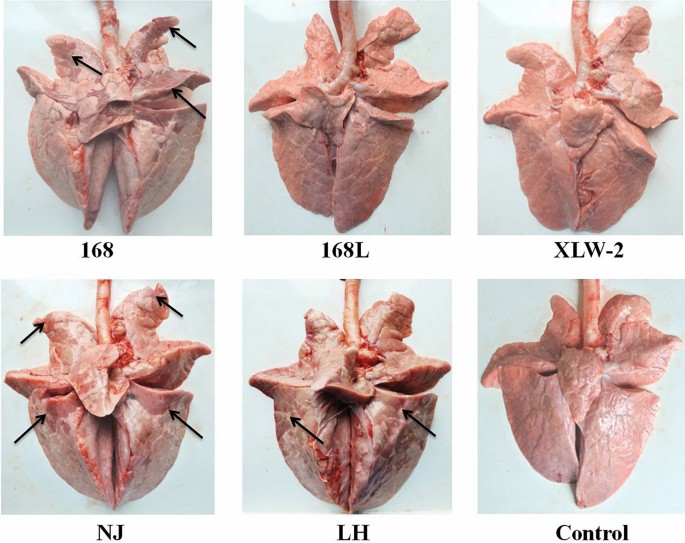
Madec F, Kobisch M (1982) Bilan lésionnel屠宰场à l 'abattoir。Journées de la Recherche猪在法国14:8(法语)
谷歌学者
于燕,王娟,韩瑞,王玲,张磊,张艾,辛杰,李松,曾勇,邵刚,冯志,熊强(2020)支原体hyopneumoniae通过伸长因子热不稳定(EF-Tu)与因子H结合来逃避补体激活。毒性11:1059 - 1074
文章中科院PubMed公共医学中心谷歌学者
马德森ML, Minion FC, Christopher-Hennings J, Dammen M, Jones KR, Thacker EL(2008)利用实时荧光定量PCR方法研究植物遗传多样性支原体hyopneumoniae.临床微生物学杂志46:2491-2498
文章中科院PubMed公共医学中心谷歌学者
张志刚,张志刚,张志刚,张志刚,张志刚,张志刚,等(2003)黄曲霉毒力研究进展支原体hyopneumoniae现场隔离。兽医微生物97:177-190
文章中科院PubMed谷歌学者
吕斌,丁露萍,沈冰,杨正宇,吕茂军,F志新,W燕娜,W海燕,S国庆,H孔旺(2014)猪肺泡巨噬细胞对支原体hyopneumoniae.PLoS One 9:e101968
文章PubMed公共医学中心谷歌学者
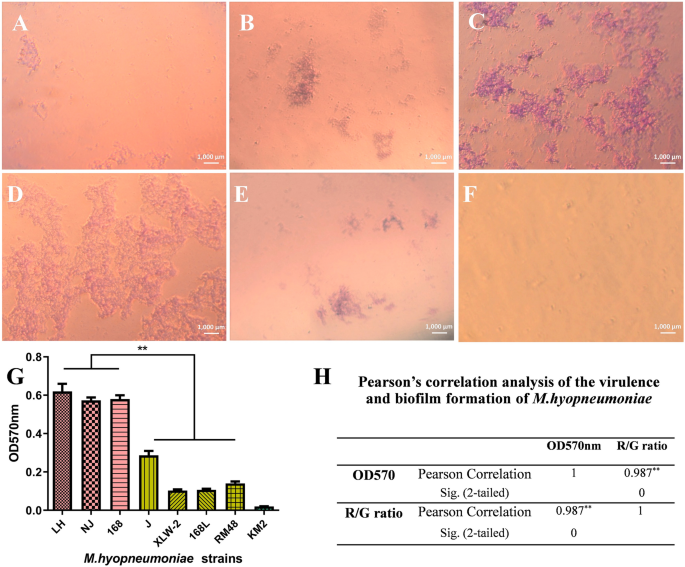
王丽敏,莫清泉,王剑霞(2015)MIrExpress:基于互信息和pearson相关的免疫细胞基因共表达相关数据库。中国免疫杂志2015:2015;140819
文章PubMed公共医学中心谷歌学者
Mattsson JG, Bergstrom K, Wallgren P, Johansson KE (1995)支原体hyopneumoniae通过体外扩增16S rRNA基因在猪鼻拭子中的表达。临床微生物学杂志33:893-897
文章中科院PubMed公共医学中心谷歌学者
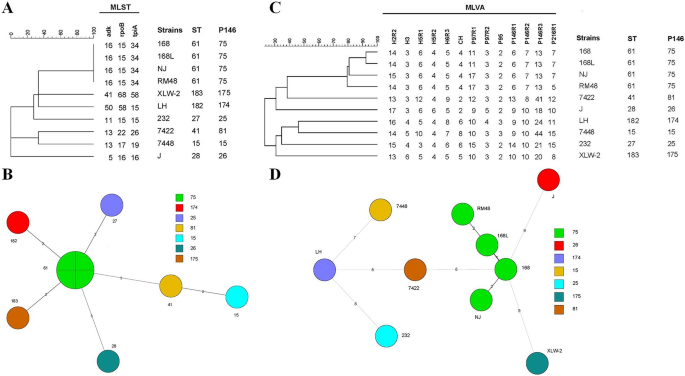
Mayor D, Jores J, Korczak BM, Kuhnert P(2008)的多位点序列分型支原体hyopneumoniae:具有有限克隆性的多样化病原体。兽医微生物127:63-72
文章中科院PubMed谷歌学者
Mayor D, Zeeh F, Frey J, Kuhnert P (2007)支原体hyopneumoniae在养猪场通过临床材料的直接分子分型揭示。兽医决议38:391-398
文章中科院PubMed谷歌学者
Vranckx K, Maes D, Calus D, Villarreal I, Pasmans F, Haesebrouck F(2011)多位点变数串重复分析是一种适合的分化工具支原体hyopneumoniae没有培育的菌株。临床微生物学杂志49:2020-2023
文章中科院PubMed公共医学中心谷歌学者
Dehkharghani AD, Haghighat S, Farzami MR, Rahbar M, Douraghi M(2021)产esbl的克隆关系和抗性谱大肠杆菌.前端细胞感染微生物11:560622
文章中科院谷歌学者
salpante SJ, Hall BG(2011)最小生成树在分子流行病学中的不足之处。临床微生物学杂志49:3568-3575
文章PubMed公共医学中心谷歌学者
Hunter PR, Gaston MA(1988)打字系统辨别能力的数值指数:辛普森多样性指数的应用。临床微生物学杂志26:2465-2466
Petrelli D, Zampaloni C, D 'Ercole S, Prenna M, Ballarini P, Ripa S, Vitali LA(2006)不同遗传性状与生物膜形成的关系分析葡萄球菌epidermidis中心静脉导管感染分离物。中华临床微生物感染杂志25:7 3 - 781
文章中科院PubMed谷歌学者
王晓明,王晓明,王晓明,王晓明,王晓明,等。(2012)中国热带植物多样性与动态的纵向研究支原体hyopneumoniae猪群感染。兽医微生物156:315-321
文章中科院PubMed谷歌学者
郭晓燕,王晓燕,王晓燕,等(2011)植物基因分型支原体hyopneumoniae在野猪肺样本中。兽医微生物152:191-195
文章中科院PubMed谷歌学者
Minion FC, Lefkowitz EJ, Madsen ML, Cleary BJ, Swartzell SM, Mahairas GG (2004)支原体hyopneumoniae232株,猪支原体病的病原体。细菌杂志186:7123-7133
文章中科院PubMed公共医学中心谷歌学者
古德温RF,波默罗伊AP,惠特尔斯通P (1967)支原体suipneumonia:引起猪地方性肺炎的支原体。环境科学学报(英文版)65:85-96
文章中科院谷歌学者
赵峰,杨华,毕D, Khaledi A,乔M(2020)尿路致病性抗生素耐药模式及生物膜形成与毒力因子相关性的系统综述和荟萃分析大肠杆菌与尿路感染隔离。微生物病原体144:104196
文章中科院PubMed谷歌学者
Franca A, Gaio V, Lopes N, Melo LDR(2021)凝固酶阴性葡萄球菌的毒力因子。病原体10:170
文章中科院PubMed公共医学中心谷歌学者
Ramires T, Kleinubing NR, Iglesias MA, Vitola HRS, Nuncio ASP, Kroning IS, Moreira GMSG, Fiorentini AM, Da Silva WP (2021)单核细胞增多性李斯特氏菌三文鱼寿司。食品法令140:109871
文章中科院PubMed谷歌学者
Tassew DD, Mechesso AF, Park NH, Song JB, Shur JW, Park SC(2017)抗生素生物膜的形成及最低生物膜根除浓度的测定支原体hyopneumoniae.兽医医学杂志79:1716-1720
文章中科院PubMed公共医学中心谷歌学者