摘要
肌肉幼虫旋毛虫寄生于寄主肠上皮。外泌体参与入侵的机制t . spiralis肌肉幼虫不清楚。因此,本研究的目的是探讨外泌体的作用t . spiralis感染幼虫(TsExos)对猪小肠上皮细胞屏障功能(IPEC-J2)的影响。首先,Ts成功获得外显子,并证实其被上皮细胞摄取。此外,通过CCK8试剂盒确定了最佳诱导条件,暴露量为150 μg/mLTsExos作用12/24 h后,IPEC-J2细胞活力降低30%。基于这个结果,对Ts研究了外显子在细胞生物学过程和紧密连接中的作用。共孵育后TsExos和IPEC-J2细胞,结果显示fitc -葡聚糖含量、乳酸脱氢酶(LDH)和活性氧(ROS)水平显著升高。细胞凋亡率增加12.57%,出现核固缩和核破裂。诱导细胞后TsExos中,IL-1表达上调,IL-10、TGF-β、TLR-5、MUC-1、MUC-2表达下调。TsExo诱导也导致ZO-1、CLDN-3和OCLN水平降低。总之,Ts外显子参与多种细胞生物学过程,它们通过破坏生理和生化过程、过度激活先天免疫和破坏紧密连接发挥作用。
介绍
旋毛虫是一种在世界范围内发现的人畜共患寄生虫病吗[1]。在肠感染阶段t . spiralis,它通过感应合适的配体侵入多个细胞[2]。侵袭过程随后可导致细胞膜破裂和细胞质破坏,从而诱导细胞凋亡并引起膜通透性改变[3.,4]。此外,为了抵抗入侵t . spiralis,宿主激活自身免疫系统;然而,它的过度反应可能对宿主本身有害[3.]。
最近的研究报告称,大多数寄生虫都能分泌外泌体,这些外泌体可以在被摄入后将它们的货物运送到宿主细胞中[5,6,7,8,9]。来源于寄生虫的外泌体转移到宿主细胞后,可通过调节宿主细胞增殖、细胞信号通路和基因表达,为寄生虫免疫逃逸创造有利的微环境[10,11]。
Song等人发现,鸡的排泄/分泌蛋白(esp)中存在丝氨酸蛋白酶和半胱氨酸蛋白酶t . spiralis通过降解紧密连接蛋白破坏肠上皮完整性,并在t . spiralis在宿主体内的入侵、生长和存活[12]。外泌体作为ESPs的重要组成部分,参与许多生物学功能的调控;然而,它们在调节宿主肠上皮细胞功能中的作用t . spiralis感染情况尚不清楚。因此,本研究的目的是探讨外泌体的作用t . spiralis肌肉幼虫(TsExos)对肠上皮细胞侵袭时屏障功能的影响t . spiralis以促进其寄生过程。本研究的结果将为探索入侵过程提供有益的见解。
材料与方法
动物、寄生虫和细胞培养
6 ~ 8周龄雌性KM小鼠购自哈尔滨医科大学。所有动物饲养和实验程序均按《中国动物管理条例》执行,动物实验标准经东北农业大学动物管理委员会批准。所有小鼠自由进食和饮水,保持在SPF条件下,湿度为70±10%,温度为20±2℃。
旋毛虫(菌株ISS533)在KM小鼠中培养,并按照先前描述的标准方法从感染KM小鼠的肌肉中分离肌肉幼虫(ML) [13]。
猪小肠上皮细胞(IPEC-J2)由哈尔滨兽医研究所捐赠,用90% DMEM (Meilunbio,中国)、10%胎牛血清(FBS, PAN,德国)和1% 100 U/mL青霉素/链霉素(Solarbio,中国)培养。
分离鉴定Ts挂式
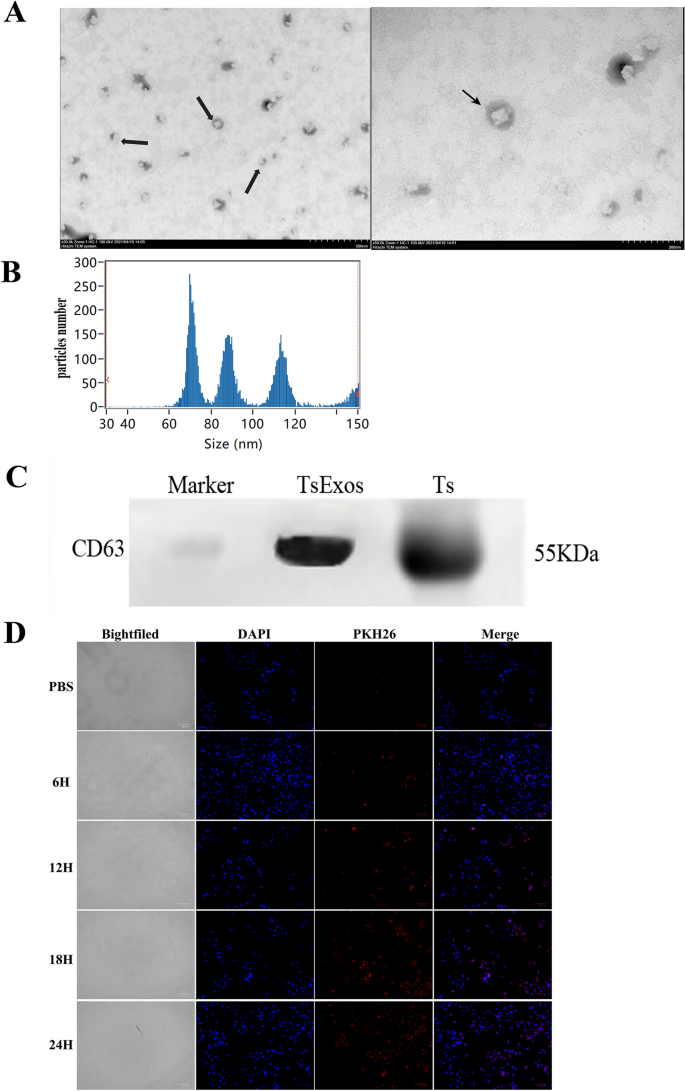
旋毛虫从小鼠肌肉中采集MLth然后在RPMI-1640培养基(Meilunbio, China)中添加1% 100 U/mL青霉素/链霉素,在37℃、5% CO条件下培养248 h。采用Wei等人的超离心方法收集培养上清中分泌的外泌体。14]。的浓度TsExos采用BCA蛋白检测试剂盒(Meilunbio, China)检测。外泌体的形状通过透射电子显微镜(TEM)观察(日立,日本)。的大小Ts使用纳米颗粒跟踪分析仪(NTA) (NanoFCM)测量Exos。的特异性标记CD63Ts蛋白印迹法测定Exos。
吸收TsIPEC-J2细胞的Exos
验证…的内化TsIPEC-J2细胞的外显子,我们将细胞接种在24孔板上(大约1 × 105用先进的DMEM在37℃、5% CO条件下培养212小时TsExos (300 μg/mL)和PBS(对照)使用Liu等人描述的PKH26试剂盒(Aidisheng, China)进行标记。[15],其中外泌体被标记为红色。贴上标签的TsExos与IPEC-J2细胞孵育6、12、18和24小时。之后,细胞用4%多聚甲醛(Biosharp,中国)固定,用PBS洗涤,用0.25% Triton X-100 (Biofroxx,德国)渗透,并用10% DAPI (Solarbio,中国)染色。用荧光显微镜检查细胞,并捕获图像(Syngene, USA)。
确定了最佳反应浓度与摄取时间之间的关系TsExos和IPEC-J2细胞
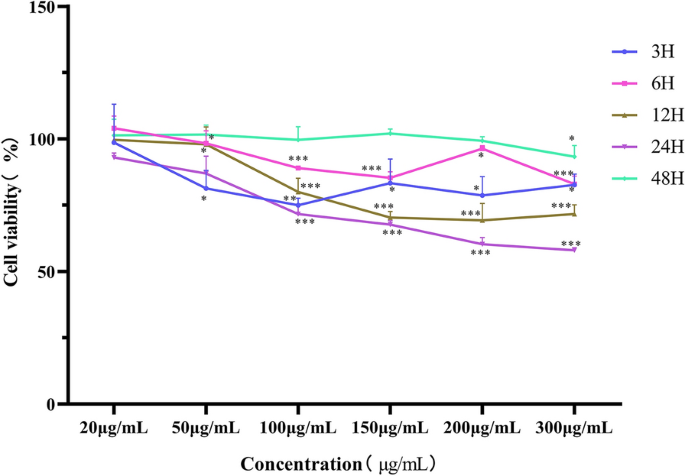
使用CCK-8试剂盒(Meilunbio, China)检测细胞活力,如前所述[16]。简单地说,细胞接种于96孔板(约1 × 103.每孔细胞),并在上述相同条件下培养。Ts将Exos(20、50、100、150、200、300 μg/mL)或PBS分别与IPEC-J2细胞共培养3、6、12、24、48 h,然后在每孔中加入10 μL CCK-8溶液,在细胞培养板上孵育2 h,使用美国BioTek公司的平板仪测定450 nm处吸光度。
渗透率测量
通过fitc -葡聚糖法测定IPEC-J2细胞单层的通透性(40 kDa, Yuanyebio, China) [17]。细胞接种于孔径为0.4 μm的Transwell腔室(Labselect, China),以5 × 10的密度置于6孔板中5细胞/。细胞在培养基中培养至完全分化。然后,Ts将Exos (150 μg/mL)分别添加到细胞中3、6、12、18和24小时。将fitc -葡聚糖(5 mg/mL)添加到Transwell插入物的顶端室中5小时。随后,将基侧培养基(不含FBS)收集到黑色CellCarrier-96微孔板(PerkinElmer, USA)中,使用微孔板读取器(Tecan, Switzerland)在493 nm激发和517 nm发射波长下测量荧光。
实时定量PCR
采用实时荧光定量PCR (RT-qPCR)检测IPECs中基因的相对表达量。各检测基因引物序列见表1.细胞制备及处理同上。使用总RNA提取试剂盒(Solarbio, China)从ipec中提取总RNA。用primer Script从总RNA合成cDNA后圣链cDNA合成试剂盒(TaKaRa,日本),rt - qpcr使用罗氏光循环480系统。计算结果采用2−∆∆Ct方法(18]。
西方墨点法
用RIPA裂解缓冲液和1% PMSF (Solarbio, China)提取IPEC-J2细胞总蛋白,每孔裂解缓冲液的比例为150-250 μL。用BCA检测试剂盒检测蛋白浓度。用5 × SDS-PAGE样品上样缓冲液(Biosharp, China)煮沸,SDS-PAGE分离。将蛋白质印迹到聚偏二氟乙烯过滤膜(Millipore, USA)上。将膜置于阻断缓冲液(5%脱脂乳)中,室温下放置2小时。随后,用合适的一抗溶液(Wanleibio, China;bios,中国;ab克隆(美国)在4°C下过夜。用PBST洗涤三次后,分别用辣根过氧化物酶(HRP)偶联二抗(ab克隆,美国)孵育,在室温下用5%脱脂牛奶(1:5000)稀释2小时。最后,使用超灵敏ECL化学发光试剂(Meilunbio, China)进行印迹,并暴露膜。 The bands were quantified using a chemiluminescence imaging system (Syngene, USA) and analysed with ImageJ.
细胞免疫荧光法
感应后TsExos,用PBS洗涤3次,用4%多聚甲醛固定30分钟,然后用0.25% Triton X-100渗透10分钟。用2%牛血清白蛋白在室温下阻断30分钟。之后,用PBS冲洗细胞,用抗ZO-1(1:300)、CLDN-3(1:300)和OCLN(1:300)的一抗在4°C下孵育过夜。随后,用PBS冲洗孔三次,并用fitc标记的二抗(1:30 00,Bioss,中国)在室温黑暗中孵育1小时。然后用2 μg/mL DAPI染色细胞核,在黑暗环境下染色8min。最后在荧光显微镜下观察细胞。
检测细胞毒性、氧化应激和细胞凋亡
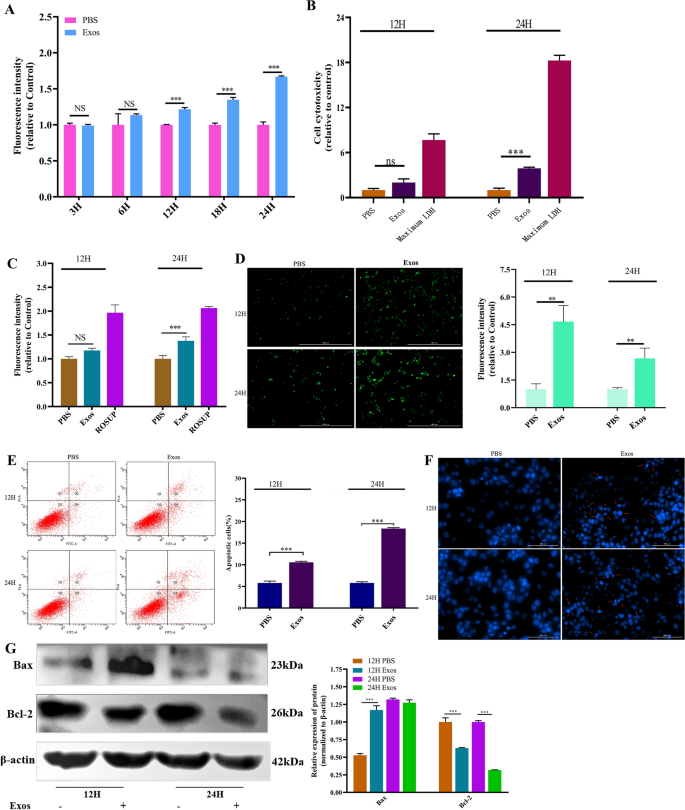
诱导的细胞毒性Ts使用LDH检测试剂盒(Beyotime,中国)通过乳酸脱氢酶(LDH)渗漏到培养基中来评估Exos。首先,ipec在不同孔的培养皿中培养12 h。Ts用150 μg/mL的Exos或PBS诱导细胞12、24 hTs根据说明书用LDH检测试剂盒检测外显子的细胞毒性。此外,根据活性氧测定试剂盒(Meilunbio, China)的技术手册,通过测量488 nm激发波长和525 nm发射波长的荧光以及在荧光显微镜下观察荧光来检测氧化应激水平。采用Annexin V-FITC/PI细胞凋亡试剂盒(Meilunbio, China)流式细胞仪检测凋亡细胞,经PI和FITC染色的细胞为凋亡细胞。Hoechst 33258 (Leagene, China)染色证实细胞凋亡,并观察蓝色荧光强度[19]。此外,采用Western blotting检测凋亡基因(Bax, Bcl-2,购于中国万莱生物公司)的表达(方法见“西方墨点法”)。
统计分析
所有数据均以平均值±SD表示。使用GraphPad Prism 5进行统计分析。采用ImageJ软件对波段强度进行量化。采用SPSS 22软件进行单因素方差分析(ANOVA)。P< 0.05认为有统计学意义。
结果
描述的Ts外显子和ipec的摄取
探讨外泌体的作用来源于t . spiralis肌肉幼虫(Ts外泌体)在肠上皮屏障上,我们从t . spiralis采用经典的超离心方法。TEM和NTA显示圆形和典型的杯状外泌体,如先前报道的[20.],大多数膜结构尺寸在60至120纳米之间(图2)1Western blot分析证实特异性标记蛋白CD63的存在(图3)1C).综上所述,这些结果表明成功获得了Ts挂式。然后,确定是否Ts外显子被ipec占用,我们孵育pkh26标记TsIPEC-J2细胞的外显子。如图所示1D、生理状态下;Ts外泌体在6 h时被上皮细胞显著内吞,摄入的外泌体数量呈明显的时间依赖性增加,特别是在24 h时,表明外泌体可以进入IPEC-J2细胞。
TsExos影响ipec的增殖
的影响TsCCK8检测试剂盒检测外显子对细胞增殖的影响。结果表明,暴露于20 μg/mL的细胞TsExos的增殖没有变化(P> 0.05)。但细胞活力明显降低(P< 0.001)时TsExos≥100 μg/mL。当ipec与TsExos作用3、6 h时,细胞活力曲线随浓度的增加呈下降趋势,而诱导12、24 h时,细胞增殖曲线呈明显下降趋势。此外,在48 h时间点,对细胞增殖没有影响,表明外泌体已经降解(图2)2).因此,150µg/mLTs选择Exos作为后续实验的工作浓度,与细胞共培养12或24 h,使细胞增殖率降低30%。
的影响Tsipec生理生化状态的外显子
基于的结果Ts外显子对细胞增殖的影响Ts外显子对细胞通透性、细胞毒性、氧化应激和凋亡的影响。首先,为了评估单层细胞的细胞通透性,我们使用多功能微孔板阅读器测量了fitc标记的葡聚糖。实验表明,经过孵育Ts与ipec作用12 h后,fitc -葡聚糖的荧光强度较对照显著增加(P< 0.001), fitc -葡聚糖含量随时间持续增加(图2)3.此外,我们分析了……的影响Ts通过在490 nm处测定乳酸脱氢酶(LDH)水平来观察细胞毒性。结果表明,两者之间没有差异。P> 0.05),但共孵育24 h后LDH含量明显升高(图2)3.B)。随后,通过荧光微孔板阅读器和荧光显微镜测量ROS水平来估计氧化应激。如图所示3.C和D,两种方法均表明荧光强度在24 h (P< 0.001;P< 0.01),与对照组比较差异无统计学意义(P用酶标仪测定12 h荧光强度时,细胞处理组与细胞对照组之间的差异为> 0.05);然而,一个显著的差异(P荧光显微镜下观察到< 0.01)。
通透性、细胞毒性、氧化应激和细胞凋亡的测定。Ts挂式(150 μg/mL)与ipec孵育不同时间,然后进行测定。一个通过检测fitc -葡聚糖在493 nm激发和517 nm发射波长下的荧光强度来测定细胞通透性。B通过评估LDH在OD下的水平来确定细胞毒性490.在488 nm激发和525 nm发射波长下,用荧光微孔板读卡器检测细胞氧化应激(C)和放大倍数为20× PL FL的荧光显微镜,比例尺为100 μm (D).膜联蛋白V和PI染色后流式细胞术检测ipec的凋亡情况(E),用Hoechst 33258染色(F),并利用Western blotting分析Bax和Bcl-2的相对表达(G).所有试验均为三次,数据以均数±标准差表示。*P< 0.05, **P< 0.01, ***P与IPEC + PBS组比较< 0.001。
最后,影响Ts采用流式细胞仪、Hoechst 33258染色和Western blotting检测细胞凋亡的外显子。结果表明,暴露12 h和24 h诱导的早期和晚期细胞凋亡率均高于对照组TsExos分别是对照组的1.8倍和3.2倍(图2)3.E)。此外,Hoechst 33258检测细胞凋亡的结果与FCM结果一致,这也验证了Ts与对照组相比,Exos显著诱导ipec细胞凋亡(图2)3.F)。采用Western blotting检测促凋亡(Bax)和抗凋亡(Bcl-2)蛋白的表达,并通过ImageJ软件分析各条带的灰色值(图2)3.G)。同样,12 h时Bax蛋白表达量显著高于对照组(P< 0.001),而Bcl-2蛋白表达量显著低于对照组(P< 0.001)。
的影响Ts外显子对ipec先天免疫的影响
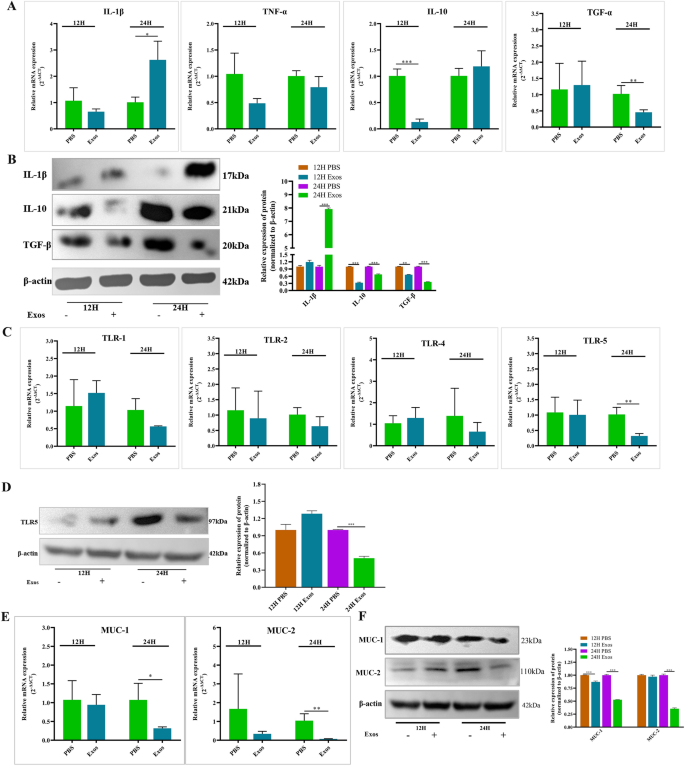
分析…的影响Ts我们检测了ipec产生的细胞因子、toll样受体和粘蛋白的转录和蛋白水平。采用RT-qPCR分析IL-1β、TNF-α、IL-10和TGF-β转录水平的变化,结果显示IL-1β的生成明显增加,而细胞因子IL-10和TGF-β均明显降低(图2)4A).为了进一步证实ipec产生的细胞因子的变化,我们采用Western blotting检测不同组IL-1β、IL-10和TGF-β的表达。Western blotting结果与RT-qPCR结果一致(图2)4B),这表明ipec诱导后IL-1β上调,IL-10和TGF-β均下调TsExos证明了这一点TsExos可以促进细胞炎症。
此外,我们使用RT-qPCR检测了ipec中toll样受体(TLR1, TLR2, TLR4, TLR5)的mRNA水平。结果表明,24 h时只有TLR5的转录水平明显高于对照组(P< 0.01)4C)。与对照组相比,TLR5蛋白水平在24 h时也显著降低(P< 0.001)(图4D)。
我们继续通过RT-qPCR检测ipec中粘蛋白(MUC1和MUC2)的转录水平。如图4E显示,MUC1和MUC2 mRNA水平显著降低(P< 0.05;P< 0.01)TsExos和ipec共培养24 h(图2)4E)。此外,Western blotting检测MUC1和MUC2的蛋白表达与RT-qPCR结果一致(图2)4F),表明TsExos可诱导ipec中粘蛋白的低表达。
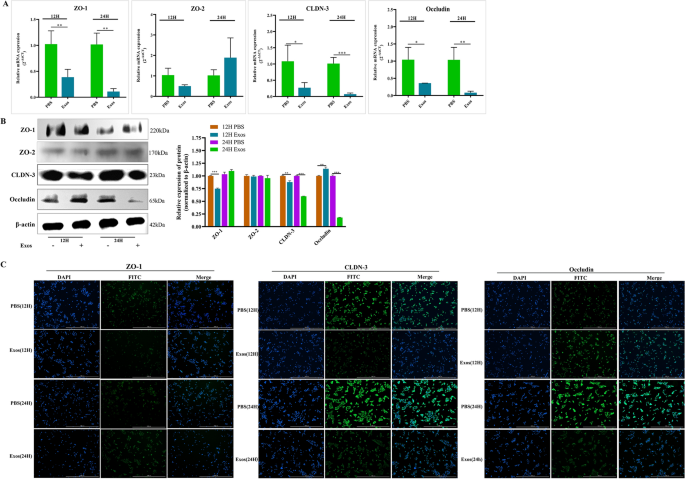
的影响Tsipec紧密连接上的外显子
评价评价…的效果Ts在ipec紧密连接上的外显子,我们测定了ipec中紧密连接相关蛋白的转录和蛋白水平。首先,我们使用RT-qPCR分析了不同紧密连接相关基因(ZO-1、ZO-2、CLDN-3和Occludin)的转录水平变化。结果如图所示5一个。Ts与对照组相比,Exos显著降低了ZO-1、CLDN-3和Occludin的转录水平(P< 0.01,P< 0.05,P< 0.05), 24 h mRNA的相对表达量明显下降TsExos未引起ZO-2转录水平的显著变化(P> 0.05)。随后,我们使用Western blotting和免疫荧光进一步验证RT-qPCR结果。Western blotting结果显示,与对照组相比,12 h时ZO-1和CLDN-3的表达水平显著降低(P< 0.001;P< 0.01)TsExos导致CLDN-3在24 h时低表达。我们还观察到,与对照组相比,Occludin的表达在12 h时显著上调(P< 0.01),与RT-qPCR检测结果比较;但在24 h时,Occludin的表达水平明显低于对照组(P< 0.001)。ZO-2蛋白表达未见变化,与RT-qPCR结果一致(图2)5B).此外,免疫荧光结果显示与Western blotting相同的趋势,表明TsExos通过降低ZO-1、CLDN-3和Occludin的表达影响ipec的紧密连接(图2)5C)。
讨论
肠上皮细胞是抵抗肠道内抗原、毒素和有害物质的第一道防线,既是物理屏障,也是肠黏膜免疫的参与者[21]。因此,细胞活力与细胞毒性、损伤、凋亡和炎症反应之间的平衡是维持上皮细胞正常屏障功能的关键[22]。源自肌肉幼虫t . spiralis被寄主摄食后,被释放到肠道内,完成其入侵、定植、繁殖等生命周期阶段。最近的研究表明,来自各种寄生虫的外泌体在信息交换、与宿主细胞相互作用和避免免疫排斥方面发挥着重要作用[23,24,25,26]。因此,探索外泌体的分泌机制t . spiralis在其入侵过程中对旋毛虫病的防治具有重要意义。
在本研究中,IPEC-J2细胞用不同浓度的Ts结果表明,随着浓度和时间的增加,细胞增殖能力下降,但在48 h时细胞活力没有差异。最后,我们选择150µg/mLTsExos作为后续实验和共培养的工作浓度TsExos与细胞作用12或24小时,使细胞增殖率降低30%。Liang等。[27结果表明,100、150和200 μg/mL的外泌体刺激48 h后,左旋细胞的活力显著降低t . asiatica成虫,这与浓度一致TsExos在我们的研究中,但诱导时间不同。
研究发现,细胞外囊泡来自寄生虫小束gigantica与人肝内胆道上皮细胞活性氧水平升高有关,并诱导自噬和DNA损伤及修复过程[28]。Lisette等。[29[3]结果表明,与黄曲霉Pan4菌株的锥乳线虫细胞外囊泡孵育的细胞t·克鲁兹它在宿主细胞中诱导了许多变化,包括细胞通透性的变化和细胞内钙水平的提高2+.因此,我们进行了一系列的实验来研究是否TsExos还影响肠上皮细胞的生理生化过程。基于…的影响Ts外泌体对肠上皮细胞增殖的影响,本研究探讨了外泌体对肠上皮细胞屏障功能的影响,包括渗透性、细胞毒性、氧化应激和凋亡。结果表明:Tsipec摄取外显子可导致一系列变化,如通透性增加、细胞毒性和氧化应激水平升高、细胞凋亡异常以及细胞反应调节。
上皮细胞的紧密连接是维持屏障功能和正常生理状态的基础,紧密连接的中断可显著改变细胞的通透性,使病原体容易侵入机体,这是许多病理状态的标志。随着进一步的研究,更多的细胞因子(炎症因子、趋化因子、肿瘤坏死因子)已在各种体内和体外研究中被证明影响紧密连接,并已被证明调节人体的内稳态和应激反应[30.,31]。此外,早期研究表明,不同的tlr参与致病性感染过程中紧密连接的调节,在维持肠上皮屏障的完整性方面发挥重要作用[32]。粘蛋白在完整肠粘膜屏障中的比例保持平衡。肠道一旦被病原体感染,就会影响粘蛋白的表达和分布[33]。因此,我们进一步研究了Ts外显子对ipec先天免疫的影响。这项研究发现TsExos可诱导IPEC-J2细胞IL-1上调,IL-10和TGF-α下调,促进炎症反应。TLR5的表达明显降低,提示TsExos通过影响TLR5的表达调节上皮细胞的屏障功能。在本实验中,MUC-1和MUC-2的表达水平较低,这可能与寄生虫在宿主攻击下的存活有关。
细胞的紧密连接是维持上皮屏障功能和完整性的关键,而这主要依赖于紧密连接蛋白[34]。在本研究中,IPEC-J2细胞由Ts结果显示,ZO-1、CLDN-3、Occludin的表达水平显著下调,说明TsExos影响ipec的紧密连接。一项研究(2021)表明,ES抗原中的丝氨酸蛋白酶t . spiralis通过MAPK信号通路降低Caco2细胞中紧密连接蛋白的表达[35],这与……的效果相似Ts在我们的研究中紧密连接蛋白的外显子。
总之,TsExos进入IPEC-J2细胞后参与细胞各种生命活动的调控。TsExos可降低细胞活力,提高细胞通透性,引起细胞损伤,引起过度氧化应激,引起异常凋亡。此外,TsExos促进细胞的炎症反应,影响toll样受体介导的信号转导,破坏细胞黏液防御系统和细胞的紧密连接。因此,外泌体在细胞凋亡过程中起着重要的作用t . spiralis入侵宿主。
数据和材料的可用性
本研究中使用或分析的数据集可按合理要求从通讯作者处获得。
参考文献
张勇,曾军,宋云云,龙绍林,刘汝德,蒋鹏,张翔,崔健,王志强(2020)一种新型胰蛋白酶在小鼠免疫中的应用旋毛虫引起对幼虫攻击的免疫保护。疫苗8:437
徐健,杨峰,杨德清,姜平,刘汝德,张旭,崔健,王志强(2018)旋毛虫半乳糖凝集素及其在幼虫侵袭宿主肠上皮细胞中的作用。退伍军人49:79
明丽,彭瑞,张丽,张春林,吕平,王志强,崔健,任海军(2016).入侵旋毛虫感染幼虫对体外肠上皮细胞炎症因子水平的影响。寄生虫学实验170:220-226
Javkar T, Hughes KR, Sablitzky F, Behnke JM, Mahida YR(2020)慢循环肠道干细胞和paneth细胞的反应旋毛虫感染。《寄生虫学》74:101923
Coakley G, Maizels RM, Buck AH(2015)外泌体和其他细胞外囊泡:寄生虫感染的新通讯媒介。寄生虫杂志31:47 - 489
Zamanian M, Fraser LM, Agbedanu PN, Harischandra H, Moorhead AR, Day TA, Bartholomay LC, Kimber MJ(2015)人丝虫体内含rna外泌体样囊泡的释放与象皮病马来.科学通报,2011,29 (5):393 - 393
马刚,罗毅,朱华,罗毅,Korhonen PK, Young ND, Gasser RB,周锐(2016).植物的microrna犬弓蛔虫以及它们预期的功能角色。寄生虫媒介9:229
Freitas TC, Jung E, Pearce EJ (2007) tgf - β信号控制寄生扁虫胚胎发育曼氏裂体吸虫.PLoS Pathog 3: 52
田中俊,田中俊,田中俊,陈建平,陈建平,陈建平,陈建平,陈建平(2015)血小板源性生长因子C转基因小鼠肝纤维化和肿瘤发生率的研究。癌症科学106:1143-1152
杨建军,杨建军,杨建军,等(2016)寄主-寄主-寄主-寄主-寄主-寄主-寄主-寄主-寄主-寄主-寄主-寄主-寄主-寄主-寄主-寄主-寄主-寄主-寄主-寄主-寄主-寄主-寄主中国生物医学工程学报,2008 (8):344 - 344
李建军,李建军,李建军,等(2019)细胞外囊泡对寄生虫存活的影响。科学363:817 - 818
宋云云,陆qq,韩立林,闫文文,张晓忠,刘汝德,龙绍林,崔健,王志强(2022)旋毛虫肠道感染性幼虫破坏肠道上皮细胞单层连接,介导幼虫侵袭。箴言53:19
顾勇,魏军,杨军,黄军,杨霞,朱霞(2013)抗旋毛虫多表位疫苗在小鼠模型中的诱导感染。PLoS One 8:e77238
魏慧,钱鑫,谢峰,崔丹(2021)肺癌患者血清外泌体的超高速离心与沉淀分离方法的比较。安:传医9:882
刘慧,沈敏,赵汝德,段勇,丁超,李慧(2019)雷公藤甲素负载外泌体对人卵巢癌SKOV3细胞增殖和凋亡的影响。生物医学学报,2019:2595801
张斌,杨艳,唐杰,陶艳,姜波,陈志,冯辉,杨玲,朱刚(2017)小鼠神经元与小胶质细胞共培养模型的建立及其作用机制。Oncotarget 8:43061 - 43067
吴晓霞,黄晓玲,陈瑞仁,李涛,叶海军,谢伟,黄志明,曹广志(2019)芍药苷预防肠道屏障破坏和抑制脂多糖(LPS)诱导的Caco-2细胞单层炎症。炎症42:2215 - 2225
Livak KJ, Schmittgen TD(2001)利用实时定量PCR和2(- δ δ c(t))方法分析相对基因表达数据。方法25:402 - 408
曹鑫,付敏,毕锐,郑鑫,付斌,田松,刘超,李强,刘军(2021)镉诱导BEAS-2B细胞凋亡和线粒体损伤的MAPK信号通路。臭氧层263:128346
Gupta S, Rawat S, Arora V, Kottarath SK, Dinda AK, Vaishnav PK, Nayak B, Mohanty S(2018)间充质干细胞培养上清液中外泌体分离的临时一步蔗糖缓冲超离心方法。干细胞研究,9点180分
Pitman RS, Blumberg RS(2000)第一道防线:肠上皮作为粘膜免疫系统活性成分的作用。[J] .胃肠病学杂志
Yan H, Ajuwon KM(2017)丁酸盐通过选择性上调紧密连接蛋白和激活AKT信号通路来调节IPEC-J2细胞的肠道屏障功能。PLoS ONE 12:e0179586
Szempruch AJ, Sykes SE, Kieft R, Dennison L, Becker AC, Gartrell A, Martin WJ, Nakayasu ES, Almeida IC, Hajduk SL, Harrington JM(2016)细胞外囊泡锥虫属brucei介导毒力因子转移,引起宿主贫血。细胞164:246 - 257
李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军。(2018)钩虫细胞外囊泡对小鼠诱导性结肠炎的影响。前方免疫:9:8 0
Eichenberger RM, Talukder MH, Field MA, Wangchuk P, Giacomin P, Loukas A, Sotillo J(2018)表征鞭虫缪里斯分泌蛋白和细胞外囊泡为宿主-寄生虫通讯提供了新的见解。[J]细胞外囊泡
张建军,张建军,张建军,张建军,等(2018)细胞外囊泡诱导免疫保护鞭虫缪里斯.寄生虫免疫学杂志40:e12536
梁鹏,李艳,毛玲,刘涛,张森,爱山美,王丽,郭安,陈刚,罗旭(2021)外泌体刺激LoVo细胞转录组分析及自噬研究t . asiatica成虫。微生物9:994
郭安,王玲,bbbbx,张生,盛志,罗旭,黄伟,王松,蔡鑫(2021)细胞外囊泡的研究小束gigantica诱导细胞对宿主细胞的应激反应。寄生虫学实验231:108173
Retana Moreira L, Rodriguez Serrano F, Osuna A (2019)鲁兹锥体组织培养细胞衍生的锥乳线虫:诱导非寄生培养细胞的生理变化。中国生物医学工程学报,2011,31 (3):851 - 851
杨晓东,杨晓东,杨晓东,等(2000)细胞因子对细胞连接结构和功能的调控。Adv Drug delivery Rev 41:303-313
王晓明,王晓明,王晓明,等(2014)肠道上皮细胞凋亡、坏死和自噬与炎症性肠病的关系。生物医学杂志,2014:218493
Burgueno JF, Abreu MT(2020)上皮toll样受体及其在肠道稳态和疾病中的作用。国际肝病杂志(17):263 - 278
盛玉华,Hasnain SZ, Florin TH, McGuckin MA(2012)黏液蛋白在炎症性肠病和结直肠癌中的作用。[J]国际肝病,27:28-38
Suzuki T(2013)紧密连接对肠上皮通透性的调节。细胞与生命科学70:631-659
李超,白霞,刘霞,张艳,刘丽,张丽,徐峰,杨艳,刘敏(2021)Caco-2细胞单分子上皮屏障的排泄分泌产物破坏旋毛虫可能与丝氨酸蛋白酶有关。微生物学前缘:634185
致谢
我们感谢所有提供实验室协助的工作人员。
资金
国家自然科学基金项目(31372427)和畜禽疫病病原生物学国家重点实验室发展基金项目(SKLVEB2019KFKT011)资助。
作者信息
作者及单位
贡献
YL设计了这项研究。RW, YZ, J Zhen, J Zhang, ZP, XS, LL和FS进行了实验。YL和RW起草并修改了稿件。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
实验经哈尔滨医科大学动物伦理委员会批准,按照动物伦理准则和已批准的实验方案进行(动物伦理委员会批准文号SYXK [Hei] 2016-007)。
相互竞争的利益
作者宣称他们没有竞争利益。
额外的信息
出版商的注意
伟德体育在线b施普林格《自然》杂志对已出版的地图和机构的管辖权要求保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
王荣,张勇,甄杰。et al。外泌体的作用来源于旋毛虫感染幼虫对肠上皮屏障功能的影响。兽医Res53, 87(2022)。https://doi.org/10.1186/s13567-022-01108-y
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13567-022-01108-y
关键字
- 液
- 旋毛虫
- 屏障功能
- 紧密连接