摘要
葡萄球菌saprophyticus由于生物膜的形成,经常涉及各种难以治疗的感染。为了寻找有效的抗生素膜策略,本研究探讨了黄芩苷增强阿奇霉素抗多药耐药能力的作用及其机制葡萄球菌saprophyticus-Liu-2016-Liyang, china - lincolin (MDRSS)生物膜的体外和体内研究当阿奇霉素与黄芩苷联用时,阿奇霉素在生物膜中的最低抑菌浓度(MICB)降低了4 ~ 512倍。与阿奇霉素和黄芩苷组相比,阿奇霉素和黄芩苷联合使用不能降低生物膜生物量,但降低了生物膜的分散速率,提高了生物膜的杀菌能力。此外,与阿奇霉素和空白对照组相比,添加黄芩苷或阿奇霉素加黄芩苷可上调WalK/R系统相关基因的相对转录水平。WalK/R系统与抗菌指数呈强相关关系,表明黄芩苷通过调节WalK/R系统增强了阿奇霉素对MDRSS生物膜的杀菌作用。在小鼠皮肤感染模型中,阿奇霉素与黄芩苷联用能有效根除MDRSS,减轻病理损伤。本研究表明,黄芩苷有可能通过调节WalK/R系统,增强阿奇霉素对生物膜形式MDRSS的抑菌活性。
介绍
机会致病菌葡萄球菌saprophyticus是一种革兰氏阳性球菌,已成为牛乳腺炎的重要病原[1]、尿路感染[2]和弗兰克林眼炎[3.]。重要的是,葡萄球菌形成生物膜,然后进入代谢不活跃和耐抗生素的持续状态,以逃避抗生素应激[4]。此外,葡萄球菌形成生物膜的能力是促进定植和粘附上皮的毒力因子,导致复发或持续感染[5,6]。据估计,约80%的慢性感染与生物膜有关[7]。细菌一旦形成成熟的生物膜,对抗生素的耐药性就会达到最大[8]。对于某些抗生素来说,消灭无根细菌所需的浓度要比消灭浮游形式的同一菌株所需的浓度高1000倍[9]。阿奇霉素是一种大环内酯类抗生素,广泛用于治疗家禽的葡萄球菌和链球菌感染[10]。从各种样品中分离的凝固酶阴性葡萄球菌(CNS)中有60%对青霉素(90%)、复方新诺明(60%)、阿奇霉素(60%)和头孢曲松(40%)具有高度耐药[11]。然而,由于耐多药(MDR)病原体的迅速传播,治疗细菌感染的可用选择正在减少[12]。因此,迫切需要替代和创新的治疗策略来克服这些问题。
许多研究表明,多种抗生素佐剂可增强抗生素的效力并延缓耐药性的发展[13]。我们先前发现阿奇霉素与黄芩苷联合使用对多药耐药具有协同作用葡萄球菌saprophyticus-Liu-2016-Liyang, china - franklin (MDRSS) [3.]。黄芩苷,一种天然黄酮类化合物黄芩,与抗生素具有显著的协同抗葡萄球菌活性[14]。然而,阿奇霉素和黄芩苷对生物膜形式的MDRSS的反应尚未得到评价。
细菌的细胞膜和细胞壁是许多中药的靶点[15]。Zhang等人的研究报道了甲氧西林耐药中黄芩苷处理后细胞膜受损金黄色葡萄球菌(耐甲氧西林金黄色葡萄球菌)16]。在葡萄球菌中,WalK/R(也称为YycG/YycF)双组分系统(TCS)在细胞壁代谢中起着重要作用。WalK/R系统高度保守,对低G + C含量的革兰氏阳性细菌具有特异性。肽聚糖的生物合成和降解受到WalK/R系统的积极控制[17]。在葡萄球菌中,大多数细胞壁锚定蛋白是MDRSS生物膜基质的组成部分[18],具有共同的细胞壁靶向基序(LPXTG),并通过分选酶a (SrtA)附着在细胞壁的肽聚糖上[19]。
综上所述,我们假设黄芩苷通过调节WalK/R系统促进肽聚糖的代谢并减少msrpm的锚定。阿奇霉素的通透性增加,并与黄芩苷协同作用。迄今为止,黄芩苷作为佐剂对阿奇霉素抗膜性能的增强作用尚不清楚。本研究评价了黄芩苷通过调节WalK/R系统,提高阿奇霉素对嵌入生物膜的固菌的杀菌活性。此外,还研究了阿奇霉素和黄芩苷对小鼠MDRSS生物膜感染的限制作用。
材料与方法
微生物菌株,培养基和培养条件
本研究使用的阿奇霉素MDRSS (1000 mg/L阿奇霉素MIC)从国内收集Francolinus pintadeanus患有眼炎,来自中国江苏省。在我们之前的研究中,MDRSS被命名为ARSS [3.,18,20.]。在37℃条件下,用Mueller-Hinton Broth (MHB)(中国青岛Hopebio公司)或Brain - Heart Infusion Broth (BHIB)(中国北京Solarbio公司)进行培养。
生物膜药敏试验
为了检测黄芩苷和阿奇霉素的抗生物膜活性,采用两倍连续稀释法测定了两种药物对生物膜细胞(MICB)的最低抑制浓度。生物膜的制备方法如前所述[21做了一些修改。简单地说,隔夜MDRSS培养稀释到1 × 105BHIB中的CFU/mL。96孔聚苯乙烯平板微滴板每孔中滴入100 μL细菌。为了促进生物膜的形成,将平板在37℃的潮湿环境中静态孵育24 h。孵育后,丢弃培养基,用磷酸盐缓冲盐水(PBS)轻轻洗涤生物膜,以去除不粘附的细菌。黄芩苷和阿奇霉素溶液在MHB中连续稀释(2倍),分别得到18 000 ~ 562.5 mg/L和24 000 ~ 11.72 mg/L的浓度。然后,稀释后的溶液与预成型的生物膜在37℃下共孵育18小时。MICB被记录为抑制可见生长的最低药物浓度[22]。
预先形成的生物膜的棋盘试验
采用棋盘法测定黄芩苷对阿奇霉素抗膜活性的辅助作用。制备成熟的MDRSS生物膜,如上文“生物膜的药敏试验”小节所述。将阿奇霉素和黄芩苷在96孔板的柱和行上依次稀释(2倍),加入100 μL的混合物到生物膜中。阿奇霉素和黄芩苷的浓度范围与生物膜药敏试验的浓度范围一致。37℃不搅拌孵育24 h。MICB被定义为药物的最低浓度,没有明显的生长。采用分数杀菌浓度指数(FBCI)测定药物的增效或拮抗作用。微滴板中每个有效组合(即对应MICB的所有孔)的FBCI由下式计算:
FBCI值bbb4表示拮抗,0.5 - 4表示无相互作用,≤0.5表示协同[23]。
阿奇霉素和黄芩苷对预成型生物膜的根除作用
为检测阿奇霉素和黄芩苷对预成型生物膜的根除效果,将预成型生物膜暴露于药物24h后,测量生物膜生物量。简单地说,按照上文“生物膜的药敏试验”小节所述的方法制备成熟生物膜。将生物膜分别在新鲜MHB(空白对照组)、MHB加1/4 MICB黄芩苷(Bac组)、MHB加1/32 MICB阿奇霉素(Azm组)、1/32 MICB阿奇霉素加1/4 MICB黄芩苷(Azm + Bac组)中37℃孵育24 h。孵育后,采用结晶紫染色法测定每孔生物膜的生物量。用无菌PBS仔细洗涤每孔,去除浮游细胞,2.5%戊二醛固定1.5 h,最后风干。用1% (wt/vol)结晶紫对孔中的生物膜染色20分钟。然后用PBS彻底冲洗孔,直到阴性对照(不含生物膜)的孔变为无色。最后,加入33%的冰醋酸溶解吸收的结晶紫。570nm处吸光度(一个570)用Multiskan FC微孔板阅读器(Thermo, USA)检测。
生物膜分散试验
为了研究药物对生物膜分散的影响,按照前面的描述进行了生物膜分散试验,并进行了轻微的修改[24]。成熟的MDRSS生物膜是在96孔聚苯乙烯平板微滴板上制备的。生物膜药敏试验”一节。根据不同处理分为Bac组、Azm组、Azm + Bac组和空白对照组。分别用黄芩苷(Bac组)、阿奇霉素(Azm组)和阿奇霉素+黄芩苷(Azm + Bac组)攻毒。空白对照组用等体积培养基处理。阿奇霉素和黄芩苷的最终浓度分别为1/32 MICB和1/4 MICB。孵育后,上清液中的细菌(C年代解析:选Cb),在PBS中按1:10稀释以测定菌落形成单位(CFU)。色散比用公式C计算年代/ (C年代+ Cb)。每个试验进行3个独立的生物重复。
阿奇霉素与黄芩苷的杀菌作用
为了检测阿奇霉素和黄芩苷的杀菌效果,测定了CFU计数和PI/总荧光强度的比值。
为了定量培养细胞,制备成熟的生物膜并进行处理。阿奇霉素和黄芩苷对预成型生物膜的根除作用”一节。将形成的生物膜超声分散20 min,收集细菌上清液,用PBS连续稀释1:10,镀在甘露醇盐琼脂(MSA)板上。37℃孵育18-24 h后,计数菌落,活细胞数以log记录10CFU。
用于PI/总荧光比值测定,1毫升1 × 105将CFU/mL MDRSS培养物添加到含有盖玻片的6孔板中生长生物膜。24小时后,用PBS仔细清洗生物膜。然后分别添加和联合添加阿奇霉素和黄芩苷,培养24 h,阿奇霉素和黄芩苷的最终浓度分别为1/32 MICB和1/4 MICB。孵育后,丢弃培养基,使用荧光LIVE/DEAD Baclight™细菌活力试剂盒L7012 (Molecular Probes, Invitrogen)根据制造商的说明对贴壁生物进行染色。在每个样品中加入SYTO9和PI(终体积为1ml),在室温下黑暗孵育15分钟。最后,用0.85%的NaCl彻底洗净这些切片。在A1共聚焦激光扫描显微镜(CLSM) (Nikon, Japan)下观察荧光图像。
扫描电镜分析MDRSS的形态
采用扫描电镜观察药物对MDRSS形态学的影响。生物膜在24孔聚苯乙烯平板微滴板中制备,该微滴板含有8毫米圆形盖玻片,如“阿奇霉素与黄芩苷的杀菌作用”一节。将生物膜与黄芩苷、阿奇霉素、阿奇霉素与黄芩苷复配共孵育。37℃孵育24 h,阿奇霉素和黄芩苷的最终浓度分别为1/32 MICB和1/4 MICB。孵育后,每个生物膜片用PBS冲洗,在2.5%戊二醛中固定,在4℃下过夜。随后,用乙醇梯度脱水,干燥,并涂上金进行扫描电镜观察(S3400N,日立,日本)。
生物膜上清液中碱性磷酸酶和β-半乳糖苷酶的含量
为了量化抗MDRSS处理诱导的细胞通透性,在24孔板中制备成熟的MDRSS生物膜,然后用阿奇霉素、黄芩苷或阿奇霉素加黄芩苷培养。阿奇霉素和黄芩苷对预成型生物膜的根除作用”一节。孵育24 h后,收集上清液,用0.22 μm注射器过滤器过滤。采用碱性磷酸酶(AKP)测定试剂盒(Solarbio,北京,中国)和β-半乳糖苷酶(β-GAL)测定试剂盒(Solarbio,北京,中国),分别测定碱性磷酸酶(AKP)和β-半乳糖苷酶(β-GAL)活性。
RT-PCR检测WalK/R系统相关基因的转录水平
为了确定药物对WalK/R系统的影响,WalK/R系统相关基因的转录水平(走,WalR,yycI,yycH),采用RT-PCR方法对MDRSS生物膜进行检测。引物采用Primer 6.0软件设计,序列如表所示1。利用管家基因16S rRNA的表达水平使靶基因的表达正常化。生物膜的制备和处理方法如上所述阿奇霉素和黄芩苷对预成型生物膜的根除作用”一节。收集各组生物膜进行RNA提取。使用RNAiso Plus Reagent (Angle, China)提取总RNA。使用NanoDrop™One (Thermo, USA)检测RNA浓度。用Hiscript II 1st Strand cDNA Synthesis Kit (Vazyme, China)按照说明书从提取的RNA生成cDNA。采用ChamQ SYBR qPCR Master Mix (Vazyme,中国),在StepOne PCR仪(Applied Biosystems, USA)上按照制造商的说明进行实时PCR。循环程序如下:保温阶段,95°C, 3min;循环阶段,95℃10 s, 60℃60 s,循环40次;熔化曲线阶段,95°C 15 s, 60°C 60 s, 95°C 15 s。
小鼠皮肤脓肿感染模型
为了评价黄芩苷对体内阿奇霉素抗生素膜活性的辅助作用,我们按照前文所述进行了一些修改,建立了小鼠皮肤脓肿感染模型[25]。将50只体重为18 ~ 22 g的小鼠随机分为黄芩苷(Bac)处理组、阿奇霉素(Azm)处理组、阿奇霉素与黄芩苷联合(Azm + Bac)处理组、MDRSS (SS)处理组和空白对照(BC)处理组。从第1天至第3天,腹腔注射环磷酰胺,剂量为30 mg/kg/天。第3天,在双侧皮下植入无菌1 cm管段。第4天,除BC组外,其余小鼠均注射2 × 108CFU MDRSS悬液环绕种植体。7日开始治疗th每天一次,连续3天。Bac组小鼠皮下注射黄芩苷,剂量为30 mg/kg。Azm组给予阿奇霉素75 mg/kg, Azm + Bac组给予阿奇霉素75 mg/kg和黄芩苷30 mg/kg;另一组则给予等量生理盐水。
末次给药后24 h颈椎脱臼安乐死。为了评估细菌的定植,收集种植体和周围组织,称重,均质,连续稀释,并在含有0.488 mg/L阿奇霉素的MSA板上计数CFU。组织病理学检查,周围组织在4%多聚甲醛中固定过夜,然后石蜡包埋。切片(厚度4 μm),用血红素和伊红(H&E)染色,光镜下观察。使用BC-2800自动血液学分析仪(中国迈瑞)从眼球采集血液样本进行常规血液检查。最后,将剩余组织快速冷冻在液氮中保存。IL-1β、TNF-α、CXCL2,及CCL2用ELISA试剂盒(Angle, China)按照生产厂家的说明进行检测。
数据分析
WalK/R系统相关基因转录物水平与杀菌效果标记物之间的相关性采用Spearman相关系数。相对基因表达数据采用2−ΔΔCT方法。其他数据的统计分析采用Kruskal-Wallis检验,不同组间采用SPSS软件包Version 20.0 (IBM, USA)进行事后Wilcoxon-Mann-Whitney或Dunn检验。结果以均数±标准差(SD)表示。对于所有的分析,ap值等于或小于0.05被认为是显著的。
结果
黄芩苷与阿奇霉素协同作用抗MDRSS生物膜
为了确定黄芩苷-阿奇霉素联合用药对MDRSS生物膜细胞的协同作用,采用黄芩苷-阿奇霉素联合用药对MDRSS预成型生物膜的作用进行了实验。结果如表所示2。单独使用时,阿奇霉素和黄芩苷对MDRSS生物膜细胞的MICBs分别为6000 mg/L和9000 mg/L。然而,当阿奇霉素和黄芩苷联合使用时,发现抗菌活性有很强的增强(表1)3.)。在服用阿奇霉素和黄芩苷时,阿奇霉素的MICBs降低了4- 512倍。黄芩苷与阿奇霉素的FBCI值为0.25 ~ 0.5020。结果表明,阿奇霉素与黄芩苷具有协同作用。
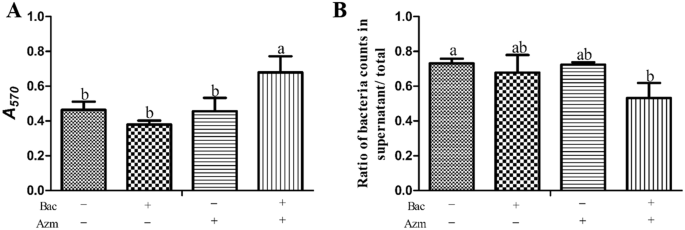
阿奇霉素与黄芩苷联用对成熟生物膜没有根除作用,但对生物膜脱离有抑制作用
为了研究阿奇霉素和黄芩苷对预成型生物膜的清除和脱离作用,测定了生物膜的质量和分散率。黄芩苷或阿奇霉素均未使MDRSS的生物膜质量降低(图2)1A).添加阿奇霉素和黄芩苷后,生物膜质量显著高于其他组(p< 0.05)。在分散试验中,与未处理组相比,阿奇霉素和黄芩苷联合使用显著抑制了MDRSS原有生物膜的分散。Bac、Azm和空白对照组之间无显著差异。然而,Bac组的弥散率低于Azm和空白对照组(图2)1B).这些结果表明黄芩苷不能增强阿奇霉素根除生物膜的作用,但能抑制生物膜的脱离。
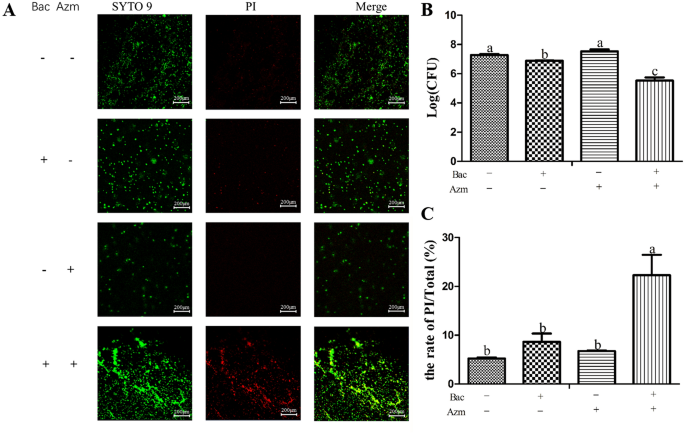
黄芩苷增强了阿奇霉素对预成型生物膜的杀菌作用
为探讨黄芩苷是否能增强阿奇霉素对MDRSS生物膜的杀菌作用,将MDRSS生物膜分别暴露于阿奇霉素和黄芩苷后,对可培养细胞进行定量检测。如图所示2B,与Bac、Azm和空白对照组相比,阿奇霉素和黄芩苷联合使用显著减少了可培养细胞的数量,减少了56倍(p< 0.05)。Bac组可培养细胞的数量显著低于空白对照组和Azm组(p< 0.05)。然后用CLSM对这些结果进行验证。在Azm + Bac组,大多数细菌被PI染色。然而,在其他组中,只有少数细菌被PI染色(图2)2A)。与其他组相比,阿奇霉素与黄芩苷联合用药可显著提高PI荧光强度/总荧光强度比率(p< 0.05,图2C)。空白对照、Bac和Azm组之间PI/总荧光强度的比率无显著差异(p> 0.05)。但Bac组PI/总荧光强度的比值高于Azm组和空白对照组。
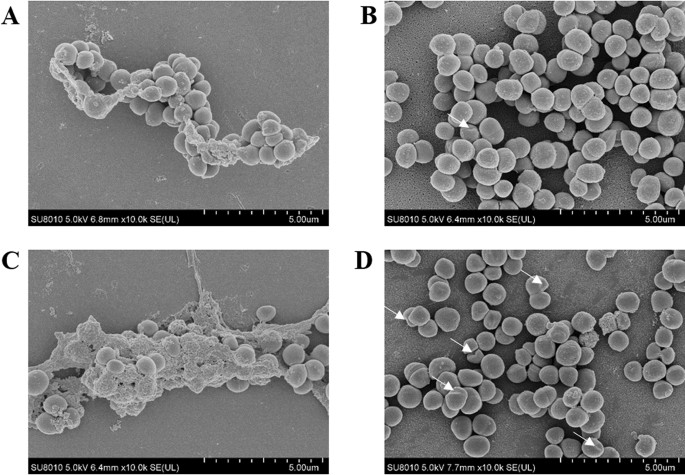
阿奇霉素和黄芩苷作用后的形态学变化
在SEM研究中,空白对照组和Azm组的细胞外观完整,饱满,典型的球形,表面光滑,细菌被细胞外聚合物(EPS)包裹(图2)3.一个和C)。很少有细菌表现出不规则和崎岖的表面。阿奇霉素与黄芩苷联合处理引起的形态学变化如图所示3.D,这表明阿奇霉素和黄芩苷联合使用会对细菌细胞造成损伤。Bac组有少量细胞受损(图2)3.B).同时,Bac和Azm + Bac组细菌表面光滑,无EPS。这些结果与CLSM和抗菌试验相同。
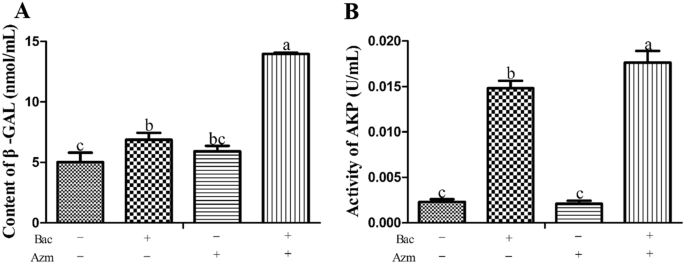
黄芩苷增强了阿奇霉素对细菌通透性的影响
为了检测阿奇霉素和黄芩苷对细菌通透性的影响,测定了AKP和β-GAL在上清液中的释放量。如图所示4,在预成型生物膜孔中加入黄芩苷+阿奇霉素后,上清液中AKP活性和β-GAL含量显著高于其他组(p< 0.05)。Bac组的AKP活性显著高于Azm组和空白对照组(p< 0.05)。在β-GAL含量方面,Bac组仅显著高于空白对照组(p< 0.05)。空白对照组与Azm组之间无显著差异(p> 0.05)。上述结果提示黄芩苷可以提高阿奇霉素破坏细菌细胞壁和细胞膜的作用,最终导致AKP和β-GAL的渗漏。
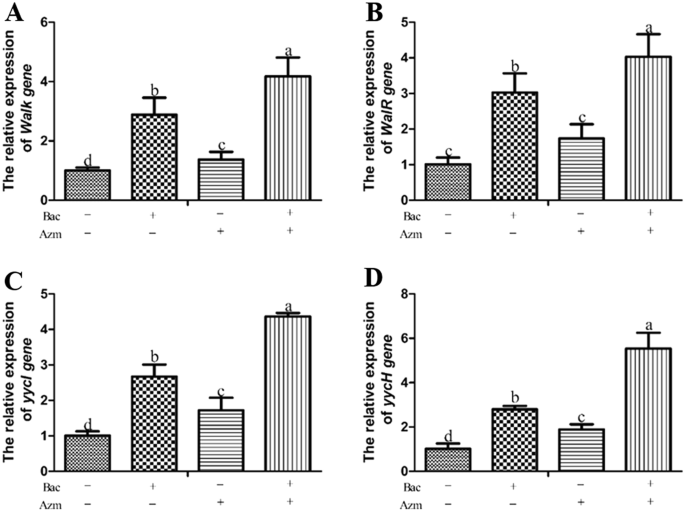
阿奇霉素和黄芩苷对WalK/R系统相关基因转录水平的影响
通过RT-PCR检测WalK/R系统相关基因的转录水平,确定阿奇霉素和黄芩苷对WalK/R系统的影响。如图所示5,与Azm和空白对照组相比,黄芩苷可显著提高WalK/R系统相关基因的转录水平(p< 0.05)。Azm + Bac组WalK/R系统相关基因转录水平显著高于其他组(p< 0.05)。
WalK/R系统与杀菌指数的Spearman相关系数
WalK/R系统与杀菌指标的相关系数见表4。这些结果表明,WalK/R系统相关基因的转录水平与上清液中β-GAL含量和AKP活性呈正相关。WalK/R系统相关基因的转录水平与β-GAL (p< 0.01)。
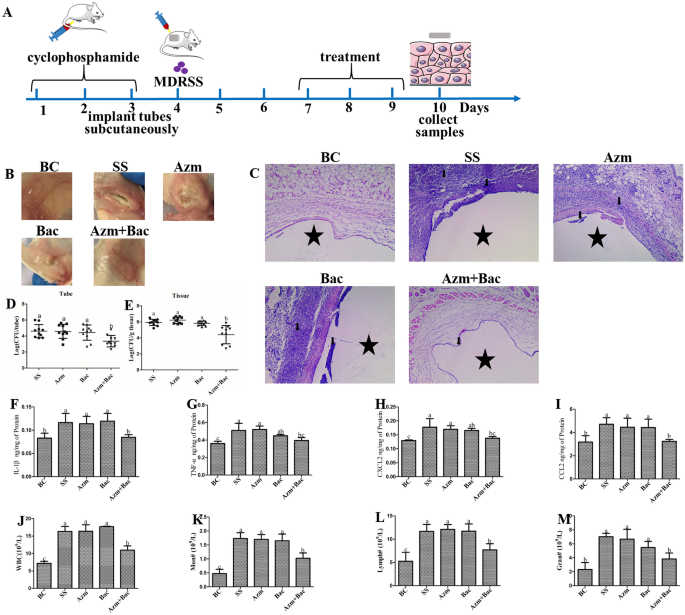
黄芩苷能增强阿奇霉素治疗生物膜感染的疗效
考虑到阿奇霉素和黄芩苷的吸引增强作用,我们在小鼠侧翼植入物感染模型中评价了阿奇霉素和黄芩苷的体内药效。除BC组外,各组种植体周围均可见明显脓肿。与SS组、Azm组和Bac组相比,阿奇霉素与黄芩苷联用能减轻大鼠的损伤。镜下检查,BC组种植体周围软组织未见病变(图2)6B)。然而,SS、Azm和Bac组小鼠的组织病理学显示少量门静脉周围炎症细胞(箭头所示)浸润到感染部位。随着阿奇霉素和黄芩苷的加入,炎症细胞数量减少(图2)6此外,阿奇霉素和黄芩苷联合使用显著降低了种植体和周围软组织中的细菌数量、IL-1β和CCL的表达2血浆中白细胞、淋巴细胞、单核细胞和中性粒细胞的数量与SS、Azm和Bac组相比(p< 0.05)。但SS、Azm、Bac组间差异无统计学意义。TNF-α和CXCL水平2与Azm + Bac组相似(图2)6D-M)。综上所述,黄芩苷增强了阿奇霉素治疗生物膜感染的疗效。
在已建立的小鼠植入物感染模型中,阿奇霉素与黄芩苷联合使用对MDRSS有较好的体内抗感染效果。Azm:阿奇霉素治疗组;Bac:黄芩苷处理组;Azm + Bac:阿奇霉素联合黄芩苷治疗组。MDRSS:耐多药葡萄球菌saprophyticus;BC:空白对照组;SS:耐多药葡萄球菌saprophyticusLiu-2016-Liyang, China-francolin (MDRSS)对照组。植入皮下管感染MDRSS菌株。10日处死小鼠th的一天。一个小鼠种植体感染模型实验方案。B组织学变化。CH&E染色分析病理变化。星号表示植入物的位置。箭头表示炎症细胞的位置。放大:×200。D,EICR小鼠植入物和植入物周围组织的MDRSS滴度。il - 1β(F)、tnf -α (G), CXCL2(H)和CCL2(我)用ELISA试剂盒检测MDRSS感染种植体周围组织的细胞因子表达谱。白血球(J)、单核细胞(K)、淋巴细胞(l),以及中性粒细胞(米)在血液中被检测到。数据以均数±标准差表示。在同一指数中,a-c中顶部字母不同的曲线图表示统计上显著的结果(p< 0.05),而用相同字母标记的条形图对应的结果无统计学显著差异。
讨论
生物膜相关感染的治疗既麻烦又昂贵[26]。这是由于生物膜嵌入细胞的代谢活性降低和EPS所赋予的保护。目前,很少有新的候选抗生素可用[27]。近年来,协同药物联合治疗已成为治疗耐多药细菌感染的一种新型多模式治疗方法[28]。此前,我们发现阿奇霉素和黄芩苷对浮游形式的MDRSS有协同作用[3.]。在本研究中,我们发现黄芩苷作为佐剂可以增强阿奇霉素在生物膜形式下抗MDRSS的能力(表1)2和3.;数字2)。生物膜发育阶段表现出以下主要事件:初始附着、生物膜成熟和扩散[29]。在我们之前的研究中,我们发现MDRSS生物膜在24至48小时内分散[20.]。在本研究中,阿奇霉素和黄芩苷在24 ~ 48 h内的生物量并没有减少(图2)1A)。然而,阿奇霉素和黄芩苷联合使用可显著抑制MDRSS的脱离(图2)1B).这些结果表明黄芩苷通过灭活MDRSS和抑制生物膜的扩散来增强阿奇霉素的作用。
葡萄球菌的生物膜基质是一种复杂的胶,它将所有的细胞包裹在成熟的结构中,它由蛋白质、多糖和eDNA组成[29]。生物膜的细胞外基质为细菌抵抗宿主免疫系统和抗微生物剂的渗透提供了安全屏障,这使得生物膜本身难以治疗,从而导致了一个重要的卫生保健问题[30.]。扫描电镜分析显示,与空白对照和Azm组相比,黄芩苷单独或联合阿奇霉素组细胞外基质明显减少(图2)3.)。这些结果表明黄芩苷可以破坏生物膜的细胞外基质。有趣的是,加入阿奇霉素和黄芩苷后,细胞呈现扭曲形状,细胞外发现AKP和β-GAL。同时,黄芩苷还能增加上清液中AKP的含量(图2)。3.和4)。AKP是一种位于细菌细胞壁和细胞膜之间的细胞间酶。β-GAL存在于细菌内部。当细菌细胞壁和细胞膜的通透性增加时,AKP和β-GAL从细菌外渗漏到胞外空间[31,32,33]。结果表明,黄芩苷增加了阿奇霉素的抑菌活性,最终导致细胞壁和细胞膜的破坏。因此,我们推测黄芩苷通过破坏生物膜和细胞壁基质增加了阿奇霉素的渗透,从而增强了阿奇霉素的药效。
细胞壁的代谢是由Walk/R系统调节的[34]。yycH和yycI在控制中发挥重要作用走它们的缺失会导致WalK/R系统的异常调节,并伴随生长和细胞壁缺陷。与浮游培养的细菌相比,生物膜显示出不同的生长速度、代谢和基因表达谱[35]。嵌入生物膜的细菌细胞代谢活性的降低是对抗菌剂和宿主免疫系统产生耐药性的原因[30.]。在金黄色葡萄球菌WalK/R系统被认为在膜通透性中起重要作用[36]。在RT-PCR实验中,黄芩苷单独使用或与阿奇霉素联合使用均能提高该基因的转录水平走,walR,yycH,yycI与阿奇霉素组和空白对照组相比(图2)5)。结果表明,黄芩苷的加入提高了生物膜形式MDRSS的代谢和膜透性。本研究表明,WalK/R系统相关基因的转录水平与杀菌指数之间存在很强的相关性(表1)4)。我们推测黄芩苷增加了生物膜内包埋细胞的代谢,从而增强了阿奇霉素的杀菌活性。
在小鼠皮肤感染模型中进一步研究了阿奇霉素与黄芩苷联合用药的治疗潜力。在联合治疗下,组织损伤减轻,种植体和感染种植体周围组织的细菌负荷降低(图2)6)。然而,单独用阿奇霉素和黄芩苷治疗组没有很好的效果。由于技术限制,未观察到植入物中细菌的形态。我们之前证明了MDRSS生物膜的基质由eDNA和蛋白质组成[20.]。众所周知,先天免疫系统通过TLR2和TLR9来识别eDNA和蛋白质[25]。然后,免疫细胞被招募到感染部位。然而,只有少数炎症细胞浸润到感染部位,中性粒细胞和巨噬细胞的细胞因子募集(CXCL)2和同2阿奇霉素与黄芩苷联合用药后,小鼠血液中炎症细胞的活性(TNF-α和IL-1β)降低(图2)6)。我们推测,阿奇霉素和黄芩苷的结合破坏了生物膜基质,杀死了嵌入细胞外基质中的细菌;因此,感染部位的炎症细胞减少。SS组炎症细胞增多,但细菌负荷没有减少。这些结果表明巨噬细胞浸润到生物膜感染部位,很少有细胞能够迁移到生物膜上。有人提出葡萄球菌生物膜促进巨噬细胞向促纤维化M2表型分化[25]。M2巨噬细胞不能以生物膜形式吞噬细菌。而浮游葡萄球菌可促进M1表型免疫应答。阿奇霉素与黄芩苷联用可破坏生物膜结构,提高m1型巨噬细胞的作用。
综上所述,黄芩苷的加入提高了阿奇霉素在固定式MDRSS中的抑菌效果。黄芩苷通过调节WalK/R系统相关基因的相对表达,增强了阿奇霉素阻碍生物膜脱离、破坏细胞膜和细胞壁的作用。阿奇霉素与黄芩苷联合应用治疗生物膜感染效果良好。这些结果表明,黄芩苷有潜力成为一种有效的抗生素佐剂,以提高阿奇霉素对预成型生物膜的作用。本研究为生物膜相关感染的治疗提供了一种简单有效的联合治疗策略。
缩写
- MDRSS:
-
耐多药葡萄球菌saprophyticus刘- 2016李阳China-francolin
- 走:
-
细胞壁代谢传感器组氨酸激酶
- WalR:
-
双分量响应调节器
- yycI:
-
双组分系统调节蛋白
- yycH:
-
双组分系统活动调节器
- CXCL2:
-
CXC趋化因子配体
- 创新领导力2:
-
CC趋化因子配体2
- 肿瘤坏死因子-α:
-
肿瘤坏死因子-α
- il - 1β:
-
白细胞介素1
- 埃德娜:
-
细胞外脱氧核糖核酸
- TLR2:
-
toll样受体2
- TLR9识别:
-
toll样受体9
- 扫描电镜:
-
扫描电子显微镜
- ELISA:
-
酶联免疫吸附试验
- rt - pcr:
-
实时聚合酶链反应
参考文献
[4]刘建军,刘建军,刘建军,等mecC-positive葡萄球菌saprophyticus来自阿根廷的牛乳腺炎。[J] .中国微生物学杂志,10 (2):391 - 391
李J, Heo年代,宋,宋D(2019)移动葡萄球菌saprophyticus从发酵海鲜中分离出具有四环素抗性的质粒。科学通报,14:e213289
王健,乔敏,周艳,王迪,胡艳,吴艳(2019)黄芩苷与阿奇霉素体外协同抗葡萄球菌saprophyticus从患有眼炎的富兰克林犬中分离得到。家禽科学98:373-380
Foster TJ, Geoghegan JA, Ganesh VK, Höök M(2014)细菌表面蛋白的粘附、侵袭和逃避金黄色葡萄球菌。微生物学报12:49-62
(2005)生物膜的制备金黄色葡萄球菌与乳腺内感染有关。兽医微生物杂志107:295-299
Melchior MB, van Osch MHJ, Lam TJGM, Vernooij JCM, Gaastra W, Fink-Gremmels J(2011)扩展生物膜敏感性试验金黄色葡萄球菌牛乳腺炎分离物:基因组成和生物膜易感性之间关联的证据。[J] .畜牧学报,94 (4):526 - 537
Saye DE(2007)复发性和抗菌素耐药性感染:考虑生物膜在临床实践中的潜在作用。造口伤口管理53:46-48
李春华,李春华,李春华,等(2010)细菌生物膜耐药性的研究进展。中华微生物学杂志,35 (5):322 - 332
Aslam S(2008)抗菌药物对生物膜的影响。[J]中国传染病控制杂志36 (3):575 - 579
Egrave G, Re S, Prescott JF, Dowling PM(2006)兽药抗菌治疗。威利,纽约
Shrestha L, Bhattarai NR, Khanal B(2018)凝固酶阴性葡萄球菌生物膜形成检测方法的比较评价及与抗生素谱的相关性。感染药物抵抗11:607-613
Laxminarayan R(2014)抗生素有效性:平衡保护与创新。科学345:1299 - 1301
Wright GD(2016)抗生素佐剂:从耐药性中拯救抗生素。微生物学进展,24:862-871
novey P, Urban J, Leuner O, Vadlejch J, Kokoska L(2011)黄芩苷与土霉素和四环素体外协同作用金黄色葡萄球菌。[J] .中国生物医学工程学报(英文版)
苏婷,邱勇,华新,叶波,罗宏,刘东,曲萍,邱忠(2020)逆转抗生素耐药的新机遇:探索具有抗抗生素耐药菌活性的中药。微生物学前缘11:610070
[张生,胡斌,徐军,任强,王铮,王生,董勇,杨刚(2020)黄芩苷抑制甲氧西林耐药菌生长及毒力相关因素研究。金黄色葡萄球菌在体外和体内。微生物病理学139:103899
Dubrac S, Boneca IG, Poupel O, Msadek T (2007) WalK/WalR (YycG/YycF)必需信号转导通路在控制细胞壁代谢和生物膜形成中的重要作用金黄色葡萄球菌。[J] .中国生物医学工程学报
[王静,焦辉,bbbbj,乔敏,杜华,何敏,明康,刘健,王东,吴勇(2019)黄芩苷通过调节MsrA药物外排泵抑制生物膜形成和群体感应系统。葡萄球菌saprophyticus。前微生物室10:2800
张建军,张建军,张建军,等(2014)抗毒副作用药物的研究进展。微生物病理学77:105-112
王军,朱军,朱军,邱婷,王伟,王锐,刘杰(2021)黄芩苷对生物膜形成的影响葡萄球菌saprophyticus。兽医微生物,262:109242
刘强,王鑫,秦军,程生,杨伟,何磊,马鑫,刘鑫,李敏,裴涛(2017)atp依赖性蛋白酶ClpP通过调控Agr和细胞壁水解酶Sle1抑制生物膜形成金黄色葡萄球菌。前细胞感染微生物:7:181
马丁斯KB, Ferreira AM, Pereira VC, Pinheiro L, Oliveira AD, Cunha MDLR(2019)抑菌剂对浮游和生物膜形式的体外影响葡萄球菌saprophyticus从尿路感染患者中分离。《微生物》10:40
李春华,李春华,李春华,李春华,等。(2019)阳离子抗菌肽对浮游生物和生物膜的协同杀菌作用金黄色葡萄球菌。中华微生物学杂志,53 (3):143 - 151
张建军,张建军,张建军,张建军。(2020)环丙沙星对环丙沙星抗生物膜活性的影响金黄色葡萄球菌生物膜。科学报告10:90 . 21
瑟罗LR (2011)金黄色葡萄球菌生物膜在体内阻止巨噬细胞吞噬和减轻炎症。[J]中华医学杂志
王晓明,王晓明,王晓明(1992)铜绿假单胞菌人类免疫缺陷病毒感染患者的感染。临床感染病14:43 - 411
李建平,李建平,李建平(2007)抗细菌药物的研究进展。Nat Rev Drug discovery, 6:29-40
李建军,张建军,张建军,张建军,张建军,张建军,张建军。(2020)抗菌药物与镇痛药物的协同抑菌作用金黄色葡萄球菌。诊断与感染杂志96:114967
Lister JL, Horswill AR (2014)金黄色葡萄球菌生物膜:生物膜扩散的最新进展。前细胞感染Mi 4:178
Stewart PS, William Costerton J(2001)细菌对生物膜的耐药性。柳叶刀358:135 - 138
Hara S, Yamakawa M(1995)蚕抗菌肽Moricin的研究;家蚕。[J] .中国生物医学工程学报(英文版),27 (5):591 - 591
[何宁,王鹏,王鹏,马超,康伟(2018)菝葜根茎中赤藓碱的抑菌机理。Toddalia asiatica(林)。BMC补体替代医学18:261
Lacriola CJ, Falk SP, Weisblum B(2012)诱导自溶的药物筛选枯草芽孢杆菌。抗菌药物Chemother 57:229-234
王晓明,王晓明,王晓明,等(2008)细胞细胞壁稳态与细胞凋亡的关系。微生物学报70:1307-1322
董兰(2002)生物膜:表面微生物的生命。紧急传染病:881 - 890
Martin PK,李涛,孙东,Biek DP, Schmid MB(1999)植物体内必需双组分系统在细胞通透性中的作用金黄色葡萄球菌。[J] .中华细菌杂志,181:3666-3673
致谢
我们感谢南京农业大学中医兽医研究所的所有工作人员对本研究实验的协助。我们也感谢Mujahid lqbal修改了英语。
作者信息
作者及单位
贡献
JW, JL和YW设计并构思了实验。JW, SL, JZ, JM进行实验。JW, TQ, WW和JD分析了数据。ZL, KL和DW提供了试剂和材料。JW, JL和YW撰写并审阅了这篇论文。MI对本文的语言进行了修改。JW、SL、JL对稿件进行了修改。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
所有动物研究均按照南京农业大学实验动物护理和使用指南进行。在整个实验过程中监测动物的日常健康状况。该议定书由IACUC批准(第。: IACUC2020012)。
相互竞争的利益
作者宣称他们没有竞争利益。
额外的信息
出版商的注意
伟德体育在线b施普林格《自然》杂志对已出版的地图和机构的管辖权要求保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/。创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
王军,李树军,刘军。et al。黄芩苷可作为佐剂增强阿奇霉素抗葡萄球菌saprophyticus生物膜:一种体外、体内和分子研究。兽医Res53, 83(2022)。https://doi.org/10.1186/s13567-022-01088-z
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13567-022-01088-z
关键字
- 美国saprophyticus
- 黄芩苷
- 阿奇霉素
- 生物膜
- 走/ R系统