摘要
中东呼吸综合征冠状病毒(MERS-CoV)严重威胁公共卫生。在这里,我们使用气液界面培养系统建立了羊驼气管外植体(ATE)体外模型,以深入了解MERS-CoV在骆驼下呼吸道的感染情况。ATE可被MERS-CoV感染,为103.TCID50/mL是建立有效感染所需的最小病毒剂量。在ATE培养中,MERS-CoV感染未诱导IFN和抗病毒ISGs,这强烈表明在体内观察到的ISGs表达是骆驼鼻黏膜中IFN诱导的结果。
简介、方法和结果
中东呼吸综合征冠状病毒(MERS-CoV)是2012年在沙特阿拉伯王国出现的一种呼吸道疾病的病原体[1].来自阿拉伯半岛的早期报告显示,该病的病死率很高[2,3.,4].截至2022年4月,世界卫生组织报告了2585例感染和890例死亡(∼病死率为34.4%),遍布四大洲的27个国家[5].中东呼吸综合征在人类的主要表现从无症状或轻微呼吸道症状到导致急性呼吸窘迫综合征的肺炎[4].单峰骆驼是中东呼吸综合征冠状病毒的宿主/中间宿主[6],因为病毒中和抗体已在该物种中报道[7,8,9,10,11,12,13],而且病毒不需要突变就能从单峰骆驼传染给人类[14].此外,所有研究的骆驼在实验和自然条件下都对MERS-CoV感染敏感[15,16,17,18,19,20.,21,22,23,24].
先天免疫是对抗病毒感染的第一个宿主防御系统,被认为在MERS发病机制中发挥关键作用。对许多人类细胞类型的中东呼吸综合征冠状病毒感染的研究得出结论,I型和III型干扰素(IFNs)在很大程度上受到抑制或延迟[25,26,27].此外,肺巨噬细胞持续大量分泌炎症细胞因子以及黏膜水平先天免疫反应的抑制可能导致人类更严重的感染[28,29,30.,31].相比之下,骆驼只表现出对MERS-CoV的亚临床反应[15,16,17,18,19,20.,21,22,23,24].这种结果显然是由于受感染的鼻上皮细胞产生的I型和III型ifn的作用,最近在羊驼中进行的工作表明[24].与远端未感染细胞不同,感染上皮细胞产生干扰素,而干扰素刺激基因(ISGs)在感染和未感染上皮细胞中的表达均升高,这表明IFNs可以以旁分泌方式诱导未感染细胞中ISGs的表达[24].同样,在鼻上皮细胞产生的ifn也可能通过内分泌途径被感知,这一点由下呼吸道(LRT)中isg的产生证明,而这些组织中没有ifn的可检测表达[22,24].
除了骆驼宿主有效的先天免疫反应外,在这些物种中可能导致中东呼吸综合征冠状病毒轻度发病机制的另一个因素是病毒能够在来自LRT的细胞内适度复制。既往研究表明,鼻内接种MERS-CoV时气管内发现的感染细胞极少[15,19,20.,22,24],虽然在骆驼中二肽基肽酶4 (DPP4)的表达水平与鼻黏膜相当[32,33].目前尚不清楚如何抑制MERS-CoV向轻型呼吸道的复制。因此,在本研究中,我们使用ALI系统建立了离体气管器官培养来填补这些知识空白。
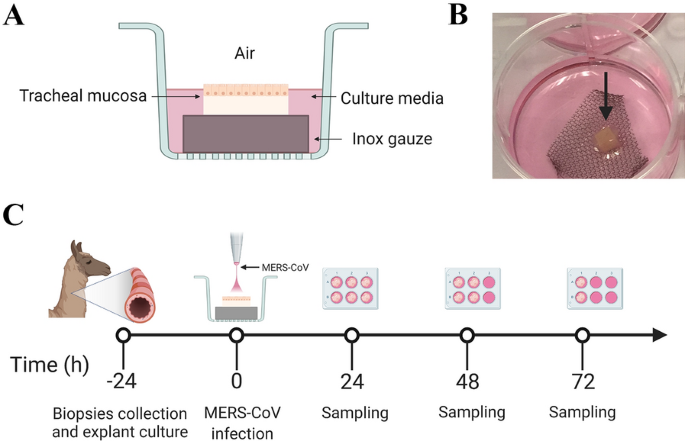
三只10至12个月大的羊驼(骆马帕科)是通过私人出售购买的,在驯化期间安置在Alcarràs(西班牙加泰罗尼亚)的IRTA农场设施中,然后转移到巴塞罗那(西班牙)的巴塞罗那自治大学进行尸检。动物被安乐死,将过量的戊巴比妥注射到颈静脉。气管的中间部分(n= 3)无菌收集,用1:1的Dulbecco 's改性Eagle 's培养基(DMEM, Lonza)和Roswell Park Memorial Institute (RPMI) 1640培养基(补充青霉素(100 U/mL)、链霉素(100 μg/mL)、l -谷氨酰胺(10 mM)的混合培养基加热运输至实验室;双两性霉素(2 μg/mL;Sigma-Aldrich)。将获得的气管组织浸泡在新鲜的温输送介质中清洗三次,然后根据先前发表的方案分离ATE [34作了一些修改。简单地说,从气管环上剥离气管黏膜。小心地丢弃软骨,然后将每个部分切成25毫米的正方形2,然后转移到细网的inox钢纱布上,放置在6孔培养板中,上皮朝上。每孔含2ml培养基(CM),由不含两性霉素的输送介质组成。ATE在ALI界面培养,使上皮细胞轻微浸入液体中,纤毛暴露在空气中(图)1A, B).外植体在37°C和5% CO的加湿培养箱中培养4天2.每天(每24小时)在光学显微镜下检查睫状体跳动。
将分支B MERS-CoV Qatar15/2015株(GenBank Accession MK280984)传代3种在Vero E6细胞中繁殖,并通过计算50%接种细胞培养物中引起细胞病变效应的稀释度来滴定(50%组织培养感染剂量终点[TCID50]),如上文所述[19].选择中东呼吸综合征冠状病毒卡塔尔15/2015株是基于目前只有B支系在阿拉伯半岛流行[35]与典型的MERS-CoV EMC/2012菌株相比,它增强了羊驼的体内复制能力[22].ATE以三种不同剂量接种MERS-CoV Qatar15/2015菌株2, 103.,和104TCID50/mL (CM1C).简单地说,气管外植体为每只动物的每个时间点制备三份(n= 3)置于无菌不锈钢纱布上,放置在6孔培养板上,上皮表面朝上(图1A, B)。培养24小时后,将外植体转移到新的6孔培养板上,然后在顶端感染每一剂MERS-CoV。仅使用CM进行模拟感染对照。病毒暴露在37°C和5% CO的加湿培养箱中1小时后2时,外植体用温PBS清洗三次,放回到原来含有CM的6孔板的纱布上。在接种后24、48和72 h (hpi)收集外植体,并在含有1)10%福尔马林的试管中引入,用于形态计量学、组织学和免疫组织化学分析(三个重复中的两个);或2)tri试剂(zyymo Research, California, USA)用于RNA病毒定量和先天免疫反应分析。
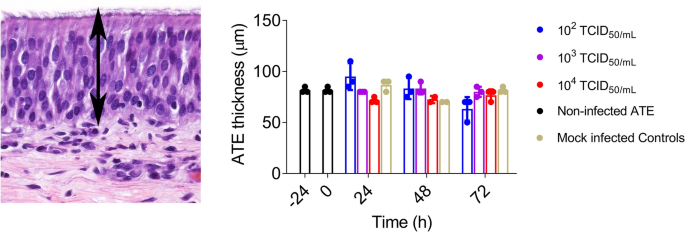
外植体在10%中性缓冲的福尔马林中浸泡5天,包埋石蜡块,进行组织学分析(苏木精和伊红染色,H&E)。此外,通过测量每个气管切片上随机选择的五个区域来评估气管上皮的厚度。使用小鼠抗MERS-CoV N蛋白抗体(Sino Biological Inc., Beijing, China)根据先前建立的方案检测MERS-CoV抗原的存在[33].由委员会认证的兽医病理学家建立了免疫组化(IHC)分级系统(−,未检测到阳性细胞;±,每个组织切片不到10个阳性细胞;+,每个组织切片10 - 50个阳性细胞;+ +,每个组织切片50 - 150个阳性细胞)。
从不同时间点收集的ATE样本中提取总RNA,并按照先前的标准程序将其转化为cDNA [24].采用微流控RT-qPCR方法对免疫相关基因的表达进行相对定量。先天免疫基因和特异性引物对扩增其转录产物的选择在以前的著作中有描述[22,24].此外,将用于检测基因组(UpE)和亚基因组(M)病毒RNA的特异性引物添加到检测中(附加文件中的表A)1) [24].数据采用Real-Time PCR Analysis 4.1.3软件(Fluidigm Corporation, South San Francisco, USA)和DAG表达软件1.0.5进行分析。6、如前所述[24].HPRT1,GAPDH而且哥伦比亚大学基因被用作归一化基因,从24、48和72 hpi收集的感染外植体中获得的值与从0 hpi的未感染ATE中获得的值进行比较。各细胞因子基因表达上调或下调均以折变值表达(附文表B)1).
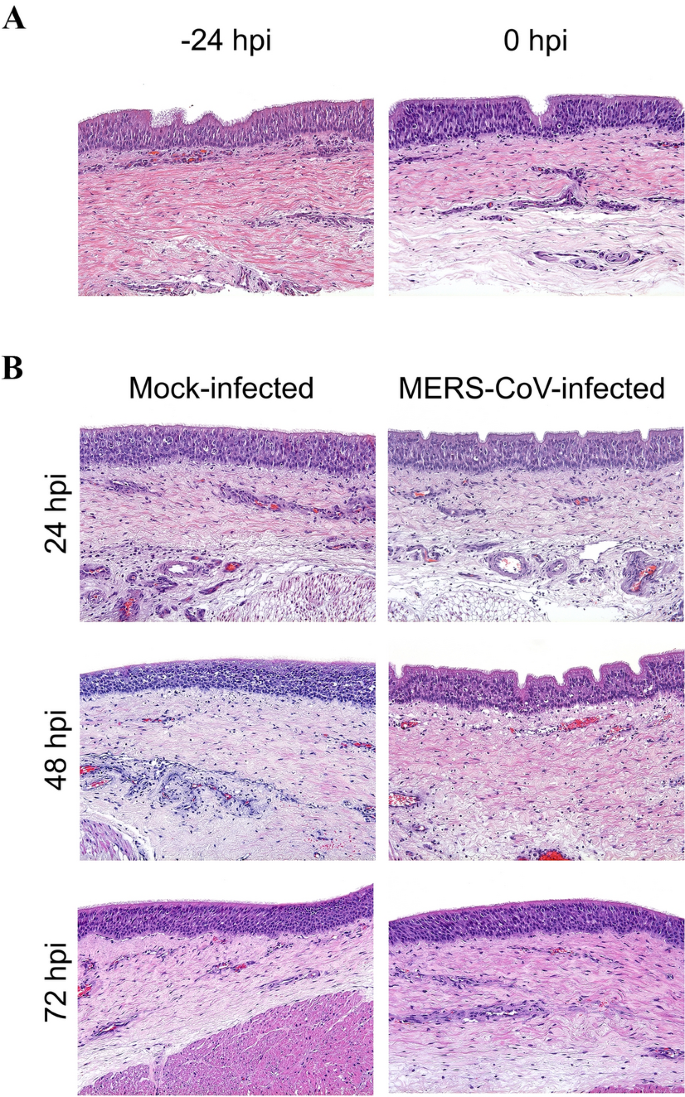
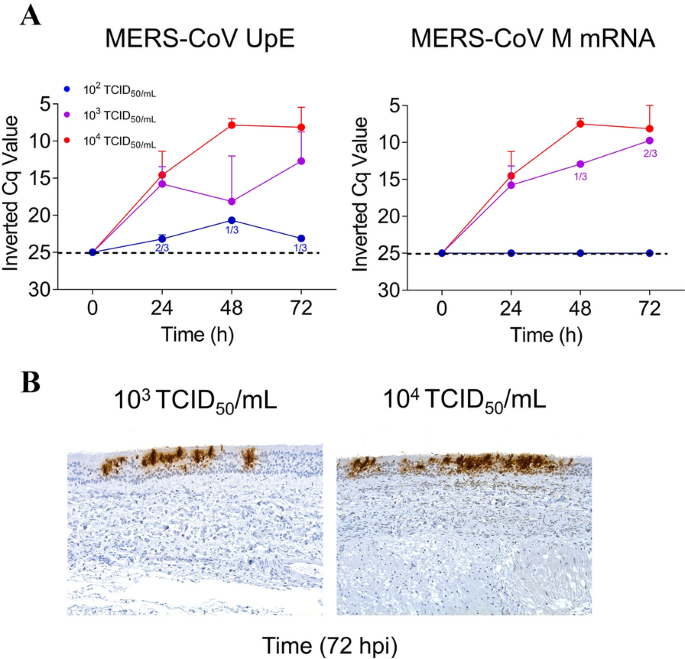
MERS-CoV感染没有显著改变上皮层的平均厚度(介于63.3至86.7 μ m之间)(图2)在整个离体实验期间,ATE也没有引起明显的组织病理学变化(图3.A, B)。从48 hpi开始,所有培养的ATE都保持了几乎完整的细胞和组织形态,尽管上皮细胞和固有层中有极少数细胞空泡化(图3.B)。4A显示感染三种不同病毒剂量后MERS-CoV产量的动力学(102, 103.和104TCID50分别为/毫升)。ATE中的病毒基因组RNA负荷与剂量和时间有关(图4左)。感染剂量为104TCID50/mL导致ATE的病毒RNA检测最高,在48 hpi后达到平台期。为了确定ATE内活跃的病毒基因转录,还评估了MERS-CoV亚基因组RNA (M基因)的存在(图4右)。仅在感染10的ATE中检测到M mRNA的载量3.或104TCID5010 . /mL接种MERS-CoV, M mRNA无转录2TCID50/毫升剂量。与病毒RNA定量结果一致,在感染ATE的10种病毒中检测到IHC阳性标记3.或104TCID50/mL在48或72 hpi采样(图4A和附加文件2).特异性染色多位于气管上皮细胞的细胞质中(图4B)。
羊驼气管外植体(ATE)中MERS-CoV负荷。(一个通过微流控RT-qPCR测定MERS-CoV基因组(左)和亚基因组(右)RNA(附文件A页)1).每条线分别代表Cq的平均值,误差条分别显示在0、24、48和72 hpi下3只动物ATE的标准差区间。蓝色、紫色和红色点表示感染了10的ATE2, 103.和104TCID50/mL MERS-CoV。(B) MERS-CoV在ATE中的组织向性。在72 hpi时,用免疫组织化学方法检测感染10株ATE的上皮中MERS-CoV N蛋白(棕色染色)3.和104TCID50/mL剂量;原始放大倍率:双组织× 200。ATE,羊驼气管外植体;1/3和2/3分别表示在三分之一或三分之一的外植体中检测到病毒RNA。
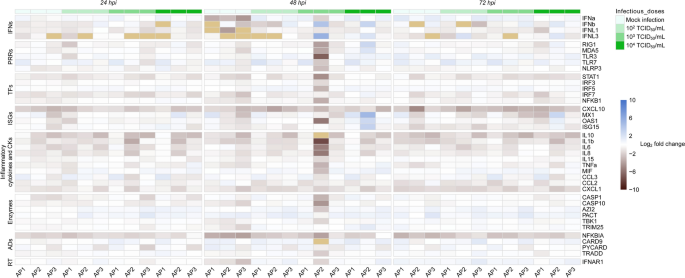
为了探索在ATE中MERS-CoV感染激活的抗病毒和炎症通路,在模拟处理和病毒感染的ATE中监测39个先天免疫应答基因的相对mRNA表达水平。检测中包括三个高度稳定的归一化基因。在0 hpi收集的未感染ATE对照中,所有基因都在基础水平上检测到,因此,可以根据这一参考时间点对整个数据集进行归一化。在任何剂量的MERS-CoV感染ATE后,促炎细胞因子、趋化因子和转录因子的转录(IRF5除外)均呈现轻微下调趋势(图5和附加文件中的表B1).其余的基因,包括ifn、ISGs、模式识别受体、下游信号转导酶、适配器和受体,在基础水平上下波动(图5和附加文件中的表B1),表明ATE抑制了MERS-CoV感染时的抗病毒反应。
讨论
MERS-CoV在中间宿主中的发病机制尚未完全了解。虽然骆驼可以在实验中感染,但这种方法意味着巨大的财政成本、伦理问题和安全风险,并需要在生物安全3级(BSL-3)环境下使用特殊的家庭设施。因此,我们开发了一个离体ATE模型来解决这些障碍。ATE在实验过程中保持了睫状体的完整性,说明气管上皮对睫状体搏动的协调和调节功能仍然存在。形态测量学和组织学评估表明,ATE在至少72 hpi内保持良好的细胞和组织形态,显示出与新收集的气管非常相似。值得注意的是,实验感染中东呼吸综合征冠状病毒的单峰骆驼的鼻上皮细胞中出现了大量的睫状体脱落[36]但在大羊驼身上却没有[33]或羊驼[24].
在本研究中,ATE无法表达ifn,这与之前对感染MERS-CoV的羊驼气管的观察一致[22,24].此外,在感染MERS-CoV后,ATE没有诱导ISGs,这支持了在体内观察到的气管黏膜ISGs上调可能是由于鼻上皮细胞产生的IFNs的旁分泌作用[24].近年来,已建立了羊驼和双峰驼假分层气道上皮细胞(AEC)培养模型。这些AEC产生于气管支气管道,支持几种MERS-CoV谱系的生长,并对IFNs的抗病毒作用敏感[37,38].然而,在这些实验中,没有检查MERS-CoV感染时ifn和细胞因子的产生。然而,当用干扰素处理时,骆驼气管细胞可以产生isg,这表明先天免疫系统具有功能性[38].ATE和AEC都可以用于测试几种导致MERS-CoV清除的先天免疫途径的激动剂和拮抗剂。
仅使用骆驼气管细胞来研究宿主- mers - cov相互作用可能还不够,因为至少在体内,感染的鼻上皮细胞能够显著上调IFN基因的转录表达[22,24].因此,开发鼻腔外植体和分化良好的鼻腔上皮细胞模型是充分了解上皮屏障与骆驼MERS-CoV感染之间相互作用的必要条件。在这方面,外植体模型可能更好地反映体内情况,因为粘膜和粘膜下层都是共同培养的,以维持组织结构。尽管如此,AEC和气管外植体模型克服了上皮细胞系固有的自然生理缺陷,包括细胞极化、睫状体协调活性和根尖与空气接触的差异[39].此外,从单一动物获得的组织块可用于多次重复,从而减少实验变异性和所用动物数量,符合3Rs原则[40].
综上所述,利用ATE建立了一种新的体外培养模型,适用于研究MERS-CoV在自然宿主体内的感染和复制。我们证明了ATE可以被MERS-CoV感染而不触发先天性抗病毒反应。此外,ATE还可用于研究骆驼类的其他呼吸道病原体,减轻实验动物的负担。
数据和材料的可用性
支持本研究结果的数据可根据合理要求从作者处获得。
缩写
- 原子能委员会:
-
假分层气道上皮细胞
- 吃:
-
羊驼气管外植体
- BSL-3:
-
生物安全三级
- CM:
-
文化传媒
- DPP4:
-
二肽基肽酶4
- 现病史:
-
小时post-inoculation
- 干扰素:
-
干扰素
- 包含IHC:
-
免疫组织化学
- 研究小组:
-
干扰素刺激基因
- 轻轨交通:
-
下呼吸道
- MERS-CoV:
-
中东呼吸综合征冠状病毒
- TCID50:
-
50%组织培养感染剂量终点
参考文献
Zaki AM, van Boheemen S, Bestebroer TM, Osterhaus ADME, Fouchier RAM(2012)沙特阿拉伯一名肺炎患者体内新型冠状病毒的分离。英国医学杂志367:1814-1820。https://doi.org/10.1056/nejmoa1211721
Arabi YM, Arifi AA, Balkhy HH, Najm H, Aldawood AS, Ghabashi A, Hawa H, Alothman A, Khaldi A, Al Raiy B(2014)中东呼吸综合征冠状病毒感染危重症患者的临床病程和转归。安实习生医学160:389-397。https://doi.org/10.7326/M13-2486
Assiri A, Al-Tawfiq JA, Al-Rabeeah AA, Al-Rabiah FA, Al-Hajjar S, Al-Barrak A, Flemban H, Al-Nassir WN, Balkhy HH, Al-Hakeem RF, Makhdoom HQ, Zumla AI, Memish ZA(2013)沙特阿拉伯47例中东呼吸综合征冠状病毒病的流行病学、人口统计学和临床特征:一项描述性研究。Lancet infection Dis 13:52 - 761。https://doi.org/10.1016/s1473 - 3099 (13) 70204 - 4
张丽娟,王丽娟,张丽娟(2015)中东呼吸综合征。柳叶刀386:995 - 1007。https://doi.org/10.1016/s0140 - 6736 (15) 60454 - 8
WHO |中东呼吸综合征冠状病毒(MERS-CoV)。https://www.who.int/emergencies/mers-cov/en/.2022年5月18日访问
Sabir JSM, Lam ht -Y, Ahmed MMM, Li L, Shen Y, Abo-Aba SEM, Qureshi MI, Abu-Zeid M, Zhang Y, Khiyami MA, Alharbi NS, Hajrah NH, Sabir MJ, Mutwakil MHZ, Kabli SA, Alsulaimany FAS, Obaid AY, Zhou B, Smith DK, Holmes EC, Zhu H, Guan Y(2016)沙特阿拉伯三种骆驼冠状病毒共循环和mers - cov重组。科学351:81 - 84。https://doi.org/10.1126/science.aac8608
Corman VM, Jores J, Meyer B, Younan M, Liljander A, Said MY, Gluecks I, Lattwein E, Bosch BJ, Drexler JF, borstein S, Drosten C, Müller MA(2014)肯尼亚单峰骆驼抗MERS冠状病毒抗体,1992-2013。涌现感染Dis 20:1319-1322。https://doi.org/10.3201/eid2008.140596
Drosten C, Meyer B, Müller MA, Corman VM, Al-Masri M, Hossain R, Madani H, Sieberg A, Bosch BJ, Lattwein E, Alhakeem RF, Assiri AM, Hajomar W, Albarrak AM, Al-Tawfiq JA, Zumla AI, Memish ZA (2014) mers冠状病毒在家庭接触中的传播。英国医学杂志371:828-835。https://doi.org/10.1056/NEJMoa1405858
Farag EABA, Reusken CBEM, Haagmans BL, Mohran KA, Stalin Raj V, Pas SD, Voermans J, Smits SL, Godeke G-J, Al- hajri MM, Alhajri FH, Al- romaihi HE, Ghobashy H, El-Maghraby MM, El-Sayed AM, Al Thani MHJ, Al- marri S, Koopmans MPG(2015)屠宰场MERS-CoV脱出单峰骆驼比例高,与人类病例存在潜在的流行病学联系,卡塔尔2014。感染生态流行病5:28305。https://doi.org/10.3402/iee.v5.28305
Reusken CB, Ababneh M, Raj VS, Meyer B, Eljarah A, Abutarbush S, Godeke GJ, Bestebroer TM, Zutt I, Muller MA, Bosch BJ, Rottier PJ, Osterhaus AD, Drosten C, Haagmans BL, Koopmans MP(2013年)2013年6月至9月约旦受影响地区主要牲畜种类中东呼吸综合征冠状病毒(MERS-CoV)的血清检测。欧洲监测18:20662。https://doi.org/10.2807/1560-7917.es2013.18.50.20662
Reusken CB, Farag EA, Jonges M, Godeke GJ, El-Sayed AM, Pas SD, Raj VS, Mohran KA, Moussa HA, Ghobashy H, Alhajri F, Ibrahim AK, Bosch BJ, Pasha SK, Al-Romaihi HE, Al-Thani M, Al-Marri SA, Alhajri MM, Haagmans BL, Koopmans MP(2014年4月,卡塔尔,根据当地习俗采集的单峰骆驼奶中中东呼吸综合征冠状病毒(MERS-CoV) RNA和中和抗体。欧洲监测19:20829。https://doi.org/10.2807/1560-7917.es2014.19.23.20829
Raj VS, Osterhaus ADME, Fouchier RAM, Haagmans BL (2014) MERS:一种新型人类冠状病毒的出现。Curr Opin Virol 5:58-62。https://doi.org/10.1016/j.coviro.2014.01.010
Reusken CBEM, Haagmans BL, Müller MA, Gutierrez C, Godeke G-J, Meyer B, Muth D, Raj VS, Smits-De Vries L, Corman VM, Drexler J- f, Smits SL, El Tahir YE, De Sousa R, van Beek J, Nowotny N, van Maanen K, Hidalgo-Hermoso E, Bosch B-J, Rottier P, Osterhaus A, Gortázar-Schmidt C, Drosten C, Koopmans MP(2013)单峰骆驼中东呼吸综合征冠状病毒中和血清抗体:一项比较血清学研究。《柳叶刀》传染病13:859-866。https://doi.org/10.1016/s1473 - 3099 (13) 70164 - 6
Hemida MG, Chu DKW, Poon LLM, Perera RAPM, Alhammadi MA, Ng H, Siu LY, Guan Y, Alnaeem A, Peiris M(2014)单峰骆驼群MERS冠状病毒。沙特阿拉伯出现传染性疾病。https://doi.org/10.3201/eid2007.140571
Adney DR, Bielefeldt-Ohmann H, Hartwig AE, Bowen RA(2016)中东呼吸综合征冠状病毒在羊驼中的感染、复制和传播。涌现感染Dis 22:1031-1037。https://doi.org/10.3201/2206.160192
Crameri G, Durr PA, Klein R, ford A, Yu M, Riddell S, Haining J, Johnson D, Hemida MG, Barr J, Peiris M, Middleton D, Wang L-F(2016)中东呼吸综合征冠状病毒对羊驼的实验感染及再挑战反应。新兴感染Dis 22:1071-1074。https://doi.org/10.3201/eid2206.160007
Reusken CBEM, Schilp C, Raj VS, De Bruin E, Kohl RHG, Farag EABA, Haagmans BL, Al-Romaihi H, Le Grange F, Bosch B-J, Koopmans MPG(2016)中东呼吸综合征冠状病毒流行地区羊驼的MERS-CoV感染。新兴感染Dis 22:11 129 - 1131。https://doi.org/10.3201/eid2206.152113
David D, Rotenberg D, Khinich E, Erster O, Bardenstein S, van Straten M, Okba NMA, Raj SV, Haagmans BL, Miculitzki M, Davidson I(2018)自然暴露的以色列大羊驼、羊驼和骆驼中的中东呼吸综合征冠状病毒特异性抗体。同一健康5:65-68。https://doi.org/10.1016/j.onehlt.2018.05.002
Vergara-Alert J, van den Brand JMA, Widagdo W, Muñoz M, Raj S, Schipper D, Solanes D, Cordón I, Bensaid A, Haagmans BL, Segalés J(2017)牲畜感染中东呼吸综合征冠状病毒的易感性。涌现感染病23:232-240。https://doi.org/10.3201/eid2302.161239
Adney DR, Letko M, Ragan IK, Scott D, van Doremalen N, Bowen RA, Munster VJ(2019)双峰驼实验感染后大量脱落中东呼吸综合征冠状病毒(MERS-CoV)。新兴微生物感染8:717-723。https://doi.org/10.1080/22221751.2019.1618687
Rodon J, Okba NMA, Te N, van Dieren B, Bosch BJ, Bensaid A, Segalés J, Haagmans BL, Vergara-Alert J(2019)通过接种重组刺突蛋白阻断中东呼吸综合征冠状病毒(MERS-CoV)在羊驼中的传播。新兴微生物感染8:1593-1603。https://doi.org/10.1080/22221751.2019.1685912
Te N, Rodon J, Pérez M, Segalés J, Vergara-Alert J, Bensaid A(2022)中东呼吸综合征冠状病毒B支系在骆驼中复制适应度高于A支系,解释了B支系在阿拉伯半岛的优势。新兴微生物感染11:26 6 - 274。https://doi.org/10.1080/22221751.2021.2019559
Te N, Ciurkiewicz M, van den Brand JMA, Rodon J, Haverkamp A- k, Vergara-Alert J, Bensaid A, Haagmans BL, Baumgartner W, Segalés J(2022)骆驼类中东呼吸综合征冠状病毒感染。兽医病理学研究。https://doi.org/10.1177/03009858211069120
Te N, Rodon J, Ballester M, Pérez M, Pailler-García L, Segalés J, Vergara-Alert J, Bensaid A(2021)鼻上皮产生的I型和III型ifn和炎症减弱是羊驼解决MERS-CoV感染的特征。PLoS Pathog 17:e1009229。https://doi.org/10.1371/journal.ppat.1009229
Comar CE, Goldstein SA, Li Y, Yount B, Baric RS, Weiss SR (2019) MERS冠状病毒感染过程中NS4a和NS4b辅助蛋白拮抗dsrna诱导的先天免疫通路。MBio 10: e00319-e419。https://doi.org/10.1128/mBio.00319-19
Gutierrez- FJ, Perlman S, Sanchez-aparicio MT, garcbi A, Enjuanes L, Sola I (2018) MERS-CoV 4b蛋白在感染期间干扰NF- κ b依赖的先天免疫反应。PLoS Pathog 4:e1006838。https://doi.org/10.1371/journal.ppat.1006838
Rabouw HH, Langereis MA, Knaap RCM, Dalebout TJ, Canton J, Sola I, Enjuanes L, Bredenbeek PJ, Kikkert M, de Groot RJ, van Kuppeveld FJM(2016)中东呼吸道冠状病毒附属蛋白4a抑制pkr介导的抗病毒应激反应。PLoS Pathog 12:e1005982。https://doi.org/10.1371/journal.ppat.1005982
Alosaimi B, Hamed ME, Naeem A, Alsharef AA, AlQahtani SY, AlDosari KM, Alamri AA, Al-Eisa K, Khojah T, Assiri AM, Enani MA (2020) MERS-CoV感染与编码Th1和Th2细胞因子/趋化因子的基因下调和下呼吸道炎症性先天免疫反应升高有关。细胞因子126:154895。https://doi.org/10.1016/j.cyto.2019.154895
周娟,朱华,李超,黄伯辉,程志生,潘文明,孙涛,刘长勇,黄桂琦,陈建伟,陈建伟,杜克雄,陈克辉,郑宝军,袁永基(2014)中东呼吸综合征冠状病毒在人巨噬细胞中的主动复制及炎症细胞因子和趋化因子的异常诱导:发病机制的意义。中国传染病杂志(英文版)https://doi.org/10.1093/infdis/jit504
赵霞,朱宏,王宝辉,赵春霞,王东,李超,刘霞,杨东,潘文明,蔡娟,陈建伟,杜kkw,周军,袁永基(2020)中东呼吸综合征冠状病毒感染巨噬细胞C型凝集素受体和(RIG) i样受体的激活参与促炎反应。中国传染病杂志221:647-659。https://doi.org/10.1093/infdis/jiz483
Kindler E, Jónsdóttir HR, Muth D, Hamming OJ, Hartmann R, Rodriguez R, Geffers R, Fouchier RAM, Drosten C, Müller MA, Dijkman R, Thiel V(2013)新型人β冠状病毒EMC在人原代上皮细胞上的高效复制凸显了其人畜共患病潜力。MBio 4:00611 - 00612。https://doi.org/10.1128/mBio.00611-12
Widagdo W, Raj VS, Schipper D, koolijn K, van Leenders GJLH, Bosch BJ, Bensaid A, Segalés J, Baumgärtner W, Osterhaus ADME, Koopmans MP, van den Brand JMA, Haagmans BL(2016)中东呼吸综合征冠状病毒受体在人类和单峰骆驼上呼吸道的差异表达。J Virol 90:4838-4842。https://doi.org/10.1128/JVI.02994-15
Te N, Vergara-Alert J, Lehmbecker A, Pérez M, Haagmans BL, Baumgärtner W, Bensaid A, Segalés J(2019)中东呼吸综合征冠状病毒(MERS-CoV)与二肽基肽酶-4在猪和羊驼呼吸道和淋巴组织中的共定位。跨界新兴Dis 66:831-841。https://doi.org/10.1111/tbed.13092
Glorieux S, Van den Broeck W, Van der Meulen KM, Van Reeth K, Favoreel HW, Nauwynck HJ(2007)猪呼吸道鼻黏膜外植体体外培养研究猪病毒与呼吸道的相互作用。病毒方法142:105-112。https://doi.org/10.1016/j.jviromet.2007.01.018
El-Kafrawy SA, Corman VM, Tolah AM, Al Masaudi SB, Hassan AM, Müller MA, Bleicker T, Harakeh SM, Alzahrani AA, Alsaaidi GA, Alagili AN, Hashem AM, Zumla A, Drosten C, Azhar EI(2019)进口非洲和当地阿拉伯单峰骆驼中东呼吸综合征冠状病毒的地方性模式:前瞻性基因组研究。柳叶刀星球治疗3:e521-e528。https://doi.org/10.1016/s2542 - 5196 (19) 30243 - 8
Haverkamp A- k, Lehmbecker A, Spitzbarth I, Widagdo W, Haagmans BL, Segalés J, Vergara-Alert J, Bensaid A, van den Brand JMA, Osterhaus ADME, Baumgärtner W(2018)中东呼吸综合征单峰驼的实验感染-冠状病毒伴有大量的毛状损失和细胞表面受体二肽基肽酶4的耗尽。科学报告8:9778。https://doi.org/10.1038/s41598-018-28109-2
Schroeder S, Mache C, Kleine-Weber H, Corman VM, Muth D, Richter A, Fatykhova D, Memish ZA, Stanifer ML, Boulant S, Gultom M, Dijkman R, Eggeling S, Hocke A, Hippenstiel S, Thiel V, Pöhlmann S, Wolff T, Müller MA, Drosten C (2021) mers -冠状病毒谱系的功能比较显示重组谱系的复制适应度增加。Nat Commun 12:5324。https://doi.org/10.1038/s41467-021-25519-1
Gultom M, Kratzel A, Portmann J, Stalder H, Chanfon Bätzner A, Gantenbein H, Gurtner C, Ebert N, Gad HH, Hartmann R, Posthaus H, Zanolari P, Pfaender S, Thiel V, Dijkman R(2022)建立高分化骆驼气道培养以研究中东呼吸综合征冠状病毒。科学报告12:10340。https://doi.org/10.1038/s41598-022-13777-y
Nunes SF, Murcia PR, Tiley LS, Brown IH, Tucker AW, Maskell DJ, Wood JLN(2010)猪气管器官体外培养研究流感感染。流感其他呼吸病毒4:7-15。https://doi.org/10.1111/j.1750-2659.2009.00119.x
罗素WMS(1995)三个r概念的发展。参照实验动画23:298-304。https://doi.org/10.1177/026119299502300306
确认
我们感谢Erasmus医疗中心(EMC,鹿特丹)的Bart L. Haagmans博士提供MERS-CoV卡塔尔-15/2015株。我们也感谢Hans Nauwynck博士和他的实验室(根特大学兽医学院病毒学实验室)的工作人员提供体外培养的高级培训。我们特别感谢IRTA-CReSA (Cerdanyola del Vallès,巴塞罗那)BSL-3生物控制动物设施的工作人员。
资金
这项研究得到了欧盟委员会的支持:[呼吁:H2020-INFRAIA-2016-2017资助N°:731014,创新药物计划(IMI)资助N°115760]。IRTA由CERCA方案/加泰罗尼亚Generalitat提供支助。港大获中国国家留学基金委(CSC)资助。201608150108)。资助者在研究设计、数据收集和分析、发表决定或手稿准备中没有任何作用。
作者信息
作者及隶属关系
贡献
NT, JR, JS, JV-A和AB设计研究;NT、JR、MP、JS和JV-A进行了研究;NT、JR、RC、MP、JS、JV-A、AB分析数据;NT和AB写了论文。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
作者确认,正如杂志的作者指南页面所指出的那样,杂志的伦理政策已经得到遵守。所有的动物实验都得到了IRTA伦理和动物福利委员会(CEEA-IRTA)和加泰罗尼亚自治政府动物实验伦理委员会的批准。CEA-OH / 10943/1)。涉及中东呼吸综合征冠状病毒的工作是在西班牙巴塞罗那的IRTA-CReSA生物遏制单位的BSL-3设施进行的。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
Te, N, Rodon, J, Creve, R。et al。评价羊驼气管外植体作为中东呼吸综合征冠状病毒(MERS-CoV)感染研究的体外模型。兽医Res5367(2022)。https://doi.org/10.1186/s13567-022-01084-3
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13567-022-01084-3
关键字
- 气液界面
- 羊驼
- 骆驼科
- 体外模型
- MERS-CoV
- 气管移植组织