摘要
背景
严重急性呼吸综合征冠状病毒2型(SARS-CoV-2)的遗传变异于2020年开始出现,并在2019年冠状病毒病(COVID-19)大流行期间在全球蔓延。尽管存在不同的COVID-19疫苗,但仍然迫切需要发现治疗SARS-CoV-2感染患者的有效抗病毒疗法。5-氨基乙酰丙酸(5-ALA)是一种天然氨基酸,具有抗病毒和抗炎活性。在之前的一项研究中,我们证明了5-ALA对SARS-CoV-2感染的体外抗病毒作用,且没有明显的细胞毒性。在本研究中,我们试图研究5-ALA加或不加柠檬酸亚铁钠(SFC)是否能在体外抑制SARS-CoV-2武汉原始菌株及其变体,包括Alpha、Beta、Gamma和Delta菌株。
方法
在Vero-E6细胞中,观察有无SFC作用下ALA的抗病毒活性。采用实时RT-PCR定量病毒抑制作用。
结果
5-ALA和SFC联合应用IC可抑制SARS-CoV-2武汉型、α型和δ型病毒50值分别为235、173和397 μ M,以及带有IC的Beta和Gamma变体501311和1516 μ M。
结论
我们的研究表明,5-ALA与SFC结合,作为治疗SARS-CoV-2变异感染患者的候选抗病毒药物,值得加速临床评估。
简介
由严重急性呼吸综合征冠状病毒2型(SARS-CoV-2)引起的冠状病毒病(COVID-19)的爆发是对全球公共卫生的严重威胁[1].SARS-CoV-2属于β -冠状病毒亚科,是一种单链阳性RNA病毒,大小约29.9 kb [2].从结构上看,新型冠状病毒2具有双层脂质包膜,包括刺突糖蛋白(S)、包膜蛋白(E)、膜蛋白(M)和核衣壳蛋白(N) [3.].刺突蛋白受体结合确实主要介导宿主细胞受体,血管紧张素转换酶2 (ACE 2)的识别[4,5].截至2021年10月18日,全球220多个国家已记录到超过2.41亿例确诊病例和490万例死亡[6].COVID-19的临床表现可从无症状到轻度、重度或危重[7];感染后可引致严重的呼吸系统、胃肠及神经系统症状[8,9,10,11].
由于它们的基因组复制保真度低,病毒随着时间的推移会发生突变,导致原始分离物的变体。迄今为止,已知有数千种SARS-CoV-2基因变异在全球范围内传播;然而,存在四个主要的SARS-CoV-2变异,即Pango谱系上的Alpha (B.1.1.7)、Beta (B.1.351)、Gamma (P.1)和Delta (B.1.617.2)变异[12].SARS-CoV-2的个体变体可能在传播潜力、毒性、临床疾病表现(较轻或较严重)、特定病毒诊断检测的识别、自然免疫或疫苗诱导免疫的反应以及对治疗药物的敏感性方面表现出差异[13,14,15,16].全球正在应用有效疫苗,39.3%的世界人口至少接种过一剂COVID-19疫苗(即总共52.5亿剂)[17].截至2021年4月,169个国家在积极接种疫苗,全球疫苗接种运动继续取得进展[18].尽管全球仍有很大一部分人口未接种疫苗,但预计病毒会不断变异,最终可能对疫苗产生至少部分耐药性,这就强调必须继续进行药物开发[19].此外,通过接种疫苗安全获得对COVID-19的群体免疫需要很长时间,因此需要有效的治疗方法来预防和治疗COVID-19 [20.].
临床研究主要集中在几种已获批准的抗病毒药物上,包括瑞德西韦[21],莫努比拉韦[22]和3c样蛋白酶抑制剂[23].5-氨基乙酰丙酸(5-ALA)是一种天然氨基酸,常见于动物、植物、真菌和细菌中。迄今为止,5-ALA已在临床上用于改善人类疾病的代谢,包括糖尿病[24]以及各种癌症的诊断和治疗[25].8个5-ALA分子的共轭产生原卟啉IX (PPIX), PPIX通过插入亚铁离子产生血红素[26].此外,PPIX已显示出对登革热、寨卡病毒、基孔肯雅热和甲型流感病毒的抗病毒作用[27,28,29].本研究旨在评价5-ALA对SARS-CoV-2武汉型、Alpha型、Beta型、Gamma型和Delta型病毒的体外抗病毒活性。由于先前关于5-ALA对血红素氧革素-1诱导的潜力的论文[30.]和抗疟疾活动[31]的研究表明,添加铁可以增强5-ALA的效果,在添加铁和不添加铁的情况下进行了研究。根据我们之前关于5-ALA在Vero E6和Caco-2细胞中对SARS-CoV-2感染作用的报道,5-ALA与SFC的比例固定为4:1 [32].
材料与方法
病毒和细胞
在这项研究中,我们使用了五种SARS-CoV-2菌株;即原武汉株(hCoV-19/Japan/TY/WK-521,2019, GenBank_LC522975)、Alpha型(hCoV-19/Japan/QK002/2020, EPI_ISL768526)、Beta型(hCoV-19/Japan/TY8-612/2020, EPI_ISL1123289)、Gamma型(hCoV-19/Japan/TY7-501/2020, EPI_ISL833366)和Delta型(hCoV-19/Japan/TY11-330-P1//2021, EPI_ISL2158613)。该菌株由日本国立传染病研究所提供,并在添加10%胎牛血清的最低必要培养基中培养的VeroE6细胞中繁殖。病毒原液作为等份保存在−80°C的冰箱中,直到进行测试。所有使用传染性SARS-CoV-2的实验均在长崎大学生物安全3级(BSL3)实验室按照标准BSL3指南进行。
化合物
5-ALA由Neopharma Japan (Tokyo, Japan)捐赠,在水中溶解至100 mM。Neopharma Japan也捐赠了柠檬酸亚铁钠(SFC),并在1 M氯化氢的水中溶解至25 mM。Remdesivir (Gilead Sciences, Foster City, CA, USA)在DMSO中溶解至10mm。
抗病毒活性测定的评价
将Remdesivir、仅含5-ALA和含SFC的5-ALA以不同浓度稀释于2%胎牛血清中的最低必需培养基中。在感染SARS-CoV-2前72 h (h),用稀释的化合物处理Vero E6细胞,然后在96孔板中播种。随后加入SARS-CoV-2,感染倍数为0.02,并在37°C的化合物存在下孵育至感染后48小时(pi)。收集感染细胞上清液,采用实时定量逆转录聚合酶链反应(qRT-PCR)定量。由于“仅含SFC”在先前的报告中没有显示抗病毒活性[24],本研究未检验“仅SFC”的疗效。
病毒RNA提取及实时定量RT-PCR
根据制造商说明,使用NX-48S病毒核酸(NA)试剂盒(Genolution Inc., Seoul, South Korea),由Nextractor NX-48机器人收集总共100 μL感染细胞上清洗液,用于病毒RNA提取。取共5 μL RNA进行实时定量RT-PCR,用共20 μL的反应混合物进行N基因扩增,反应混合物包括5 μL Taqman master mix, 7 μL核酸酶水,1 μL 0.5- M正向和反向引物,1 μL 0.25- M探针,带有Taqman Fast Virus 1- step master mix的SARS-CoV-2 N引物(Life Technologies, Carlsbad, CA, USA) [33].引物和探针在我们之前的报告中有更详细的介绍[34].
细胞活力测定
96孔板中的Vero E6细胞用样品处理3天,细胞活力测定与抗病毒测定同时进行。为了确定导致细胞存活率降低50%的浓度(CC50),细胞活力测定结果由3-(4,5-二甲基噻唑-2-基)-2,5-二苯四唑溴化铵(Promega, Madison, WI, USA)根据制造商说明书进行评估。光密度在570 nm处使用microplate阅读器(Synergy H1 M;BioTek Instruments, Winooski, VT, USA)。细胞活力测定采用以下公式:细胞活力(%)=(样品值)/(细胞对照)× 100。此外,病毒抑制率为50% (IC50)的计算公式为:病毒抑制率(%)=(病毒对照-样本)病毒拷贝数/病毒对照× 100。
统计分析
使用GraphPad Prism版本9 (GraphPad Software, Inc., San Diego, CA, USA)分析数据。连续变量以平均值±标准差值表示。组间比较采用单向方差分析。一个t两组间连续变量的比较采用检验。对于所有的计算,aP< 0.05为差异有统计学意义。
结果
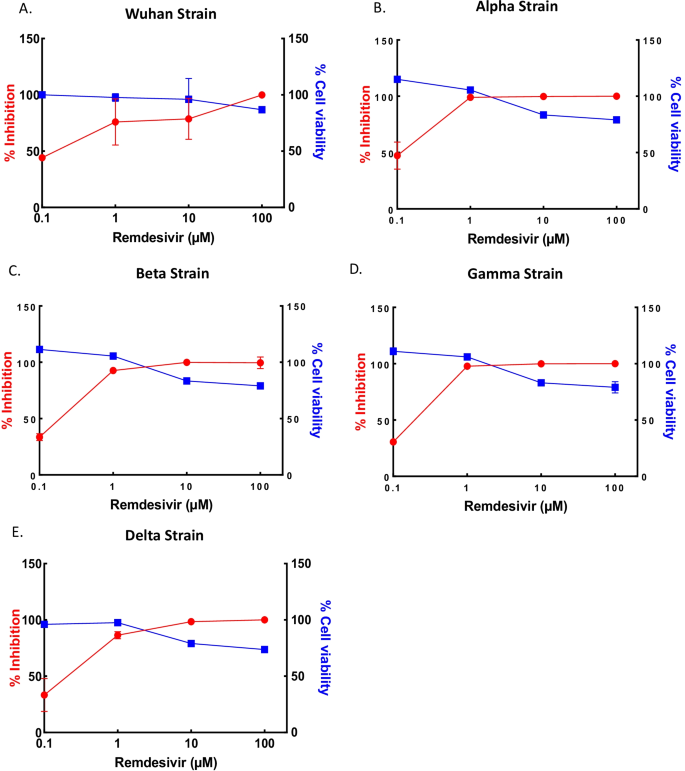
为了评估这些化合物的抗病毒作用,我们首先测试了一种已获批准的抗病毒药物瑞德西韦(remdesivir)对SARS-CoV-2武汉、Alpha、Beta、Gamma和Delta菌株的抗病毒作用;使用特定的基于qrt - pcr的方法测定细胞上清中的病毒拷贝数。抗病毒效果IC50瑞德西韦对武汉株和四种SARS-CoV-2变种的检测值为0.1-1µM(图2)。1).
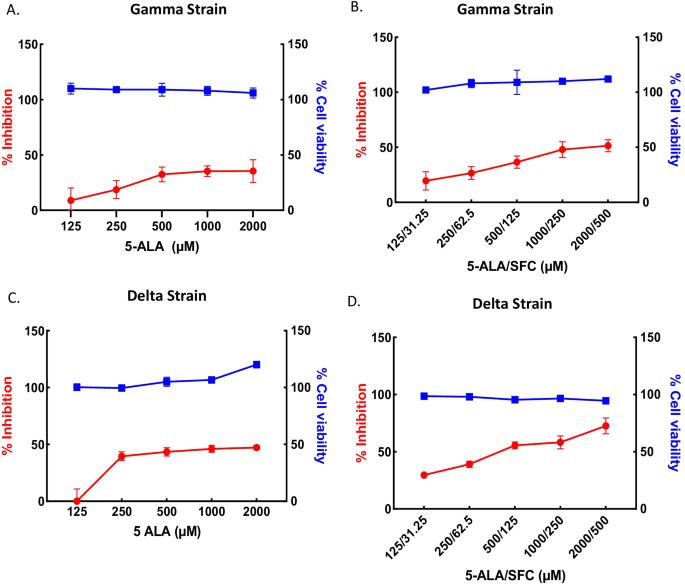
采用相同的qRT-PCR方法,测定5-ALA和SFC的抗病毒作用;2000µM的5-ALA和500µM的SFC对Vero E6细胞无细胞毒作用。5-ALA处理和5-ALA与SFC联合处理VeroE6细胞对武汉株SARS-CoV-2感染呈剂量依赖性抑制作用50值分别为207和235/59µM(图;2A, B).此外,抗病毒效果IC50与5-ALA和5-ALA加SFC处理相关的值分别为104和173/43µM,并以剂量依赖的方式对抗Alpha变体(图。2C, D)和1592,1311/328 μ M以剂量依赖的方式对抗Beta变体(图。2E, F),分别。
相反,在给药5-ALA后,没有病毒抑制,病毒抑制很少(图。3.A)和Delta变量(图。3.C)分别是SARS-CoV-2。然而,5-ALA和SFC联合治疗可导致病毒抑制IC50Gamma和Delta变异感染后的值分别为1516/379和397/99µM。3.B, D, IC50和CC50表中描述了5-ALA和5-ALA与SFC对SARS-CoV-2变体的影响1.
讨论
由于SARS-CoV-2的多种变体,全球正在出现新的临床特征[35].尽管COVID-19疫苗已经研制成功,但仍有必要寻找新的治疗方法。在我们之前的研究中,我们使用免疫荧光法研究了5-ALA和SFC对来自日本患者的SARS-CoV-2临床分离物的抗病毒作用[32].在本研究中,我们报道了5-ALA在同时和不同时使用SFC对SARS-CoV-2原始菌株和几个变体的杀病毒活性。低浓度的5-ALA配SFC对武汉、Alpha和Delta菌株有抑制作用,高浓度的5-ALA配SFC对Beta和Gamma菌株有抑制作用。因此,我们的结果表明,5-ALA与SFC具有抗病毒武汉病毒和SARS-CoV-2变种的作用,且没有细胞毒性。5-ALA仅能抑制SARS-CoV-2武汉株、α株和β株,表明具有特定的抗病毒作用。
最近的研究表明,一种分子靶点g -四重结构(G4)具有抑制SARS-CoV-2复制的抗病毒活性,因此具有潜在的兴趣[36,37].G4s是在生理条件下,在单链DNA和RNA富含鸟嘌呤的序列中形成的核酸二级结构[38].G4结构已在包括冠状病毒在内的几种DNA和RNA病毒中被报道,并与关键病毒过程的控制有关[39].许多算法已经被开发用于全基因组水平的G4倾向预测;即quada - parser、QGRS Mapper、G4P Calculator、QuadBase、ccc score、G4Hunter、G4RNA screener [40].在SARS-CoV-2的RNA基因组中,使用QGRS Mapper发现了大约25个假定的四重结构形成序列[36,41,42],以及G4RNA筛选器[43].其中,在SARS-CoV-2核衣壳磷蛋白编码序列区域的G4形成RNA可以被吡啶抑素衍生物G4配体稳定。吡啶抑素衍生物可降低sars - cov - 2n在体外和细胞内的表达[37].许多G4结合分子已被报道为靶向G4的治疗策略,包括卟啉[43].我们以前报道过,细胞内产生的卟啉PPIX和hemin是新的G4结合剂,它们由5-ALA代谢而来[44,45,46,47].在本研究中,我们发现外源性提供的5-ALA可以抑制SARS-CoV-2感染。这可能是由于PPIX生成增加所致。这些数据表明了一种新的治疗策略,即通过细胞内生成5-ALA卟啉来靶向G4对抗SARS-CoV-2。然而,利用计算预测算法,SARS-CoV-2基因组中PQSs的密度显著降低,这表明预测的SARS-CoV-2 PQSs的G4折叠能力由许多“弱G4”组成。由于SARS-CoV-2变体之间的PQSs没有差异,5-ALA的其他机制可能参与其中。病毒对细胞入侵效率的差异是原因之一。由于PQRs只是一种生物信息学分析,未来有必要从生物学角度对病毒基因组中的G4s进行识别。
5-ALA是由大多数动物和植物产生的,因此存在于我们的食物中,由于生物利用度高,可以通过口服途径摄取[48].5-ALA with SFC是一种在日本注册的补充剂配方,是一种具有功能声明的食品。在最近的一项临床研究中,口服5-ALA和SFC胶囊的日本COVID-19患者的康复时间比仅接受标准治疗的SARS-CoV-2感染患者的康复时间短[49].关于治疗对人体影响及其后遗症的指定临床试验的注册已经完成,目前正在分析数据(日本临床试验注册局CRB 7180001和3190006)。
结论
本研究证实了5-ALA和SFC对SARS-CoV-2变体的体外抗病毒作用,并可能揭示这些成分作为COVID-19的治疗和预防措施。
数据和材料的可用性
不适用。
缩写
- SARS-CoV-2:
-
严重急性呼吸综合征冠状病毒2
- COVID-19:
-
2019冠状病毒病
- 5-ALA:
-
5-Aminolevulinic酸
- 证监会:
-
柠檬酸亚铁钠
- 史:
-
斯派克糖蛋白
- 艾凡:
-
包膜蛋白
- M:
-
膜蛋白
- 护士:
-
核衣壳蛋白
- ACE 2:
-
血管紧张素转换酶2
- PPIX:
-
原卟啉IX
- BSL3:
-
生物安全等级3
- 存在:
-
定量实时反转录聚合酶链反应
- 拿拿淋:
-
核酸
- CC50:
-
细胞存活率降低50%
- IC50:
-
50%病毒抑制
- G4:
-
G-quadruplex
- PQSs:
-
推定的四重结构形成序列
参考文献
李强,关旭,吴鹏,王旭,周林,童勇,等。新型冠状病毒感染的肺炎在中国武汉的早期传播动态中华医学杂志,2020;
卢荣,赵鑫,李娟,牛鹏,杨波,吴华,等。2019新型冠状病毒的基因组特征和流行病学:对病毒起源和受体结合的影响。《柳叶刀》杂志。2020;395:565 - 74。
张玉珍,贺姆斯EC。SARS-CoV-2起源和出现的基因组视角。细胞。2020;181:223-7。
Hoffmann M, Kleine-Weber H, Schroeder S, Krüger N, Herrler T, Erichsen S,等。SARS-CoV-2细胞进入依赖于ACE2和TMPRSS2,并被临床证明的蛋白酶抑制剂阻断。细胞。2020;181:271 - 80。
兰娟,葛娟,于娟,单山,周华,樊松,等。SARS-CoV-2刺突受体结合域与ACE2受体结合的结构。大自然。2020;581:215-20。
世界卫生组织。https://covid19.who.int/.8月27日访问。
何峰,邓毅,李伟。2019冠状病毒病:我们知道什么?中国医学病毒学杂志,2020;92:719-25。
周震,康宏,李松,赵霞。新冠病毒的嗜神经特征:从新冠病毒的神经学表现到潜在的嗜神经机制。中华神经科学杂志,2020;
Ahmed MU, Hanif M, Ali MJ, Haider MA, Kherani D, Memon GM,等。COVID-19 (SARS-CoV-2)神经学表现综述Front Neurol, 2020。https://doi.org/10.3389/fneur.2020.00518.
金九,金美娟,罗士华,李俊,裴松,等。新型冠状病毒肺炎轻症无症状和有症状患者的临床特征。临床微生物感染,2020。https://doi.org/10.1016/j.cmi.2020.04.040.
林林,姜旭,张震,黄松,张震,方震,等。95例SARS-CoV-2感染患者胃肠道症状分析肠道。2020;69:997 - 1001。
世界卫生组织。https://www.who.int/en/activities/tracking-SARS-CoV-2-variants/.8月25日访问。
吴凯,吴纳·AP,莫里瓦·吉,科赫·M,崔·A,等。mRNA-1273疫苗诱导对抗SARS-CoV-2全球变体刺突突变体的中和抗体。bioRxiv。2021.https://doi.org/10.1101/2021.01.25.427948.
谢欣,邹娟,冯特斯- garfias CR,夏红,Swanson KA,等。BNT162b2疫苗诱导血清中和N501Y突变体SARS-CoV-2bioRxiv。2021.https://doi.org/10.1101/2021.01.07.425740.
魏斯布卢姆,张峰,张晓东,张晓东,等。通过SARS-CoV-2刺突蛋白变体逃离中和抗体。eLife。2020; 9:1。
Resende PC, Bezerra JF, Vasconcelos RHT, Arantes I, Appolinario L, Mendoncą AC,等。与再感染病例相关的严重急性呼吸综合征冠状病毒2 P.2谱系,巴西,2020年6月至10月。新兴感染杂志2021;27:1789-94。
世界卫生组织。COVID-19大流行。2020.https://www.who.int/emergencies/diseases/novel-coronavirus-2019.
马thieu E, Ritchie H, ortizo - ospina E, Roser M, Hasell J, Appel C,等。COVID-19疫苗接种全球数据库。娜·哈姆·比哈夫,2021;5:947-53。https://doi.org/10.1038/s41562-021-01122-8.
Zahradník J, Marciano S, Shemesh M, Zoler E, Harari D, Chiaravalli J,等。通过RBD体外进化实现SARS-CoV-2变异预测和抗病毒药物设计。微生物学报。2021;6:1188-98。https://doi.org/10.1038/s41564-021-00954-4.
Ashburn TT, Thor KB。药物重新定位:确定和开发现有药物的新用途。中国医药科学,2004;3:673-83。
王勇,张东,杜刚,杜瑞,赵杰,金勇,等。瑞德西韦治疗成年重症COVID-19:一项随机、双盲、安慰剂对照、多中心试验。《柳叶刀》杂志。2020;395:1569 - 78。https://doi.org/10.1016/s0140 - 6736 (20) 31022 - 9.
费希尔W, Eron JJ, Holman W, Cohen MS,方林,Szewczyk LJ,等。Molnupiravir是一种口服抗病毒治疗COVID-19的药物。medRxiv。2021.https://doi.org/10.1101/2021.06.17.21258639.
Boras B, Jones RM, Anson BJ, Arenson D, Aschenbrenner L, Bakowski MA,等。静脉注射冠状病毒3CL蛋白酶抑制剂用于治疗covid - 19的临床前研究Nat Commun. 2021;12:6055。
Rehani PR, Iftikhar H, Nakajima M, Tanaka T, Jabbar Z, Rehani RN。糖尿病药物与5-氨基乙酰丙酸(5-ALA)比较的安全性和作用模式。《糖尿病杂志》2019年版。https://doi.org/10.1155/2019/4267357.
杨欣,陈斌,陈斌。基于氨基乙酰丙酸的肿瘤检测与治疗:分子机制与增强策略。中国生物医学工程学报(英文版);2015;
藤野M,西尾Y,伊藤H,田中T,李小凯。5-氨基乙酰丙酸调节炎症反应和同种免疫反应。《免疫药典》2016;37:71-8。https://doi.org/10.1016/j.intimp.2015.11.034.
Assunção-Miranda I, Cruz-Oliveira C, Neris RL, Figueiredo CM, Pereira LP, Rodrigues D, Araujo DF, Da Poian AT, Bozza MT.血红素、钴原卟啉IX和锡原卟啉IX灭活登革热和黄热病病毒。中国生物医学工程学报,2016;
Neris RLS, Figueiredo CM, Higa LM, Araujo DF, Carvalho CAM, Verçoza BRF,等。co -原卟啉IX和sn -原卟啉IX通过靶向病毒包膜灭活寨卡病毒、基孔肯雅病毒和其他虫媒病毒。科学通报2018;8:1-13。
马丽玲,张鹏,王海峰,李玉峰,胡军,蒋建德,等。血红素加氧酶-1激动剂CoPP通过irf3介导的IFN-α/β的产生抑制流感病毒的复制。病毒学》2019。https://doi.org/10.1016/j.virol.2018.11.016.
Ito H, Nishio Y, Hara T, hideitsu S, Tanaka T, Li X.口服5-氨基乙酰丙酸联合亚铁诱导健康人外周血单个核细胞血红素加氧酶-1表达欧洲药物学杂志,2018;833:25-33。
铃木S, Hikosaka K, Balogun EO,小松也K,新仓M,小林F,等。口服5-氨基乙酰丙酸加亚铁离子对疟疾的体内治疗和保护潜力。抗微生物制剂Chemother 2015; 59:6960-7。
Sakurai Y, Ngwe Tun MM, Kurosaki Y, Sakura T, Inaoka DK, Fujine K,等。5-氨基乙酰丙酸体外抑制SARS-CoV-2感染的研究。生物化学生物物理学报。2021;545:203-7。
Tun MMN, Muthugala R, Nabeshima T, Soe AM, Dumre SP, Rajamanthri L,等。脑炎患者脑脊液中嗜神经登革病毒2世界性基因型的全基因组分析与鉴定PLoS ONE。2020; 15(6): 1 - 15。
白藤K,直尾N,片野H,高山I,斋藤S,加藤F,等。日本新型冠状病毒2019 (nCoV-2019)检测基因诊断方法的开发。中华流行病学杂志;2020;43(3):344 - 344。
Alhadrami HA, Sayed AM, Hassan HM, Youssif KA, Gaber Y, Moatasim Y,等。Cnicin作为一种抗sars - cov -2:一种快速识别潜在covid-19治疗方法的硅体外综合方法抗生素。2021;10(5):542。
Panera N, Tozzi AE, Alisi a . g -四联体/解旋酶世界是一种潜在的对抗COVID-19的抗病毒方法。药。2020;80:941-6。
赵超,秦刚,牛娟,王震,王超,任娟,曲霞。靶向SARS-CoV-2 RNA G-四重体:新冠肺炎有希望的治疗靶点?Angew Chem Int Ed. 2020; 60:432-8。
李志强,李志强,李志强,等。g -四联体结构的体内证据和功能。细胞生物学杂志2009;19:414-22。
Lavezzo E, Berselli M, Frasson I, Perrone R, Palù G, Brazzale AR,等。所有已知人类病毒基因组中的g -四重体形成序列:全面指南。《公共科学图书馆·计算生物学》2018;14:1-20。
Asamitsu S, Takeuchi M, Ikenoshita S,今井Y, Kashiwagi H, Shioda N. g -四重结构在神经生物学和神经药理学中的应用前景。中国药理学杂志2019;20:1-15。
季东,朱海敏,曾敏敏,郭志强,李艳,张艳。SARS-CoV-2中g -四重基形成序列的发现。生物信息,2021;22:1150-60。
崔华,张磊。包括SARS-CoV-2在内的人冠状病毒中存在g -四重复合物。前沿微生物,2020年。https://doi.org/10.3389/fmicb.2020.567317.
Asamitsu S, Obata S, Yu Z, Bando T, Sugiyama H.靶向g -四聚体优选配体在癌症治疗中的最新进展。分子。2019;24(3):429。
盐田N, Yabuki Y,山口K, Onozato M,李Y,黑泽明K,等。g -四重体DNA靶向治疗ATR-X综合征的认知功能。中国医学杂志2018;24:8 2 - 13。
Wada T, Suzuki S, Shioda N. 5-氨基乙酰丙酸可以改善ATR-X综合征患者的语言功能障碍。京都。2020; 60:147-8。
Asamitsu S, Yabuki Y, Ikenoshita S, Wada T, Shioda N.使用卟啉治疗神经系统疾病的g -四聚物的药理前景。生物化学生物物理研究,2020;531:51-5。
浅光S, Yabuki Y, Ikenoshita S,川久保玲K,川崎M, Usuki S,等。CGG重复RNA g -四重链与FMRpolyG相互作用导致脆性x相关震颤/共济失调综合征的神经元功能障碍。科学通报2021;7:1-14。
道尔顿JT,叶芝CR,尹D,斯特劳恩A,马库斯SL, Golub AL,等。5-氨基乙酰丙酸在健康志愿者和复发性膀胱癌高危患者中的临床药代动力学中国药物学杂志2002;
Nakajima M, Kaketani K. 5-氨基乙酰丙酸磷酸盐(血红素加氧酶1诱导物)联合柠檬酸亚铁钠治疗COVID-19患者的安全性、耐受性和有效性打开COVID J. 2021。https://doi.org/10.2174/2666958702101010052.
确认
作者感谢Chris Smith博士(长崎大学)对手稿准备的支持。
资金
这项工作得到了日本医学研究与开发机构(资助号JP21wm0125006)和长崎大学全球卫生“世界领先的创新和智能教育博士项目”、“建设更健康世界的全球卫生精英项目”的资助。
作者信息
作者及隶属关系
贡献
MMNT, JY, KK和KM:概念化,研究设计。MMNT, TS, YS, YK, DI:数据分析和调查。MMNT:写作-初稿准备。MMNT, NS, YS, YK和KK:写作-评论和编辑。JY, KK和KM:监督和资金获取。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
Kita K.是日本Neopharma的科学顾问。其他作者宣称没有利益竞争。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
Ngwe Tun, m.m.,樱,T.,樱井,Y。et al。5-氨基乙酰丙酸对严重急性呼吸综合征变异型冠状病毒的抗病毒作用Trop Med Health50, 6(2022)。https://doi.org/10.1186/s41182-021-00397-x
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s41182-021-00397-x
关键字
- SARS-CoV-2变体
- 5-ALA
- 香港证监会
- 抗病毒药物