- 研究gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
反转录环介导的等温扩增技术检测和鉴别多株寨卡病毒gydF4y2Ba
热带医学与卫生gydF4y2Ba体积gydF4y2Ba48gydF4y2Ba,文章号:gydF4y2Ba87gydF4y2Ba(gydF4y2Ba2020gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
监测寨卡病毒疾病侵入自由国家和在流行国家的传播对于避免全球大流行至关重要。然而,寨卡病毒的基因组序列突变种类繁多,检测难度很大。为了建立一种快速、简便、准确的方法,采用逆转录环介导等温扩增(RT-LAMP)技术对来自多个国家的寨卡病毒毒株进行检测。gydF4y2Ba
结果gydF4y2Ba
RT-LAMP的常用引物是基于两种标准寨卡病毒株的基因组序列设计的:非洲系MR-766和亚洲系PRVABC59。RT-LAMP反应使用筛选的引物集,针对NS3区域,检测到两种寨卡病毒株。最小检出量为3 × 10gydF4y2Ba−2gydF4y2Bang的病毒RNA。观察到不同菌株之间的反应时间有明显的滞后。RT-LAMP方法从一名有加勒比群岛旅行史的患者的尿液和血清中扩增了目标病毒序列,还提供了关于存在寨卡病毒毒株谱系的预测。gydF4y2Ba
结论gydF4y2Ba
RT-LAMP方法采用优化的引物集,对多种基因组RNA序列的寨卡病毒毒株检测具有较高的特异性和敏感性。结合LAMP反应在等温条件下的简单性,本研究建立的优化引物集可以通过毒株信息快速准确地诊断寨卡热患者。gydF4y2Ba
背景gydF4y2Ba
寨卡病毒(ZIKV)属于虫媒病毒科gydF4y2Ba黄gydF4y2Ba.寨卡病毒通过被感染者叮咬传播gydF4y2Ba伊蚊gydF4y2Ba蚊子主要分布在热带地区,与登革热、基孔肯雅热和黄热病一样。2016年2月,世界卫生组织宣布寨卡热(又称寨卡病毒病)为国际关注的突发公共卫生事件,成为全球重要的医疗问题。寨卡病毒于1947年在乌干达首次被发现,几乎没有引起人们的关注,直到2015年巴西大规模爆发寨卡病毒与小头畸形症之间的联系才被怀疑[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba].大多数ZIKV感染病例被认为是无症状的,但一些有症状的病例表现为皮疹、发烧和关节痛,很少有严重的症状Guillain-Barré综合征。寨卡病毒对人类的负担更大,特别是在怀孕期间感染,导致小头畸形和其他胎儿结局[gydF4y2Ba3.gydF4y2Ba].gydF4y2Ba
环介导等温扩增(LAMP)是一种利用DNA聚合酶进行DNA扩增的方法gydF4y2BaBstgydF4y2BaOmniAmp®能够在等温条件下使用4到6种特定引物进行扩增[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba].LAMP已经成为基于pcr的方法的一个有利的替代方案,主要是由于它的简单性和实用性不需要专门的设备。LAMP使用多个引物以高特异性扩增目标DNA,并已用于DNA序列中单核苷酸多态性的分型[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba].它也被广泛用于检测蚊媒病原体,例如人蚊和病媒蚊的寄生虫和病毒[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba].利用逆转录(RT)-LAMP技术检测ZIKV的基因组RNA [gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba],因为最近的疫情发生在资源有限的环境中,增加了对适用于可靠、具有成本效益和高通量的ZIKV诊断的简单测定方法的需求。gydF4y2Ba
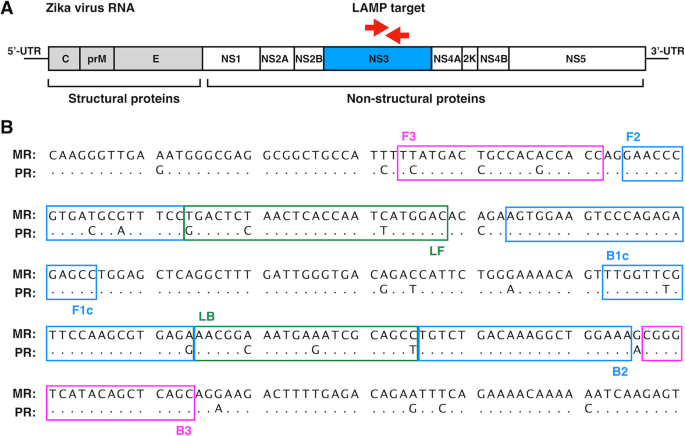
由于病毒的高度基因组多样性,检测病毒的难度仍然很明显[gydF4y2Ba18gydF4y2Ba].病毒基因组测序和系统发育分析支持了遗传变异的时空比较。基因组流行病学方法通过绘制病毒在美洲的传播和进化,成功地重建了ZIKV的出现[gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba].最近,两种主要的不同的ZIKV的完整基因组序列被确定:MR-766-NIID,一种非洲ZIKV分离物,于1947年在乌干达恩德培附近的寨卡森林中从一只发烧的哨兵猴身上发现[gydF4y2Ba1gydF4y2Ba],以及2015年12月从波多黎各一名人类血液中分离出的美国流行毒株PRVABC59 [gydF4y2Ba22gydF4y2Ba].利用29个可用的ZIKV基因组序列进行的系统发育分析将这两株毒株分为主要的遗传谱系,非洲(MR-766-NIID)和亚洲(PRVABC59) [gydF4y2Ba23gydF4y2Ba].gydF4y2Ba
本研究利用新优化的通用引物对RT-LAMP检测非洲MR-766-NIID和亚洲PRVABC59两种标准ZIKV毒株的敏感性和特异性进行了评价。使用该引物组的RT-LAMP还检测到了从一名寨卡热患者身上收集的一种不明的ZIKV毒株,突出了RT-LAMP在诊断病媒传播疾病方面的高特异性优势。gydF4y2Ba
方法gydF4y2Ba
细胞培养gydF4y2Ba
本研究中使用的zikv在其中一种环境中培养gydF4y2Ba白纹伊蚊gydF4y2BaC6/36细胞(龚诚博士赠予)或非洲绿猴肾Vero细胞(ATCC)或两者兼有。C6/36细胞培养于D-MEM,高葡萄糖(赛默飞世尔科学公司),添加10%胎牛血清(FBS)和青霉素-链霉素。Vero细胞在添加10%胎牛血清、MEM非必需氨基酸溶液(赛默飞世尔科学公司)和青霉素-链霉素的E-MEM中培养。gydF4y2Ba
病毒分离与传播gydF4y2Ba
两株标准的ZIKV毒株MR-766-NIID(非洲系)和PRVABC59(亚洲系)在Vero细胞中传代。为了从感染zikv的患者中分离病毒,同时使用了C6/36和Vero细胞。简单地说,将患者的尿液稀释在培养基中,并在28°C下初步接种到C6/36细胞中。将部分培养上清接种到新鲜的C6/36细胞中。在37°C, 5% CO的Vero细胞的病毒细胞培养中经过几次传代gydF4y2Ba2gydF4y2Ba几天后,通过常规RT-PCR方法观察细胞病变效应和细胞上清中ZIKV RNA载量的增加,确认了病毒复制。简单地说,ZIKV的cdna是根据制造商的说明使用M-MLV逆转录酶(赛默飞世尔科学公司)合成的。PCR反应使用TaKaRa Ex Taq (TaKaRa Bio Inc.)按照制造商的说明进行,并使用针对包膜区域部分序列的引物(正向:GCTGGDGCRGACACHGGRACT,反向:RTCYACYGCCATYTGGRCTG) [gydF4y2Ba24gydF4y2Ba].目标序列的扩增过程如下:在98°C下进行1次循环,持续3分钟,在94°C下进行34次循环,持续10秒,在55°C下持续30秒,在72°C下持续30秒。扩增产物经凝胶电泳确证。然后将ZIKV分离物保存在Vero细胞中。gydF4y2Ba
患者样本gydF4y2Ba
我们分析了一名确诊感染ZIKV的患者的样本,该患者参加了一项在日本东京的绩庆大学医院进行的描述性观察性研究。该研究方案得到了机构审查委员会的批准(许可号为28-023[8266],来自绩庆大学医学院)。符合疑似急性寨卡病毒病例定义的所有年龄和任何性别的个体(发烧和/或皮疹,以及一种或多种其他症状,包括关节痛、肌痛、非化脓性结膜炎或结膜充血、头痛和不适)均符合研究条件。获得每位参与者的知情同意。经同意后,每次就诊均采集血清和尿液样本。在目前的研究中,纳入了一名患者,他于2016年访问了多米尼加共和国,并返回日本,血清和尿液中确诊了寨卡病毒感染。在日本国立传染病研究所使用引物-探针组,利用实时RT-PCR从该患者血清中检测到ZIKV RNA [gydF4y2Ba25gydF4y2Ba].收集患者的血清和尿液,并保存在−80°C下,以供进一步分析。gydF4y2Ba
病毒RNA提取gydF4y2Ba
病毒感染的Vero细胞培养上清以430倍离心gydF4y2BaggydF4y2Ba在4°C下浸泡15分钟,以消除宿主细胞。用高纯病毒核酸试剂盒(Roche Ltd.)从上清液中提取病毒rna,按照制造商的说明进行轻微修改。收集的RNA(主要由病毒RNA组成)被连续稀释,并提供给进一步的实验。gydF4y2Ba
为了从患者身上提取病毒RNA,将感染zikv患者的尿液和血清样本放在冰上解冻。从每个样品250 μl中提取总RNA,方法如下:每个样品与750 μl TRIzol LS (Thermo Fisher Scientific Inc.)混合均匀,室温孵育5分钟。加入200 μl氯仿,室温孵育15 min。离心20400 ×,收集上清液500微升gydF4y2BaggydF4y2Ba加入500 μl异丙醇,在4℃下静置15分钟。RNA经20,400×离心沉淀gydF4y2BaggydF4y2Ba4°C浸泡10分钟,用70%乙醇冲洗,晾干。RNA在21 μl无rnase水中稀释。每个RNA溶液取2.5 μl作为模板进行RT-LAMP反应。gydF4y2Ba
RT-LAMP反应gydF4y2Ba
RT-LAMP引物使用PrimerExplorer V5(富士通有限公司)设计。RT-LAMP反应按照制造商(Eiken Chemical Co., Ltd)的说明进行,并进行了轻微修改。简单地说,反应在12.5 μl的反应混合物中进行(提取的RNA溶液2.5 μl,酶合剂0.5 μl,引物溶液3.25 μl [F3和B3引物各2.5 pmol, FIP和BIP引物各20 pmol, Loop-F和Loop-B引物各10 pmol], 2×反应混合物6.25 μl)。反应混合物在62°C下使用Loopamp Realtime浊度计(LoopampEXIA;艾肯化工有限公司)。在80℃下孵育5分钟,终止反应。在50 V下,用2%琼脂糖凝胶电泳检测反应扩增产物。凝胶用溴化乙锭染色,在312 nm紫外光下观察。gydF4y2Ba
病毒序列分析gydF4y2Ba
为了分析和比较ZIKV株之间的序列,我们合成了来自一名感染患者的ZIKV cDNA,并进行了扩增和测序。简单地说,将1 μg提取的RNA溶解在10.5 μl无rnase水中,与反应混合物(3 μl 40 μM随机引物(Thermo Fisher Scientific Inc.), 6 μl 5× First-Strand Buffer (Thermo Fisher Scientific Inc.), 1.9 μl 0.1 M DTT (Thermo Fisher Scientific Inc.), 7.5 μl dNTP mix (Takara Bio Inc.))在65℃下孵育5分钟。在反应混合物中加入0.6 μl RNase inhibitor (Promega Co.)和0.5 μl M-MLV逆转录酶(Thermo Fisher Scientific Inc.), 37℃孵育90 min。使用PrimeSTAR Max DNA聚合酶(Takara Bio Inc.),以引物组(正向:TCACAGATCCCTCAAGTATAGC,反向:CTCTGAAATGTCAGTTGTCACG)或用于RT-LAMP的F3和B3引物PCR扩增部分cDNA(表2)gydF4y2Ba1gydF4y2Ba).扩增产物用QIAEX II Gel Extraction Kit (QIAGEN)进行纯化,并直接与扩增所用引物进行测序。测定序列与6株ZIKV菌株(来自NCBI: PRVABC59、DOM_2016_BB-0076-SER (GenBank: KY014305.2)、DOM_2016_BB-0183-SER (GenBank: KY785420.1)、DOM_2016_BB-0127-SER (GenBank: KY014303.2)、DOM_2016_BB-0208-SER (GenBank: ky0143002)、DOM_2016_BB-0180-URI (GenBank: KY785476.1)序列进行比对。gydF4y2Ba
结果gydF4y2Ba
ZIKV RT-LAMP优化引物组的设计与筛选gydF4y2Ba
为了通过RT-LAMP鉴定ZIKV MR-766- niid (MR)和PRVABC59 (PR)菌株的感染,设计了一套通用引物,针对覆盖整个ZIKV基因组的区域(图2)。gydF4y2Ba1gydF4y2Baa).对ZIKV MR-766- niid菌株(GenBank: LC002520.1)和PRVABC59菌株(GenBank: KU501215.1)的全基因组cDNA序列进行比对,根据MR菌株的核苷酸序列,使用primer Explorer V5 (Fujitsu Ltd.)确定几个适用于引物设计的目标序列。引物组与PR菌株的序列有几处不匹配(图2)。gydF4y2Ba1gydF4y2Bab).筛选这些引物组在检测ZIKV MR株基因组RNA的RT-LAMP反应中的敏感性,其中靶向ZIKV NS3区域的引物组具有最高的敏感性(表2)gydF4y2Ba1gydF4y2Ba).使用该引物组优化RT-LAMP反应条件的温度为62℃,时间为60 min。gydF4y2Ba
RT-LAMP检测不同ZIKV菌株的灵敏度gydF4y2Ba
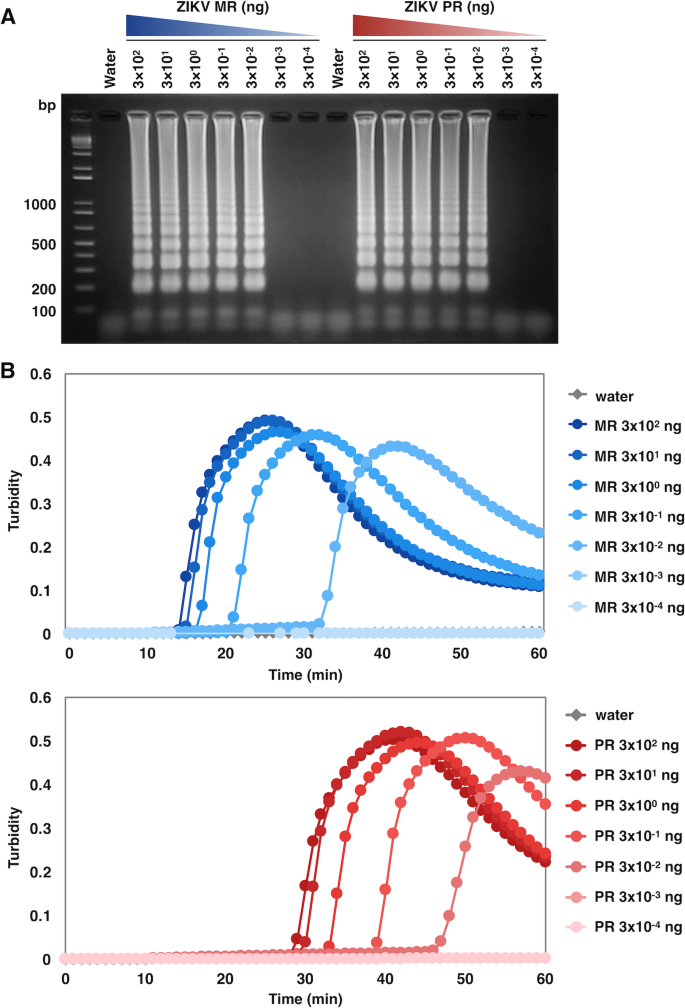
为了评估使用常用引物组的ZIKV RT-LAMP的敏感性,以连续稀释的ZIKV RNA为模板。从ZIKV MR株和PR株感染的细胞培养上清中提取rna,进行RT-LAMP反应。在优化条件下(62℃,60 min),两株菌株的检出量均降至3 × 10gydF4y2Ba−2gydF4y2Bang RNA作为孵育后50 min内的下检出限(图;gydF4y2Ba2gydF4y2Baa),即使引物组特异性于MR菌株的基因组序列,并且包括与PR菌株的几次错配(图2)。gydF4y2Ba1gydF4y2Bab).基于lamp的基因扩增可以通过检测扩增副产物焦磷酸镁存在引起的白色浊度同时监测。实时浊度测定结果表明,引物组对MR菌株的扩增速度比PR菌株快,如3 × 10gydF4y2Ba2gydF4y2Ba分别在大约15分钟和30分钟后,MR和PR菌株的ng RNA作为扩增产物被检测到(图2)。gydF4y2Ba2gydF4y2Bab).这些结果表明,在优化的RT-LAMP条件下,新设计的引物具有较高的灵敏度,可用于不同ZIKV菌株的鉴别。gydF4y2Ba
RT-LAMP检测ZIKV MR和PR株的敏感性。每个ZIKV菌株的RNA (3 × 10gydF4y2Ba2gydF4y2Ba, 3 × 10gydF4y2Ba1gydF4y2Ba, 3 × 10gydF4y2Ba0gydF4y2Ba, 3 × 10gydF4y2Ba−1gydF4y2Ba, 3 × 10gydF4y2Ba−2gydF4y2Ba, 3 × 10gydF4y2Ba−3gydF4y2Ba, 3 × 10gydF4y2Ba−4gydF4y2Bang)作为模板,在62℃下RT-LAMP反应60 min。RT-LAMP反应以水为阴性对照。gydF4y2Ba一个gydF4y2BaRT-LAMP扩增产物琼脂糖凝胶电泳。反应混合物在2%琼脂糖凝胶上电泳。左边的数字表示分子量标记物(bp)的迁移。gydF4y2BabgydF4y2Ba实时浊度计监测MR和PR菌株ZIKV NS3的扩增(浊度为650 nm)gydF4y2Ba
RT-LAMP检测临床标本中ZIKVgydF4y2Ba
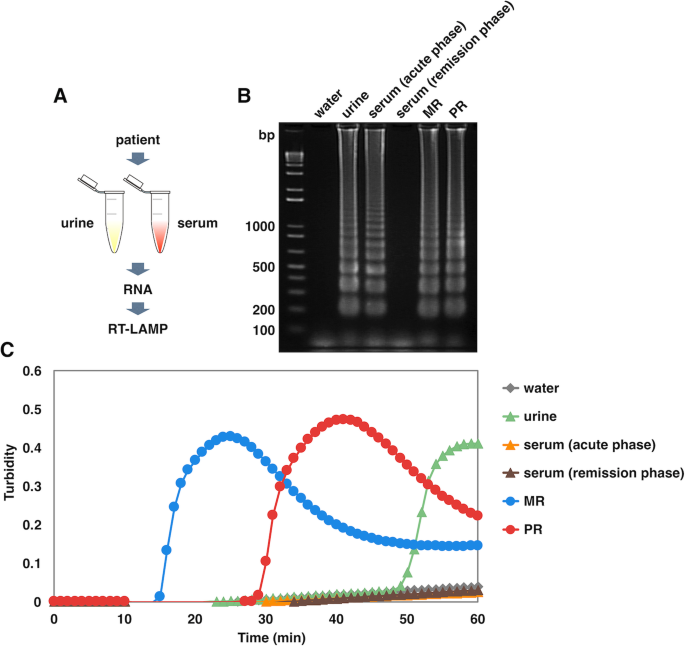
为了检验ZIKV RT-LAMP是否可以揭示人类样本中病毒RNA的存在,这些样本通常包含宿主细胞中的核苷酸等各种碎片,研究人员测试了ZIKV感染患者的尿液和血清。2016年访问多米尼加共和国的一名中年男性被诊断为寨卡热,在疾病急性期和缓解期均采集了患者的血清和尿液;在症状明显的患者第一次就诊和症状缓解的患者第二次就诊时采集初始和后续血清。还从同一名缓解期患者身上采集了尿液。从每个样品中提取RNA,然后进行RT-LAMP反应(图2)。gydF4y2Ba3.gydF4y2Baa).结果通过凝胶电泳在尿液和血清(急性期)中均检测到ZIKV,但在血清(缓解期)中未检测到(图。gydF4y2Ba3.gydF4y2Bab).浊度分析还从尿液样本中识别出扩增产物,但从血清样本中未识别出扩增产物,这可能是由于低水平病毒血症低于检测限(图。gydF4y2Ba3.gydF4y2Bac).这些结果表明ZIKV RT-LAMP适用于使用尿液和血清进行寨卡热的潜在诊断。gydF4y2Ba
RT-LAMP对ZIKV谱系的可能估计gydF4y2Ba
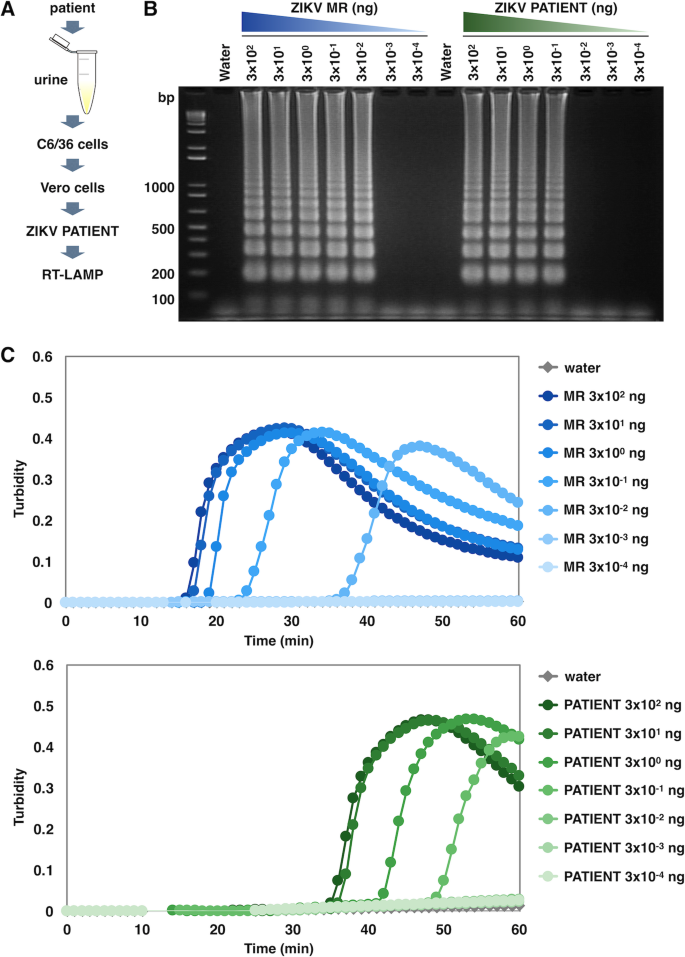
为了探索寨卡病毒RT-LAMP反应在哪些方面可以提供关于未知的寨卡病毒株的信息,在寨卡热患者中观察到的病毒(如图所示)。gydF4y2Ba3.gydF4y2Ba)是孤立的。首先,将培养的细胞与患者的尿液混合,进行ZIKV的增殖,命名为ZIKV patient。然后从ZIKV PATIENT菌株中提取病毒RNA,在优化的条件下进行RT-LAMP反应(图2)。gydF4y2Ba4gydF4y2Baa).患者株RNA小于3 × 10gydF4y2Ba−2gydF4y2Ba与MR菌株相比,比浊法或凝胶电泳均未检测到ng。gydF4y2Ba4gydF4y2Bab, c). RT-LAMP反应中观察到的浊度法扩增PATIENT菌株比MR菌株慢;3 × 10gydF4y2Ba2gydF4y2Ba分别在大约15分钟和35分钟后,MR和PATIENT菌株的ng RNA作为扩增产物被检测到(图2)。gydF4y2Ba4gydF4y2Bac)。gydF4y2Ba
RT-LAMP检测寨卡热患者ZIKV的敏感性gydF4y2Ba一个gydF4y2Ba从患者尿液中制备用于RT-LAMP检测的ZIKV PATIENT菌株的方案。gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2BaRT-LAMP扩增MR和患者株ZIKV NS3。每个ZIKV株的RNA (3 × 10gydF4y2Ba2gydF4y2Ba, 3 × 10gydF4y2Ba1gydF4y2Ba, 3 × 10gydF4y2Ba0gydF4y2Ba, 3 × 10gydF4y2Ba−1gydF4y2Ba, 3 × 10gydF4y2Ba−2gydF4y2Ba, 3 × 10gydF4y2Ba−3gydF4y2Ba, 3 × 10gydF4y2Ba−4gydF4y2Bang)作为模板,在62℃下RT-LAMP反应60 min。水作为RT-LAMP反应的阴性对照。gydF4y2BabgydF4y2BaRT-LAMP扩增产物琼脂糖凝胶电泳。反应混合物在2%琼脂糖凝胶上电泳。左边的数字表示分子质量标记(bp)的迁移。gydF4y2BacgydF4y2Ba使用实时浊度计(浊度在650 nm)监测MR和PATIENT菌株目标序列的扩增。gydF4y2Ba
确定了包含RT-LAMP靶区的PATIENT株的部分cDNA序列,并与在多米尼加共和国分离的5株ZIKV株的序列进行了比对。PATIENT菌株的序列与PR菌株和所有5株多米尼加菌株完全匹配(图2)。gydF4y2Ba5gydF4y2Ba),表明PATIENT菌株属于亚洲血统。结果也与观察到的MR、PR和PATIENT菌株之间扩增反应时间的滞后一致(图2)。gydF4y2Ba2gydF4y2Bab和gydF4y2Ba4gydF4y2Bac).本研究结果表明,具有共同引物集的RT-LAMP方法可能是一种可行的工具,不仅可以高灵敏度地检测ZIKV,而且还可以估计ZIKV的具体谱系。gydF4y2Ba
讨论gydF4y2Ba
2015年寨卡病毒病大规模爆发后,人们广泛寻求更快、更准确的诊断方法进行风险评估。迄今为止,检测抗体的血清学检测和检测病毒基因组中目标序列的核酸检测,包括RT-PCR,已被用作标准的诊断方法[gydF4y2Ba18gydF4y2Ba].gydF4y2Ba
在本研究中,我们用一套通用引物RT-LAMP检测患者血清和尿液中的ZIKV,该引物设计用于检测两种ZIKV标准菌株MR-766-NIID和PRVABC59。虽然RT-LAMP方法有效地检测了两种ZIKV菌株,但通过测量浊度检测所需的反应时间,可以观察到每种菌株的灵敏度明显不同。这可以用每个引物的序列来解释,它们被设计成在MR-766-NIID菌株的序列之前匹配。RT-LAMP扩增患者样本ZIKV序列与PRVABC59相似,说明病毒基因组序列变异与PRVABC59相似,而与MR-766-NIID不同。用RT-LAMP检测ZIKV已有报道,其中使用几个标准菌株作为模板[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba].我们的研究结果通过RT-LAMP检测了实验室标准菌株和临床菌株,支持了这些工作,并提示了在使用RT-LAMP和通用引物集检测ZIKV时考虑基因组序列变化的重要性。gydF4y2Ba
本研究开发的RT-LAMP方法在患者第一次就诊的尿液和血清中检测到ZIKV,但在第二次就诊的血清中未检测到ZIKV。这一发现表明,在第一次和第二次就诊之间,病毒RNA已从血清中消失,与患者症状的改善相一致。美国疾病控制及预防中心(CDC)至今建议采用RT-PCR检测发病后7天内的血清,以及出现症状后14天内收集的尿液[gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba].由于患者发病症状不明确,第二次就诊日可能晚于血清病毒rna检测期。除了血清外,RT-LAMP在每个时间点检查患者的尿液对于准确诊断寨卡病毒疾病可能是必要的。gydF4y2Ba
患者菌株检出下限为3 × 10gydF4y2Ba−1gydF4y2Bang RNA表达水平高于PR株(3 × 10gydF4y2Ba−2gydF4y2Bang),甚至PR和PATIENT菌株的靶序列也完全相同。这可能是因为样本中存在非目标rna;与病毒RNA相比,患者株样本可能含有大量来自患者细胞和尿液的RNA。此外,我们知道,当样品中含有非靶核苷酸时,偶尔会观察到低灵敏度的延迟LAMP反应。虽然我们根据纯化RNA的重量连续测试稀释样本,但使用指定的病毒副本或感染单位样本进行进一步评估将为诊断用途提供更充分的信息。gydF4y2Ba
RT-LAMP采用4 - 6个引物,针对一个基因的6 - 8个区域,具有高特异性。本研究中描述的RT-LAMP方法显示登革病毒2 (DENV-2)序列没有扩增(稿件正在准备中)。报道的黄病毒(包括DENV-1-4、西尼罗河病毒和黄热病病毒)的NS3序列表明,由于对DNA延伸至关重要的引物区域不匹配,它们的序列不太可能被RT-LAMP扩增。gydF4y2Ba4gydF4y2Ba].RT-LAMP方法在寨卡病毒流行区应用时,还需要进一步实验,以确认对该地区常见的其他黄病毒没有虚假扩增。gydF4y2Ba
结论gydF4y2Ba
本研究表明,RT-LAMP方法对ZIKV多株毒株检测具有较高的特异性和敏感性。使用精心选择的通用引物集实施RT-LAMP可能是诊断ZIKV感染患者的一种有前途的策略。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
支持本研究结论的数据集包含在文章中。gydF4y2Ba
参考文献gydF4y2Ba
Dick GW, Kitchen SF, Haddow AJ。寨卡病毒(I).分离和血清学特异性。《热带医学科学》1952;46:509-20。gydF4y2Ba
Kindhauser MK, Allen T, Frank V, Santhana RS, Dye C.寨卡病毒:蚊媒病毒的起源和传播。公牛世界卫生机构,2016;94:675-686C。gydF4y2Ba
世界卫生组织。情况报告:寨卡病毒、小头症、guillain-Barré综合征2016年11月3日。2016年的人。可以在:gydF4y2Bahttps://apps.who.int/iris/bitstream/handle/10665/250724/zikasitrep3Nov16-eng.pdf;jsessionid=0D6727AFA8947DC75EA024B60D430910?sequence=1gydF4y2Ba.gydF4y2Ba
Notomi T, Okayama H, Masubuchi H, Yonekawa T, Watanabe K, Amino N, Hase T. DNA环介导等温扩增。核酸研究,2000;28:E63。gydF4y2Ba
长胺K, Hase T, Notomi T.环介导等温扩增环引物加速反应。分子细胞探针,2002;16:23 3 - 9。gydF4y2Ba
Iwasaki M, Yonekawa T, Otsuka K, Suzuki W, Nagamine K, Hase T, Tatsumi K, Horigome T, Notomi T, Kanda H.全血单核苷酸多态性基因分型环介导等温扩增方法的验证。基因组通讯,2003;2:119-26。gydF4y2Ba
傅田,杨丽娟,杨晓明,杨晓明。甜瓜货架期SNP标记的研究进展。应用科学学报。2006;47:303-8。gydF4y2Ba
池田S, Takabe K, Inagaki M, Funakoshi N, Suzuki K.石蜡切片中基因点突变的原位环介导等温扩增。《病理学》,2007;57:594-9。gydF4y2Ba
青沼H,铃木M,石木H,佩雷拉N,尼尔森B,五十岚I,八木T, Kanuka H,福本sgydF4y2Ba疟原虫gydF4y2Ba使用环介导的等温扩增技术对携带疟原虫的蚊子进行检测。生物化学与生物物理学报,2008;gydF4y2Ba
Aonuma H, Yoshimura A, Perera N, Shinzawa N, Bando H, Oshiro S, Nelson B, fumoto S, Kanuka H.环介导等温扩增在蚊媒丝虫病检测中的应用:gydF4y2BaDirofilaria巨细胞gydF4y2Ba作为一个学习模型。寄生虫载体。2009;2:15。gydF4y2Ba
胡顺峰,李敏,钟丽丽,陆明生,刘志新,蒲建勇,温建军,黄霞。反转录环介导等温扩增快速检测和鉴别登革病毒血清型1-4的方法。BMC微生物学。2015;15:265。gydF4y2Ba
Parida MM, Santhosh SR, Dash PK, Tripathi NK, Lakshmi V, Mamidi N, Shrivastva A, Gupta N, Saxena P, Babu JP, Rao PV, Morita K.基孔肯雅病毒的逆转录环介导等温扩增快速实时检测中华微生物学杂志,2007;gydF4y2Ba
Perera N, Aonuma H, Yoshimura A, Teramoto T, Iseki H, Nelson B, Igarashi I, Yagi T, fumoto S, Kanuka H.利用逆转录环介导的等温扩增技术快速鉴定携带病毒的蚊子。中国病毒学杂志,2009;156:32-6。gydF4y2Ba
Lamb LE, Bartolone SN, Tree MO, Conway MJ, Rossignol J, Smith CP, Chancellor MB.反转录环介导的等温扩增技术快速检测尿液和感染蚊子中的寨卡病毒。科学代表2018;8:3803。gydF4y2Ba
Kurosaki Y, Martins DBG, Kimura M, Catena ADS, Borba MACSM, SDS M, Abe H, Yoshikawa R, de Lima Filho JL, Yasuda J.反转录环介导等温扩增快速分子诊断寨卡病毒感染的开发与评价。科学通报2017;7:13503。gydF4y2Ba
埃斯特雷拉PFN,门德斯GM,德奥利维拉KG, Bailão AM,苏亚雷斯CMA, Assunção NA,杜阿尔特GRM。RT-LAMP在血清样本中10分钟直接检测寨卡病毒。j .性研究。方法。2019;v271:113675。gydF4y2Ba
Silva SJRD, Paiva MHS, Guedes DRD, Krokovsky L, Melo FL, Silva MALD, Silva AD, Ayres CFJ, Pena LJ。反转录环介导等温扩增(RT-LAMP)在巴西蚊子样本中快速检测寨卡病毒的开发和验证。科学通报2019;v9:4494。gydF4y2Ba
Charel RN, Leparc-Goffart I, Pas S, de Lamballerie X, Koopmans M, Reusken C.关于寨卡病毒的知识状况,以作出适当的实验室反应。《公牛世界卫生器官》2016年。gydF4y2Bahttps://doi.org/10.2471/BLT.16.171207gydF4y2Ba.gydF4y2Ba
Grubaugh ND, Ladner JT, Kraemer MUG, Dudas G, Tan AL, Gangavarapu K,等。基因组流行病学揭示了寨卡病毒多次传入美国。大自然。2017;546:401-5。gydF4y2Ba
Metsky HC, Matranga CB, Wohl S, Schaffner SF, Freije CA, Winnicki SM,等。寨卡病毒在美洲的进化和传播。大自然。2017;546:411-5。gydF4y2Ba
Faria NR, Quick J, Claro IM, Thézé J, de Jesus JG, Giovanetti M,等。寨卡病毒在巴西和美洲的建立和秘密传播。大自然。2017;546:406-10。gydF4y2Ba
Lanciotti RS, Lambert AJ, Holodniy M, Saavedra S, Signor LC。2015年西半球寨卡病毒系统发育。新兴感染杂志2016;22:933 - 35。gydF4y2Ba
Yun SI, Song BH, Frank JC, Julander JG, Polejaeva IA, Davies CJ, White KL, Lee YM。三种历史上重要的、时空上不同的、遗传上不同的寨卡病毒株的完整基因组序列:MR-766、P6-740和PRVABC-59。基因组学通报。2016;4:e00800-16。gydF4y2Ba
Faye O, Faye O, Dupressoir A, Weidmann M, Ndiaye M, Alpha SA。一步RT-PCR检测寨卡病毒。临床病毒学杂志。2008;43:96-101。gydF4y2Ba
Lanciotti RS, Kosoy OL, Laven JJ, Velez JO, Lambert AJ, Johnson AJ,等。与一次流行病有关的寨卡病毒的遗传和血清学特性,密克罗尼西亚雅浦州,2007年。新兴感染杂志2008;14:1232-9。gydF4y2Ba
疾病控制和预防中心。备忘录:美国公共卫生实验室对寨卡病毒、基孔肯雅热病毒和登革热病毒进行修订诊断测试。CDC, 2016年2月7日发布。可以在:gydF4y2Bahttps://stacks.cdc.gov/view/cdc/38149gydF4y2Ba.gydF4y2Ba
尿液寨卡病毒检测临时指南-美国,2016年。MMWR Morb Mortal Wkly Rep 2016;65.doi:gydF4y2Bahttps://doi.org/10.15585/mmwr.mm6518e1gydF4y2Ba.gydF4y2Ba
确认gydF4y2Ba
感谢龚成博士(清华大学)提供C6/36细胞。我们也感谢Kanuka实验室的所有成员,特别是Tomomi Harada,对实验的支持。gydF4y2Ba
资金gydF4y2Ba
这项研究得到了日本医学研究与开发机构、AMED (JP17jm0510002h0003) (HK)和Ohyama健康基金会(HA)的“应对非洲国家被热带病挑战国际合作研究计划”的支持。资助机构在研究的设计和实施中没有任何作用;数据的收集、管理、分析和解释;以及手稿的准备、审查或批准。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
医管局与香港大学共同构思这项研究,并撰写手稿。HA进行了实验并分析了数据。制备培养细胞、标准株病毒和病毒RNA。TH和SH检查了患者并采集了血液和尿液。ST和MS制备培养的病毒。所有作者都同意了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
本研究得到了济庆大学医学院伦理委员会的批准(许可号28-023[8266])。在患者书面知情同意的情况下采集血液和尿液进行诊断和分析。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
青沼,H.,饭冢-盐田,I.,星娜,T.。gydF4y2Baet al。gydF4y2Ba反转录环介导的等温扩增技术检测和鉴别多株寨卡病毒。gydF4y2BaTrop Med HealthgydF4y2Ba48gydF4y2Ba, 87(2020)。https://doi.org/10.1186/s41182-020-00274-zgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s41182-020-00274-zgydF4y2Ba
关键字gydF4y2Ba
- 兹卡热gydF4y2Ba
- Zika病毒gydF4y2Ba
- 核糖核酸gydF4y2Ba
- 环介导等温扩增gydF4y2Ba
- 病人gydF4y2Ba