摘要
背景
疾病复发是胰腺导管腺癌(PDAC)切除术后死亡的主要原因。在20-30%的切除患者中,出现孤立的局部PDAC复发。回顾性研究表明,立体定向体放射治疗(SBRT)可能会改善这些患者的局部控制,对生存和生活质量都有潜在的有益影响。“使用立体定向体辐射治疗孤立性局部胰腺癌复发的额外治疗的全国随机对照试验”(ARCADE)将调查在孤立性局部PDAC复发患者中,与单独的标准护理相比,SBRT在生存和生活质量结果方面的价值。
方法
ARCADE试验嵌套在一个前瞻性队列中(荷兰胰腺癌项目;PACAP)根据“队列内试验”设计。所有初次切除术后出现孤立性局部PDAC复发的PACAP参与者,均知情同意在未来的研究中进行随机化。患者将在标准治疗或单独标准治疗的基础上随机接受局部治疗(8 Gy SBRT的5个组分)。总共包括174名患者。主要研究终点是复发后的生存期。最重要的次要终点是生活质量。
讨论
据推测,与单独的护理标准相比,额外的SBRT可以改善PDAC切除术后孤立性局部复发患者的生存和生活质量。
试验注册
ClinicalTrials.gov登记NCT04881487.2021年5月11日注册。
政务信息
注:本协议中花括号内的数字为SPIRIT检查项编号。项目的顺序已被修改,以对相似的项目进行分组(请参阅http://www.equator-network.org/reporting-guidelines/spirit-2013-statement-defining-standard-protocol-items-for-clinical-trials/).
| 标题{1} | 立体定向体放射治疗(ARCADE)治疗孤立性局部胰腺癌复发的全国随机对照试验 |
| 试用注册{2a和2b}。 | Clinicaltrials.gov注册,NCT04881487。注册于2021年5月11日,https://www.clinicaltrials.gov/ct2/show/NCT04881487. |
| 协议版本为{3} | 2.0版,2021年2月4日。 |
| 资金{4} | 荷兰癌症协会(KWF;批准号12568)。 |
| 作者详情{5a} | 1荷兰乌得勒支地区学术癌症中心外科。 2荷兰Nieuwegein。 3.荷兰乌得勒支地区学术癌症中心放射肿瘤科。 4荷兰乌得勒支乌得勒支大学医学中心成像和肿瘤科。 5荷兰阿姆斯特丹大学阿姆斯特丹大学医学中心外科。 6阿姆斯特丹癌症中心,阿姆斯特丹,荷兰。 7阿姆斯特丹大学医学中心放射肿瘤科,位于荷兰阿姆斯特丹自由大学。 8荷兰乌得勒支乌得勒支地区学术癌症中心肿瘤内科。 9荷兰鹿特丹伊拉斯谟斯医学中心外科。 10乌得勒支,荷兰。 11荷兰奈梅亨内梅亨大学医学中心放射肿瘤科。 12阿姆斯特丹大学医学中心肿瘤内科,位于荷兰阿姆斯特丹大学。 13荷兰鹿特丹伊拉斯谟医学中心放射肿瘤科。 14荷兰阿姆斯特丹大学阿姆斯特丹大学医学中心放射肿瘤科。 |
| 试验发起人的姓名和联系信息 | 乌得勒支大学医学中心 Heidelberglaan 100 邮政信箱85500 3584 CX乌得勒支,荷兰 |
| 赞助商的作用{5c} | 主办单位负责试验设置、试验协调、数据收集和分析,并提交最终稿件发表。 |
简介
背景和理论基础
背景
胰腺导管腺癌(PDAC)目前是男性和女性癌症相关死亡的第四大原因[1,2,3.].对于局部可切除疾病的患者,手术联合(新)辅助治疗提供了长期生存的最佳机会[4,5,6].然而,即使在切除后,几乎所有患者都会出现局部和/或远处疾病复发,大多数在前2年内[6,7,8,9,10].因此,PDAC在术后5年生存率仅为12-17% [11,12,13,14].
无远处转移证据的局部复发(也称为孤立性局部复发)发生在所有PDAC复发患者的20-30% [15,16,17,18,19,20.].这些患者的预后略好,中位复发时间为9个月,而远处转移患者为7个月。此外,复发后的中位生存期较好,分别为9个月和6个月[4,10,21].
目前,大多数PDAC复发且性能状态良好的患者采用姑息性化疗治疗,因为生存主要取决于全身疾病控制[22].然而,孤立的局部PDAC复发往往与局部破坏性肿瘤生长的相当高的发病率相关,包括疼痛、胃肠道或胆道梗阻、营养不良和门脉高压,导致生活质量显著降低[23].因此,局部治疗可能对改善局部疾病控制有额外价值,这可以积极改善这些患者的生活质量[21,24,25,26,27,28,29,30.].此外,先前的研究表明,额外的局部治疗有利于生存[22].
放射治疗是一种广泛接受的治疗各种类型癌症的治疗方式,是一种微创治疗选择,毒性相对较轻[31,32].然而,PDAC患者放射治疗的主要困难在于胰腺被耐受辐射剂量有限的器官紧紧包围,如十二指肠、小肠和胃[33].此外,由于呼吸和肠道充盈,上腹部结构的日复一日的位置变化和运动增加了所需的边缘,因此增加了限制剂量的必要性[34].这些因素阻碍胰腺和胰周区域肿瘤的高剂量照射[35].然而,建议需要高剂量照射才能局部控制PDAC复发[36,37].
近年来,引入了新的放射治疗技术,如图像引导立体定向体放射治疗(SBRT),允许向胰腺肿瘤提供高剂量照射,同时限制正常邻近器官和组织的暴露[38,39,40,41,42].SBRT是一种外部束放射治疗方法,在在线CT或MR成像的指导下,以有限数量的分数精确地向目标提供高照射剂量。它通过实时跟踪(跟踪)或仅当肿瘤在正确的位置(门控)时才开启光束来补偿目标的运动和位置变化。研究表明,SBRT可以安全地对胰腺病变进行剂量递增的放射治疗。在荷兰,拥有MR-linac的乌得勒支大学医学中心(UMC)、拥有MRIdian的阿姆斯特丹大学医学中心和拥有射波刀的伊拉斯谟医学中心(MC)都在向胰腺区域输送SBRT方面拥有丰富的经验[43,44,45].回顾性单中心研究的早期结果表明改善无进展生存期,这可能转化为更长的总生存期[37,42,46].此外,孤立的局部PDAC复发患者在SBRT后的中位生存期可达16个月[22,47,48].此外,SBRT改善了PDAC患者的局部控制和与局部进展相关的症状缓解[47,49,50].在接受SBRT治疗的局部PDAC复发患者中,与治疗相关的毒性相对较轻,10%经历了3级或更高的胃肠道毒性[47].然而,除了护理标准外,还需要前瞻性研究来证实SBRT在孤立性局部PDAC复发患者中的价值。
基本原理
ARCADE试验旨在研究与单独标准治疗相比,使用SBRT进行额外的局部治疗是否能改善孤立性局部复发性PDAC患者的生存和生活质量。
目标{7}
ARCADE试验的假设是,局部SBRT除护理标准外,可改善胰腺癌局部复发患者的局部控制、生存和生活质量,并具有可接受的毒性。本研究的主要目的是提高这些患者复发后的生存率。
本研究的次要目标是:
评估SBRT对生活质量的影响
评估SBRT对总生存期的影响
评估SBRT对无病生存的影响
评估SBRT对局部无进展期的影响
评估SBRT对远端无转移间期的影响
通过计算机断层扫描(CT)成像评估治疗效果
评价SBRT的急性和晚期毒性
评估患者对SBRT的接受程度
试设计{8}
ARCADE试验是一项全国性的多中心试验,纳入了大型全国性前瞻性队列(荷兰胰腺癌项目;PACAP)。PACAP是遵循“队列内试验”(TwiCs)设计的试验设施[51,52].通过这种设计,“招募了一个大型的观察性队列患者,并将其用作多个试验设施,并应用‘以患者为中心’的信息和同意”[53,54].
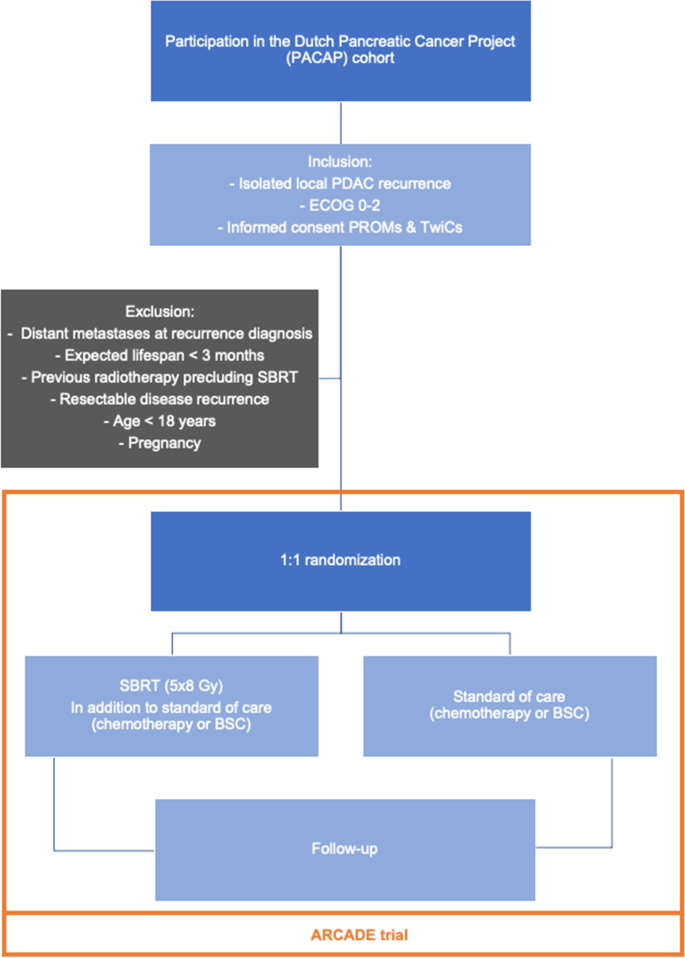
当地调查员或授权代表将检查患者是否符合所有纳入标准(不符合任何排除标准)。符合参与条件并广泛知情同意参与PACAP队列、生活质量问卷和未来随机分组的患者将形成一个子队列。从这个子队列中,患者被集成在Castor电子数据采集(EDC)系统中的计算机生成的随机化模块以1:1的比例随机化为干预组或对照组。随机选择进行干预的患者由来自三个参与辐射中心之一的放射肿瘤学家咨询,他们将为他们提供有关干预的信息。之后,患者决定是否接受干预,如果他们决定这样做,则获得额外的书面知情同意(分阶段知情同意)[55].分配到控制组的患者不被告知并接受标准治疗,他们的结果将在PACAP的背景下收集,将被相对使用。为了说明,ARCADE试验的纳入和随机化过程如图所示。1.
方法:参与者、干预措施和结果
学习设置{9}
所有参与PACAP队列并知情同意接受生活质量问卷调查并根据TwiCs设计随机分组的孤立性局部PDAC复发患者均有资格纳入ARCADE试验。
资格标准{10}
符合以下所有标准的患者有资格进行随机分组:
- (1)
经书面知情同意参与PACAP队列的生活质量问卷调查(患者报告的结果测量;prom)和未来随机化的广泛同意(TwiCs)
- (2)
经组织学证实,初次切除术后局部复发。局部淋巴结转移也被认为是局部复发。如果组织学无法确认(因为第一次尝试失败或技术上不可能),可以在多学科会议上就存在孤立的局部复发达成共识(例如,基于影像学、升高的癌症抗原19-9 (CA 19-9)和临床情况)。
- (3)
东部肿瘤合作组(ECOG)绩效评分0-2分
排除标准如下:
- (1)
复发诊断为远处转移。区域淋巴结不被认为是远处转移。
- (2)
预期寿命< 3个月
- (3)
既往放疗排除SBRT
- (4)
专家小组认为,高选择性病例符合再次切除而不进行诱导治疗的条件
- (5)
年龄< 18岁
- (6)
怀孕
谁会接受知情同意?{26}
根据TwiCs设计,只有随机进入干预组的患者才会由三个参与辐射中心之一的放射肿瘤学家接触,以获得额外的知情同意。
关于收集和使用参与者数据和生物标本的额外同意条款
参与ARCADE试验的参与者已知情同意以PACAP的标准方式收集他们的数据。根据TwiCs设计,只有随机进入干预组的患者被要求提供参与ARCADE试验的知情同意。本试验不涉及生物标本的收集。
干预措施
选择比较国的解释
所有患者(两个研究组)将接受标准治疗。在大多数情况下,这包括标准化疗,包括12个周期的(改良的)亚叶酸钙、5-氟尿嘧啶(5-FU)、伊立替康和奥沙利铂联合治疗(FOLFIRINOX),包括5-FU 400 mg/m的大剂量2第1天继续输注2400mg /m2在46小时内;奥沙利铂85 mg/m2第一天;伊立替康180 mg/m2第1天加亚叶酸400 mg/m2第1天,或6个周期的吉西他滨(1000mg /m2)和nab -紫杉醇(125 mg/m2)在4周周期的第1、8和15天。如果患者出于选择或身体状况受损而不接受化疗,则患者将接受最佳支持护理(BSC)。
干预描述{11a}
干预组的患者将在图像引导下接受额外的SBRT治疗,该方案为8格雷(Gy)的5分,规定为规划目标容量的95%。肿瘤总体积为CT或MRI所定义的局部复发性PDAC。SBRT在三个参与中心之一进行。在UMC乌得勒支和阿姆斯特丹UMC,采用MR指导应用SBRT。在Erasmus MC中,使用ct引导成像,因此在肿瘤内或附近放置三个不透光标记物(基准)[55].在一个参与中心进行治疗,每周进行2或3次,总治疗时间最长为21天。治疗准备和交付程序将根据治疗中心的协议确定。然而,所有机构对所有危险器官的辐照剂量限制是相同的。
并发处理
随机接受SBRT的患者除了接受标准治疗(主要包括全身化疗)外,还可以接受干预。应用这两种处理方法没有预设的顺序。但是,它们不能同时被接收。在诊断出孤立性局部复发后,应尽早给予SBRT。因此,如果已经开始全身化疗,SBRT可以在两个周期的全身治疗之间进行。
停止或修改已分配干预措施的标准{11b}
如果患者愿意,他们可以在任何时间以任何理由离开研究,而不承担任何后果。指导委员会可能出于以下一种或多种原因让患者退出研究:(1)不正确的随机分组,即没有正确遵循合格标准;(2)继续参与可能对患者有害;(3)研究提前终止。个别患者在停药后不会被另一名患者替代,但他们将由一名医生进行随访,直到死亡。
提高干预依从性的策略{11c}
为了提高对干预方案的依从性,患者可以自由选择他们希望在三个参与的放射治疗中心中的哪一个进行干预。在接受SBRT治疗并预约随访后,患者可返回转诊医院接受进一步治疗和/或随访。
试验期间允许或禁止的相关伴随护理
其他实验性治疗仅在患者放疗干预期间禁止。
审判后护理的规定{30}
参与者将继续参与ARCADE试验最多18个月或直到患者退出。在参加ARCADE试验后,参与者将被转介给他们的治疗肿瘤医生或全科医生。
结果{12}
主要研究终点是有意治疗复发后的生存期,定义为复发诊断日期至任何原因死亡日期或最后一次随访日期之间的时间。疾病复发的组织学证据日期将被用作复发诊断的日期。如果无法获得组织学证据,则将使用诊断孤立性局部复发的多学科会议的日期。
次要终点为:
患者报告的生活质量,作为荷兰胰腺癌小组(DPCG)当前PACAP的一部分,通过评估PROMs来标准衡量[51].
根据实体肿瘤疗效评价标准v1.1 (RECIST),通过CT成像评估治疗疗效[56].
急性和晚期毒性,在定期随访期间使用不良事件通用术语标准(CTCAE 5.0版)评估[57].在干预组,急性毒性将由治疗放射肿瘤学家监测。急性毒性将定义为SBRT治疗结束后90天内的毒性,并将在第1、3、6和12周进行评估。晚期毒性定义为SBRT 90天后发生>毒性。
总生存期,定义为从初次切除日期到任何原因死亡日期之间的间隔。
无进展间隔期,定义为疾病复发日期与局部和/或远处疾病发生进展日期之间的间隔。
局部无进展间隔期,定义为疾病复发日期与局部疾病发生进展日期之间的间隔。
远处无转移间隔期,定义为疾病复发日期与疾病发生远处进展日期之间的间隔期。
评估患者对SBRT的接受程度
参与者时间线{13}
表格1显示参与者时间轴。
样本容量{14}
孤立性局部PDAC复发患者的中位生存期为复发后9个月;加用SBRT治疗的患者的合并中位生存期为16个月[10,19,22,47,48,58,59].
由于我们预计80%的患者接受干预组提供的实验性干预,因此需要考虑20%的估计拒绝率。这将干预组所有患者的总生存率稀释为14.6个月(80% × 16个月+ 20% × 9个月)。干预组和对照组的临床相关生存期差异分别为14.6个月和9个月,对应的生存相对危险度(RH)为1.62,用于计算研究的样本量。
为了检测干预组患者的总生存率较对照组提高62%(生存RH为1.62),统计幂为80%,双侧显著性水平为0.05,需要样本量为174例。这一计算基于指数模型的假设,对照组的中位总生存期为9个月,随访时间为18个月,审查率为1%,基线事件率为7.7%。据此计算,我们计划共纳入174例患者:对照组87例,干预组87例[60].
招聘{15}
DPCG内的全国合作将提高患者登记率。在荷兰,孤立性PDAC复发患者的治疗在DPCG附属中心进行。我们的目标是将所有15个dpcg附属中心纳入本研究。
2019年,荷兰有360例患者接受了PDAC宏观根治性(R0-R1)切除术。荷兰的所有胰腺切除术都在DPCG附属中心进行。早期研究显示21%的患者出现局部复发[61].然而,先前进行了试验特异性标准化监测策略的试验表明,通过标准化监测,26%的患者可以发现孤立的局部复发(表2)2).由于雷达- panc试验将在荷兰境内同时进行,该试验旨在提高3个月的标准化监测与成像和肿瘤标志物检测的附加价值(NCT04875325),预计约25%的患者会出现孤立性局部复发(n= 90)。根据目前的成功注册进度,我们预计90% (n= 81)的所有患者将在PACAP队列中每年进行注册,并且83% (n= 67)的患者将根据当前PACAP的参与率,为TwiCs设计提供知情同意。其中50%的病人(n= 33)将被随机分配到试验的干预组。纳入174例患者(每组87例)所需的预期时间为4.5年,其中包括在所有DPCG中心启动试验的1.5年启动期。此外,在试验的启动阶段,由于RADAR-PANC试验启动的标准化随访方案尚未在所有中心推广,孤立的局部复发率将较低。最终分析将在最后一位患者入组18个月后进行。
干预措施的分配:分配
序列生成{16a}
参与者由计算机生成的程序按照2-4-6块随机分组随机分配。随机分组将根据研究所和监测策略进行分层。根据目前的临床实践,这可以是症状性的,也可以是标准化的,例如,当患者参加RADAR-PANC试验时(TwiCs研究了使用成像和血清肿瘤标志物检测的标准化监测策略对PDAC切除术患者的生存和生活质量的影响;NCT04875325)。
隐藏机制{16b}
根据TwiCs设计,只有随机参与干预的参与者才会被告知他们的随机化。在随机分组后,放射肿瘤学家将直接联系这些患者,告知他们已被随机分组进行干预。随机纳入对照组的患者将不被告知。因此,没有必要隐瞒参与者的分配情况。
实现c {16}
一旦参与者满足所有纳入标准,他们就会被随机分配。中央研究协调员执行随机化并分配参与者进行干预。将解释SBRT的利与弊,并询问额外的知情同意。未给予SBRT知情同意的患者将根据干预组(ITT)进行跟踪和分析。当参与者被随机分配到干预组时,将通知来自三个放射中心之一的放射肿瘤学家(基于患者的偏好)。放射肿瘤学家将联系患者安排预约,告知他们有关干预的情况。
干预的分配:盲法
谁将被蒙蔽双眼
盲法不适用于根据twic设计设计的研究。然而,由于设计的固有性,随机分配到对照组的参与者不会得到明确的通知。
如有需要,可进行开盲操作。
不适用,因为将不进行致盲。
数据收集和管理
评估和收集成果的计划
所有试验参与者的基线特征被标准收集,作为DPCG的PACAP队列的一部分。此外,prom还在标准时间点对所有PACAP参与者的生活质量进行评估。额外的数据是从患者的电子档案中收集的。参与中心的当地临床医生负责数据收集。然而,他们可以将这一责任转移给研究团队。研究小组将指定合适的人员进行数据收集。
计划促进参与者保留和完成随访{18b}
治疗放射肿瘤学家将根据协议安排随访预约,使参与者随机进行试验干预并完成随访。此外,中心研究协调员将在随访期间密切跟踪所有试验参与者。
数据管理{19}.
数据管理将按照UMC乌得勒支数据管理政策进行,并按照预定义的数据管理计划进行。数据将使用Castor EDC中预定义的电子病例报告表格收集,仅包含编码数据。
保密{27}
个人数据的处理将遵守欧洲议会和理事会2016年4月27日关于保护自然人处理个人数据和此类数据自由流动的条例(EU) 2016/679(一般数据保护条例)。将使用主题识别码列表将数据链接到主题。这些代码不会基于患者姓名首字母和出生日期。当地调查员会保护密码的钥匙。
本试验/未来使用{33}的生物样本收集、实验室评估和存储计划用于遗传或分子分析
如上文26b所述,不会收集生物标本。
统计方法
主要和次要结果的统计方法{20a}
基线数据将分析和报告使用标准的描述性统计。通过比较干预组和对照组的基线数据来评估随机化成功。分析将根据意向治疗原则进行。主要终点是复发后生存期,定义为复发诊断日期到任何原因死亡或最后一次随访日期之间的时间。复发后的生存期,以及次要终点总生存期、无进展间期、局部无进展间期和远处无转移间期,将以95%置信区间(CI)的中位数报告,并使用Kaplan-Meier生存曲线方法计算。对数秩检验用于组间比较。此外,将对复发后的生存期进行敏感性分析,将其定义为随机化日期至任何原因死亡日期或最后一次随访之间的时间。将进行单因素cox-proportion危险分析,以确定SBRT对复发后生存的粗略影响。将进行多变量分析以确定调整后的效应估计。调整后的分析将对几个基线混杂因素进行校正,如年龄、性别、术前CA 19-9水平、肿瘤大小、阳性淋巴结数量、肿瘤分化、切缘状态、辅助化疗和疾病复发治疗。 Results will be presented as HRs with corresponding 95% CIs. A two-tailed probability value (P-value) < 0.05为有统计学意义。治疗反应,急性和晚期毒性,以及不合格或排除的原因将使用描述性统计报告。卡方检验或费雪精确检验用于适当地比较分类变量。参数连续变量以标准差(SD)表示,并使用Student 's进行比较t测试。非参数连续变量呈现为中位数与四分位范围(IQR)和比较使用曼-惠特尼U测试。还将采用混合模型评估急性和晚期毒性,以考虑人体内和跨人的变异性,并考虑重复的毒性测量。基线生活质量将与随访期间的所有其他时间点进行比较。量表宽度改变10%将被认为是临床相关的生活质量改变[62].数据将分为稳定、恶化(生活质量下降≥10%)或改善(生活质量提高≥10%)。这些时间点将使用卡方检验进行比较P-value≤0.05。在使用混合模型方法进行重复测量分析的随访期间,我们还将评估生活质量的模式作为持续的结果。
统计分析将使用最新版本的R Studio。
中期分析{21b}
纳入所需患者人数的50%(87例),其中随机分组进行干预的患者已接受SBRT,进行中期疗效分析。研究结果将与医学研究伦理委员会(MREC)共享,后者可以决定是否提前结束研究。停用指南是干预组的主要终点(复发后生存率)比对照组增加两倍,或干预拒绝率超过20%。一个P-value < 0.01被认为有统计学意义。
附加分析的方法(例如,亚组分析)
当以下亚组中有足够数量的患者时,将比较接受SBRT +化疗、单独SBRT、单独化疗和单独BSC的患者,并评估这些特定亚组中对生存结局和生活质量的影响。假设最小相关效应量为0.50,统计功率为80%,双侧显著性水平为0.05,一个亚组至少应包含33例患者来检测效应量。
处理协议不遵守的分析方法和处理缺失数据的统计方法{20c}
由于一些患者在随机化后会拒绝干预(根据TwiCs设计),因此在计算样本量时考虑了拒绝率。分析将根据意向治疗原则进行,这意味着被随机分配到干预组但否认干预的参与者将被分析,就像他们确实接受了干预一样。缺失的基线数据将使用多种估算技术进行估算。将进行完整的案例分析和多次归因后的分析,以检查不一致。
允许访问完整协议、参与者级数据和统计代码的计划
研究方案、衍生数据和统计分析代码将根据要求提供。
监督和监测
协调中心和试验指导委员会的组成
在协调中心,一名哲学博士(博士)学生负责日常试验的运行,由两名主要研究员和一名博士后研究员监督。至少每周评估一次审判进度,在这周可以咨询监督员进行进一步审议。此外,(潜在的)试验参与者在每周的多学科小组会议上被确定和讨论。
在所有三个参与的放射中心,当地的主要研究人员(放射肿瘤学家)负责现场后勤工作。审判指导委员会由规划和规划小组成员组成,他们可以在四次年度会议期间轻松了解有关审判进展的最新情况,但也可以应要求进一步了解最新情况。试验团队的数据管理由协调部门的数据管理人员提供支持。
数据监测委员会的组成、作用和报告结构
这项研究的质量由Julius Clinical监督,这是一个独立的科学合同研究组织,它将控制试验对象的安全。指定的监督员将检查纳入率和退出率、研究文件和知情同意书的完整性、严重不良事件(SAE)程序的信息、纳入和排除标准、研究程序以及人员认证和培训。开始前将安排启动访问,包括在每个参与中心。在前五次纳入后,将安排后续监测访问,因此每个中心每年至少两次(取决于患者登记情况)。最后,将在每个参与中心安排一次收尾访问。
不良事件报告和危害{22}
受试者自发报告或现场调查员或其工作人员观察到的所有3级或更高级别(S) ae(预期或意外)将在SBRT后3个月内记录在电子病例报告表格的相应部分。SAE将由当地首席研究员或其工作人员在知悉SAE后24小时内以加密形式通过SAE表格向UMC乌得勒支首席研究员报告。然后发起人将通过web门户报告saeToetsingOnline向批准议定书的经认可的MREC提交,在首次获悉导致死亡或危及生命的紧急事故后7天内,最多8天内完成初步报告。所有其他SAE将在发起人首次了解SAE后最多15天内报告。在治疗后的前3个月,直到研究结束,仅记录治疗诱导的3级或更高级别(S) ae。首席研究员或授权代表将决定(S)AE是否与SBRT有关。由于PDAC患者预后很差,我们预计在2年的研究期内,许多患者会出现后续放疗无关的sae。这些sae将被记录,尽管没有报告。
审核试运行的频率和计划{23}
在研究期间的任何给定时间点,都可以选择该试验进行审核。没有预先确定的审计和检查时间表。
与相关方(如试验参与者、伦理委员会)沟通重要议定书修正案的计划{25}
在试验过程中,申办人可能需要对方案或其他试验文件进行更改,这些更改需要由主管部门和MREC提供新的有利意见。如有必要,试验参与者将被告知这些修改,并可能获得更新的知情同意。所有修改都将通知参与试验的中心。
传播计划{31a}
试验结果将通过在同行评议的期刊上发表和在国家和国际科学会议上发言的方式完全公开。积极和消极的结果都将被公开。
讨论
ARCADE试验调查了在荷兰PDAC切除术后局部复发的患者中,与单独的标准护理相比,SBRT在标准护理的基础上是否能提高复发后的生存率和生活质量。
在研究的设计过程中,有几个讨论点。首先,关于随机化的准确时间一直存在一些争论。荷兰所有局部孤立复发的患者将接受化疗作为复发治疗。最初的想法是,孤立的局部复发患者首先必须接受几个疗程的系统化疗。在这些疗程结束后,将对肿瘤进行评估,如果肿瘤稳定且没有发生远处转移,则对患者进行随机分组。然而,这带来了一种风险,即最初符合SBRT条件的患者将在化疗期间发生远处转移,因此不能再接受SBRT进行孤立的局部复发。此外,一些患者不愿意或不能接受化疗,而他们确实希望接受放射治疗以控制局部肿瘤。因此,无论是否需要系统化疗或平衡sc,被随机分配到干预组的患者将在标准护理的基础上接受SBRT。在随机化的基础上,可以预期两组患者接受或不接受化疗的比例是相同的。
最后,我们交换了关于TwiCs设计的想法。在传统的随机对照试验中,患者希望避免被随机纳入对照组的可能性,因此放弃参与。更重要的是,如果他们决定参与,他们可能会在随机选择对照组时感到失望,导致他们退出或交叉到干预组。然而,在TwiCs设计的情况下,随机分配到对照组的患者不会被明确通知,这限制了选择和交叉偏倚,并防止了随机分配到对照组的患者的潜在痛苦。此外,它还能有效利用通过队列定期收集的现有数据。因此,新的干预措施可以更快地提供给符合条件的患者[54].由于患者可以从现有队列中识别,因此患者招募更有效。最后,测量患者对干预的接受程度。事实上,被随机分配到对照组的参与者没有被明确告知他们参与了特定的试验,这引起了医生的一些担忧。然而,最近的一项研究表明,患者本身并没有遇到这种问题[63].
试验状态
协议2.0版,2021年2月4日。第一名参与者于2021年7月5日随机进行。预计招募工作将于2025年底完成(临床试验的积极招募状态见NCT04881487在clinicaltrials.gov上)。
数据和资料的可获得性{29}
研究方案、衍生数据和统计分析代码将根据要求提供。
缩写
- 研究者用:
-
5 -氟尿嘧啶
- (S) AE (S):
-
(严重)不良事件
- 二元同步通信:
-
最佳支持性护理
- CA胜负:
-
癌症抗原19-9
- 置信区间:
-
置信区间
- CT:
-
计算机断层扫描
- CTCAE:
-
不良事件的通用术语标准
- DPCG:
-
荷兰胰腺癌研究小组
- ECOG:
-
东方肿瘤合作集团
- EDC:
-
电子数据采集
- EPI:
-
外分泌胰腺功能不全
- FOLFIRINOX:
-
联合化疗包括亚叶酸钙、5-氟尿嘧啶、伊立替康和奥沙利铂
- 孔侑:
-
灰色的;每千克物质吸收一焦耳的辐射能
- 有:
-
医院焦虑抑郁量表
- HRQL:
-
与健康有关的生活质量
- 差:
-
四分位范围
- 主持人:
-
医疗中心
- MREC:
-
医学研究伦理委员会
- (我)先生:
-
磁共振(成像)
- PACAP:
-
荷兰胰腺癌项目
- PDAC:
-
胰导管腺癌
- 博士:
-
哲学博士
- 舞会:
-
患者报告的结果测量
- P价值:
-
概率值
- RECIST:
-
实体瘤疗效评价标准
- RH:
-
相对风险
- SBRT:
-
立体定向身体放射疗法
- SD:
-
标准偏差
- TwiCs:
-
队列内的试验
- 联华电子:
-
大学医疗中心
- woc:
-
应对量表的方法
- 黄蜂:
-
癌症进展担忧量表
参考文献
罗拉P, Sunkara T, Gaduputi V.胰腺癌流行病学:全球趋势,病因和危险因素。World J Oncol, 2019。https://doi.org/10.14740/wjon1166.
Ferlay J, Colombet M, Soerjomataram I, Dyba T, Randi G, Bettio M,等。欧洲癌症发病率和死亡率模式:2018年对40个国家和25种主要癌症的估计。EJC。2018.https://doi.org/10.1016/j.ejca.2018.07.005.
Siegel RL, Miller KD, Jemal A.癌症统计,2020。CA癌症J临床,2020。https://doi.org/10.3322/caac.21590.
张志强,张志强,张志强,等。胰腺癌切除术后放化疗与化疗的随机试验。英语医学。2004。https://doi.org/10.1056/NEJMoa03229.
Oettle H, Neuhaus P, Hochhaus A, Hartmann JT, Gellert K, Ridwelski K,等。吉西他滨辅助化疗与切除术胰腺癌患者的长期预后:CONKO-001随机试验《美国医学协会杂志》上。2013.https://doi.org/10.1001/jama.2013.279201.
张志强,张志强,张志强,等。FOLFIRINOX或吉西他滨作为胰腺癌的辅助治疗。英语医学。2018。https://doi.org/10.1056/NEJMoa1809775.
柴田K,松本T,矢田K,佐佐木A, Ohta M,北野S.胰腺导管癌切除术后复发的预测因素。胰腺》2005。https://doi.org/10.1097/01.mpa.0000166998.04266.88.
Suenaga M,藤井T,神田M, Takami H,奥村N,猪川Y,等。胰腺癌首次复发病灶的模式:肝脏复发与不良预后和门静脉侵犯有关。杂志。2014;61(134):1756 - 61。
Parikh AA, Maiga A, Bentrem D, Squires MH, Kooby DA, Maithel SK,等。胰腺癌辅助治疗:是否影响复发模式?J Am Coll外科,2016。https://doi.org/10.1016/j.jamcollsurg.2015.12.031.
Groot VP, Rezaee N, Wu W, Cameron JL, Fishman EK, Hruban RH,等。胰管腺癌切除术后复发的模式、时间和预测因素。安,2018年。https://doi.org/10.1097/SLA.0000000000002234.
费龙,刘志强,李志强,方勇,等。胰腺腺癌:实际5年存活者。中华胃肠外科杂志,2008。https://doi.org/10.1007/s11605-007-0384-8.
张志刚,张志刚,张志刚,等。胰导管腺癌:长期生存不等于治愈。手术。2012。https://doi.org/10.1016/j.surg.2012.05.020.
Katz MH, Wang H H, Fleming JB, Sun CC, Hwang RF, Wolff RA,等。胰腺癌切除术多学科治疗后的长期生存。Ann Surg Oncol, 2009。https://doi.org/10.1245/s10434-008-0295-2.
He J, Ahuja N, Makary MA, Cameron JL, Eckhauser FE, Choti MA,等。2564例壶腹周围腺癌在单一机构切除:近30年的趋势。HPB。2014.https://doi.org/10.1111/hpb.12078.
Regine WF, Winter KA, Abrams RA, Safran H, Hoffman JP, Konski A,等。胰腺腺癌切除术后基于氟尿嘧啶的放化疗前后氟尿嘧啶vs吉西他滨化疗:一项随机对照试验《美国医学协会杂志》上。2008.https://doi.org/10.1001/jama.299.9.1019.
上野H, Kosuge T,松山Y,山本J,中尾A,江川S,等。一项随机III期试验比较吉西他滨与单纯手术治疗胰腺癌切除术患者:日本胰腺癌辅助治疗研究组癌症杂志,2009。https://doi.org/10.1038/sj.bjc.6605256.
Van Laethem JL, Hammel P, Mornex F, Azria D, Van Tienhoven G, Vergauwe P,等。胰腺癌治愈性切除术后单独辅助吉西他滨与基于吉西他滨的放化疗:一项随机的EORTC-40013-22012/FFCD-9203/GERCOR II期研究中华临床肿瘤学杂志,2010。https://doi.org/10.1200/JCO.2010.30.3446.
上坂K, Boku N, fuutomi A,冈村Y, Konishi M,松本I,等。S-1与吉西他滨对切除胰腺癌的辅助化疗:一项3期、开放标签、随机、非劣效性试验(JASPAC 01)柳叶刀》2016。https://doi.org/10.1016/s0140 - 6736 (16) 30583 - 9.
张艳,Frampton AE, Kyriakides C, Bong JJ, Habib N, Ahmad R,等。胰腺导管腺癌切除术后局部复发:预测因素和辅助放化疗的意义。《中华癌症杂志》2012。https://doi.org/10.1007/s00432-012-1165-7.
胰腺导管腺癌切除术后复发的Sperti C, Pasquali C, Piccoli A。世界外科杂志,1997。https://doi.org/10.1007/s002689900215.
史文凯,王志强,王志强,等。辅助放化疗或观察后胰腺癌和壶腹周围癌的长期生存和转移模式:EORTC试验40891的长期结果安外科2007年。https://doi.org/10.1097/SLA.0b013e318156eef3.
Groot VP, van Santvoort HC, Rombouts SJ, Hagendoorn J, Borel Rinkes IH, van Vulpen M,等。胰腺癌术后孤立性局部复发治疗的系统综述再切除、放化疗和SBRT。HPB。2017.https://doi.org/10.1016/j.hpb.2016.11.001.
Willett CG, Czito BG, Bendell JC, Ryan DP。局部晚期胰腺癌。中华临床肿瘤学杂志,2005。https://doi.org/10.1200/JCO.2005.23.911.
小川K,涉谷H,内田N,大西H,大野Y,妙真M,等。胰腺癌术后外束放射治疗:化疗对局部控制和生存的影响。中国癌症杂志,2010;30(7):2959-67。
Cupp JS, Koong AC, Fisher GA, Norton JA, Goodman KA。射波刀立体定向体放射治疗腹部恶性肿瘤后的组织效应。Clin Oncol (R Coll Radiol)。2008.https://doi.org/10.1016/j.clon.2007.08.009.
Zacharias T, Oussoultzoglou E, Jaeck D, Pessaux P, Bachellier P.壶腹周围恶性肿瘤复发的手术治疗。中华胃肠外科杂志,2009。https://doi.org/10.1007/s11605-008-0769-3.
王志强,王志强,王志强,Dühmke E。胰腺癌切除术后局部复发的临床观察。事的话。2006年,7(1):34-40。
张德昌,谢伦伯格D,沈杰,金杰,古德曼KA, Fisher GA,等。立体定向放射治疗不可切除的胰腺腺癌。癌症。2009。https://doi.org/10.1002/cncr.24059.
张志强,张志强,张志强,等。图像引导立体定向放射手术治疗前85例局部晚期胰腺腺癌结果。中华胃肠外科杂志,2010。https://doi.org/10.1007/s11605-010-1323-7.
射波刀机械臂立体定向放射外科。J Am Coll Radiol, 2007。https://doi.org/10.1016/j.jacr.2007.05.003.
李佳,杨荣荣,杨国强。癌症与放射治疗:当前进展与未来发展方向。国际医学杂志,2012。https://doi.org/10.7150/ijms.3635.
张志刚,张志刚,张志刚。立体定向放射治疗在多器官部位的应用。临床肿瘤学杂志,2007。https://doi.org/10.1200/JCO.2006.09.7469.
张晓东,张晓东,张晓东,张晓东。腹部和胸部立体定向体放射治疗的正常组织约束。Semin Radiat Oncol, 2017。https://doi.org/10.1016/j.semradonc.2017.02.001.
莫斯塔菲F,泰A,欧马里E,等。放射治疗期间mri评估的蠕动运动的变化。PLoS One, 2018。https://doi.org/10.1371/journal.pone.0205917.
hamel P, Huguet F, van Laethem JL, LAP07试验组,等。在吉西他滨联合或不联合厄洛替尼治疗4个月后,放化疗与化疗对局部晚期胰腺癌患者生存的影响:LAP07随机临床试验《美国医学协会杂志》上。2016.https://doi.org/10.1001/jama.2016.4324.
罗德龙,王志强,王志强,等。应用自适应磁共振成像引导放射疗法治疗不能手术的胰腺癌。癌症医学。2019。https://doi.org/10.1002/cam4.2100.
李志强,李志强,李志强,等。局灶放射治疗剂量增加提高局部晚期胰腺癌患者接受诱导化疗和巩固放化疗的总生存率。国际放射肿瘤生物物理杂志。2016。https://doi.org/10.1016/j.ijrobp.2015.12.003.
Ghaly M, Gogineni E, Saif MW。胰腺癌立体定向体放射治疗的发展领域。胰腺(Fairfax)。2019.https://doi.org/10.17140/POJ-3-110.
局部晚期胰腺癌的低分割消融放射治疗。J辐射res 2016。https://doi.org/10.1093/jrr/rrw016.
钟娟,王志强,王志强,等。局部晚期胰腺腺癌患者采用立体定向体放射治疗与常规分割放疗的疗效比较。癌症。2017。https://doi.org/10.1002/cncr.30706.
朴俊杰,哈吉C,雷金德M,等。立体定向体辐射与调强辐射治疗不可切除胰腺癌。学报学报,2017。https://doi.org/10.1080/0284186X.2017.1342863.
李志强,李志强。局部晚期胰腺癌消融性放射治疗的研究进展。2019年Radiat Oncol。https://doi.org/10.1186/s13014-019-1309-x.
Daamen LA, de Mol van Otterloo SR, van Goor IWJM, Eijkelenkamp H, Erickson BA, Hall WA,等。使用1.5T mr - linear ac在线自适应mr引导立体定向放射治疗上腹部不可切除恶性肿瘤学报,2022。https://doi.org/10.1080/0284186X.2021.2012593.
Bruynzeel AME, Lagerwaard FJ, Tetar SU, Oei SS, Haasbeek CJA, Bohoudi O.立体定向mr引导适应性放射治疗局部晚期胰腺肿瘤。国际肿瘤生物物理杂志。2017。https://doi.org/10.1016/j.ijrobp.2017.06.293.
徐志刚,王志刚,王志刚,等。folfirinox立体定向放射治疗局部晚期胰腺癌患者的疗效和可行性(LAPC-1试验)。EClinicalMedicine。2019.https://doi.org/10.1016/j.eclinm.2019.10.013.
李志强,李志强,李志强,等。更高的生物有效剂量预测胰腺癌SBRT的生存期:多中心分析(PAULA-1)。抗癌2020号决议。https://doi.org/10.21873/anticanres.13975.
Ryan JF, Groot VP, Rosati LM,等。立体定向体放射治疗胰腺导管腺癌手术切除后局部复发是安全有效的。Ann Surg Oncol, 2018。https://doi.org/10.1245/s10434-017-6134-6.
Comito T, Cozzi L, Clerici E, Franzese C, Tozzi A, Iftode C,等。立体定向体放射治疗对不能切除的局部晚期胰腺腺癌是否可行且有效?二期研究结果。科技癌症治疗,2017。https://doi.org/10.1177/1533034616650778.
Ryan JF, Rosati LM, Groot VP,等。立体定向体放射治疗在老年和医学上不能手术的胰腺腺癌患者中的姑息性管理。Oncotarget》2018。https://doi.org/10.18632/oncotarget.24713.
张文杰,张文杰,张文杰,等。2期多机构试验评价吉西他滨和立体定向体放疗治疗局部晚期不可切除胰腺腺癌患者。癌症。2015。https://doi.org/10.1002/cncr.29161.
Coebergh van den Braak RRJ, van Rijssen LB, van Kleef JJ,等。全国综合胃肠癌队列:3P计划。学报,2018。https://doi.org/10.1080/0284186X.2017.1346381.
van der Velden JM, Verkooijen HM, Young-Afat DA,等。队列多随机对照试验设计:实用试验的有效和有效的替代方案?国际流行病学杂志,2017。https://doi.org/10.1093/ije/dyw050.
Relton C, Torgerson D, O 'Cathain A, Nicholl J.重新思考实用主义随机对照试验:引入“队列多重随机对照试验”设计。BMJ。2010.https://doi.org/10.1136/bmj.c1066.
Verkooijen HM, Roes K, van Gils CH.队列多随机对照试验。NTVG。2013; 157 (17): A5762。
杨晓东,张晓东,张晓东,等。局部晚期和复发性胰腺癌立体定向体放射治疗的EUS指导基准点放置胃肠内窥镜。2010。https://doi.org/10.1016/j.gie.2009.12.020.
艾森豪尔EA, Therasse P, Bogaerts J, Schwartz LH, Sargent D, Ford R,等。实体肿瘤的新反应评价标准:修订的RECIST指南(1.1版)。《欧洲癌症杂志》2009。https://doi.org/10.1016/j.ejca.2008.10.026.
美国卫生与公众服务部,国家卫生研究院,国家癌症研究所。不良事件通用术语标准(CTCAE) 5.0版。2017.https://ctep.cancer.gov/protocoldevelopment/electronic_applications/ctc.htm.8月2日访问。
李文杰,李志强,李志强,等。立体定向体放疗(SBRT)治疗复发性胰腺癌。癌症杂志,2016。https://doi.org/10.7150/jca.13295.
曾晓玲,王海辉,孟MB,吴志强,宋玉春,庄海峰,等。腹侧淋巴结或术后残端(包括胰残端和其他残端)复发胰腺腺癌的立体定向体放射治疗。Onco Targets Ther. 2016。https://doi.org/10.2147/OTT.S102784.
Kohn MA, Senyak J.样本容量计算器。2022.https://www.sample-size.net.8月2日访问。
Daamen LA, Groot VP, Besselink MG, Bosscha K, Busch OR, Cirkel GA,等。荷兰胰腺癌复发的检测、治疗和生存:一项全国性的分析。安外科,2020年。https://doi.org/10.1097/SLA.0000000000004093.
王晓明,王晓明,王晓明,等。来自临床试验的健康相关生活质量数据的分析和解释:加拿大国家癌症研究所临床试验组的基本方法。《欧洲癌症杂志》2005。https://doi.org/10.1016/j.ejca.2004.10.017.
Verweij M, Gal R, Burbach JPM, Young-Afat DA, van der Velden JM, van der Graaf R,等。在队列设计的试验中,大多数患者积极或中立地报告作为对照。临床流行病学杂志,2022。https://doi.org/10.1016/j.clinepi.2022.04.015.
确认
不适用。
资金
ARCADE试验是由荷兰癌症协会(KWF;批准号12568)。荷兰癌症协会不参与研究的设计、数据的收集、分析和解释以及手稿的撰写。
作者信息
作者及隶属关系
财团
贡献
MI(首席研究员)、QM、AB、JN和LD发起了研究并制定了方案。民政事务总署和劳工处牵头提出拨款申请。IvG和LD起草了研究方案并撰写了手稿。IvG、LD、MB、AB、OB、GC、BGK、NHM、HH、HvL、GM、JN、HvS、GvT、HV、JW、QM和MI均参与了研究设计。IvG是中心研究协调人,负责MREC的批准。所有作者都阅读、审阅并批准了这篇手稿的最终版本。
作者的信息
Iris van Goor是一名医生,目前在乌得勒支地区学术癌症中心外科和放射肿瘤科攻读博士学位。她的主要工作重点是胰腺癌复发的检测和治疗。除了作为ARCADE试验的中心研究协调员,她还是RADAR-PANC试验的中心研究协调员(根据TwiCs设计的全国性随机对照试验,研究使用成像和血清肿瘤标志物检测的标准化监测策略对PDAC切除术患者的生存和生活质量的影响;NCT04875325)。此外,她正在乌得勒支大学攻读流行病学硕士学位。
相应的作者
道德声明
伦理批准并同意参与{24}
这项研究是根据《赫尔辛基宣言》(2013年10月,巴西福塔莱萨,第64届WMA大会)的原则进行的。此外,还获得了荷兰人体医学研究法案(WMO)的批准。该方案已得到乌得勒支大学医学中心医学伦理委员会的批准(参考编号20-805,NL74336.041.20, 2021年2月18日)。在每个单独的参与中心获得二次批准。所有患者信息和知情同意书均由机构审查委员会批准,并将获得所有参与者的书面知情同意。
发表同意{32}
不适用-这里没有提供或将在试验结果报告中提供参与者的识别图像或其他个人或临床细节。应要求,通讯作者可提供知情同意材料。
利益竞争{28}
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
范古尔,I.W.J.M,达门,洛杉矶,贝塞林克,M.G.et al。一项关于使用立体定向体放射治疗(ARCADE)治疗孤立性局部胰腺癌复发的全国性随机对照试验。试用23, 913(2022)。https://doi.org/10.1186/s13063-022-06829-1
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13063-022-06829-1
关键字
- 胰腺癌
- 胰导管腺癌
- PDAC
- 疾病复发
- 孤立性局部复发
- 立体定向身体放射疗法
- SBRT
- SABR
- 图像引导放射治疗