- 研究协议
- 开放获取
- 发表:
XAV-19在covid -19诱导的中度肺炎患者中的安全性和有效性评估:一项随机、双盲、安慰剂对照的2期(2a和2b)试验的研究方案
试用体积22,文章号:199(2021)
摘要
背景
早期抑制严重急性呼吸综合征冠状病毒2型(SARS-CoV-2)的进入和复制是一种非常有前途的治疗方法。多克隆中和抗体具有许多优点,如提供即时免疫,从而削弱早期促炎病原内源性抗体反应和缺乏药物-药物相互作用。
通过提供即时免疫和抑制进入细胞,中和抗体治疗对covid -19诱导的中度肺炎患者很有意义。因此,用于治疗感染患者的恢复期血浆是目前正在评估的相关治疗方案(corimuno - plasnct04324047)。然而,长期采集血浆的困难还不适应在所有人群中广泛使用。
Xenothera公司开发的新型人源抗sars - cov2多克隆抗体(XAV-19),静脉注射给药。XAV-19是一种抗SARS-CoV-2刺突蛋白的异源猪糖人化多克隆抗体(GH-pAb),可阻断ace -2阳性的人细胞感染SARS-CoV-2。
方法
在包括灵长类动物在内的临床前模型中进行了药代动力学和药效学研究。来自Xenothera的另一种完全具有代表性的GH-pAb的首次人体研究正在肾移植受者中进行。这些研究表明,连续5次给药gh - pab可以安全地在人体上进行。
这项两步2期随机双盲、安慰剂对照研究的目的是确定对SARS-CoV-2诱导的中度肺炎患者使用XAV-19的安全性和最佳剂量,并评估选定剂量XAV-19在该人群中的临床益处。
讨论
本研究将确定XAV-19用于sars - cov -2诱导的中度肺炎患者的临床益处。作为先决条件,研究的第一步将确定XAV-19的安全性和使用剂量。
这种治疗可能成为一种新的治疗选择,为COVID-19患者提供有效的治疗(可能与抗病毒和免疫疗法结合使用)。进一步的研究可以评估这种被动免疫疗法作为潜在的暴露后预防。
试验注册
ClinicalTrials.govNCT04453384,于2020年7月1日注册,以及于2020年6月6日注册的EUDRACT 2020-002574-27。
政务信息
项目的顺序已被修改,以对相似的项目进行分组(请参阅http://www.equator-network.org/reporting-guidelines/spirit-2013-statement-defining-standard-protocol-items-for-clinical-trials/).
标题{1} |
一项随机、双盲、安慰剂对照的2期(2a和2b)研究,评估XAV-19在COVID-19诱导的中度肺炎患者中的安全性和有效性 |
试用注册{2a和2b} |
注册编号NCT04453384,于2020年7月1日首次发布。https://clinicaltrials.gov/ct2/show/NCT04453384欧盟法规编号2020-002574-27,于2020年6月15日首次发布。https://www.clinicaltrialsregister.eu/ctr-search/trial/2020-002574-27/FR |
协议版本为{3} |
2020年8月4日更新的协议版本为1.4。 |
资金{4} |
本研究由公共投资银行(也称为法国BPI)在“未来投资”计划(programme d 'Investissements d 'Avenir)框架下支持。 |
作者详细信息{5a} |
Benjamin Gaborit, Pascale Morineau, Jeremie Orain, Morgane Le Bras和François Raffi属于CHU南特,传染病部和CIC1413临床调查中心(INSERM和CHU南特)。Alexandra Poinas完全属于CIC1413临床研究中心(INSERM和CHU南特)。Marie-Anne Vibet;Aurélie Le Thuaut, Laetitia Berly, Anne Omnes和Alexandra Jobert属于CHU南特,赞助部门。属于南特大学医院的其他作者是Karine Botturi(合作与创新部门),Regis Josien(免疫学实验室),Sophie Brouard和Nicolas Degauque(移植和免疫学研究中心)Virginie Ferré(病毒学实验室)和Laurent Flet(药剂科)。Odile Duvaux和Bernard Vanhove属于Xenothera实验室。Florence Ader, Karine Lacombe和Vincent Dubee是主要研究员,分别属于里昂大学医院(里昂平民医院),AP-HP(圣安东尼医院)和昂热大学医院。Eric Vicaut属于AP-HP, Fernand Widal医院。 |
试验发起人的姓名和联系信息 |
Karine Botturi和Laetitia Berly是发起人项目经理,他们管理试验的后勤工作。如欲索取POLYCOR的资料,可透过以下电邮地址提出:BP-direction-de-la-recherche@chu-nantes.fr. |
赞助商的作用{5c} |
所有提交的文件/声明都是由南特大学的主办部门提交的,该部门当然负责管理所收集数据的质量。研究期间收集的数据将按照法国国家数据保护委员会(CNIL)、法国数据保护局(data Protection Authority)的要求以及欧洲和法国有关安全问题的规定进行电子处理。 根据2004年8月9日颁布的第2004-806号法律及其实施法令,申办方应提出对议定书进行实质性修改的请求,以获得批准或通知法国监管机构和/或有关的伦理审查委员会。 |
简介
背景和理论基础
2019年12月,中国武汉出现新型冠状病毒病(COVID-19)。10个月后,COVID-19导致超过35,216,168例确诊病例,超过1,037,557例已宣布(https://coronavirus.jhu.edu/map.html查看2020年10月5日)。
由于缺乏有效的治疗方法,病毒的传播也没有得到任何控制,世界卫生组织于2020年1月30日宣布为国际关注的突发公共卫生事件。
严重急性呼吸综合征冠状病毒2型(SARS-CoV-2)是一种蛋白质包膜RNA病毒[1]引起流感样症状(发烧、咳嗽、呼吸困难、呕吐、腹泻),20%的呼吸道疾病病例需要入院治疗,5%的重症病例需要住进重症监护室[2].超过25%的患者在发病第二周出现严重急性呼吸窘迫综合征(ARDS),并出现急性呼吸窘迫[3.].
据报道,SARS-CoV-2感染可引起直接器官损伤[4,5]及引起"病毒性败血症"的不适当免疫反应[6,7,8].严重感染的病理生理机制尚不清楚[9].在最严重的病例中,由系统性多器官病毒入侵引起的压倒性免疫反应导致多器官衰竭和随后的死亡[10].抗病毒药物和炎症通路的阻断很可能都是优化反应所必需的。
由于迫切需要开发现有的治疗方法来管理COVID-19的肺部并发症,许多努力仍在继续开发针对COVID-19的抗病毒药物和免疫疗法。
通过提供即时免疫和抑制进入细胞,恢复期血浆在2003年已被证明可提高SARS-CoV感染患者的存活率[11].已证明SARS-CoV-2使用与SARS-CoV相同的细胞进入受体,血管紧张素转换酶2 (ACE2) [12,13].通过抑制SARS-CoV-2 spike糖蛋白(S)介导的进入细胞,恢复期血浆是治疗SARS-CoV-2感染患者的一种有前途的方法。早期给药中和抗体可抑制病毒进入和复制,从而钝化早期促炎反应。
总部位于南特的生物技术公司Xenothera从南特大学分拆出来,开发了一种新的多克隆糖人化(GH-pAb)抗sars - cov2猪抗体“XAV-19”。Vanhove等人和Salama等人描述的GH-pAbs [14,15]已在非人类灵长类动物和志愿者肾移植患者的临床前评估中评估了安全性、药代动力学和药效学效应,这些患者每天服用0.6 mg/kg、1mg /kg、3mg /kg、6mg /kg和8mg /kg 5个剂量水平[16].因此,40毫克每公斤是人类服用过的最大累积剂量。虽然研究仍在进行中,数据和安全监测委员会(DSMC)同意继续进行研究的第二部分(治疗剂量),GH-pAb将以8 mg/kg的剂量给药5次(累计剂量为40 mg/kg)。
中和抗体(Abs)的功效
在小鼠中,中和抗首次感染引起的SARS-CoV的Ab,可防止naïve小鼠的继发感染,防止SARS-CoV在呼吸道复制[11].对SARS-CoV和SARS-CoV-2患者的小型回顾性病例比较研究表明,恢复期血浆治疗后病死率降低[17,18,19].在病理主要由病毒复制驱动的时期早期给药似乎是最合适的。
安全配置文件
与恢复期血浆相关的潜在毒性问题和收集血浆的困难是这种治疗广泛使用的主要限制。XAV-19是Xenothera实验室的一种新型GH-pAb。就其本身而言,XAV-19从未在人体中使用过。然而,它在化学上与LIS1相当,LIS1是Xenothera于2019年在临床引入的一种消耗淋巴细胞的GH-pAb。LIS1已安全应用于肾移植受者,累积剂量高达40 mg/kg,是POLYCOR研究中XAV-19预期最低剂量的40倍。
新的糖化多克隆抗sars - cov2抗体配方
XAV-19原料药(DS)为无色液体无菌溶液,浓度为5.0±0.5 mg/mL。XAV-19的生成过程如下:活性物质的制造过程始于用重组抗原(SARS-Cov-2刺突蛋白结构域)免疫后收集的猪血清池。用类似于纯化单抗的下游工艺纯化IgG部分。
POLYCOR研究
已知gh - paabs在人体内具有良好的耐受性,并且中和Abs可以成为SARS疾病期间的有效治疗方法,POLYCOR旨在通过随机双盲、安慰剂对照研究,探讨多克隆人源化抗SARS- cov2抗体(XAV-19)在covid -19诱导的中度肺炎患者中的疗效。
POLYCOR分为2个步骤:2a期为双升剂量(DAD)、双盲、安慰剂对照随机研究,以选择XAV-19的最佳剂量用于2b期。2b期(双固定剂量(DFD))将是一项双盲、安慰剂对照随机研究,旨在评估2a期选择剂量XAV-19在352名患有covid -19相关中度肺炎的住院成人中的临床获益和安全性。
目标{7}
2a期研究的目标
主要目的是(1)评估治疗组与安慰剂组患者在第8天的XAV-19滴度;(2)评估XAV-19的安全性和耐受性。
本研究的次要目标是:(1)描述XAV-19感染患者在D1至D29期间的药代动力学(PK),(2)评估XAV-19抗体滴度,并在第8天比较第1组患者与第2组患者,(3)根据临床变量(补充氧气持续时间、重症监护病房(ICU)转移、发烧恢复正常、生物标志物滴度、第15天评估的顺序量表,住院时间)。
探索性目标将是评估在纵向随访中使用中和抗体对病毒诱导免疫反应的影响,并确定下一阶段研究的“免疫监测”靶点,并调查XAV-19治疗期间COVID-19的免疫原性。
2b期研究的目标
这项研究的主要目的是比较两组治疗前或第15天断奶前补充氧气的持续时间。
该研究的次要目标是比较两组:
- 1.
国家预警评分的演变(新闻2)[20.]
- 2.
基线和第15天之间7点顺序量表的变化
- 3.
采用7分制的顺序量表,从录取开始改进一个类别
- 4.
发烧恢复正常
- 5.
氧疗时间超过29天
- 6.
29天的氧气需求量
- 7.
在第15天无氧气需求的情况下,从补充氧气到断奶的时间和比例
- 8.
需有创机械通气或高流量O2转入ICU
- 9.
住院时间
- 10.
所有死亡原因
- 11.
XAV-19的安全性
要注意,两项辅助研究将完成2b阶段。药代动力学研究将纳入16例患者,免疫监测研究将纳入30例患者。所进行的分析将与2a期研究中所进行的分析相同。
参与这些辅助研究的研究地点将建议他们的第一批患者参与这些研究。患者可以同时参与两项研究。
药代动力学研究的目的是表征xav -19感染患者在D1至D29期间的药代动力学(PK)。药代动力学分析对应于第1天(剂量前,剂量后)、第3天、第5天(剂量前,剂量后)、第8天、第15天和第29天的抗体滴度测量。
目的是评估在纵向随访中使用中和抗体对病毒诱导免疫反应的影响,并确定下一阶段研究的“免疫监测”靶点,并调查XAV-19治疗期间COVID-19的免疫原性。
试设计{8}
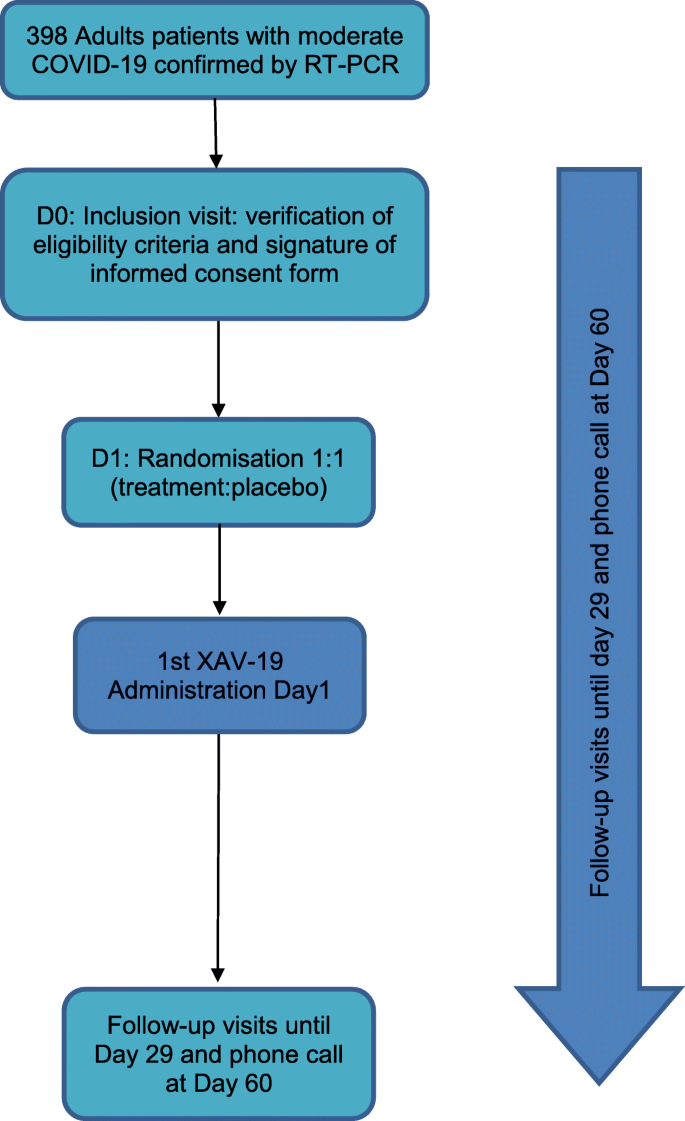
如前所述,POLYCOR是一项二期研究,旨在确定用于中度COVID-19患者的最佳XAV-19剂量,并评估其安全性和有效性。POLYCOR分为两个步骤。2a期将是一项双上升剂量(DAD)、双盲、安慰剂对照随机研究,以选择XAV-19的最佳剂量用于2b期。2b期(双固定剂量,DFD)是一项双盲、安慰剂对照随机研究,旨在评估2a期选择剂量XAV-19在352例covid -19相关中度肺炎住院成人中的临床获益和安全性。
方法:参与者、干预措施和结果
学习设置{9}
本研究是多中心的、全国性的。2a期试验的16名患者将在4家医院招募,更准确地说是在南特大学医院、里昂、昂热和圣安东尼医院(巴黎)的传染病科。
一旦2a阶段完成,2b阶段将开始,除了2a阶段的4个医院中心外,还有31个医院中心。这35个中心将覆盖整个法国领土。
资格标准{10}
研究人群为成年人(男性或女性),年龄在18岁以上,因COVID-19感染住院,RT-PCR阳性确诊时间少于10天,伴有肺炎,氧疗Sp02≥94%。患者将在本研究中宣布的研究地点进行招募。
有生育潜力的妇女(WOCBP)在临床试验期间必须使用适当的避孕方法(口服避孕、植入或宫内节育器(IUD))。孕妇、未采取有效避孕措施的育龄妇女(WOCBP)、哺乳期妇女、受监护或托管的患者不纳入研究范围。此外,所有性活跃的男性受试者必须同意在整个研究期间和最后一剂研究药物后90天内使用适当的避孕方法,并同意在研究结束前不捐献精子,或在最后一剂XAV-19后90天内不捐献精子,以时间较长的为准。
受试者不能同时参与其他介入性研究,直到他们参与本研究结束后3个月。所有纳入和排除标准见表1.
谁会接受知情同意
研究人员在进行任何特定研究程序之前,应获得患者的书面同意。参与是自愿的,个人可以在任何阶段退出,参与不影响他们的治疗。
关于收集和使用参与者数据和生物标本的额外同意条款
我们将利用CHU Nantes宣布的现有“免疫学”研究计划,建立“POLYCOR”生物收藏。如果患者签署了生物收集知情同意书,生物样本将被收集和存储。在这份知情同意书中,我们注意到样本可能会被用于其他科学研究。这一生物收集将对诊断为COVID-19的患者进行生物学和纵向随访,以评估免疫变化和宿主-病毒相互作用。伦理授权已经授予,预分析步骤已经实施且有效。
干预措施
选择比较国的解释
POLYCOR项目旨在确定用于中度COVID-19肺炎患者的最佳XAV-19剂量,并评估其安全性和有效性。
因此,法国监管机构(ANSM)已经给出了他们的科学建议,将该研究的第一部分(2a阶段)作为首次人体研究,并进行连续登记以检查安全性。
XAV-19首次人体评估中选择的剂量水平基于3个数据集:
- 1)
LIS1糖化猪IgG给药的临床经验。LIS1是一种实验性的减淋巴多克隆猪抗体,由Xenothera实验室glyco-humanized GH-pAb平台生产。目前正在欧盟肾移植患者中进行临床开发(EUDRACT 2019-000917-35)。到目前为止,在递增剂量组中已达到并被DSMC(建议在此剂量下进行试验)认为可接受的最大剂量是每天给药5次,剂量为8mg /kg,即累积剂量为40mg /kg。因此,在XAV-19的首次人体试验中,我们建议累计剂量低于给予的最大LIS1剂量。
- 2)
已发表的使用含有抗covid -19中和抗体的恢复期血浆(CP)的临床经验,已证明改善了临床症状。首先,对COVID-19危重患者连续两次输注200 mL CP, CP中sars - cov -2特异性抗体(IgG)结合滴度大于1:1000,中和滴度大于40(终点稀释滴度)[9].在这种经验中,结合滴度和中和滴度之间的比率因此平均为25倍。其次,段等用一剂200ml CP治疗了10例COVID-19患者[21].在本报告中,40 CP计算的平均中和滴度为> 1/160。第三,在2003年对sars恢复期患者输血80例CP的临床经验中,CP的平均体积为279 mL,中和滴度为> 1/160 [22].因此,总的来说,估计输血200ml CP相当于25mg /kg的IgG(考虑到血浆中含有10mg /mL的IgG,考虑到80公斤的患者),我们可以假设25mg /kg的IgG制剂具有至少1/40的中和效价,具有临床价值。获得XAV-19的糖人化血清的结合和中和效价分别约为1/10万和1/4000 (ELISA中和试验)。在细胞致病效应试验中,中和滴度为1:1600。因此,与文献显示具有临床意义的COVID-19 CP相比,XAV-19的中和滴度高出40- 100倍(取决于测定方法),比欧盟委员会推荐的高12.5倍。在选择剂量时,应考虑XAV-19中和滴度与CP的比值。根据现有数据,与CP比为40倍的批次可能因此以40倍的低剂量使用,这意味着注射0.6 mg/kg XAV-19与注射25 mg/kg CP在体内产生类似的效果。欧洲委员会最近关于CP使用的指南修订了CP的理想中和滴度,并建议“中和抗体滴度最佳应大于1:20 20,但较低的阈值也可能有效”(https://www.phc.org.ua/sites/default/files/users/user90/Guidance_plasma_covid19_en.pdf).因此,还可能测试另一种高于0.6 mg/kg的XAV-19剂量。
- 3)
XAV-19体外评估获得的PK/PD信息。XAV-19已在竞争性ELISA(抑制COVID-19刺突蛋白与ACE-2受体结合)中进行了评估,并在针对SARS-CoV-2的中和活性测定中进行了测试,使用Vero细胞进行了经典斑块减少试验。我们的数据显示有IC50(测试中达到最大信号50%的浓度)。第一批XAV-19 ELISA和中和试验2.5 μg/mL [14].细胞致病效应实验数据显示,该实验对SARS-CoV-2传染性的完全抑制达到15 ~ 25 μg/mL左右。考虑到平均血浆容量为38.5 mL/kg,这批XAV-19需要注射0.96 mg/kg才能达到(Cmax) 25 μg/mL的血浆浓度(Cmax)。在灵长类动物中测量的猪糖人化IgG的分布体积(53 mL/kg)与血浆中的值接近,这表明XAV-19 IgGs基本上会在血浆中循环。同时考虑到灵长类动物的分布和消除半衰期(估计为172小时),我们可以选择比这一目标高2倍的初始剂量,在第1天和第5天给予,以便在一周以上的时间内保持在25 μg/mL的过渡水平之上,这一持续时间被认为是获得临床反应的适当时间。达到这一目标的估计剂量为2毫克/公斤。
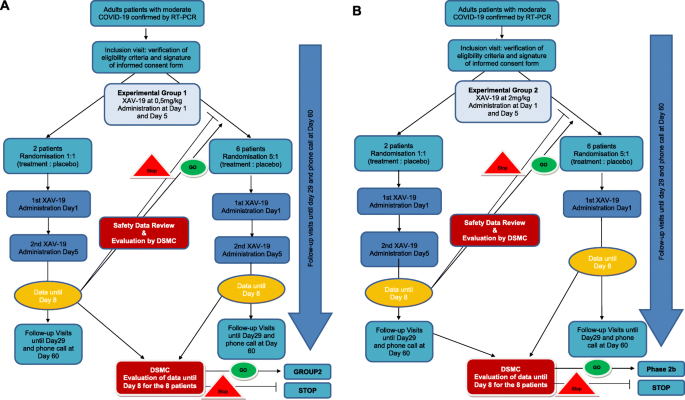
基于这3个数据集,对于出现IC的一批XAV-19, 2a期第2组的药物活性剂量(PAD)护理标准SOC将在第1天和第5天注射2mg /kg50在ELISA Spike/ACE2中和试验中,2.5 μg/mL。它的目的是在数天内将XAV-19的最低水平维持在25 μg/mL以上。这一剂量低于以往临床经验中证明LIS1安全性的人体给药剂量(每天5次,剂量为8mg /kg,总共为40mg /kg),因此低于可能达到剂量限制毒性的剂量。换句话说,与之前使用糖人化猪IgG相比,这种剂量(2 mg/kg两次给药)对XAV-19的首次给药具有10倍的安全系数。根据该PAD,可根据欧洲委员会的升级指南将首次人用剂量(2a阶段的第1组)设置为安全系数为4。因此,建议第1天和第5天的首次人用剂量为0.5 mg/kg,即累积剂量为1 mg/kg。因此,在阶段2a中,组1和组2之间有4倍的增量。
对两个给药组的安全性和药代动力学参数的评估将指导2b期研究中使用剂量的选择。
干预措施描述{11a}
2a阶段将招募16名受试者,分为两个剂量水平组之一:第1组根据XAV-19批中和效价确定剂量水平(初步估计为0.5 mg/kg),第2组比第1组高4倍(估计为2.0 mg/kg)。如果患者没有接受完整的治疗,或者没有随访8天,则将在总共20名患者的限制内进行更换。每个受试者将接受两次XAV-19或安慰剂注射,间隔4天(第1天和第5天给药)。
更准确地说,在低剂量组的前两名患者(一名接受治疗的患者和一名服用安慰剂的患者)登记后,将在第一次(第1天)和第二次(第5天)注射后收集数据,以收集任何可能发生的严重不良事件,特别是在每次注射后的前48小时内。
DSMC必须立即审查前2名患者的安全性数据(基于第8天的信息),并就第1组最后6名患者(低剂量)的继续入组提供建议。DSMC的声明和赞助商关于继续研究的决定将立即传达给ANSM。
如果前两例患者在入组第8天没有严重不耐受的信号,该组其余患者将采用相同的耐受性审查程序入组。
当第1组的最后一名患者入组时,DSMC必须审查来自这一低剂量队列的所有8名患者的第8天安全性数据,以建议开始高剂量组(第2组)。DSMC的声明和赞助商关于继续研究的决定将立即传达给ANSM。
在2a期研究期间的任何时候,如果发生严重不良事件,将通知DSMC,主办方和协调研究者将有责任决定DSMC是否必须开会就研究行为提出建议。
第二组的剂量为2 mg/kg,将适用相同的顺序XAV-19给药,并有安全步骤和DSMC数据审查。
在2a阶段结束时,应法国监管机构(ANSM)的要求,将对议定书进行修订,以继续2b阶段的研究。
2b期(DFD)将是一项双盲、安慰剂对照的随机研究,旨在评估2a期选择剂量XAV-19在352例covid -19相关中度肺炎住院成人中的临床获益和安全性。患者将按1:1的比例随机分配到XAV-19组或安慰剂组,并将间隔4天(第1天和第5天)连续接受2次剂量。显然,在这项2b研究中,DSMC将定期满足DSMC章程中定义的要求。
在2b期研究中,如果纳入后需要有创机械通气的患者比例增加到30~50%(以50例患者为增量组进行分析),则在不终止研究的情况下,要求DSMC复查数据。如果纳入后需要有创机械通气的患者比例大于研究纳入患者的50%(以50例患者为增量组进行分析),将暂时停止纳入,并要求DSMC审查数据并决定早期最终终止研究。
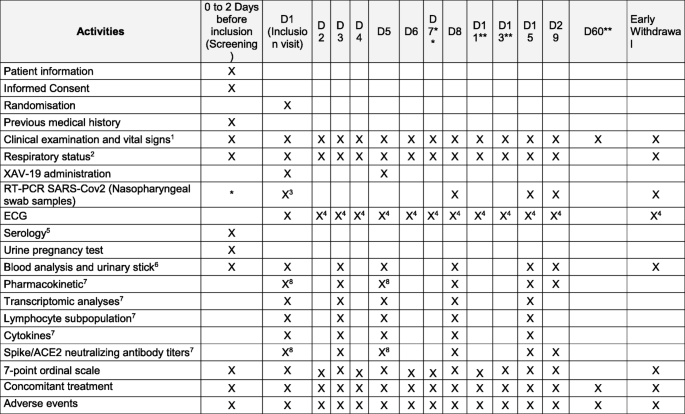
图中所示的流程图总结了所有访问的研究日程安排。3.;所有这些检查均适用于2a期和2b期的所有患者,辅助研究的特定血液样本除外。在2a阶段,采血适用于所有患者。在2b期,以下血液采集是辅助研究的一部分:
辅助研究1:20例患者进行药代动力学评价
▪淋巴细胞亚群
辅助研究2:来自2b期的30例患者评估:
▪Spike/ACE2相互作用中和抗体样本
▪淋巴细胞亚群
▪细胞因子
▪转录组分析
▪B细胞上的单细胞RNAseq
▪B-Tfh功能交互
停止或修改已分配干预措施的标准{11b}
在研究治疗提前中断的情况下,研究者将尽一切努力邀请患者进行随访结束。中止的主要原因必须记录在e-CRF的适当部分,以及为尽可能彻底地完成和报告观察结果所做的所有努力。
如果患者未能返回预定的访问/随访,应尝试与患者联系,以确定不返回的原因。同样,如果患者宣布他们希望停止研究,例如,由于个人原因,应尽一切努力确定原因不是由于不良事件(记住,患者没有义务接受他们的原因)。
最终或暂时终止全部或部分研究可由ANSM、伦理委员会、数据和安全监测委员会(DSMC)提出意见后的主办方决定.
无论如何:
提前终止研究的书面确认应发送给该研究的协调研究者(说明提前终止的原因)。
应告知参与研究的所有患者,并应参加他们的早期戒断访视。
每个早期离开研究的人都应该接受常规的医疗随访。
提高干预依从性的策略{11c}
这些研究将在医院实现;患者坚持不适用。
试验期间允许或禁止的相关伴随护理
在研究期间,COVID-19的SOC将根据当地实践和/或地方/国家指南进行,其中可能包括(但不限于)抗生素、抗病毒治疗、皮质类固醇、非基于抗体的免疫治疗和抗凝血剂。具体而言,目前COVID-19发作的血清疗法将不被允许。
审判后护理的规定{30}
研究结束后,每位患者将接受常规的医疗随访。
保荐人按照规定投保其民事责任的经济后果。
结果{12}
2a期研究的主要终点是(a)所有治疗患者和安慰剂组所有患者在第8天(最后一次给药后3天)测量XAV-19抗体滴度的药代动力学测量以及(b)两组治疗患者与安慰剂组之间29天内XAV-19的耐受性和不良事件,评估如下:
所有疑似xav -19相关不良反应的发生情况及严重不良事件的发生情况
出现治疗突发不良事件导致研究药物停药的受试者比例
住院期间重大或细菌或真菌感染的发生率
过敏反应及输注反应发生率。需要注意的是,在第60天之前登记不良事件,而与注射相关的不良事件则在48小时后登记。
白细胞计数,血红蛋白,血小板,肌酐,ALT, AST,第1天,第3天,第5天,第8天,第15天,第29天
SARS-CoV-2病毒载量随时间的变化(第1天至第29天),取自鼻咽拭子样本
鼻咽拭子样本RT-PCR病毒阴性时间
阶段2a的次要终点是:
- 一)
药代动力学分析:第1天(剂量前,剂量后)、第3天、第5天(剂量前,剂量后)、第8天、第15天和第29天的抗体滴度测量。
- b)
第1组和第2组患者在第15天测定XAV-19抗体滴度。
- c)
临床方面:
补氧时间
转移到重症监护室,需要有创机械通气或高流量氧气
发烧正常化≥24小时:从第1天到第14天每天进行临床评估。评估将在上午8点至12点之间进行,第X天评估将考虑第X-1天(上午8点至上午8点)的较高值
-正常发热(鼓室≤37.8°C或腋窝≤36.6°C或≤37.2°C口服,除退烧药外,每天4小时),退烧至少48小时
生物标志物:CRP,铁蛋白(第1、3、5、8、15和29天)
第15天评估顺序量表。7点顺序量表是在第15天第一次评估时对临床状况的评估。量表如下:
- 1.
没有住院,没有活动限制
- 2.
没有住院,活动受限
- 3.
住院,不需要补充氧气
- 4.
住院,需要补充氧气
- 5.
住院,采用无创通气或高流量O2设备
- 6.
住院接受有创机械通气或ECMO
- 7.
死亡
住院时间
阶段2b的主要终点是辅助氧断奶的时间。
如果患者在第15天仍在吸氧,或者如果患者断奶后又恢复吸氧,则延迟将在第15天取消。
次要终点是:
- 一)
第15天的国家预警评分(NEWS2)以及第1天和第15天之间NEWS2的差异
- b)
在第3天、第5天、第8天、第11天、第15天和第29天使用7点顺序量表评估临床状态
- c)
从使用7分制的顺序量表录取到改进一个类别的时间
- d)
第一次发烧恢复正常的时间(恢复正常的标准:腋窝温度< 36.6℃,口腔温度< 37.2℃,直肠或鼓室温度< 37.8℃)
- e)
氧疗时间超过29天
- f)
两组29天内需氧量比较
- g)
根据基线(第1天)需氧量(≤4 L/min或4 L/min),到第15天无需氧量的补充氧断奶时间和比例
- h)
研究中有创机械通气的无创通气或高流量氧气设备的发生率和持续时间
- 我)
住院时间
- j)
第29天的全因死亡率
- k)
XAV-19的安全性评估如下:
发生所有疑似xav -19相关不良反应或发生严重不良事件
出现治疗突发不良事件导致研究药物停药的受试者比例
重大或机会性细菌或真菌感染的发生率
过敏反应及输注反应发生率
白细胞计数,血红蛋白,血小板,肌酐,ALT, AST,第1天,第3天,第5天,第8天,第11天,第15天,第29天
SARS-CoV-2病毒载量随时间的变化(第1天至第29天),取自鼻咽拭子样本
鼻咽拭子样本RT-PCR病毒阴性时间
参与者时间线{13}
对于2a期研究:每位患者的治疗时间对应于第1天和第5天的输液,患者的随访时间为2个月,招募期为2个月。
对于2b期研究:每位患者的治疗时间也将对应于第1天和第5天的输液,患者的随访时间为2个月,招募期为6个月。
样本容量{14}
由于是2a期,患者人数是根据2a期的相关出版物确定的[23,24,25]。研究决定纳入两个8例患者的队列(每个队列中6例接受治疗的患者和2例匹配的安慰剂)。
对于2b期,基于至少在第15天放弃氧疗的患者的预期生存率(对照组为80%,实验组为90%),在α风险为5%和幂度为80%的控制下,预定样本量为352名参与者。对照组中位氧疗时间为8天,实验组中位氧疗时间为6天。因此,估计的危险比为0.75。按Schoenfeld公式计算样本量[26],由于Cortes的出版物[27].
招聘{15}
2a期研究计划招募4个月,2b期研究计划招募6个月。开放研究者中心的数量弥补了纳入时间的短。
干预措施的分配:分配
序列生成{16a}
将执行随机化,并按块进行平衡。用于随机化的软件是SAS版本9.4。
在比例方面,对于2a期,每个队列中前2例患者的比例为1:1,如果一切顺利,2个队列中剩余6例患者的比例为1:5(1个安慰剂5剂XAV-19)。对于2b阶段,将以1:1的比例进行。
隐藏机制{16b}
随机分组将通过连接到以下网站的EnnovClinical软件进行:https://nantes-lrsy.hugo-online.fr/.连接将使用由CHU南特赞助部门的数据经理颁发的登录名、密码和研究号进行。包含号和随机化臂将自动分配。
实现c {16}
只有不参与研究的生物统计学家和数据管理人员知道随机化的关键,这使得研究人员不可能分配特定的治疗方法。
干预的分配:盲法
谁将被蒙蔽双眼
我们的研究是随机双盲试验。患者、研究人员及其团队将被蒙蔽,不知道分配的治疗方案。正如Karanicolas等人在2010年的文章中指出的那样,他们的研究应该向生物统计学家隐瞒,直到进行分析,以减少研究偏倚[28].
如有需要,可进行开盲操作。
正常情况下,在所有患者完成研究并锁定数据库之前,不应打破盲。在目前的研究中,研究者不需要知道患者的治疗臂,以防不良事件发生,因为治疗将是对症性的,不适合该手臂。只有药物警戒团队为了安全目的和传播才会打破盲区。这将根据内部保荐人的程序来完成。
数据收集和管理
评估计划和结果收集-评估疗效的参数描述
所有检查将由研究者或一名合格的调查人员进行。首先,他将进行全面的身体检查,包括以下评估:心血管、头耳鼻喉、眼睛、肠胃、总体外观、淋巴结、肌肉骨骼、神经系统、呼吸系统、皮肤和粘膜。测量体重和身高。
纳入时出现的任何异常或后续变化将在eCRF的相应章节中记录。在研究结束时,研究者将跟踪任何持续存在的临床显著异常,直到解决或达到临床稳定终点。报告生命体征和呼吸状况。在患者仰卧位至少5分钟时,根据研究计划记录12导联数字化心电图。纳入访视时行心电图;其他心电图将由研究者自行决定,视患者护理需要而定。
临床患者状况将通过7级序数量表进行评估(从1到7级,得分越高表示病情越严重)。该量表将在每次研究访问时进行评估。每天记录前24小时的最差评分,即在第3天,获取第2天评分,记为第2天。第1天和第5天,必须在XAV-19输注前进行评估。
我们还将使用NEWS2,这是2017年12月更新的国家预警评分(NEWS)的最新版本[20.),该组织倡导建立一个系统来规范急性疾病的评估和应对。NEWS2基于一个简单的综合评分系统,在该系统中,当患者在医院就诊或正在医院接受监测时,评分将分配给在常规实践中已经记录的生理测量。6个简单的生理参数构成了评分系统的基础:(1)呼吸频率,(2)氧饱和度,(3)收缩压,(4)脉搏频率,(5)意识水平或新的混乱,以及(6)温度。当每个参数被测量时,分数被分配给它们,分数的大小反映了参数与常态之间的极大差异。然后,需要补充氧气以维持推荐氧饱和度的人的分数被汇总并提高2分。
提高参与者留存率和完成随访的计划{18b}
提醒一下,目标人群会住院;数据缺失只能导致撤回同意或严重不良事件(SAE)。目前还没有提高参与者留存率的计划。
数据管理{19}.
为每个患者创建病例报告表(CRF),其中包括确保遵守方案所需的数据以及统计分析和确定主要方案偏差所需的所有数据。数据收集由负责研究的研究员或临床研究助理直接完成,使用由CHU Nantes赞助部门与ENNOV临床开发的电子CRF (eCRF)。数据经过编码,以保证病人的身份保密。
保密{27}
研究期间收集的数据将按照CNIL的要求进行电子处理(符合法国参考方法MR001)。法国国家数据保护委员会(CNIL)是法国一家独立的行政监管机构,其使命是确保数据隐私法适用于个人数据的收集、存储和使用。
本试验/未来使用{33}的生物样本收集、实验室评估和存储计划用于遗传或分子分析
对于药代动力学分析,将在每次抽取时收集血液样本进行具体分析,如下所述,根据研究时间表。这些分析将在良好实验室规范条件下进行。在2a期,所有纳入研究的患者都将采集药代动力学样本。
对于免疫学分析,将根据研究日程收集血液样本进行具体分析,具体分析如下所示。eCRF上必须准确记录抽血的实际时间和日期。
将进行以下分析:
T和B淋巴细胞亚群(谱流式细胞术)
Tfh-B细胞相互作用
PBMC和B细胞的转录组学分析
Spike/ACE2相互作用中和抗体
血清细胞因子:MCP1、IP10、IL-10、IFNα、TNF-α、IL-1b、IL-6、IL-82 (2a阶段)和IL-6、IFNa2、IL-10、IP10、CCL2 (2b阶段)
最后,将从外周血中提取信使RNA分子的转录组学分析,以识别与临床状态和病毒载量相关的特异性过表达或过表达的转录本。目标是识别疾病严重程度和疾病对治疗的反应的可能生物标志物,并使用反褶积生物分析,还可以识别细胞群的变化,以补充直接流式细胞术分析。重点是B细胞亚群及其在与Tfh细胞相互作用中的作用。这些免疫分析将由南特大学的CRTI进行(INSERM U1064)(由法国国家科学研究中心的Sophie Brouard领导)。
在研究结束时,所有2a期患者和仅接受参与2b期免疫监测研究的患者的采样(血液样本)所产生的残留生物样本将被保留。在后一种情况下,筛选时将收集受试者的书面同意,存储的样本将被整合到位于南特大学生物资源中心(CRB)的生物收藏“POLYCOR”中,由Gaborit博士负责。该生物收藏将附属于2011年5月9日宣布的“免疫学”研究项目。DC-2011-1399和以下修订声明(DC-2012-1555;DC-2013-1832, DC2014-2206和DC-2017-2987目前待定),并已于2015年4月7日获得CPP Ouest VI(伦理委员会)的有利决定。
统计方法
主要和次要结果的统计方法{20a}
在2a期研究中,安全人群包括所有随机纳入研究的受试者,他们至少接受了一剂研究药物。意向治疗(暴露,ITT[E])人群定义为所有符合研究标准并随机进入研究的受试者,有文件证明接受了至少一次随机治疗和至少一次基线后XAV-19 IgG SARS-CoV2滴度测量。每方案人群定义为包括在ITTE人群中的所有受试者,不包括那些至少有一个重大方案偏差的受试者。
主要终点将在所有安慰剂患者和所有治疗患者之间通过Kruskal-Wallis试验评估ITTE人群。
治疗组将根据次要终点的变量进行描述。分类变量用百分比来概括,连续变量用均值和标准误差、中位数和四分位差来概括。
在阶段2b中,分类变量用百分比进行汇总,连续变量用均值和标准误差进行汇总,中位数和四分位差进行汇总。将比较两组患者的生存率和氧疗持续时间,以确定主要终点。
次要终点比较,定量终点采用线性混合模型,定性数据采用logistic混合模型,考虑分层因素。时间数据将使用生存模型进行分析。将采用Fine和Gray方法来考虑竞争风险。
中期分析{21b}
不会进行中期分析,也不会提出提前停止无用的规则。
附加分析的方法(例如,亚组分析)
PK浓度人群包括所有在研究期间至少接受过一次XAV-19的受试者。PK总结人群包括在第8天具有可评估的XAV-19药代动力学特征的受试者。PK/PD总结人群包括符合PP人群和PK总结人群标准的受试者。
药代动力学分析将通过累积性、时不变性、稳态成就和剂量比例性的研究进行评估,采用方差分析模型,受试者的术语为随机效应,天数为固定效应。
处理协议不遵守的分析方法和处理缺失数据的统计方法{20c}
对于phase2a研究,本研究不实现归责。未接受两种剂量或随访至D8的患者将被更换。对于2b阶段,我们不期望缺少主要结果的数据。然而,如果患者被随访,那么数据将在最后已知日期被审查。次要疗效和安全性结果不使用归责。没有更换受试者的计划。
允许访问完整协议、参与者级数据和统计代码的计划
根据法国法律,研究结果将在监管机构的网站上公布。数据只在调查人员之间共享。但是,在当前研究中分析的数据集将在合理的要求下从通讯作者那里获得。此外,一旦研究的主要出版物发表,赞助者将立即将研究结果输入欧盟数据库,以保护知识产权。
监督和监测
协调中心和试验指导委员会的组成
由于B . Gaborit博士创建和协调的科学委员会,该议定书和试验得以实施。科学委员会的任务是:
DSMC成分的批准
询问有关研究项目进展、任何潜在问题和现有结果的信息
确保符合道德规范要求
进行研究的科学跟踪:保持研究目标的相关性和为实现这些目标而实施的方法的永久有效性
应协调研究者或DSMC的要求,就研究的良好开展、符合方案、任何特定于研究的程序和良好临床实践做出所有重要决定
决定完成研究项目所需的所有有关方案的修改(包括促进招聘的措施、提交规管文件前的方案修订、增加或关闭参与地点)
为了向所有调查人员和其他研究参与者提供信息,
为了确保与数据和生物样本访问相关的规则得到遵守,
确保与研究成果的交流和发表相关的规则得到遵守
会议纪要由项目负责人和科学委员会总统在每次会议后起草(至少详尽地列出讨论的问题、作出的决定以及提出的要点)。会议记录提交给出席会议的科学委员会成员审查和修改。会议记录由科学委员会总统确认。然后分发给科学委员会成员和被邀请参加会议的人,以及南特医院临床研究部主任。会议纪要在科学委员会下次会议开始时正式通过。
数据监测委员会的组成、作用和报告结构
DSMC的作用是审查试验的进展和积累的数据,以发现入选受试者早期安全问题的证据。DSMC将对正在进行的试验提出修改建议(见图2)。1而且2),并批准在第2a期每组内及在第2a期至第2b期之间继续进行下一步研究。
临床试验领域(疾病和方法学)的主管人员不参与研究。他们在研究期间被任命,并承诺参与并尊重数据机密性。
年度安全报告被发送到数据和安全监测委员会。如果SUSAR或SAE提出了特定的分析问题,或者在研究过程中出现了益处/风险方面的疑问,安全药理学负责人可能会要求委员会进行审查。
不良事件报告和危害{22}
在两个研究阶段,所有患者都将被密切监测总体生物学和临床安全性数据(例如,感染或恶性肿瘤)以及任何药物毒性。
根据规定,每个由患者报告或由研究者识别的AE必须收集并报告给发起人,一旦他意识到,如果它符合从纳入受试者到参与结束的严重性标准。
作为常规预防措施,参加本试验的患者必须在注射研究药物后至少观察2小时。评估患者输注反应的体征或症状(如低血压、缺氧、心动过速、发热、恶心、疲劳、头痛、肌痛和不适)。
审核试运行的频率和计划{23}
检查或审计可作为本次研究的一部分,由主办方或/和监管机构执行。检查人员将检查文件、后勤、记录和当局认为与临床试验有关的任何其他资源,这些资源可能位于试验现场。
与相关方(如试验参与者、伦理委员会)沟通重要议定书修正案的计划{25}
修订后的协议将是一个有日期的更新版本。如有需要,资料表及同意书应予以修订。主办项目经理将通知各研究中心,并将修订后的方案副本发送给所有主要研究人员,以添加到研究人员现场文件中。目前,更新后的协议是2020年7月17日的1.2版。所有提交/声明将由CHU Nantes的申办部门提交给法国监管机构(ANSM)和伦理委员会(Comité de Protection des Personnes Ouest VI)。申办部门的临床研究助理(CRA)将报告方案的任何偏差。它们将使用违约报告表格完整记录。
传播计划{31a}
这项研究的结果将在科学会议上发表或发表。
讨论
该研究将是首个评估多克隆人源抗sars - cov2抗体在COVID-19引起的中度肺炎中的药代动力学、药效学、安全性和有效性的随机对照试验。
虽然大多数感染SARS-CoV-2的患者病情轻微,但超过25%的covid - 19住院患者在住院的第二周出现急性呼吸窘迫,并出现严重的ARDS。被动抗体疗法是一种很有前途的治疗策略,它涉及给药抗体给予即时免疫以中和病毒入侵。
对于SARS-CoV-1,由于没有任何特异性治疗,死亡率很高,因此只能使用恢复期血浆进行被动免疫治疗[29].对于没有免疫力的患者,早期提供恢复期血浆似乎与更好的结果有关,特别是对于在疾病的前14天接受治疗的患者[22].
在COVID-19中,首批用于治疗住院患者的恢复期血浆报告表明,在最严重的形式下具有可接受的耐受性,具有潜在疗效[19]并在5000多名接受治疗的患者中评估安全性[30.].最近的报告表明,由IDSA领导的恢复期血浆可能在COVID-19的初始阶段有益,以支持在随机临床试验中进一步收集数据,以更好地评估其益处。
然而,难以获得含有足够中和抗体的等离子体导致了基于与“XAV-19”类似方法的创新治疗方法的发展。XAV-19的有效成分是纯化的高免疫抗sars - cov -2刺突RBD蛋白猪乙二醇人源化IgG的稳定溶液,具有中和活性。事实上,多克隆人源化抗sars - cov2有可能通过有效地冻结疾病过程,显著减少SARS-CoV-2在患者中引起的严重并发症。其他好处是可以减轻肺炎引起的损伤和其他与covid -19相关的损伤,如急性肾损伤(AKI)、心肌炎和继发性细菌感染。这种治疗有望缩短氧疗所需时间和住院时间,最大限度地减少与长时间住院有关的身体、心理和经济并发症。
XAV-19 igg是从转基因猪中生产的,与现有的多克隆抗体相比,具有以下特点和优势:(1)糖人源化,允许低天然免疫原性[15];(2)增强补体介导的细胞毒性[31].事实上,糖人源化猪IgG抗体具有Fc片段的3D结构,允许增加招募人类C1q蛋白和激活补体的能力;(3)缺乏可能的抗体依赖性增强(ADE),由于缺乏与人Fc受体的结合[32].ADE是指通过允许Fc受体依赖进入Fc受体阳性细胞(主要是巨噬细胞)来增强微生物的感染性;(4)与SARS-CoV-2尖刺分子结合;(5)对SARS-CoV-2的中和作用。
根据临床前数据,XAV-19与现有抗体疗法(迄今仅限于在恢复期血浆中输血)相比,预期的临床获益可能是相对于其他潜在的异体多克隆抗体治疗(正在开发中)的疗效和更好的耐受性。
试验状态
2a期的招募期已于2020年9月1日开始,并纳入了第一位患者。2a阶段已于2020年12月底完成,2b阶段已于2021年1月开始。
2020年8月4日,更新后的协议为1.4版。
缩写
- ACE2:
-
血管紧张素转换酶2
- 正面:
-
锁定增强
- AE:
-
不良事件
- ANSM:
-
Agence Nationale de Sécurité du Médicament et des producits de santé -法国监管机构
- ARDS:
-
急性呼吸窘迫综合征
- yann padova:
-
国家信息委员会Libertés -法国国家信息与自由委员会
- CP:
-
康复的等离子体
- CRA:
-
临床研究助理
- CRF:
-
病例报告表
- 爸爸:
-
双倍上升剂量
- 过程:
-
双倍固定剂量
- 出发:
-
数据和安全监测委员会
- eCRF:
-
电子病例报告表格
- ITTE:
-
治疗暴露的意向
- 新闻:
-
国家预警评分
- 垫:
-
药理活性剂量
- 帕金森病:
-
药效学
- PK:
-
药代动力学
- SAE:
-
严重不良事件
- 特别行政区:
-
严重不良反应
- “非典”:
-
严重急性呼吸系统综合症
- SOC:
-
护理标准
- SUSAR:
-
疑似意外严重不良反应
- WOCBP:
-
有生育潜力的妇女
参考文献
朱楠,张东,王伟,李霞,杨波,宋杰,等。2019年中国肺炎患者的新型冠状病毒。中华实用医学杂志,2015;29(4):344 - 344。
吴震,McGoogan JM。中国2019冠状病毒病(COVID-19)暴发的特征和重要教训:中国疾病预防控制中心72 314例报告摘要《美国医学协会杂志》上。2020; 323(13): 1239 - 42。
黄超,王勇,李霞,任玲,赵娟,胡勇,等。武汉地区新型冠状病毒感染患者临床特征分析《柳叶刀》杂志。2020;395:497 - 506。
Hamming I, Timens W, Bulthuis MLC, Lely AT, Navis GJ, van Goor H. SARS冠状病毒功能受体ACE2蛋白的组织分布。了解SARS发病机制的第一步。中华病理学杂志。2004;203:631-7。
Jeffers SA, Tusell SM, Gillim-Ross L, Hemmila EM, Achenbach JE, Babcock GJ,等。CD209L (L-SIGN)是严重急性呼吸综合征冠状病毒的受体。中国科学院学报(自然科学版)2004;101:15748-53。
徐震,石磊,王勇,张杰,黄磊,张超,等。COVID-19与急性呼吸窘迫综合征相关的病理结果《柳叶刀》呼吸医学2020;8:420-2。
林国良,McGinley JP, Drysdale SB, Pollard AJ。病毒性脓毒症的流行病学与免疫发病机制。Front Immunol. 2018;9[引自2020年7月27日]。可以从:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6170629/.
田松,胡伟,牛林,刘辉,徐辉,肖世勇。2例肺癌患者2019年早期新型冠状病毒肺炎的肺部病理。中华外科杂志。2020;15:7 - 4。
周峰,于涛,杜锐,范刚,刘勇,刘震,等。中国武汉成人COVID-19住院患者的临床病程和死亡危险因素:一项回顾性队列研究《柳叶刀》杂志。2020;395:1054 - 62。
秦超,周琳,胡震,张松,杨松,陶勇,等。中国武汉COVID-19患者免疫反应失调中国生物医学工程学报(自然科学版);
孙文杰,李文杰,李文杰,等。先前感染和被动转移中和抗体可以防止严重急性呼吸综合征冠状病毒在小鼠呼吸道的复制。中国病毒学杂志,2004;78:3572-7。
李伟,Moore MJ, Vasilieva N, Sui J, Wong SK, Berne MA,等。血管紧张素转换酶2是SARS冠状病毒的功能性受体。大自然。2003;426(6965):450 - 4。
闫锐,张颖,李艳,夏玲,郭艳,周强。人ACE2全长识别SARS-CoV-2的结构基础。科学。2020;367:1444-8。
范霍夫,杜沃欧,鲁斯,罗耶,P-J, Evanno G, Ciron C,等。猪糖化多克隆抗体对SARS-CoV-2具有高中和能力。bioRxiv。2020; 07.25.217158。https://doi.org/10.1101/2020.07.25.217158.
李志强,李志强,李志强,等。兔抗胸腺细胞多克隆IgGs治疗后,非免疫抑制患者抗gal和抗neu5gc反应。移植。2017;101:2501-7。
鲁思J,西龙C,李立龙E,伊瓦诺G,罗耶P-J,布兰乔G,等。下一代猪低免疫原性抗淋巴细胞免疫球蛋白显示T淋巴细胞相对于Treg和Breg的选择性耗竭。2019:https://www.xenothera.com/wp-content/uploads/2019/11/Selective-depletion-Rousse-et-al.-ESOT2019.pdf.2020年7月27日访问。
苏耀勇,郑毅,黄瑞,许世德,李志强,曾建科,等。SARS患者恢复期血浆与持续大剂量甲基强的松龙治疗的回顾性比较临床微生物感染。2004;10:676-8。
沈超,王震,赵峰,杨勇,李娟,袁杰,等。应用恢复期血浆治疗5例新型冠状病毒肺炎重症患者《美国医学协会杂志》上。2020; 323(16): 1582 - 9。
李玲,张伟,胡勇,童霞,郑松,杨娟,等。恢复期血浆治疗对严重危及生命的COVID-19患者临床改善时间的影响:一项随机临床试验《美国医学协会杂志》上。2020; 324:460。
Smith GB, Redfern OC, Pimentel MA, Gerry S, Collins GS, Malycha J, Prytherch D, Schmidt PE, Watkinson PJ。国家预警评分2 (NEWS2)。临床医学(伦敦)。2019; 19(3): 260。
段凯,刘波,李超,张辉,于涛,曲娟,等。恢复期血浆治疗对重症COVID-19患者的疗效观察。中国自然科学学报(自然科学版)2020;
郑勇,黄锐,苏耀勇,王伟,李志强,吴明林,等。香港沙士病人使用恢复期血浆治疗的情况。中华临床微生物学杂志2005;24:44-6。
Cotte L, Dellamonica P, Raffi F, Yazdanpanah Y, Molina j m, Boué F,等。BMS-986001(一种新型HIV NRTI) 10天单药治疗HIV-1感染者的安全性、耐受性、抗病毒活性和药代动力学的随机安慰剂对照研究中国免疫缺陷综合征杂志,2013;
闵s, Sloan L, DeJesus E, Hawkins T, McCurdy L, Song I,等。dolutegravir对hiv -1感染成人10天单药治疗的抗病毒活性、安全性和药代动力学/药效学艾滋病。2011; 25:1737-45。
Markowitz M, morares - ramirez JO, Nguyen B-Y, Kovacs CM, Steigbigel RT, Cooper DA,等。一种新型HIV-1整合酶抑制剂MK-0518的抗逆转录病毒活性、药代动力学和耐受性,在未接受治疗的HIV-1感染者中作为单药治疗10天。获得性免疫缺陷综合征2006;43:59 - 15。
Schoenfeld哒。比例风险回归模型的样本量公式。生物识别技术。1983;(2):499 - 503。
Cortés J, González JA, Campbell MJ, Cobo E.根据中位生存时间的比值估计危险比,但具有相当大的不确定性。中华临床流行病学杂志。2014;67:1172-7。
Karanicolas PJ, Farrokhyar F, Bhandari M.外科研究的实用技巧:致盲:谁,什么,什么时候,为什么,如何?中华实用外科杂志,2010;29(5):344 - 344。
张建生,陈建涛,刘永祥,张志生,高红,刘勇,等。SARS恢复期血清中和抗体效价的血清学调查。中华医学病毒学杂志,2005;
Joyner MJ, Wright RS, Fairweather D, Senefeld JW, Bruno KA, Klassen SA,等。5000例COVID-19恢复期血浆的早期安全性指标中华临床医学杂志,2020;
李Y, Johnson JB, Parks GD。副流感病毒5上调CD55的表达,产生对补体介导的中和抗性增强的病毒粒子。病毒学。2016;497:305-13。
在泰特罗农协。COVID-19是否接受其他冠状病毒的ADE ?微生物感染,2020;22:72-3。
国际医学期刊编辑委员会。国际医学期刊编辑委员会(ICMJE):提交生物医学期刊稿件的统一要求:生物医学出版物的写作和编辑。Haematologica。2004;89(3):264。
确认
本研究由公共投资银行(也称为法国BPI)在“未来投资”计划(programme d 'Investissements d 'Avenir)框架下支持。
感谢所有临床药理学部门(南特大学医院)对该方案的支持。
感谢POLYCOR研究小组:Eric Dailly, Thomas Guimard, Cécile Braudeau, Denis Malvy, Jean-François Faucher, Gabriela Illes Hajnal, Marc-Olivier Vareil, Mariam Roncato-Saberam, Laurent Vacher, Charlotte Biron, Maeva Lefebvre, Géraldine Gallot, Paul Le Turnier, Deschanvres, Raphael Lecomte, Marie Chauveau, Anne-sophie Lecompte, Matthieu Grégoire, Ronan Bellouard, Guillaume Deslandes, Zineb Ouazene, Diane Bollens, Thibault Chiarabani, Jessica krase -Le Garrec, Agathe Becker, Pierre Chauvelot, Anne Conrad, Tristan Ferry,Patrick Miailhes, Cécile Pouderoux, Sandrine Roux, Claire Triffault-Fillit。
作者贡献{31b}
研究人员将遵循国际医学期刊编辑委员会(ICMJE)的规则和指导方针[33].在实践中,科学委员会将是该出版物的作者之一,研究人员也将在试验中纳入最多的患者。BG, FR和AP撰写了手稿。LB、KB、FA、BV、LF、SB、ALT、MAV协助起草稿件。BG、OD、BV和FR设计了试验。BG, PM, FR, JO, MLB, FA, OD, VF, KL, AO, FR, BV, EV, RJ, SB, ND, LB, LF撰写实验药物的方案和/或文件,并协助起草手稿。LB和KB协调了议定书的提交和(1)卫生部投标和(2)监管当局的后续工作,并协调了试验。MAV、ALT和EV在方案中编写了方法学/统计学分析。BG、PM、FR、FA、FV和VD参与患者登记和随访。AJ协助进行试验的药物警戒。 All authors have contributed to writing the manuscript as detailed and no professional writers have been involved. The authors read and approved the final manuscript.
资金{4}
本研究由公共投资银行(也称为法国BPI)在“未来投资”计划(programme d 'Investissements d 'Avenir)框架下支持。这个资助机构在研究设计中没有任何作用;数据的收集、管理、分析和解释;报告的撰写;以及提交报告发表的决定。
数据和资料的可获得性{29}
数据共享不适用于本文,因为在当前的研究中没有生成或分析数据集。研究人员将分享最终试验的全部数据集。在测试过程中收集的数据可以按照CNIL的要求进行电子处理(符合参考方法MR001)。
作者信息
作者及隶属关系
财团
相应的作者
道德声明
伦理批准并同意参与{24}
所有参与研究的患者都获得了关于该试验的口头和书面信息,并签署了知情同意书。该临床研究于2020年7月7日由伦理委员会(Comité de Protection des Personnes West VI - West VI人身保护委员会)提交并批准,参考文献:CPP Ouest 6 - CPP 1305 ME1。
发表同意{32}
的补充材料文件包含患者在纳入试验前签署的法文知情同意书(方案:1.2版,2020年7月17日更新)。
利益竞争{28}
FR从Gilead Sciences和Xenothera获得了咨询费。OD和BV是Xenothera的员工和股东。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
Gaborit, B., Vanhove, B., Vibet, MA。et al。XAV-19在covid -19诱导的中度肺炎患者中的安全性和有效性评估:一项随机、双盲、安慰剂对照的2期(2a和2b)试验的研究方案试用22, 199(2021)。https://doi.org/10.1186/s13063-021-05132-9
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13063-021-05132-9
关键字
- 新型冠状病毒肺炎
- Anti-SARS-CoV-2抗体
- 温和的肺炎
- 免疫疗法
- 随机对照试验
- 第二阶段