摘要
背景
血流感染(BSIs)是肝移植(LT)最致命的并发症之一。自然杀伤细胞(NK)是先天免疫的重要组成部分,在感染和癌症中起着至关重要的作用。活化NK细胞过继转移有可能减少lt后感染,包括bsi。
方法
在这项前瞻性、单中心、介入性、单臂、历史对照的I/II期研究中,37名LT接受者将入选。患者将在肝移植后3 - 5天接受单次供体肝来源的NK细胞输注。
讨论
主要终点是lt后第一个月内bsi的发生率。次要终点包括总生存期、不良事件、免疫反应、肝细胞恶性肿瘤或新生恶性肿瘤以及感染性疾病的发生率。
试验注册
本研究前瞻性注册号码为UMIN000019183 (https://center6.umin.ac.jp/cgi-open-bin/ctr/ctr_view.cgi?recptno=R000022074)于2015年11月1日及jRCTa0601900362020年2月27日。
背景
尽管活体供肝移植(LDLT)的围手术期管理和手术技术已经进步,但感染并发症是LDLT后不久死亡的最常见原因[1].血流感染(BSIs)仍主要与发病率和死亡率相关,据报道BSIs的发病率约为10 - 40% [2,3.,4,5].因此,需要有效的预防和治疗。
自然杀伤(NK)细胞在抵御感染和肿瘤的第一道防线上发挥着至关重要的作用[6].肝脏中含有许多NK细胞,这些细胞对肝癌细胞表现出强烈的细胞毒性,并在人和小鼠中产生大量细胞因子[7,8].我们之前报道了肝源性NK细胞用于肝细胞肝移植后预防肝细胞肝癌的临床免疫治疗的安全性和有效性[9,10].在本临床试验的亚组分析中,NK治疗组的bsi显著降低[11].我们报道了一种涉及肝移植术后血流感染的FcgRIIIa单核苷酸多态性[12].我们还发现NK细胞的ADCC(抗体依赖细胞毒性)结合易损性是一个促成因素,并且这种易损性可以通过NK细胞治疗克服[13].
因此,我们进行了一项过继免疫治疗方法的临床试验,使用从同种异体肝移植灌注液中提取的淋巴细胞来预防肝移植后的BSIs。
方法/设计
研究设计
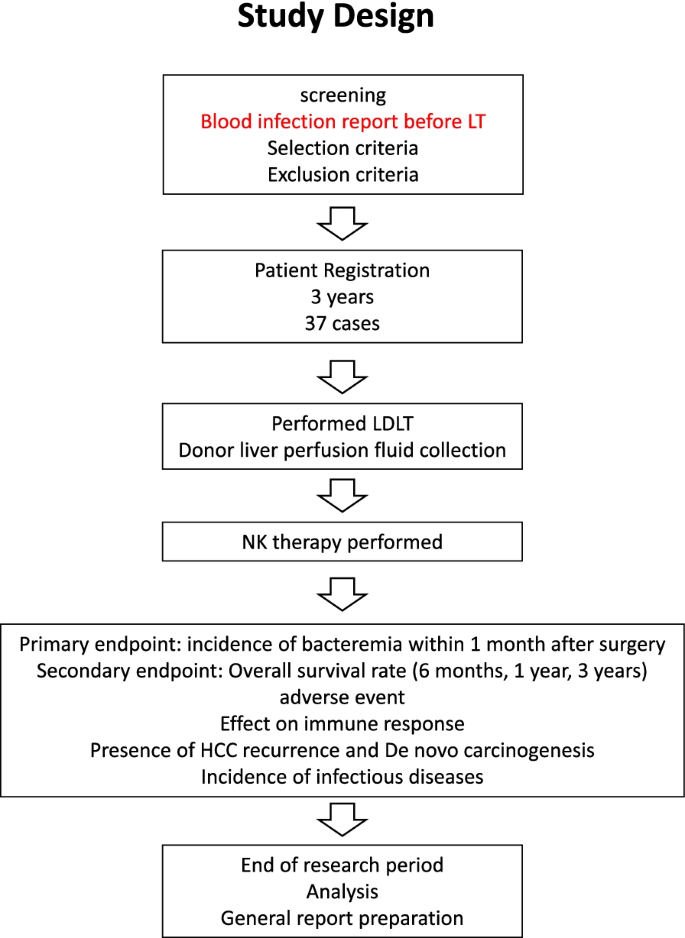
这项单中心、开放标签、I/II期研究旨在获得活体供肝来源的NK细胞免疫治疗预防LDLT后BSI的证据。这项研究正在日本广岛的广岛大学医院进行。符合资格标准的参与者将被纳入研究。研究设计如图所示。1.
37名患者将被纳入这项研究。符合条件的患者接受标准的肝移植,并将在移植后3 - 5天注入富集的供肝NK细胞。根据以下细胞剂量,将纳入的患者分为两组:低剂量组(10 - 100⋅106细胞);高剂量组(100 ~ 1000⋅106细胞/体),根据我们初步研究的结果[14].本研究旨在评估肝移植后静脉注射供肝NK细胞的安全性,并评估该免疫疗法可能的临床疗效。免疫抑制包括3 - 6个月的逐渐减少皮质类固醇和钙调神经磷酸酶抑制剂(通常是他克莫司),与霉酚酸酯联合或不联合使用。收集并分析围手术期给予的预防性抗菌药物和术后给予的免疫抑制剂。主要终点是lt后第一个月BSI的发生率。次要终点如下:
- 1.
总生存期(术后6个月,1年和3年)。
- 2.
不良事件:本临床研究中发生的不良事件类型、严重程度、发生频率、持续时间、因果关系。
- 3.
对免疫反应的影响:通过CFSE-MLR评估供者特异性免疫反应性(术后1、2、3和4周),供者特异性抗体检测(年度筛查),排斥反应发生率,以及受者外周血NK细胞活性评估。
- 4.
肝细胞癌复发(仅肝细胞癌病例)和从头癌变的存在和时间。
- 5.
传染病发病率(细菌感染、巨细胞病毒感染、真菌感染和遗传多态性分析)。
入选标准
接受者(再生医学接受者)的选择标准如下:
- 1.
接受部分肝移植治疗难治性无代偿性肝硬化的患者。
- 2.
患者在同意时年龄≥20岁。
- 3.
经病人或替代医生书面同意的病人。
细胞供体(供体)的选择标准如下:
- 1.
符合肝移植研究小组“活体供体手术指南”标准并作为肝供体接受活体供体手术的患者。
- 2.
在获得同意时,患者必须≥20岁。
- 3.
从供者或代孕者处获得书面同意,从供者肝移植物的灌注液中制备肝源性NK细胞并将其注射给受体的患者。
排除标准
豁免受助人的标准如下:
- 1.
接受reLT的患者。
- 2.
接受死亡供体肝移植的患者。
- 3.
其他患者经主研究员或副研究员判断不适合参与本临床研究。
细胞供体(供体)的排除标准如下:
- 1.
接受肝移植治疗的患者。
- 2.
主研究员或副研究员判断患者不适合参加本临床研究。
样本量计算
在之前的一项研究中,比较了2004年1月至2009年12月进行的114例活体肝移植中,NK治疗组的21例患者和匹配的非NK治疗组的21例患者在LDLT后1个月的BSI发生率,NK治疗组的BSI发生率为10%,而非NK治疗组的BSI发生率为30% [11].基于这些结果,将LDLT后1个月NK治疗中bsi的预期发生率设定为10%,在5%显著性水平(双方)下检验非NK治疗中30%发生率的阈值所需的病例数计算为34。考虑到入组时的退学病例,我们将目标病例数设置为37例。
治疗
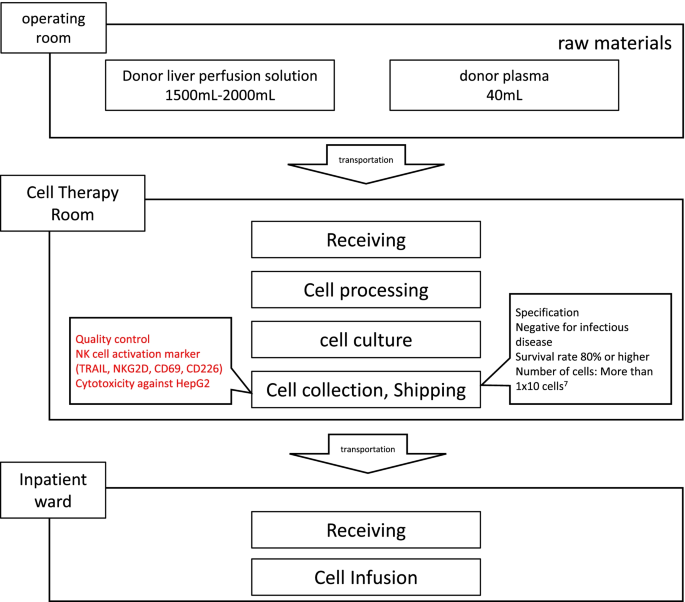
细胞制备如前所述[14].简单地说,在器官恢复后,肝脏通过门静脉灌注2l威斯康星大学溶液在后面的桌子上。使用Ficoll-Hypaque密度梯度离心收集肝脏单个核细胞,并与1000 U/mL人重组白细胞介素(IL)-2 (Teceleukin, Shionogi, Japan)在X-VIVO 15培养基(LONZA, Walkersville, MD)中培养,补充100µg/ mL庆大霉素(APP Pharmaceuticals, Schaumburg, IL), 10%人AB血清(Valley Biomedical, Winchester, VA) 3 - 5天,以启动具有增强抗肿瘤特性的NK细胞。预防移植物抗宿主病(GVHD),即使CD3失活+在细胞收获前1天,将抗cd3单克隆抗体(mAb) (Miltenyi, Germany)加入培养基(100µg/mL)。最小为1 × 107细胞活力为> 80%的细胞才能释放NK细胞产物用于输注。经过质量控制验证,包括革兰氏染色、培养、内毒素和支原体试验,所有未分离的细胞,如上所述处理并定义为最终的NK细胞产品,在细胞收获当天通过静脉注射注入患者体内(图2)。2).在给药前后进行定期血液检查、各种培养试验、x光检查以及外周血中NK细胞表型和细胞毒活性的测量。
疗效随访和评估
在肝移植后的第一个月内,患者每周进行血液培养和发热检查。术后3年,患者接受生存检查、不良事件检查、感染和恶性肿瘤检查。
免疫学评估
所有流式细胞仪(FCM)分析均在BD LSR Fortessa、FACS Canto II流式细胞仪和FACSCalibur流式细胞仪(BD Biosciences, San Jose, CA)上进行。为了检测表面表型,白细胞用单克隆抗体染色:抗CD3(克隆HIT3a;BD Biosciences - Pharmingen),肿瘤坏死因子相关凋亡诱导配体(克隆RIK-2;eBioscience), NKG2D(克隆1D11;(克隆FN50;(克隆11A8;bilegend)和CD56(克隆B159;BD Biosciences - Pharmingen)。数据分析使用FlowJo软件(Tree Star, Inc.)。亚什兰或)。 A51cr释放试验如前所述[7],以HepG2肿瘤细胞(日本癌症研究资源库)为靶点。简单地说,51将cr标记的靶肿瘤细胞添加到圆形底96孔微量滴度板(BD Biosciences - Discovery Labware)中的效应细胞中,在37°C下作用4小时。特定的百分比51Cr释放量计算公式为:%细胞毒性=[(实验释放cpm -自发释放cpm)/(最大释放cpm -自发释放cpm)] × 100。所有测定都是一式三份。
不良反应的安全评估和报告
在细胞给药后,研究者将记录所有事件,无论细胞给药是否相关,包括lt后的并发症。如果发生与长时间住院或死亡相关的严重并发症,研究者将立即向再生医学委员会和厚生劳动省报告。
讨论
BSI是肝移植术后最严重的并发症之一,影响预后。为了满足这一高医疗需求,我们引入了使用供体肝NK细胞的免疫疗法来评估肝移植后患者的安全性和有效性。
60%到80%的肝移植受者会在手术的第一年经历某种类型的感染。这些感染大多数是可以治愈的;然而,有些是致命的[15,16].据报道,BSI是30%移植后死亡的原因。特别是移植后第一个月内感染的频率最高[17].
自2006年以来,日本广岛大学首次将供体肝来源的NK细胞免疫治疗应用于LDLT [10].这种NK疗法涉及GVHD和急性排斥反应的风险,因为使用了异基因细胞。抗cd3抗体用于消除异源性T细胞[14].在本试验中,24名LT受者安全接受NK细胞输注,结果可接受,即无严重不良事件,包括GVHD、急性排斥反应和无复发,总体生存令人满意[9].我们分析了2004年至2009年在广岛大学医院进行的114例LDLT患者早期术后bsi的发生率。使用倾向评分匹配法对背景因素进行调整后,NK细胞输注组bsi的发生频率明显低于未接受NK细胞输注的患者[11].免疫抑制增加感染风险的论点是被接受的。相比之下,对微生物的免疫监测是通过协调先天免疫和获得性免疫来实现的,目前LT后使用的免疫抑制药物优先抑制获得性成分,如T细胞和B细胞[18].因此,先天免疫,包括NK细胞,在LT设置的预防活动中起着主要作用。我们之前已经证明,编码FcγRIIIa的基因多态性(由NK细胞表达并介导天然抗体定向的先天免疫活性)可能是严重细菌感染的易感因素,并预测LT后的死亡率[12].尽管NK细胞发挥了重要作用,但在需要肝移植的终末期肝病患者中,已观察到NK细胞的功能损害和数量减少[7,19,20.].对于可能处于这种免疫困境的肝移植受者,增强功能性激活的肝NK细胞可能是一种有前途的方法。然而,获取肝脏来源的NK细胞的唯一技术是肝移植,其中肝脏可以被冲洗。我们目前正在研究从外周血或骨髓cd34阳性干细胞中产生肝源性NK细胞的技术,以应用于肝移植以外的疾病。
数据和材料的可用性
试验和数据收集正在进行中。临床数据集可从通讯作者处获得。
缩写
- BSI:
-
血液感染
- FCM:
-
流式细胞术
- 移植物抗宿主病:
-
移植物抗宿主病
- 肝:
-
活体供肝移植
- LT:
-
肝移植
- NK:
-
自然杀伤细胞
参考文献
巴甘纳特F, Beal EW, Tumin D, Azoulay D, Mumtaz K, Black SM,等。肝移植术后早期死亡:确定病程和原因。手术。2018;164(4):694 - 704。
桑托斯CA,霍奇基斯RS,查普曼WC,奥尔森MA。肝移植受者多中心回顾性队列血流感染流行病学研究直接移植。2016; 2 (3): e67。
朴杰,金宝文,崔海杰,洪帅,朴志生,崔志华,等。活体供肝移植后早期菌血症的危险分层:一项回顾性观察队列研究。BMC外科杂志2020;20(1):2。
饭田T,海道T,八木S,吉泽A,畑K,水本M,等。成年活体肝移植受者的移植后菌血症。肝脏移植杂志,2010;16(12):1379-85。
池上T, Shirabe K, Yoshiya S, Yoshizumi T, Ninomiya M,内山H,等。活体肝移植后细菌性败血症:早期肠内营养的影响。中华口腔外科杂志,2012;29(3):389 - 397。
维维耶E, Tomasello E, Baratin M, Walzer T, Ugolini S.自然杀伤细胞的功能。中华免疫杂志2008;9(5):503-10。
Ishiyama K, Ohdan H, Ohira M, Mitsuta H, Arihiro K, Asahara T.人类肝脏和周围自然杀伤细胞对肝细胞癌的细胞毒性差异。43肝脏病学。2006;(2):362 - 72。
大平M,大丹H,三田H,石山K,田中Y,五十岚Y,等。表达trail的自然杀伤细胞过继移植可防止肝细胞癌部分切除后复发。移植。2006;82(12):1712 - 9。
大ira M, Hotta R, Tanaka Y, Matsuura T, Tekin A, Selvaggi G,等。确定死亡供肝自然杀伤细胞输注到肝移植受者的安全性和可行性的初步研究。中国生物医学工程杂志,2002,23(3):349 - 349。
大平M,石山K,田中Y, Doskali M,五十岚Y,田代H,等。用肝移植物来源的淋巴细胞进行过继免疫治疗可诱导人类和人源化小鼠肝移植后抗hcv活性。中华临床医学杂志。2009;29(11):366 - 366。
田代H,石山K,大平M,五十岚Y,田原H,井出K,等。肝移植淋巴细胞辅助免疫治疗对活体供肝移植菌血症的影响。移植。2011;92(5):575 - 80。
清水S,田中Y,田泽H, Verma S, Onoe T,石山K,等。fc - γ受体多态性易导致肝移植术后感染并发症。中华外科杂志,2016;16(2):625-33。
清水山,大平M,田中Y,井出K,田原H,黑田S,等。过继免疫治疗克服了肝移植后fc- γ受体多态性导致的血流感染的遗传易感性。Am J Transplant, 2022年。(新闻)
大ira M, Nishida S, Tryphonopoulos P, Tekin A, Selvaggi G, Moon J,等。临床尺度分离白介素-2刺激的肝脏自然杀伤细胞治疗肝移植合并肝细胞癌中国生物医学工程学报,2012;21(7):1397-406。
Colonna JO 2nd, Winston DJ, Brill JE, Goldstein LI, Hoff MP, Hiatt JR,等。肝移植的感染并发症。中华外科杂志,1998;23(3):344 - 344。
Kawecki D, Chmura, Pacholczyk M, Lagiewska B, Adadynski L, Wasiak D,等。肝移植术后早期细菌感染:病原及其易感性。医学科学监测:国际医学实验临床杂志2009;15(12):CR628-37。
鱼人JA,鲁宾RH。器官移植受者的感染。中华实用医学杂志,1998;29(3):344 - 344。
原田N,岛田M,冈野S, Suehiro T,宗岛Y,富田Y,等。IL-12基因治疗是免疫抑制小鼠肝细胞癌的有效治疗策略。中华免疫杂志2004;173(11):6635 - 444。
Balch CM, Tilden AB, Dougherty PA, Cloud GA, Abo T.结肠癌患者自然杀伤淋巴细胞异常的异质性。手术。1984;95(1):63 - 70。
蔡林,张震,周林,王辉,付杰,张松,等。肝细胞癌患者循环NK细胞和肝内NK细胞功能损害及其机制临床免疫杂志2008;29(3):428-37。
确认
我们要感谢Editage.com对这篇手稿的校对。
资金
本研究由AMED(批准号JP21fk0210051)和JSPS KAKENHI(批准号JP20K09104)资助。
作者信息
作者及隶属关系
贡献
MO参与试验设计,进行NK治疗,并撰写手稿。YI、KS、KI、RN、NT制定研究方案,进行NK治疗。HT、KI和TK协助准备研究方案并进行手术操作。YT协助制定研究方案,并进行免疫学分析。HO设计了试验,准备了研究方案,并进行了通信。所有作者均已阅读并批准最终稿。
相应的作者
道德声明
伦理批准并同意参与
该I期临床试验由广岛大学再生医学特别委员会批准,并在日本临床试验注册中心注册(jRCTa060190036)。这项试验是在《赫尔辛基宣言》之后设计和进行的。所有患者在入组前均获得书面知情同意书。
发表同意书
不适用。
相互竞争的利益
本手稿的作者没有利益冲突需要披露。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.
关于本文
引用本文
大平,M,今冈,Y,佐藤,K。et al。使用供肝移植源性自然杀伤细胞的过继免疫治疗预防肝移植后血流感染的I/II期研究:一项研究方案翻译医疗公社7, 19(2022)。https://doi.org/10.1186/s41231-022-00126-4
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s41231-022-00126-4
关键字
- 免疫疗法
- 天然杀伤细胞
- 肝移植
- 血液感染