人体组织样本gydF4y2Ba
15名MSA患者,15名PD患者,5名对照组和5名核上进行性麻痹患者,根据明确的神经病理诊断,从大学健康网络-神经退行性脑收集(UHN-NBC,多伦多,加拿大)和Navarrabiomed脑库(西班牙潘普洛纳)中选择。死亡年龄,性别和完整的神经病理检查列在附加文件中gydF4y2Ba1gydF4y2Ba:表S1。采集人脑解剖组织时需征得患者或其亲属的知情同意,并经当地机构审查委员会批准。这项研究得到了大学卫生网络研究伦理委员会(no . 20-5258)的批准。在纳入研究之前,根据神经退行性疾病和共同病理的诊断标准进行了系统的神经病理检查[gydF4y2Ba20.gydF4y2Ba].对侧半球在尸检时被冠状切片,并立即冷冻并在−80°C保存。使用4毫米的脑组织打孔器,对以下区域进行微观解剖:前扣带皮层、前扣带白质、额叶皮层、额叶白质、壳核、苍白球、杏仁核、海马体、颞叶皮层、颞叶白质、黑质(SN)、脑桥基底和小脑白质。所有冲子都储存在低蛋白结合管中(Eppendorf, Hamburg, Germany),立即闪冻并在- 80°C下储存。gydF4y2Ba
蛋白质的提取gydF4y2Ba
对于PBS可溶部分,将40-50 mg冷冻的微解剖组织在湿冰上解冻,然后立即在温和- macs Octo Dissociator (Miltenyi BioTec, Auburn, CA)中均质500 μl PBS中加入蛋白酶(Roche, Basel, Switzerland)和磷酸酶抑制剂(Thermo Scientific, Waltham, MA)。将匀浆转移到1.5 ml的低蛋白结合管(Eppendorf)中,在10,000下离心gydF4y2BaggydF4y2Ba如前所述,在4°C下加热10分钟[gydF4y2Ba21gydF4y2Ba].然后,收集上清液,并在0.5 ml低蛋白结合管(Eppendorf)中进行混叠,以避免过度的冻融循环。如前所述,使用1克冷冻脑组织从MSA患者的三个大脑区域(小脑、壳核和额叶皮层)中提取萨科齐不溶性物质[gydF4y2Ba9gydF4y2Ba].采用双辛酸蛋白(BCA)测定法(Thermo Scientific)测定所有等分物的总蛋白浓度。gydF4y2Ba
组织学分析gydF4y2Ba
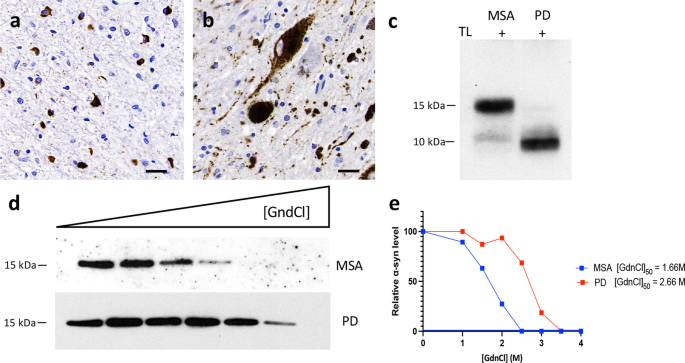
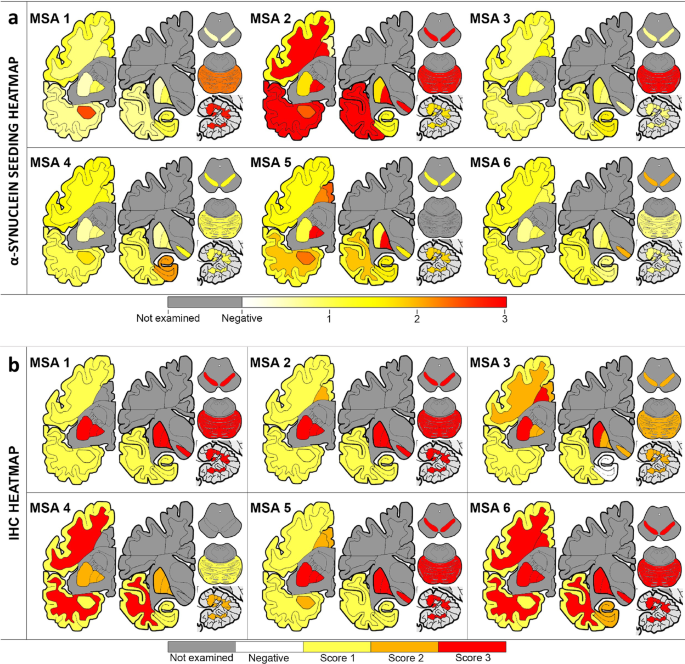
福尔马林固定的4微米厚的石蜡包埋组织切片,包含选择用于微解剖的13个解剖区域(见上文)。除Hematoxylin和Eosin-Luxol Fast Blue外,小鼠聚集α-synuclein (5G4;1:4000;Roboscreen,莱比锡,德国),硝化突触核蛋白(Syn514;1:20 00;Biolegend, San Diego, CA), c端截断的x-122 α-synuclein (A15127A;1:20 00;bioolegend)和磷酸化-α-synuclein (pSyn#64;1:10,000;采用FUJIFILM Wako Pure Chemical Corporation,大阪,日本)进行免疫组化。 To map the co-pathology, the following mouse monoclonal antibodies were used: anti-tau AT8 (pS202/pT205; 1:1000; Thermo Scientific), anti-phospho-TDP-43 (pS409/410; 1:2000; Cosmo Bio, Tokyo, Japan) and anti-Aβ (6F/3D; 1:50; Dako, Santa Clara, CA). The DAKO EnVision detection kit, Peroxidase/DAB, Rabbit/Mouse (Dako) was used to visualize the antibody staining. For comparison of different α-synuclein antibodies, immunostained sections against nitrated, truncated, phosphorylated, and aggregated (5G4) α-synuclein were scanned using Tissuescope™ and were cropped with the HuronViewer™ (Huron, Saint Jacobs, Canada). Images were taken from the exact same location of the putamen and cerebellum across the different antibodies. Initially, 100 immunoreactive oligodendrocytes from each antibody, region and case with visible nucleus were optically dissected using Photoshop (2021, Adobe, San Jose, CA). Using Image J (NIH, Bethesda, MD), the minimum and maximum areas (px2gydF4y2Ba)的100个内含物被记录。测量了单位夹杂物的黑点密度。5G4染色,采用α-突触核蛋白免疫组化方法检测上述13个脑区α-突触核蛋白聚集量、GCI和神经元细胞质包涵体(NCI)负荷。对于半定量分析,我们使用了4点量表:0,缺席;1、温和;2、温和;3、严重的,如前所述[gydF4y2Ba22gydF4y2Ba].gydF4y2Ba
ELISAgydF4y2Ba
人α-Synuclein Patho和Total elisa试剂盒(Roboscreen,莱比锡,德国)根据制造商的方案使用,如前所述[gydF4y2Ba23gydF4y2Ba].gydF4y2Ba
SDS-PAGE和免疫印迹gydF4y2Ba
凝胶电泳使用4%-12%或12%的Bolt Bis-Tris Plus凝胶(Thermo Scientific)进行。将蛋白质转移到0.45 μm聚偏氟乙烯膜上,在35 V下放置60 min。蛋白质通过0.4% (gydF4y2BavgydF4y2Ba/gydF4y2BavgydF4y2Ba)多聚甲醛在PBS中室温孵育30分钟,摇晃。膜在室温下在阻塞缓冲液中阻塞60分钟(5% [gydF4y2BawgydF4y2Ba/gydF4y2BavgydF4y2Ba]脱脂牛奶中1× TBST (TBS和0.05% [gydF4y2BavgydF4y2Ba/gydF4y2BavgydF4y2Ba]吐温-20)),然后与针对α-synuclein蛋白15-123氨基酸的一抗(1:10 000稀释,参考:610786,BD Biosciences, Franklin Lakes, NJ)在4℃下孵育过夜[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba24gydF4y2Ba],在阻挡缓冲液中稀释。然后用TBST清洗膜三次,然后在室温下用1:10 000稀释的山葵过氧化物酶偶联二抗(参考:172-1011,Bio-Rad, Hercules, CA)在阻断缓冲液中孵育60分钟。再用TBST冲洗三次后,使用Western Lightning增强化学发光Pro (PerkinElmer, Waltham, MA)进行免疫印迹,并使用x射线胶片或LiCor Odyssey Fc系统成像。gydF4y2Ba
RT-QuIC检测和缓冲液制备gydF4y2Ba
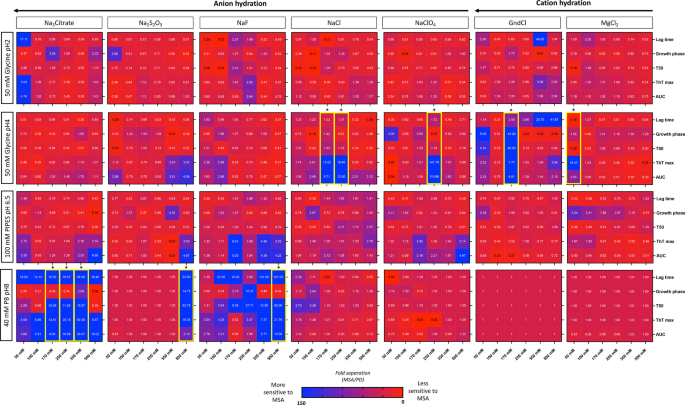
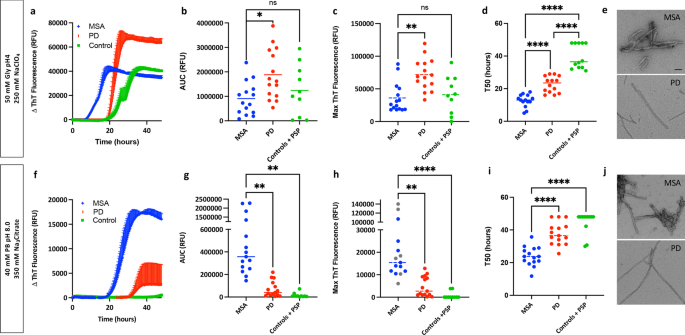
RT-QuIC反应在384孔透明底板中进行(Nunc, NY)。重组α-突触核蛋白(rPeptide, Athens, GA)从−80°C存储解冻,在hplc级水中重建(Sigma, St. Louis, MI),并通过100 kda自旋过滤器(Thermo Scientific)以500-µl的量过滤。所有用于反应缓冲液的试剂均购自Sigma。再取生物样品10 μl (pbs可溶性部分总蛋白5 μg)加入反应缓冲液20 μl、50 μM ThT 10 μl、单体重组α-突触核蛋白0.5 mg/ml 10 μl的孔中。在每个培养皿中分别加入阳性(1 μg α-synuclein preformed fibrils (rPeptide))和阴性(去离子水)对照。为保证RT-QuIC的重现性,对不同运行的阳性对照信号进行比较时,变异系数不大于20%。将平板密封,在BMG flustar Omega平板阅读器中37°C孵育,周期为1分钟震动(400转/分双轨)和14分钟休息。荧光测量(450±10 nm激发和480±10 nm发射,底部读数)每15分钟进行一次,持续72 h。gydF4y2Ba
构象稳定性测定(CSA)gydF4y2Ba
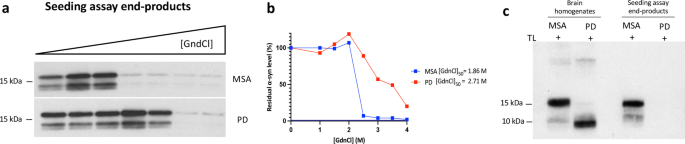
将20微升的2×盐酸胍(GdnCl)原液加入等量的pbs -可溶性脑匀浆或rt - quic衍生的α-突触核蛋白原纤维中,得到最终的GdnCl浓度0,1,1.5,2,2.5,3,3.5和4 M,如前所述[gydF4y2Ba24gydF4y2Ba].简单地说,PBS可溶性的大脑样本在室温下摇晃120分钟(800转),然后在PBS中稀释到0.4 M GdnCl。10万下高速超离心gydF4y2BaggydF4y2Ba在4℃下重悬60 min,在1× LDS负载缓冲液中煮沸10 min。通过SDS-PAGE和免疫印迹法测定残留α-突触核蛋白的水平,如上所述。使用ImageJ进行密度测量,将数值归一化到强度最高的样品,设置为100%。GdnClgydF4y2Ba50gydF4y2Ba在GraphPad Prism (v9, San Diego, CA)中,使用s型剂量-响应(变斜率)方程,通过非线性回归确定了50%团聚体溶解时的GdnCl浓度,其顶部和底部值分别固定为100和0。gydF4y2Ba
嗜热菌蛋白酶消化gydF4y2Ba
如前所述,进行热溶素消化[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba24gydF4y2Ba],只做了一些小修改。在pbs -可溶性脑匀浆中加入50 μg/ml的热熔素。rt - quic衍生的α-突触核蛋白原纤维用含5 μg/ml热熔素的1 × PBS稀释。样品在37°C下连续振荡(600 rpm)孵育60分钟。在EDTA最终浓度为2.5 mM时停止消化,并在100,000下进行超离心gydF4y2BaggydF4y2Ba在4°C下放置60分钟。弃上清,颗粒重悬于1× LDS缓冲液中,SDS-PAGE分析,免疫印迹,如上所述。gydF4y2Ba
电子显微镜gydF4y2Ba
将含有不同rt - quic衍生的α-突触核蛋白原纤维的等分物(5 μl α-突触核蛋白原纤维制品)加载到刚放电的400目碳涂层铜栅格上(电子显微镜科学,哈特菲尔德,PA),吸附1分钟。干燥后,使用Talos L120C透射电子显微镜(Thermo Fisher)在200 kV加速电压下观察栅格。使用Eagle 4kx4k CETA CMOS相机(赛默飞世尔)记录电子显微照片。gydF4y2Ba
统计数据gydF4y2Ba
使用GraphPad Prism (v.9)进行统计学分析,显著性阈值为gydF4y2BaPgydF4y2Ba= 0.05。RT-QuIC相对荧光响应也使用GraphPad Prism软件进行分析和绘制(v.9)。使用未配对的双尾进行比较gydF4y2BatgydF4y2Ba-测试或单向方差分析与Tukey的多重比较检验。双尾枪兵gydF4y2BargydF4y2Ba非参数相关性用于关联从单个个体中获得的不同变量,使用SPSS (v.25,芝加哥,伊利诺伊州)。gydF4y2Ba