摘要
背景
嵌合抗原受体(CAR)-T细胞疗法是一种针对b细胞恶性肿瘤和某些类型实体肿瘤的强大过继免疫疗法。白介素(IL) -15是一种重要的免疫刺激剂,可能提供理想的长期持久性CAR-T细胞。然而,较高的血清IL-15基线或峰值水平也与严重毒性有关,如细胞因子释放综合征(CRS)、移植物抗宿主病(GVHD)和神经毒性。
方法
我们成功构建了过表达IL-I5和IL-15受体α (IL-15Ra)的CD19特异性装甲CAR-T细胞。采用流式细胞仪检测CAR-T细胞体外分化和活力,并采用体内异种移植小鼠模型评估CAR-T细胞的抗肿瘤效果和肝损伤。
结果
单独过表达IL-15的CAR-T细胞在体外表现出增强的活力,延缓衰竭,在体内表现出优越的肿瘤抑制作用。然而,这些无肿瘤小鼠的存活率较低,并有严重的肝损伤,这可能是毒性的结果。正如预期的那样,在体外实验中,过表达IL-15联合IL-15Ra的CAR-T细胞降低了CD132的表达,释放了更少的细胞因子(IFNγ, IL-2和IL-15),并且与CAR-IL-15 T细胞相比,有通过抑制肿瘤细胞的生长和保持肝脏健康来提高小鼠存活率的倾向。
结论
这些结果表明IL-15在增强T细胞持久性方面的重要性,IL-15Ra在减少IL-15的不良反应方面的重要性,在CAR-T治疗期间具有优越的肿瘤延迟性。这项研究为未来IL-15在过继细胞治疗中的快速开发铺平了道路。
背景
由于IL-2具有强大的增殖和刺激T细胞的能力,它是临床癌症试验中使用的第一个细胞因子。然而,IL-2的应用导致T细胞衰竭,特别是在过继T细胞治疗中。近年来,IL-15因其与IL-2的相似性而在细胞因子受体生物学中引起了广泛的关注。有研究报道,给药重组IL-15或过表达IL-15可保护小鼠免受各种感染[1,2],并且由于其能够延长T细胞寿命,IL-15的临床应用得到了进一步加强。
IL-15和IL-2作为常见的γ链细胞因子家族的成员,都参与调节T细胞的稳态和分化。这些细胞因子共享许多生物活性,可能是因为与IL-2受体复合物相似[3.].共同的活动包括活化T细胞和自然杀伤(NK)细胞的生长和迁移,以及诱导B细胞分化和增殖[4].IL-15和IL-2各自利用一种异三聚体受体复合物,由IL-2Rβ和γc亚基以及一个特定的、独特的α亚基组成[3.].IL-15受体α (IL-15Ra)是一种具有高亲和力的IL-15特异性受体。在免疫细胞分泌后,IL-15结合到效应细胞上表达的IL-15Ra,然后这种IL-15-IL-15Ra融合蛋白结合到附近效应细胞上表达的IL-2Rβγ (IL-15Rβγ)复合体,如NK细胞、B细胞和T细胞,依次导致Janus激酶1 (JAK1)和JAK3的募集和激活[5].激活的JAK1和JAK3进一步促进效应细胞中il -15调控基因的转录[6通过信号换能器和转录激活因子3 (STAT3)和STAT5。此外,在缺乏IL-15Ra的情况下,IL-15也可以结合IL-15Rβγ复合物,导致PI3K和MAPK通路的激活[7].因此,IL-15和IL-15- il - 15ra复合物对t细胞介导的免疫应答有不同的贡献。
嵌合抗原受体(CAR)是一种合成分子,由细胞外肿瘤抗原结合域、铰链、跨膜和细胞内信号域构成[8].表达CAR的T细胞(CAR-T细胞)可以通过细胞外结构域的单链可变片段(scfv)直接识别肿瘤相关抗原。CAR-T细胞识别后被激活,释放多种细胞因子,如颗粒酶、穿孔素、干扰素-γ (IFN-γ)等,诱导肿瘤细胞凋亡[9,10].CAR-T细胞的发育包括四个阶段。第一代CAR,不包含共刺激信号域,被开发用于治疗癌症,但体内持久性差。为了解决这一问题,我们将二代CAR与CD28或4-1BB的共刺激信号域合并到CAR细胞内结构中。由于这两个结构域决定了CAR-T细胞的不同功能特性,因此建立了含有CD28和4-1BB的第三代CARs [11].然而,尽管CAR-T治疗取得了重大突破,但就其临床疗效而言,仍有几个因素限制了CAR-T细胞的抗肿瘤疗效。例如,CAR-T细胞的耗尽是普遍的[12],从而导致抗肿瘤活性差和复发。由此,在第三代CAR的基础上,结合CRISPR/Cas9技术、细胞因子、抗体等,出现了第四代CAR,也被称为装甲CAR [13,14]被构建来克服CAR-T细胞的这些缺陷。
有充分的临床前和临床证据表明CAR-T细胞易于衰竭和持久性差,这限制了免疫治疗的疗效[11].IL-15的应用在一定程度上解决了这一问题。然而,也可能发生其他不良事件,如毒性。CAR-T细胞可以通过几种机制引起毒性。如果CAR靶向的肿瘤相关抗原在正常组织上表达,这些组织可能会受损,就像正常B细胞被CD19 CAR- t细胞破坏和耗尽一样[15].此外,CAR-T细胞最突出和描述最清楚的毒性是细胞因子释放综合征(CRS),这是由注入的T细胞释放的细胞因子引起的,症状包括低血压和发烧。CAR - t细胞疗法也可能导致神经毒性[16,17].值得注意的是,IL-15的应用总是伴随着严重的毒性,据报道IL-15可诱导更好的抗肿瘤反应[18,19].
在本研究中,为了减少CAR-T治疗期间IL-15的不良反应和优势,我们生成了连接IL-15和IL-15Ra的CD19特异性装甲车。我们发现IL-15Ra和IL-15联合使用可以阻断毒性,但对IL-15诱导的CAR-T细胞的持久性和抗肿瘤活性没有影响。这一发现为IL-15在过继细胞治疗中快速应用于癌症患者的治疗提供了线索。
材料与方法
细胞系
人NALM-6和逆转录病毒包装细胞系PG13购自美国类型培养收藏(ATCC)。逆转录病毒感染产生了表达eGFP和萤火虫荧光素酶的NALM-6细胞。NALM-6细胞维持在rmi -1640 (Lonza)中,含有10%胎牛血清(Biosera)和10,000 IU/mL青霉素/10,000 μg/mL链霉素(EallBio Life Sciences)。所有细胞在5% CO中培养2在加湿培养箱中,37°C, 95%空气。
CD19特异性CAR-T细胞的产生
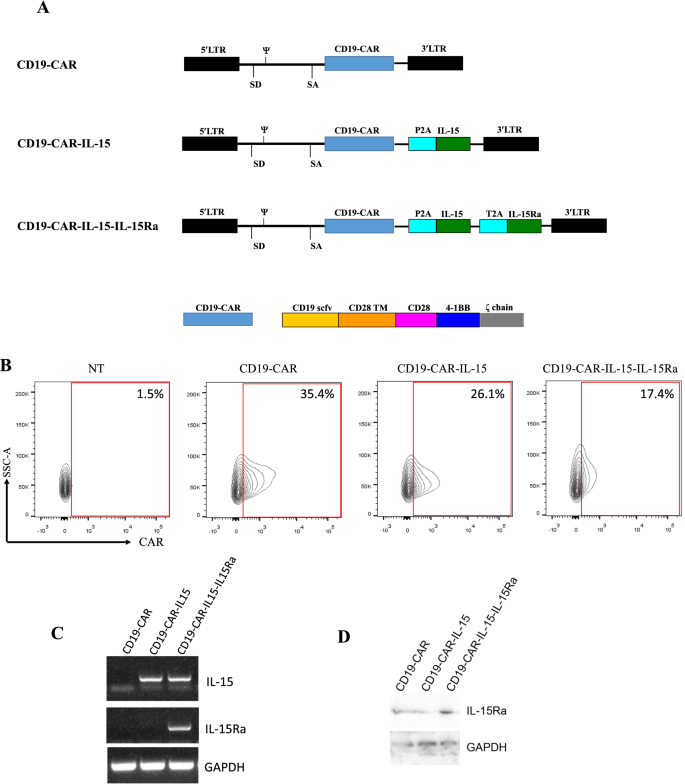
CD19特异性CAR编码序列由GeneArt (Invitrogen)合成,然后亚克隆到SFG逆转录病毒载体中。IL-15 (HG10360-M)和IL-15Ra (HG18366-G)的cdna购自信和生物。所有CARs克隆均经测序验证。质粒瞬时转染后,PG13细胞产生逆转录病毒颗粒。健康人外周血单个核细胞(pmcs)通过淋巴oprep (MP Biomedicals)梯度离心分离。用抗cd3 /CD28珠刺激后,用逆转录病毒感染pbmc中的T细胞。7天后,CAR- t细胞进行CAR表达检测,然后在含5% GemCellTM Human Serum AB和IL-2 (138 U/ml)的X-VIVOTM15无血清培养基中扩增。本研究经北京世纪坛医院机构审查委员会批准,并获得所有健康捐赠者的知情同意。
流式细胞术
流式细胞术在FACSCanto Plus仪器(BD Biosciences)和FlowJo v.10上进行(FlowJo, LLC)用于数据分析。所有抗体均购自BD生物科学公司。用apc -cy7标记的小鼠抗人CD3抗体、fitc标记的小鼠抗人CD8抗体、Alexa Fluor 700标记的小鼠抗人CD8抗体、BV421标记的小鼠抗人CD4抗体、bv605标记的小鼠抗人CD45RO、pe -cy7标记的小鼠抗人CCR7、Alexa Fluor 700标记的小鼠抗人CD27、pe -cy5标记的小鼠抗人CD95染色后检测CAR-T细胞,Alexa Fluor 647标记山羊抗小鼠IgG (Fab特异性)F(ab′)2抗体(Jackson免疫研究公司)。
Western blot分析
用PBS清洗细胞三次,然后用RIPA缓冲液提取蛋白质。蛋白质样品使用Pierce BCA蛋白测定试剂盒(赛默飞世尔科学公司)定量,然后在十二烷基硫酸钠(SDS)/β-巯基乙醇样品缓冲液中变性。样品在15% sds -聚丙烯酰胺凝胶上分离,并通过电泳转移在聚偏氟乙烯膜(Millipore)上进行印迹。膜用兔抗人IL-15Ra抗体(Sino Biological)在4℃孵育过夜,然后用酶标山羊抗兔二抗(Santa Cruz Biotechnology)检测特异性蛋白抗体复合物。化学发光反应的检测使用ECL试剂盒(赛默飞世尔科学公司)进行。
细胞毒性试验
CAR-T细胞与NALM-6-eGFP(2:1)在24孔板中共培养。24小时后,收集细胞,根据制造商的说明使用流式细胞仪(BD FacsCanto II Plus)使用表面标记检测肿瘤细胞。
CAR-T细胞与NALM-6-eGFP(2:1)在96孔板中共培养。24 h后,添加20 μL d -荧光素钾(1.515 mg/mL) (Thermo Fisher Scientific)后,使用IVIS成像系统(IVIS, Xenogen, Alameda, CA, USA)监测荧光素酶活性。细胞活力=活细胞荧光值/对照× 100%
扩散分析
用NALM-6-eGFP(10:1)培养CD19-CAR-T细胞、CD19-CAR-IL-15 T细胞和CD19-CAR-IL-15- il - 15ra T细胞。使用Vi-CELL细胞活力分析仪,通过台盼蓝排除法计数第0天、第7天和第14天的细胞数量。
细胞因子产生分析
CAR-T细胞与NALM-6-eGFP在E:T比为2:1的条件下共培养24小时。收集上清液,根据制造商说明通过ELISA试剂盒(DY285B, D1500, DY202,研发系统)检测IFN-γ, IL-15和IL-2。
聚合酶链反应
PCR检测IL-15和IL-15Ra在抗原刺激的CAR-T细胞中的表达。按照制造商的说明,使用TRIzol试剂(Invitrogen)从CAR-T细胞中提取总rna。利用高容量cDNA逆转录试剂盒(Thermo Fisher Scientific)合成cDNA。采用引物5 ' - ATGGATGCAATGAAGAGAGGG-3 '(义)和5 ' - CGACGTGTTCATGAACATCTGGA-3 '(反义)扩增IL-15基因表达;IL-15Ra用引物5 ' - atggccccgaggcgggcgcgagg -3 '(正义)和5 ' - TAGGTGGTGCGAGCAGT-3 '(反义)扩增;以引物5 ' - TGACCACAGTCCATGCCATC-3 '(义)和5 ' - gtgagcttcccgttcagctc -3 '(反义)作为对照扩增GAPDH。
注射NALM-6-eGFP细胞的异种移植小鼠模型
6 - 8周大的NOD-SCID小鼠购自查尔斯河实验室。然后是1 × 106将NALM-6-eGFP细胞静脉注射到NOD-SCID小鼠体内,建立异种移植小鼠模型。注射肿瘤细胞后1天,1 × 107CAR-T细胞(2 × 106CAR阳性T细胞)注入尾静脉,每天1次,连续3天。使用IVIS监测肿瘤发展。成像后腹腔注射d -荧光素钾200 μL (15.15 mg/mL)。阴性对照为静脉注射非转导T细胞(NT)。这些老鼠被监测了三个多月。所有实验,包括小鼠实验,都得到了北京世纪坛医院机构审查委员会的批准。
苏木精-伊红染色
这些老鼠被监测了一段时间。当小鼠死亡时,从小鼠身上切除的肝脏样本被固定在4%的多聚甲醛中。H&E染色由Bioss公司(北京,中国)进行。
移植物抗宿主病(GVDH)评分
GVHD评分参照Hechinger等[20.]详细评估肝组织胆管损伤(表现为核深染、核聚集、淋巴细胞浸润和细胞质空泡化)和炎症(淋巴细胞、中性粒细胞和嗜酸性粒细胞浸润)。根据受累尿道的数量和每个尿道疾病的严重程度(0,无;1、受累病灶少,受累轻度;2、受累尿道多,但病情轻;3、损伤部位多在大片;4、大部尿道受累严重)。
统计分析
使用GraphPad Prism 8.0.2版本进行图表和统计分析。数据是用Student软件分析的t参数检验或Mann-Whitney检验p值< 0.05为有统计学意义。ELISA法测定细胞因子时,数据以均数±S.E.M.表示至少三个独立的实验,每个实验重复三次。对于所有流式细胞术结果,数据均以均数±标准差表示至少三个独立的实验。NALM-6-eGFP异种移植小鼠的总生存率采用Mental-Cox检验进行组间比较。*p< 0.05;**p< 0.01;***p< 0.001;****p< 0.0001;n.s.,不重要。
结果
CD19特异性CAR-T细胞被开发
构建连接CD19-CAR基因的IL-15和IL-15Ra基因。1A)和这些共同表达的逆转录病毒载体被转导到T细胞。数字1B显示转导效率和CD4/CD8比值在三组之间是相似的(附加文件1:图S1)。接下来,通过PCR验证IL-15和IL-15Ra的成功表达。从CAR-T细胞中提取总rna。结果显示CD19-CAR-IL-15 T细胞过表达IL-15, CD19-CAR-IL-15-IL-15Ra T细胞过表达IL-15和IL-15Ra(图。1C)。western blotting也证实了IL-15Ra的表达(图。1D)。
IL-15装甲CAR-T细胞在体外表现出较高的增殖和低分化表型
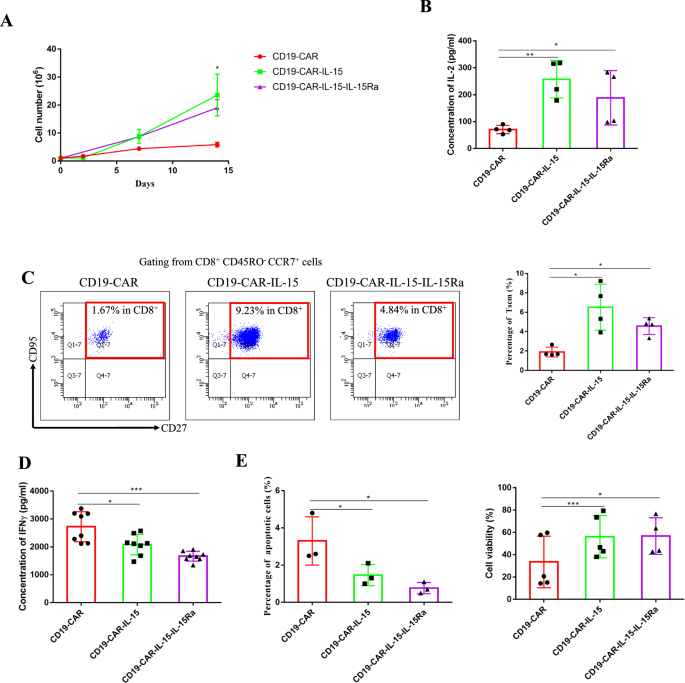
使用非转导的T细胞调整CAR阳性T细胞的百分比以保持一致。直接细胞计数显示,NALM-6-eGFP刺激后,过表达IL-15和IL-15Ra的CAR-T细胞具有更高的增殖能力。2此外,由于IL-2是T细胞的生长因子,因此测量了上清液中IL-2的浓度,结果显示CD19-CAR- il -15和CD19-CAR- il -15- il - 15ra T细胞比CD19-CAR- T细胞释放更多的IL-2(图19- car -15- il - 15ra T细胞)。2B). CAR-T细胞分化表型的测定。NALM-6-eGFP细胞刺激7天后,结果显示CD8仅为1.67%+CD19-CAR- T细胞为T记忆干细胞(Tscm),而CD19-CAR- il -15和CD19-CAR- il -15- il - 15ra T细胞中Tscm细胞较多(分别为9.23%和4.84%)。2C和附加文件1:图S2)。此外,据报道,低分化的T细胞在抗原刺激下产生较少的IFNγ。因此,用NALM-6-eGFP细胞刺激CD19-CAR、CD19-CAR- il -15和CD19-CAR- il -15- il - 15ra T细胞24小时,并用ELISA法测定IFNγ的浓度。如图所示。2D、IL-15和IL-15Ra表现出较少IFNγ产生的T细胞,这意味着CD19-CAR-IL-15和CD19-CAR-IL-15-IL-15Ra T细胞的低分化表型。随后,由于IL-15可扩增T细胞增殖,我们分析了凋亡细胞百分比和细胞存活率。我们发现IL-15和IL-15Ra抑制CAR-T细胞凋亡并增强细胞活力(图。2E)。
IL-15装甲CAR-T细胞在体外表现出较高的增殖和低分化表型。一个T细胞增殖的程度通过直接细胞计数随时间的变化来反映。每7天用新鲜的NALM-6-eGFP细胞(10:1)刺激CAR-T细胞,并在加入NALM-6-eGFP细胞前计数T细胞。BCAR-T细胞与不含IL-2的NALM-6-eGFP(2:1)在培养基中共培养24 h, ELISA法检测上清液中IL-2浓度。CCAR-T细胞与NALM-6-eGFP(10:1)共培养7 d,流式细胞仪检测T亚群。DCAR-T细胞与NALM-6-eGFP(2:1)共培养24 h。收集上清液,ELISA检测IFN-γ浓度。ECAR-T细胞与NALM-6-eGFP共培养(10:1)。7 d后收集所有细胞,通过Annexin V和7- add染色检测凋亡细胞百分比和细胞活力。结果以学生成绩分析t-test后面是参数测试。*p< 0.05;**p< 0.01;***p< 0.001
IL-15Ra可降低il -15诱导的体外毒性
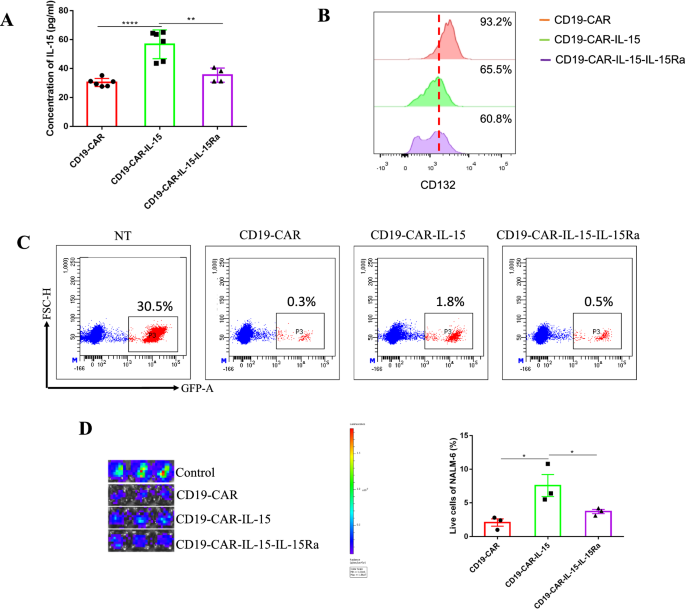
为了研究IL-15Ra在细胞培养条件下对IL-15的影响,采集CAR-T装甲细胞上清液,采用ELISA法检测IL-15浓度。CD19-CAR-IL-15 T细胞的IL-15释放量最高,而CD19-CAR-IL-15- il - 15ra T细胞的IL-15释放量与CD19-CAR-T细胞相同。如图所示。1C, CAR-IL-15-IL-15Ra T细胞成功表达IL-15和IL-15Ra,证明IL-15Ra与IL-15结合可降低培养基中IL-15的浓度,具有降低毒性的潜力。此外,与GVHD相关的高表达IL-15受体CD132 [20.],被检测到。数字3.B显示CD19-CAR- il -15- il - 15ra T细胞的CD132表达量最低(分别为60.8%,CD19-CAR为93.2%,CD19-CAR- il -15为65.5%)。研究了装甲CAR-T细胞的抗肿瘤活性。CD19-CAR- T细胞和CAR-IL-15-IL-15Ra T细胞具有相同的抗肿瘤能力,而CD19-CAR- il -15 T细胞的抗肿瘤能力最低。3.C和D)。
IL-15Ra可降低il -15诱导的体外毒性。一个CAR-T细胞与NALM-6-eGFP(2:1)共培养24 h。收集上清液,ELISA检测IL-15浓度。BCAR-T细胞与NALM-6-eGFP(10:1)共培养7天,流式细胞仪检测细胞表面CD132的表达。CCAR-T细胞与NALM-6-eGFP细胞(2:1)在24孔板中共培养24 h。流式细胞术检测活的NALM-6-eGFP。DCAR-T细胞与NALM-6-eGFP细胞(2:1)在96孔板中共培养24 h。荧光素酶活性测定肿瘤细胞活力。左图为IVIS成像系统图像,右图为统计分析。控件表示NALM-6-eGFP细胞。结果以学生成绩分析t-test后面是参数测试。*p< 0.05;**p< 0.01;***p< 0.001
与IL-15Ra共表达的IL-15装甲CAR-T细胞在体内表现出增强的抗肿瘤活性和降低的毒性
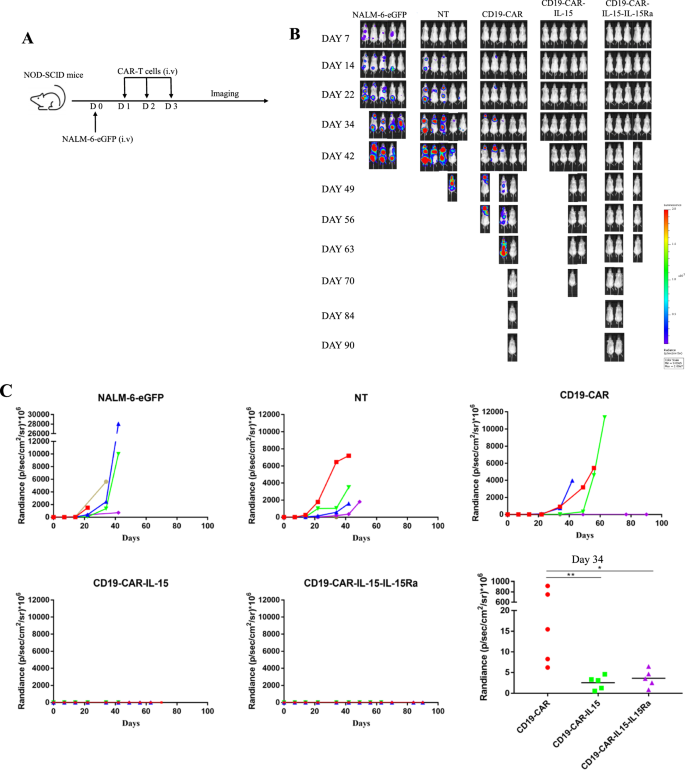
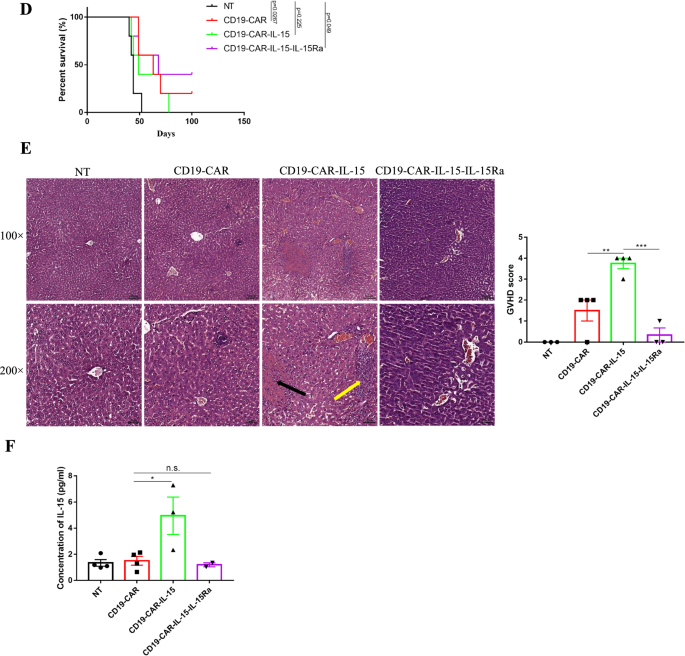
为了进一步研究装甲T细胞在体内的抗肿瘤活性,将NALM-6-eGFP细胞静脉注射到NOD-SCID小鼠体内,生成异种移植小鼠模型。一天后,静脉注射T细胞与非转导T细胞(NT)作为阴性对照,并对小鼠进行3个多月的监测(图2)。4A).如图所示。4B, C和附加文件1:图S3B,与肿瘤发展迅速的对照组小鼠相比,CD19-CAR-IL-15 T细胞和CD19-CAR-IL-15- il - 15ra T细胞处理的小鼠没有肿瘤发展,这表明IL-15诱导的抗肿瘤活性增强。尽管没有肿瘤发展,CD19-CAR- il -15 T细胞处理组的存活率与CD19-CAR和CD19-CAR- il -15- il - 15ra T细胞处理组相比是最低的,其中所有小鼠都在70天内死亡。4CD19-CAR组只有20%的小鼠存活超过90天,与之相比,CD19-CAR- il -15- il - 15ra组的存活率为40%(图4)。4最重要的是,在小鼠死亡时采集肝脏,通过H&E染色观察导管损伤和炎症。数字4E和附加文件1:图S3A显示,CD19-CAR-IL-15 t处理小鼠肝脏结构异常严重,门静脉区浸润大量中性粒细胞,小叶内大面积坏死病变,CD19-CAR-IL-15- il - 15ra t处理小鼠肝脏相对健康。CD19-CAR-IL-15 t处理小鼠的GVHD评分约为4分,其他三组为0分,这表明IL-15Ra减少了IL-15的不良反应。在小鼠死亡前,每只小鼠的血液被收集,血清被用于检测人IL-15的浓度。如图所示。4F, CD19-CAR-IL-15 t处理小鼠血液中人IL-15水平最高,这意味着IL-15Ra的共表达阻断了血清中IL-15的密度。这些结果表明,IL-15Ra具有通过降低IL-15毒性来延长生存率的趋势。
IL-15Ra表达的IL-15装甲CAR-T细胞在体内表现出增强的抗肿瘤活性和降低的毒性。一个小鼠实验过程示意图。1 × 106通过静脉注射NALM-6-eGFP细胞构建NOD-SCID小鼠异种移植模型。注射肿瘤细胞后1天,1 × 107CAR-T细胞(2 × 106CAR阳性细胞)注射尾静脉,每天1次,连续3天。用IVIS监测肿瘤发展。B, C定量生物发光(辐射=光子/厘米2/sr)显示所有小鼠的成像数据。对第34天的定量生物发光进行了统计分析。DNALM-6-eGFP异种移植小鼠的总存活率。E采集CAR-T处理小鼠的肝脏进行苏木精和伊红染色。黄色箭头显示大量浸润中性粒细胞,黑色箭头显示坏死病灶区域。右图显示肝脏GVHD评分。F提取小鼠血清,ELISA检测人IL-15浓度。结果以学生成绩分析t-test后进行参数检验或Mann-Whitney检验。采用Mantel-Cox检验分析生存曲线。*p< 0.05;**p< 0.01;***p< 0.001;n.s.,不重要
讨论
在本研究中,我们评估了IL-15和IL-15- il - 15ra复合物对CAR-T细胞治疗的影响。我们的研究结果表明,IL-15装甲CAR-T细胞在细胞培养条件下可导致最高比例的Tscm细胞和细胞活力。IL-15和IL-15Ra联合使用Tscm的比例较高,但低于IL-15单独使用。IL-15-IL-15Ra装甲CAR-T细胞毒性最低,细胞因子释放(IFNγ)和CD132表达较少。在一个异种移植小鼠模型中,IL-15装甲CAR-T细胞完全抑制肿瘤复发,但具有严重的毒性(所有小鼠在70天内死于严重的肝损伤),而IL-15- il - 15ra装甲CAR-T细胞完全抑制肿瘤复发,毒性较低(40%的小鼠肝脏健康存活超过90天)。重要的是,CD19-CAR-IL-15 t处理小鼠肝脏的GVHD评分约为4分,而CD19-CAR-IL-15-IL-15Ra t处理小鼠肝脏的GVHD评分约为0分,说明IL-15Ra对IL-15毒性有抑制作用。
CD19特异性CAR-T疗法已在B细胞恶性肿瘤和某些类型的实体肿瘤中显示出显著的抗肿瘤作用[21].然而,各种研究表明,不同方法或不同实验室产生的CAR-T产品抗肿瘤效率不一致。一些因素限制了CAR-T细胞的抗肿瘤效率,如抗体亲和力、脱靶毒性、令人印象深刻的肿瘤微环境以及终端分化[22].CAR-T细胞的持久性是一个关键问题,在获得增强扩增、持久性和抗肿瘤反应的细胞产物方面已经取得了相当大的进展。研究表明,在培养中使用IL-15和IL-7具有抗肿瘤作用[23]或IL-15与CAR同步基因改造成T细胞[24,25].此外,DLBCL和B-ALL患者血清中高IL-15水平与CD19 CAR-T治疗后更好的预后相关[26,27].这些结果表明,联合辅助IL-15提高了CAR-T治疗的抗肿瘤疗效。事实上,在这项研究中,我们开发了一种用于治疗白血病的装甲CAR。我们的体外细胞培养结果表明,这种靶向CD19的car装甲增强了细胞活力,抑制了细胞凋亡,维持了CAR-T细胞的低分化表型,证明了T细胞寿命的增强[28,29].
尽管一些临床研究已经报道了IL-15表达升高与患者生存率的提高相关,但IL-15的给药已经引起了相当大的毒性,包括癌症患者的低血压、发热和血小板减少,这可能进一步阻碍了IL-15的安全批准[18,30.].与这些研究一致,使用NALM-6肿瘤治疗小鼠,我们发现IL-15装甲CD19-CAR-T细胞完全抑制肿瘤复发;然而,毒性严重,所有小鼠在70天内死亡,严重的肝损伤和较高的GVHD评分,表明IL-15的严重不良反应。IL-15-IL-15Ra复合物已被证明能显著刺激CD8+T细胞,尤其是记忆CD8+T细胞,以增强对多发性肿瘤的细胞毒性,如骨髓瘤[31]、乳癌[32]、大肠癌[33],并延长荷瘤小鼠的生存期,建立长期免疫记忆对抗肿瘤再挑战[34,35].IL-15-IL-15Ra与anti-FAP的融合蛋白具有较强的靶向抗肿瘤杀伤能力,为未来开发抗体-IL-15-IL-15Ra融合蛋白用于癌症免疫治疗提供了理论基础[36].因此,在本研究中,使用IL-15Ra作为CAR盒的一部分后,我们的研究发现,与传统的CAR-T细胞相比,IL-15Ra与IL-15过表达可增强细胞活力,减少凋亡细胞,并保留T细胞分化,且Tscm更多。最后,与CD19-CAR-IL-15 T细胞相比,IL-15Ra在肝脏相对健康且GVHD评分较低的肿瘤治疗小鼠中完全抑制肿瘤的发展,为改善CAR构建提供了新的选择。
IL-15由CD8上表达的IL-15Ra顺式表达+T细胞也能够增强这些CD8的增殖和活力+体内T淋巴细胞[37]和IL-15Ra显著提高血清中IL-15的稳定性[38].在一项研究中,稳定表达第二代CD19-CAR和IL-15-IL-15Ra的外周T细胞延缓了白血病的发展,并在长寿命Tscm清除肿瘤后持续抵抗[24].然而,这并不表明IL-15具有毒性作用。在我们的研究中,我们发现IL-15联合IL-15Ra显著减少了CAR-T治疗期间的不良事件,有可能延长肝脏健康和GVHD评分较低的肿瘤治疗小鼠的存活率,这表明IL-15Ra具有新的功能。这一发现有两个原因。首先,我们使用的CD19特异性CAR是第三代CAR,其中CD28和4-1BB进入CAR细胞内结构,可能会影响细胞内信号转导[39].其次,与之前的研究不同,我们构建了cd19特异性装甲车,将CAR、IL-15和IL-15Ra连接到同一质粒中。因此,单细胞内CD19-CAR和IL-15-IL-15Ra融合蛋白的共表达可能会影响IL-15Ra的功能。然而,IL-15Ra降低毒性的机制还有待进一步研究。
CD132是一个常见的γ链,是白细胞介素受体的亚单位,包括IL-2, IL-4, IL-7, IL-9和IL-15。因为这些细胞因子的水平在急性和慢性GVHD患者的血清中升高,抑制CD132可能对GVHD产生深远的影响[20.],检测了CD132在装甲CAR-T细胞上的表达,与CD19-CAR-T和CD19-CAR-IL-15 t相比,CAR-T细胞连同IL-15和IL-15Ra的CD132表达水平最低。此外,研究表明炎症性肠病与可溶性CD132表达增加有关[40], IL-7Rα和CD132的表达升高与银屑病样皮肤炎症呈正相关[41].因此,对于IL-15-IL-15Ra复合装甲CAR-T细胞,可以预测应用后对患者的低毒性。
CAR-T细胞引起的毒性是多种多样的,尚不完全清楚;因此,使用免疫抑制剂来降低毒性是一种不断发展的实践[42,43].IL-15刺激各种免疫细胞的增殖和激活,特别是CD8+T细胞,导致细胞毒性增加和细胞因子的产生,但也放大了CAR-T细胞的不良作用[44],如严重的GVHD。在本研究中,使用cd19特异性CAR,我们的结果表明,与常规CAR- t和IL-15装甲CAR- t细胞相比,IL-15联合IL-15Ra降低了CD132的表达,导致肿瘤治疗小鼠的生存率相对较高,并保持肝脏健康。即便如此,IL-15Ra在临床的新应用可能与异种移植小鼠模型不一致[45].本研究对IL-15Ra进行了初步研究,临床应用还有很长的路要走。此外,有报道称,在CAR-T治疗期间应用IL-15对多种靶点有益,如VEGFR-2 [29],她-2 [46], glypican-3 [47)等。在本项目中,我们仅使用CAR靶向CD19细胞来研究IL-15Ra的作用,这是本研究的局限性。未来,该模型将应用于其他car进行进一步研究。
结论
总之,在过继t细胞治疗之前维持Tscm种群的体外扩张是具有挑战性的。在这里,我们证明了IL-15用于CAR-T细胞生成的组合保留了Tscm表型,并导致自我更新能力增强,但在体内具有严重的毒性。接下来,我们成功构建了结合IL-15-IL-15Ra融合蛋白的CD19特异性CAR,并在体外检测了其细胞活力和异种移植小鼠模型的免疫毒性,为临床白血病治疗提供了候选工具。
数据和材料的可用性
本研究的原始数据可根据合理要求从通讯作者处获得。
参考文献
Yajima T, Nishimura H, Ishimitsu R, Watase T, Busch HD, Pamer GE, Kuwano H, Yoshikai Y.在微生物暴露后,IL-15在体内过表达增加抗原驱动的记忆CD8+ T细胞。中华免疫杂志2002;https://doi.org/10.4049/jimmunol.168.3.1198.
汤普森AL,斯塔茨HF。细胞因子:鼻内疫苗佐剂的未来。临床免疫研究。2011;2011:289597。https://doi.org/10.1155/2011/289597.
肯尼迪MK, Park LS。白介素-15 (IL-15)和IL-15受体复合物的特征。中华临床免疫杂志。1996;16:134-43。https://doi.org/10.1007/bf01540911.
Giri JD, Ahdieh M, Eisenman J, Shanebeck K, Grabstein K, Kumaki S, Namen A, Park LS, Cosman D, Anderson D.新型细胞因子IL-15对IL-2受体β和γ链的利用Embo j . 1994; 13:2822-30。
刘志刚,刘志刚,刘志刚,王志刚。白细胞介素-15对淋巴细胞稳态的调控作用。细胞因子生长因子,2002;13:29 - 39。https://doi.org/10.1016/s1359 - 6101 (02) 00029 - 1.
Sato N, Patel HJ, Waldmann TA, Tagaya Y.细胞表面的IL-15/IL-15Ralpha使IL-15持续活性,并有助于CD8记忆T细胞的长期生存。中国科学院学报(自然科学版)2007;104:588-93。https://doi.org/10.1073/pnas.0610115104.
杨晓明,李志强,李志强,等。白介素15在肿瘤免疫治疗中的应用前景。细胞因子生长因子,2011;22:99-108。https://doi.org/10.1016/j.cytogfr.2011.04.001.
冯志刚,李文杰,李文杰。工程T细胞:肿瘤免疫治疗的前景与挑战。癌症,2016;16:566-81。https://doi.org/10.1038/nrc.2016.97.
杨晓明,李志强,李志强。细胞毒性淋巴细胞是如何杀死癌细胞的?临床癌症决议2015;21:5047-56。https://doi.org/10.1158/1078-0432.CCR-15-0685.
Eshhar Z, Waks T, Gross G, Schindler DG。通过由抗体结合域和免疫球蛋白和t细胞受体的γ或zeta亚基组成的嵌合单链特异性激活和靶向细胞毒性淋巴细胞。中国科学院学报(自然科学版),1993;30(2):344 - 344。https://doi.org/10.1073/pnas.90.2.720.
Weber EW, Maus MV, Mackall CL。免疫细胞疗法的新兴前景。细胞。2020;181:46 - 62。https://doi.org/10.1016/j.cell.2020.03.001.
李志强,李志强,陈志强,陈志强,等。CAR - T细胞功能障碍的研究进展。致癌基因。2021;40:421-35。https://doi.org/10.1038/s41388-020-01501-x.
李萍,杨立林,李涛,宾顺丰,孙博凯,黄奕婷,杨ky,单德明,谷海辉,李华。第三代抗HER2嵌合抗原受体小鼠T细胞单独或联合抗pd1抗体在体外和免疫能力小鼠体内抑制表达HER2的小鼠乳腺肿瘤细胞的生长。Front Oncol, 2020;10:1143。https://doi.org/10.3389/fonc.2020.01143.
黄蓉,李霞,何勇,朱伟,郜林,刘勇,郜林,文强,钟芳杰,张超,等。CAR-T细胞工程的最新进展。中华血液病杂志,2020;13:86。https://doi.org/10.1186/s13045-020-00910-5.
Grupp SA, Kalos M, Barrett D, Aplenc R, Porter DL, Rheingold SR, Teachey DT, Chew A, Hauck B, Wright JF,等。嵌合抗原受体修饰的T细胞治疗急性淋巴白血病。中华外科杂志,2013;368:1509-18。https://doi.org/10.1056/NEJMoa1215134.
Brudno JN, Kochenderfer JN。嵌合抗原受体T细胞的毒性:识别和处理。血。2016;127:3321-30。https://doi.org/10.1182/blood-2016-04-703751.
Kochenderfer JN, Dudley ME, Kassim SH, Somerville RPT, Carpenter RO, steler - stevenson M, Yang JC, Phan GQ, Hughes MS, Sherry RM,等。化疗难治性弥漫性大b细胞淋巴瘤和惰性b细胞恶性肿瘤可以用表达抗cd19嵌合抗原受体的自体T细胞有效治疗。中华临床医学杂志,2015;https://doi.org/10.1200/jco.2014.56.2025.
Gust J, Ponce R, Liles WC, Garden GA, Turtle CJ。CAR - T细胞相关神经毒性中的细胞因子。免疫前沿杂志2020;11:577027。https://doi.org/10.3389/fimmu.2020.577027.
石世霞,李玉杰,石凯,Wood K, Ducruet AF,刘强,IL -15(白细胞介素)连接星形胶质细胞-小胶质细胞的串音并加剧脑出血后的脑损伤。中风。2020;51:967 - 74。https://doi.org/10.1161/strokeaha.119.028638.
Hechinger AK, Smith BAH, Flynn R, Hanke K, McDonald-Hyman C, Taylor PA, Pfeifer D, Hackanson B, Leonhardt F, Prinz G,等。多种常见γ链细胞因子抑制在急性和慢性移植物抗宿主病中的治疗活性。血。2015;125:570 - 80。https://doi.org/10.1182/blood-2014-06-581793.
韩东,徐铮,庄勇,叶铮,钱强。CAR-T细胞治疗恶性血液病的研究进展。癌症杂志。2021;12:26 - 34。https://doi.org/10.7150/jca.48976.
王娥,Cesano A, Butterfield LH。提高过继细胞治疗指标:影响疗效的关键因素。中华免疫杂志,2020;8:e001619。https://doi.org/10.1136/jitc-2020-001619.
徐勇,张敏,Ramos CA, Durett A,刘娥,Dakhova O,刘h, Creighton CJ, Gee AP, Heslop HE,等。密切相关的t记忆干细胞与CAR的体内扩增相关。CD19-T细胞被IL-7和IL-15保存。血。2014;123:3750-9。https://doi.org/10.1182/blood-2014-01-552174.
Hurton LV, Singh H, Najjar AM, Switzer KC, Mi T, Maiti S, Olivares S, Rabinovich B, Huls H, Forget M,等。拴系IL-15增强抗肿瘤活性,并促进肿瘤特异性T细胞中的干细胞记忆子集。中国科学院学报(自然科学版),2016;https://doi.org/10.1073/pnas.1610544113.
Krenciute G, Prinzing BL, Yi Z, Wu MF, Liu H, Dotti G, Balyasnikova IV, Gottschalk S. il - 15的转基因表达提高了IL13Rα2-CAR - T细胞的抗胶质瘤活性,但导致抗原丢失变异。癌症免疫杂志2017;5:571-81。https://doi.org/10.1158/2326-6066.cir-16-0376.
Rossi J, Paczkowski P, Shen Y, Morse K, Flynn B, Kaiser A, Ng C, Gallatin K, Cain T, Fan R,等。预输注多功能抗cd19嵌合抗原受体T细胞与NHL的临床结果相关血。2018;132:804-14。https://doi.org/10.1182/blood-2018-01-828343.
Kochenderfer JN, Somerville RPT, Lu T, Shi V, Bot A, Rossi J, Xue A, Goff SL, Yang JC, Sherry RM,等。抗cd19嵌合抗原受体T细胞引起的淋巴瘤缓解与血清白介素-15水平高有关。中华临床医学杂志,2017;https://doi.org/10.1200/jco.2016.71.3024.
Gattinoni L, Lugli E, Ji Y, Pos Z, Paulos CM, Quigley MF, Almeida JR, Gostick E, Yu Z, Carpenito C,等。具有干细胞样特性的人类记忆T细胞子集。医学杂志,2011;17:1290-7。https://doi.org/10.1038/nm.2446.
Lanitis E, Rota G, Kosti P, Ronet C, Spill A, Seijo B, Romero P, Dangaj D, Coukos G, Irving M.优化的小鼠CAR-T细胞基因工程揭示了IL-15共表达的有益作用。中华实验医学杂志2021;218:e20192203。https://doi.org/10.1084/jem.20192203.
Conlon KC, Lugli E, Welles HC, Rosenberg SA, Fojo AT, Morris JC, Fleisher AT, Dubois SP, Perera LP, Stewart DM,等。重组人白细胞介素-15在癌症患者中的首次临床试验中的再分配、过度增殖、自然杀伤细胞和CD8 T细胞的激活以及细胞因子的产生。中华儿科杂志,2015;33:74-82。https://doi.org/10.1200/jco.2014.57.3329.
黄HC,郑ek, Rhode PR.基于il -15的超级激动剂ALT-803促进记忆性CD8(+) T细胞向具有抗肿瘤活性的先天性样效应细胞的抗原独立转化。肿瘤免疫学。2013;2:e26442。https://doi.org/10.4161/onci.26442.
郭淑娟,郭志强,王志强,王志强。IL-15/IL-15Rα异二聚体复合物在小鼠乳腺癌模型中的免疫治疗作用。免疫前沿杂志2020;11:614667。https://doi.org/10.3389/fimmu.2020.614667.
Bessard A, Solé V, Bouchaud G, Quéméner A, Jacques Y.白细胞介素-15 (IL-15)-IL-15受体α融合蛋白RLI在转移性黑色素瘤和结直肠癌中的高抗肿瘤活性。中华癌症杂志2009;8:2736-45。https://doi.org/10.1158/1535-7163.mct-09-0275.
mathieos D, Park C, Marcus WD, Alter S, Rhode PR,郑ek, Wong HC, Pardoll DM, Lim M. IL-15超激动剂复合物ALT-803的治疗管理可导致小鼠胶质母细胞瘤模型的长期生存和持久的抗肿瘤免疫反应。国际癌症杂志,2016;138:187-94。https://doi.org/10.1002/ijc.29686.
Dubois S, Patel HJ, Zhang M, Waldmann TA, Müller JR. IL-15与IL-15R α - igg1 - fc预结合增强其对NK和CD8+/CD44high T细胞增殖的活性及其抗肿瘤作用。中华免疫杂志,2008;18:2099 - 106。https://doi.org/10.4049/jimmunol.180.4.2099.
鲁士丹MP, Kovar M, Purton JF, Cho JH, Boyman O, Surh CD, Sprent J.通过与可溶性IL-15R{α}结合将IL-15转化为超级激动剂。中国科学院学报(自然科学版);2006;23(3):366 - 366。https://doi.org/10.1073/pnas.0600240103.
罗利J,莫妮A,洪文峰,吴廷涛。IL-15RA的表达或IL-15/IL-15RA在CD8+ T细胞上的融合改变了过继转移的T细胞功能。中华免疫杂志2009;39:491-506。https://doi.org/10.1002/eji.200838594.
Ochoa MC, Fioravanti J, Rodriguez I, Hervas-Stubbs S, Azpilikueta A, Mazzolini G, Gúrpide A, Prieto J, Pardo J, Berraondo P,等。一种hdl偶联嵌合IL-15融合蛋白的抗肿瘤免疫治疗和毒性特性。癌症决议2013;73:139-49。https://doi.org/10.1158/0008-5472.can-12-2660.
Cappell KM, Kochenderfer JN。含有CD28和4-1BB共刺激结构域的嵌合抗原受体的比较。Nat Rev clinin Oncol, 2021; 18:715-27。https://doi.org/10.1038/s41571-021-00530-z.
陈志强,陈志强,陈志强。炎症性肠病中常见γ链(CD132)的研究进展。美国胃肠病学杂志。1998;93:323-8。https://doi.org/10.1111/j.1572-0241.1998.00323.x.
Vranova M, Friess MC, Jahromi NH, Collado-Diaz V, Vallone A, Hagedorn O, Jadhav M, Willrodt A, Polomska A, Lerouxet J,等。内皮细胞和白细胞表达的IL-7Rα在银屑病样皮肤炎症调节中的对立作用科学代表2019;9:11714。https://doi.org/10.1038/s41598-019-48046-y.
Schubert ML, Schmitt M, Wang L, Ramos CA, Jordan K, Müller-Tidow C, Dreger P.嵌合抗原受体(CAR - t细胞)治疗的副作用管理。安·昂科尔,2021;32:34-48。https://doi.org/10.1016/j.annonc.2020.10.478.
Schmidts A, Wehrli M, mouse MV。为了更好地理解和管理CAR-T细胞相关的毒性。年Rev医学2021;72:365-82。https://doi.org/10.1146/annurev-med-061119-015600.
郭艳,栾琳,佩蒂尔·NK, ER。IL-15/IL-15Rα复合物作为抗肿瘤和抗病毒药物的免疫生物学研究细胞因子生长因子Rev. 2017; 38:10-21。https://doi.org/10.1016/j.cytogfr.2017.08.002.
Scheidt M,赵杨,Kurt Z,潘c,曾林,杨欣,Schunkert H, Lusis JA。小鼠模型在理解人类动脉粥样硬化中的应用和局限性。Cell Metab, 2017; 25:48 - 61。https://doi.org/10.1016/j.cmet.2016.11.001.
Giuffrida L, Sek K, Henderson AM, House IG, Lai J, Chen AXY, Todd KL, Petley EV, Mardiana S, Todorovski I,等。IL-15预处理增强CAR - T细胞对检查点阻断的反应,以改善实体肿瘤的治疗。Mol Ther, 2020; 28:2379-93。https://doi.org/10.1016/j.ymthe.2020.07.018.
Batra SA, Rathi P, Guo L, Courtney AN, Fleurence J, Balzeau J, Shaik RS, Nguyen TP, Wu M, Bulsara S.共表达IL15和IL21的glypican -3特异性CAR - T细胞对肝细胞癌具有良好的扩增和抗肿瘤活性。癌症免疫res 2020; 8:309-20。https://doi.org/10.1158/2326-6066.CIR-19-0293.
确认
我们感谢斯隆-凯特琳癌症纪念中心和M. Sadelain。本研究获得北京世纪坛医院制度审查委员会的批准。
资金
本研究由北京市科委脑科学研究基金(Z16110000021636)资助。
作者信息
作者及隶属关系
贡献
概念与设计,XZ;数据采集,YZ, QZ, CZ, CX, AG, WHZ, YH;数据分析,YZ, QZ, WHZ;资金获取,XZ;软件,YZ和YH;写作,YZ;审查和编辑,XZ和YH。最终批准,QZ, FW, CZ, CX, AG, WHZ, YH和XZ。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
本研究获得北京世纪坛医院制度审查委员会的批准。
发表同意书
不适用。
相互竞争的利益
作者声明没有利益竞争。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:图S1。
采用流式细胞术检测CAR-T细胞CD4和CD8的表达。图S2。CAR-T细胞经流式细胞术检测Tscm。图S3。1 × 106通过静脉注射NALM-6-eGFP细胞构建NOD-SCID小鼠异种移植模型。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
张勇,庄强,王飞。et al。在CAR-T免疫治疗期间,IL-15受体α与IL-15共表达可通过限制IL-15全身暴露来降低毒性。翻译医学杂志20., 432(2022)。https://doi.org/10.1186/s12967-022-03626-x
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-022-03626-x
关键字
- 装甲嵌合抗原受体T
- 白介素15
- 白细胞介素15受体
- 毒性