摘要
背景
目前,还没有针对神经系统和神经退行性疾病患者的再生疗法。细胞疗法已经成为许多脑部疾病的潜在治疗方法。尽管干细胞技术最近取得了进展,但人们对临床应用细胞疗法的可行性和安全性提出了主要担忧。
方法
我们从转基因和无异种诱导多能干细胞(iPSCs)中生成了符合GMP规范的神经祖细胞(npc),可以顺利地适应临床应用。NPCs在体外和体内分别被移植到野生型小鼠和基因免疫抑制小鼠后进行了分化潜力的研究。
结果
生成的npc至少有15个稳定的基因表达,并且可以扩展到10个18每个细胞最初播种10个6细胞。体外生长因子停用后,细胞适应神经命运,主要分化为活性神经元。为了确保在体内应用的NPC种群是纯的,我们通过应用微rna开关技术作为安全检查点,降低了iPSC污染的风险。使用荧光和生物发光双报告结构的慢病毒转导,结合无创体内生物发光成像,我们在健康野生型和遗传免疫抑制小鼠以及缺血性中风小鼠模型中纵向跟踪移植细胞。长期深入的表征显示,移植的npc在一个月的时间过程中具有存活并自发分化为功能成熟的神经元的能力,而没有检测到残留的多能细胞。
结论
我们描述了转基因和无异种的npc的生成。这种简单的分化方案与体内细胞跟踪能力相结合,为开发安全有效的细胞疗法治疗各种脑损伤提供了有价值的工具。
背景
神经退行性疾病和其他脑损伤是巨大的个人和经济负担[1].基于细胞的治疗被认为是一种新兴的治疗范式,它有可能再生受损组织并恢复大脑功能。虽然管理不同类型干细胞疗法的安全性和可行性似乎已得到合理证明,但由于临床试验结果相互矛盾,其疗效仍不确定[2].临床设置的一个主要限制是选择可靠和可扩展的细胞源,因为一次移植可能需要多达10亿个细胞[3.].大多数临床试验依赖于初级间充质干细胞(MSCs)的使用,因为它们在成人体内无处不在。然而,间充质干细胞在异质性、可扩展性和分化潜力方面存在主要缺陷,特别是在神经谱系的细胞类型方面。诱导多能干细胞(iPSC)技术的最新发展促进了神经祖细胞(npc)的无限生成,这是一种通过细胞替换、神经保护和/或免疫调节实现脑再生的更均匀的细胞来源[4].
在将iPSC技术推向临床现实的同时,也出现了关于重编程后转基因的存在、培养基中的异种因子以及移植物受体中未分化细胞形成畸胎瘤的风险的挑战[5].
仙台病毒非整合RNA载体的使用使重编程无需载体和转基因序列[6].此外,改进的鼻咽癌分化和培养方案使其能够在定义的介质中传播,消除异种因子[7].可以通过应用高效的分化方案和/或有效的纯化技术来降低畸胎瘤形成的风险,例如RNA开关技术专门消除培养物中的多能残馀[8,9].该技术基于细胞特异性微RNA (miRNA)的存在,可用于从细胞培养中富集或消除特定的细胞类型。这些进步提高了npc在临床前和临床体内应用的安全性和可行性。然而,在将细胞疗法转化为标准临床应用之前,人们对体内系统中移植细胞的时空动力学、生存能力和分化表型的理解仍然很差。
在这里,我们在没有基因组修饰的情况下,在无异种化合物的化学定义的环境下,从iPSCs中生成并描述了npc。生成的npc在15个传代中表现出稳定的基因表达,并能够在体外自发分化为功能活跃的神经元。我们使用rna开关技术消除残留的iPSCs,进一步确保了纯npc种群。为了表征npc在体内的命运,使用由生物发光和荧光报告器组成的双报告器系统转导细胞。移植后1个月对移植移植物进行纵向跟踪和表型分析。NPCs的分化图谱显示,随着各种神经元标记的表达,NPCs对神经元命运有强烈的偏好。在本研究分析的基础上,我们证明了高纯度npc的可靠生成,并降低了在小鼠体内长期应用的多能残留风险。
方法
生成和维护npc
npc的生成如前所述[10作了修改。详细地说,在第2天,每孔80.000个iPSCs被镀在12孔板上,涂上Vitronectin (StemMACS iPS-Brew XF (Miltenyi),补充2uM Thiazovivin),并孵育一夜。
第1天,细胞在PBS中清洗一次,并将培养基换成新鲜的StemMACS iPS-Brew XF。
第0天,PBS清洗细胞,将培养基换成神经诱导培养基1 (50% DMEM/F12, 50% Neurobasal培养基,1 × N2-supplement, 1 × B27-supplement, 1 × Glutamax, 10 ng/ml hLIF, 4µM CHIR99021, 3µM SB431542, 2µM Dorsomorphin, 0.1µM Compound E)诱导鼻咽腺细胞分化,第1天加入新鲜培养基。第2天用PBS清洗细胞,培养基改为神经诱导培养基2 (50% DMEM/F12, 50% Neurobasal培养基,1 × N2-supplement, 1 × B27-supplement, 1 × Glutamax, 10 ng/ml hLIF, 4µM CHIR99021, 3µM SB431542, 0.1µM Compound E),每天更换培养基,连续4天。第6天,细胞在神经干细胞维持培养基(NSMM, 50% DMEM/F12, 50% Neurobasal培养基,1 × N2-supplement, 1 × B27-supplement, 1 × Glutamax, 10 ng/ml hLIF, 4 μ M CHIR99021, 3 μ M SB431542)中分离到pLO/ l521包被板上。
每天更换NSMM培养基,达到80-100%融合时分裂细胞。在前6个传代中,分裂后加入2µM噻唑维文。在NSMM培养基上添加5 ng/ml FGF2。详见附加文件中的培养基和细胞培养材料8:表S1。
npc的神经分化
NPCs以NSMM + 5 ng/ml FGF2在24孔板上接种20 000个细胞/ml。通过去除CHIR99021、SB431542、hLIF和FGF2小分子诱导分化。细胞在不含小分子、hLIF和FGF2的NSMM中培养21天,第一周每天更换培养基,第2周和第3周分别每隔一天或两周更换一次培养基。
NPC转导在活的有机体内跟踪
对于体内细胞追踪,从System Bioscience获得双报告慢病毒质粒pll410_ef1a - rffc - t2a - gfp - mpgk - puro (LL410PA-1)和pll - cmv - rffc - t2a - gfp - mpgk - puro (LL310PA-1)。如前所述进行慢病毒的生成[11].对于NPC转导,65万个细胞/孔被NSMM + 5 ng/ml FGF2接种。24 h后,更换培养基时每孔加入20 μ l病毒(= 1/100病毒/孔)。
NPC转导与钙成像
腺相关病毒(AAV)滴度≥1 × 1013vg/ml,在人突触素启动子(pAAV-hSyn1-mRuby2-GSG-P2A-GCaMP6s-WPRE-pA)下表达mRuby2和GCaMP6s,购自Addgene (50,942-AAV1)。按上述方法将npc分化为神经细胞,并在细胞播种后5天,在µ-Slide 4孔中每孔加入1.44 μ l病毒溶液进行转导。对于神经元刺激,在成像期间添加氯化钾至最终浓度为60 mM。
图像采用Leica SP8共聚焦显微镜,配备10 × HC PL FLUOTAR 0.30 DRY物镜。GCaMP6s的图像设置如下:488 nm激光激发(氩激光);Xyt扫描模式;512 × 512像素;15 min延时成像,间隔1.29 s;200赫兹。mRuby的图像设置如下:561 nm激光激发(DPSS);Xyz扫描模式;1024 × 1024像素;100赫兹。
mRuby和GCamp6的图像量化
对于mRuby的定量,在随机选择的感兴趣区域(ROIs)中测量mRuby的荧光信号强度,并使用Fiji (ImageJ)归一化为DAPI细胞计数。对于GCamp6定量:每种条件下至少鉴定出20个分化神经细胞,并使用Fiji (ImageJ)将其描绘为roi。在500 s以上连续测量这些roi中的荧光信号强度。
qPCR
RNA提取使用Quiagen RNeasy试剂盒,按照制造商的建议进行。qPCR使用SYBR绿色试剂盒(Biorad公司的iTaq Universal SYBR green Supermix),每个引物含有0.5µM,循环条件如下(保持阶段:95°C, 10 min, 1个循环;PCR阶段(95°C, 15 s, 60°C 1 min;95°C 15 s, 40个循环;熔化曲线(95°C, 15 s, 60°C, 1 min)。人类总脑总RNA (ThermoFisher, QS0611)作为阳性对照(见附加文件)9:表S2)。
免疫细胞化学
用4%多聚甲醛(PFA)/4%蔗糖固定细胞进行ICC,用驴血清进行阻滞染色。在4℃下孵育一抗,即NPC特异性标记Pax6、Sox1和Nestin以及iPSC特异性标记Oct4。次日,二抗室温孵育2小时,DAPI染色。共聚焦显微镜成像。
流式细胞术
细胞解冻并在FACS缓冲液(0.1% BSA在PBS中)中孵育,活/死固定近红外染色(分子探针)在4℃下孵育30分钟。随后,细胞在RT下在1%的PFA中固定20分钟,并在4℃下用含有0.5%皂素的FACS缓冲液渗透20分钟。细胞内抗体Pax6、Nestin、Sox1、Oct4在4℃下染色30 min。使用LSR Fortessa (BD Bioscience)获取细胞,并用FlowJo软件(Tree Star)分析数据。
核型分析
npc的核型分析如前所述[11].简而言之,在相关传代,用80 ng/ml灭血剂处理npc以实现中期阻滞,从而使染色体可见。收集细胞,在75 mM KCl中孵育15分钟,并在3:1的甲醇/醋酸混合物中固定30分钟。涂抹在甲醇清洗过的载玻片上,干燥一夜,在阿那平溶液中染色10分钟,并使用Zeiss Axioskop HBO 50荧光显微镜(Zeiss)和Ikaros Software (MetaSystems)进行分析。
核糖开关
RNA开关的制备如前所述[8,12].简单地说,使用带有T7启动子和poly(a)尾的适当引物,从编码Barnase、Barstar或purromycin的载体中PCR扩增正常mRNA体外转录的模板DNA。使用含有5'UTR位点miRNA反义序列的引物,从同一载体上扩增miR-302a-5p响应性关闭开关(Barstar)模板。对于miR-302a-5p响应性ON开关(Barnase),通过第一次PCR从同一载体扩增开放阅读框、poly(A) tail和miRNA反义序列。然后,PCR产物和额外的序列按此顺序融合,进行第二次PCR。所有模板dna均采用MinElute PCR纯化试剂盒进行纯化。使用MEGAScript T7转录试剂盒,使用1-甲基伪尿苷-5 ' -三磷酸和Anti Reverse Cap Analog, ARCA,在37℃下转录6h。转录RNA用Turbo DNase I和antarctic磷酸酶处理去除模板DNA,用RNeasy MinElute Cleanup Kit (QIAGEN)纯化。采用Qubit microRNA Assay Kit测定其浓度。
转染前一天,细胞按上述方法传代,并将其播种到PLO/L521涂层板上。第二天,用Lipofectamin RNAiMAX转染试剂转染mRNA。将转染复合物滴入细胞,搅拌后放入培养箱,4h后更换培养基。为了去除未转染的细胞,用2µg/ml嘌呤霉素处理24h进行嘌呤霉素筛选。最后用流式细胞仪对细胞进行分析。
在体外荧光素酶检测
将细胞接种于24孔板上,制作一系列稀释荧光素标准曲线(起始浓度为300 ug/ml)。细胞在37℃孵育10分钟后,用Tecan M1000 pro测量生物发光。
NPC可行性分析
为了确定解冻后和移植前NPC的活力,将NPC(15万个细胞/ml PBS)存放在冰上,并使用Vi-Cell XR细胞活力分析仪测量细胞活力。
动物
所有的动物实验都是按照政府和机构(苏黎世大学)的指导方针进行的,并得到了苏黎世州兽医办公室的批准(许可证号:31687)。免疫抑制重组激活基因2敲除小鼠(Rag2−−/,n= 3),非肥胖糖尿病SCID γ小鼠(NSG,n= 4)和具有C57BL/6基因背景的野生型(wt)小鼠(10 - 14周龄,雌性和雄性,n= 10)。动物被关在标准的II/III型笼子里,至少成对被关在一个温度和湿度可控的房间里,12/12小时的光/暗循环(从早上06.00亮到下午6:00亮),食物/水自由分配。研究人员对注射的细胞数量以及组织收集和分析进行了盲化。未进行随机分组。所使用的动物数量是根据以前的研究计算的[13].
细胞移植
细胞移植如前所述[14].总之,所有实验均使用传代号≥11的npc。在细胞移植时,GFP+/卢克+npc最终浓度为8 × 104细胞/µL无菌1 × PBS (pH 7.4,不含钙或镁;赛默飞世尔科学公司(Thermo Fisher Scientific))冷冻保存,直到移植。异氟醚麻醉小鼠(4%诱导,1.5%维持;Attane, Provet AG)。止痛剂(Rimadyl;术前皮下注射辉瑞(5mg /kg体重)。动物被放置在立体定向框架中(David Kopf Instruments),手术区域消毒,通过中线皮肤切口暴露颅骨以显示λ而且前囱点。计算坐标(为该方案选择的兴趣坐标为:AP: + 0.5, ML: + 1.5, DV: -0.8相对于bregma),并使用外科牙钻钻一个孔(Foredom, Bethel CT)。小鼠注射1.6 × 105使用10 μ L Hamilton微注射器(33-gauge)和流量为0.3 μ L/min(注射)和1.5 μ L/min(提取)的微泵系统(2 μ L/min)进行细胞(2 μ L/注射)。此外,连续稀释(1.8 × 105, 1 × 105, 6 × 104, 1.2 × 104, 6 × 103.)的npc注入皮层(AP: + 0.5, ML: + 1.5, DV: -0.8相对于bregma),以确定在体内可检测到的最小细胞数。伤口用6/0丝线缝合,老鼠在装有加热垫的笼子里恢复。对于术后护理,所有动物术后均接受至少2天的镇痛药(Rimadyl, Pfizer)。中风小鼠在中风诱导后7天接受鼻咽癌移植,因为这段时间在临床上被认为更相关,并且与急性移植到不利的中风环境相比,移植物存活率更高[15,16].
血栓形成致卒中
如前所述,在野生型(wt)小鼠中诱导光血栓性卒中[14,17- - - - - -20.]以及NSG和Rag2−−/老鼠。简而言之,使用异氟醚(4%诱导,1.5%维持,Attane, Provet AG)麻醉小鼠。在手术开始前24小时,患者通过饮用水给予镇痛药(诺瓦金、赛诺菲)。在右侧感觉运动皮层诱发了光栓性损伤。简单地说,动物被固定在立体定向框架中(David Kopf Instruments),手术区域(从脖子后面到眼睛)被剃毛并消毒(Betadine, Braun)。使用面罩维持麻醉。使用眼部润滑剂(维生素A,博士伦),并使用加热垫将体温持续保持在36°至37°C之间。头骨通过皮肤正中切口暴露。一个冷光源(Olympus KL 1500lcs, 150 W, 3000 K)被放置在右脑前脑皮层(前/后:相对于Bregma: - 1.5 - + 1.5 mm,内侧/外侧0毫米至+ 2毫米)。光照前5分钟,腹腔注射孟加拉玫瑰(15 mg/ml, 0.9% NaCl, Sigma)。 Subsequently, the exposed area was illuminated through the intact skull using an opaque template with an opening of 3 × 4 mm. After 10.5 min, light exposure was stopped and the wound was closed using a 6/0 silk suture. For postoperative care, all animals received analgesics (Novalgin, Sanofi and Rimadyl, Zoetis) for at least 3 days after surgery.
免疫组织化学
为了进行组织学分析,动物通过腹腔注射戊巴比妥(150 mg/kg体重,Streuli Pharma AG)和经心灌注林格氏溶液(含5 ml/l肝素,B. Braun)安乐死,然后再用PFA (4%, 0.2 M磷酸盐缓冲液,pH 7)。大脑在同一固定液中固定约4小时,然后转移到30%蔗糖中进行冷冻保护,并在4°C保存。使用滑动切片刀(Microm HM430,徕卡)切割厚度为40 μm的冠状切片,收集并作为自由漂浮切片保存在−20°C的冷冻保护剂溶液中,直到进一步加工。
脑切片用0.1 M磷酸盐缓冲液(PB)清洗,并用含有驴血清(5%,Sigma)的阻塞溶液在PB中室温孵育60分钟。切片用小鼠抗核抗体(Merck, 1:100)在4°C孵育过夜,用于移植的人npc染色。为了识别不同发育阶段的移植细胞,使用了以下抗体:山羊抗人NANOG(研发系统,1:200),兔子10 - 4a(细胞信号技术,1:200),小鼠抗pax6单克隆抗体(赛默飞世尔科学,1:200),小鼠抗neun抗体(默克,#MAB377, 1:200),兔抗神经丝200抗体(默克,#N4142, 1:100),兔抗betaiii - tubulin抗体(Abcam, #ab18207, 1:500),小鼠MAP2单克隆抗体(赛默飞世尔科学,1:100),兔抗s100b抗体(赛默飞世尔科学,1:300)。为了鉴定增殖细胞,使用兔抗ki67抗体(赛默飞世尔科学公司,1:150)。一抗孵育后,与相应荧光二抗(1:500,赛默飞世尔科技公司)在室温下孵育2小时。用DAPI (1:2000, 0.1 M PB, Sigma)对细胞核进行反染色。切片装在0.1 M PB的Superfrost PlusTM显微镜载玻片上,并嵌入Mowiol。所有图像均使用徕卡SP8激光扫描共聚焦显微镜,配备10x, 20 ×和40 ×物镜。图像处理使用斐济(ImageJ)和Adobe Illustrator CC。
他染色
冠状切片厚度为40 μm,用0.1 M PBS冲洗,苏木精/伊红(HE)染色。在光学显微镜(徕卡SP8激光扫描共聚焦显微镜)下病理观察,每张玻片在20 ×和40 ×放大倍率下随机选取2个视图(中风区、对侧区)。
梗死面积和容积定量
采用GFAP、IBA1和DAPI染色计算梗死面积和体积。染色的冠状脑切片使用Axio扫描成像。Z1 slidescanner;缺血性病变明显为小胶质细胞浸润区,周围为GFAP+细胞。使用Fiji (ImageJ)在每个大脑的5 - 6个冠状面上勾画梗死区域(取自Bregma单位:mm;2、1.5、0.5、−0.50、−1.5、−2)。总梗死体积由平均梗死面积乘以各节段之间的距离得到。
在活的有机体内生物荧光成像
生物发光成像(BLI)实验采用IVIS光谱CT (PerkinElmer)进行,如前所述[14].对于长期实验,动物在移植后24小时开始定期成像,持续35天。研究中用来确定最小可检测细胞数量的动物仅被成像一次移植后1.5 h。将30 mg/ml d -荧光素钾盐(PerkinElmer)溶解在NaCl (0.9%, B. Braun)中,并用0.22 μ m注射器过滤器消毒。在异氟醚麻醉前腹腔注射荧光素,最终剂量为300 mg/kg体重(4%诱导,1.5%维持;Attane, Provet AG)。在第一次BLI记录之前,动物的头部区域被剃光。在以下设置下进行图像采集20分钟:视野:A,被摄对象高度:1.5厘米,分框:16,F/Stop: 2.曝光时间(从1到60秒)由系统自动设置,以达到最敏感的设置。成像参数和测量程序在受试者内部和受试者之间保持一致。
在活的有机体内成像分析
体内BLI数据使用Living Image Software (LI 4.7.3)进行分析,如前所述[14,21].简单地说,roi是根据每张图像上的解剖标志(眼睛、耳朵和鼻子)手动绘制的。用RStudio进行作图和统计分析。计算并校正了从动物背部皮肤上的ROI提取的非特异性信号和从小鼠外部的ROI提取的噪声。信噪比(SNR)由平均光子通量(ph/s/cm)除以计算2/sr)为噪声的标准差。用平均光子通量减去背景通量计算生物发光信号。
统计分析
采用RStudio 4.0进行统计分析。根据我们之前的研究,我们设计了足够的样本量。所有数据均采用Shapiro-Wilk检验进行正态分布检验。正态分布数据用双尾未配对单样本检验差异t-test比较两组之间的变化(转导细胞与对照细胞的GFP表达),如图所示。4F.如图所示的多重比较。1C和附加文件1:图S1A (NPC基因表达差异),图。2B,C,F(蛋白质荧光强度),图3.D (FACS iPSC信号)初步用Shapiro-Wilk检验进行正态分布检验。使用Tukey的HSD评估正态分布多重比较之间的平均差异的显著性。统计学意义定义为∗p< 0.05,∗∗p< 0.01,且∗∗∗p< 0.001。
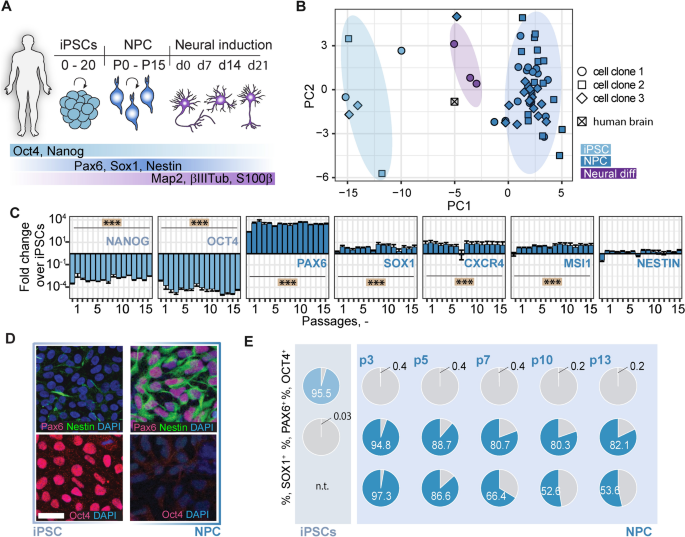
ipsc衍生npc的生成和描述。一个:所分析的细胞类型、时间框架和用于表征的主要标记蛋白的示意图表示。B: NPCs(3个克隆,深蓝色)、iPSCs(3个克隆,浅蓝色)、神经分化后21d的npc(克隆1,紫色)和人脑总RNA的qPCR数据的主成分分析。每个符号都很好地说明了从一个细胞培养物中提取的RNA的数据。C: qPCR检测15代NPC中多能性标志物(NANOG、OCT4)和NPC标志物(PAX6、SOX1、CXCR4、MSI1、NESTIN)的基因表达。D: Pax6、Nestin、Oct4和DAPI染色的iPSCs(左图)和通道7-10处的npc(右图)。E:流式细胞术分析Oct4、Pax6和Sox1不同传代的iPSCs(上行)和npc(下行)。饼图说明了各自标记物和细胞类型的阳性百分比(浅/深蓝色)。Neural diff:神经分化后的npc;CXCR4: cxc基序趋化因子受体-4;MSI1: Musashi-1;比例尺:50µm。使用Tukey 's HSD评估组间平均差异的显著性。星号表示显著性:*** P < 0.001
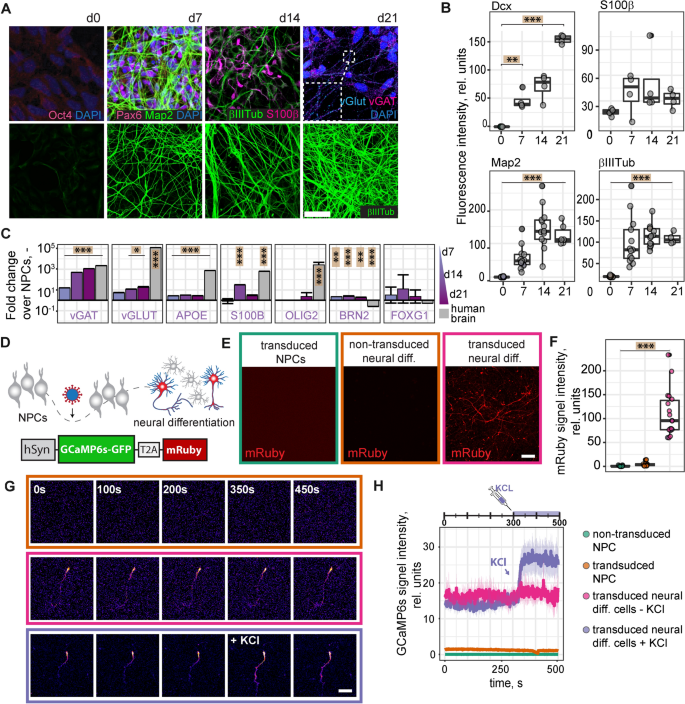
npc的神经分化。一个:分化后的npc,在分化后的第21天(上行),对Oct4、Pax6、Map2、βIII-Tubulin、vGlut和vGat进行染色。分化后的npc在分化后的d0、d7、d14和d21(下排)进行βIII-Tubulin染色。B:定量NPCs分化d0、d7、d14、d21时显微图像的荧光强度,染色Dcx、S100β、Map2、βIII-Tubulin。C: qPCR检测神经分化后7、14、21d神经元(vGAT、vGLUT、BRN2、FOXG1)、星形胶质细胞(APOE、S100β)和少突胶质细胞标记物(OLIG2)基因表达。人脑总RNA作为对照。D:在人突触素启动子下测定分化npc活性的实验设置和GCaMP6s和mRuby表达的AAV结构。E:基于突触素启动子的mRuby在npc和分化神经细胞中的表达。用AAV-mRuby结构转导的npc共聚焦图像(左),分化后d21处分化的npc(中)和分化后d21处分化的npc并用AAV-mRuby结构转导的共聚焦图像(右)。F: mRuby信号在转导的npc(左)、未转导的分化神经细胞(中)和转导的神经细胞(右)中的定量。1G。G:未转导的分化神经细胞(上排)和经AAV-GCaMP6s构建物转导的神经细胞(中排)的共聚焦延时图像。350 s后,用60 mM KCL处理细胞(下排)。比例尺:50µm。H:共焦延时图像中GCaMP6s信号强度的量化。vGAT囊泡GABA转运体,vGLUT泡状谷氨酸转运体,克莱斯勒doublecortin,βIIITubβIII-Tubulin,hSyn人类synapsin。箱线图表示数据的25-75%的四分位数。图中的每个点很好地代表一个细胞培养,使用Tukey的HSD评估组间平均差异的显著性。折线图绘制为均值±sem。*表示显著性:* p < 0.05, ** p < 0.01, *** p < 0.001
结果
生成功能性的纯ipsc衍生npc
为了产生具有高翻译潜力的人类神经细胞,我们将人类iPSCs分化为神经祖细胞(npc)(图。1A).同样是在异种和无饲料条件下,使用双smad抑制进行npc的分化和维持。npc被扩展和描述了至少15个段落。在神经诱导(1个克隆)后7、14和21天,对iPSCs(3个不同克隆)、npc(3个不同克隆)和分化细胞的基因表达分析显示细胞类型而非克隆特异性聚类(图2)。1B)人类整个大脑样本聚集在神经细胞旁边,这些神经细胞是从npc中分化出来的。NPCs中多能标记物NANOG和OCT4基因表达高度下调(均p < 0.001),而神经祖细胞标记物PAX6、SOX1、CXCR4和MSI1在15个传代中稳定上调(均p < 0.001,图。1C).相比之下,HAND1和FOXA2,分别为中胚层和内胚层谱系的标记,没有上调,即使在高传代也保持持续的低水平(附加文件)1:图S1)。免疫染色显示NPC阳性Pax6和Nestin,而非Oct4,而iPSCs阳性Oct4,而非Pax6(图)。1D)。观察到Nestin轻度染色。这些结果得到几次传代流式细胞术分析的支持(图。1E).不同传代(p5, p8, p12和p15)的核型分析显示一个稳定的44,XX核型(附加文件2:图S2)。在另外两个iPSC克隆系中进一步测试了NPC分化方案,得到了类似的结果,表明强大的NPC分化(附加文件)3.:图S3)。
为了确定生成npc的自发神经分化潜能,我们在3周内从NSMM中提取了CHIR99021、SB431542、hLIF和FGF2。分化神经细胞的免疫细胞化学分析显示,神经元标记物Map2和βIII-Tubulin、星形胶质细胞标记物S100β以及NPC标记物Pax6表达,但不表达多能标记物Oct4(图4)。2上一行)。泡状谷氨酸转运体(vGlut)和泡状GABA转运体(vGat)沿神经突呈点状染色,提示神经元间突触收缩的形成。此外,βIII-Tubulin阳性神经突的数量(图;2A,下排)以及Map2和doublecortin的荧光强度(DCX,图。2B)随着时间的推移而增加(所有p < 0.001),表明分化过程中神经细胞数量和网络复杂性逐渐增加。与未分化的npc相比,分化细胞的突触基因表达呈时间依赖性增加(vGAT:均p < 0.001;vGLUT: p < 0.05 (d14, d21))2C).星形细胞基因APOE和S100β也部分上调(APOE:均p < 0.001, S100β: d14: p < 0.001);d21时少突胶质细胞标记物水平略有升高,但无显著性差异(均p > 0.05)。BRN2和FOXG1水平升高提示兴奋性皮层神经元的存在。为了证实分化的神经细胞是活跃的并对刺激有反应,我们使用腺相关病毒(adeno-associated virus, AAV)在人突触素1启动子下表达mRuby2和钙传感器GCaMP6s。2D).仅在分化的神经细胞中观察到mRuby的表达,而在未分化的npc中则没有(p < 0.001,图。2E, F)表明突触素1启动子仅在分化细胞中有活性。通过共聚焦活体成像分析,神经细胞在基线时显示出更高的GCaMP6s信号,添加60 mM KCl立即增加了GCaMP6s荧光(图2)。2G H)。
综上所述,在无异种条件下产生的ipsc衍生NPC表现为i)典型NPC标记的上调,ii)多能性标记的强烈下调,iii)在体外自发分化为功能神经元和胶质细胞。
使用RNA开关消除ipsc
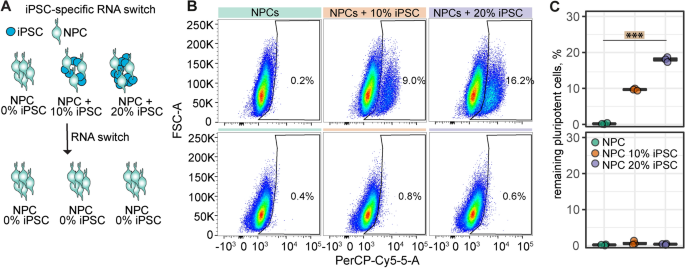
剩余的多能细胞是基于ipsc的细胞治疗的主要问题。为了降低iPSC残留的风险,我们利用RNA开关技术来消除潜在的残留iPSC。RNA开关被设计用于特异性检测hiPSCs中高表达的miR-302a-5p,并消除细胞培养中的iPSCs [8,12,22].由于我们的分化方案已经产生了高度纯净的NPC群体,我们通过向NPC培养物中添加10%和20%的iPSCs来测试mRNA开关的功效(图2)。3.A).在这两种条件下,我们都能够将培养物的ipsc含量降低到oct4阳性iPSCs的< 1%,通过流式细胞术检测。阴性对照RNA开关,即不含RNA的脂质细胞,不影响添加的iPSCs的数量(图2)。3.B, C)。
功能化的npc在活的有机体内跟踪
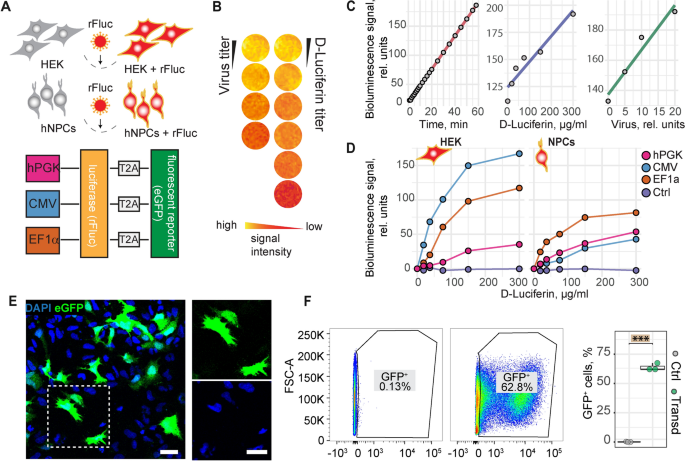
为了能够在移植后跟踪npc,我们建立了一个结合荧光(GFP)和生物发光(红萤火虫荧光素酶(rfLuc))报告器的双报告器系统。我们确定了三种常用启动子的最佳表达条件,并测试了发光信号强度,即人磷酸甘油酸激酶(hPGK)、巨细胞病毒(CMV)和人伸长因子1α (EF1α)启动子(图1)。4A).发光信号随暴露时间、病毒滴度以及底物(d-荧光素)浓度呈线性增加(图。4当rfLuc在EF1α启动子下表达时,NPCs的发光信号最强,而CMV的发光信号最低(图2 - 3)。4D).这与HEK细胞相反,在HEK细胞中,cmv驱动的rFluc表达产生了最强的发光信号,这表明启动子必须根据使用的细胞类型来选择。在接下来的实验中,使用EF1α启动子下的慢病毒双报告子转导的npc,其转导效率为∼60 - 70%(无花果。4E、F)。
双报告体系的体外优化与验证。一个:实验设置和慢病毒双报告基因表达结构的示意图。荧光素酶和eGFP在hPCK、CMV或EF1α启动子下表达。B:体外荧光素酶试验,伪彩色显示。C:生物发光信号(rel.单位)与检测时间、病毒量、d -荧光素浓度之间的线性回归散点图。D发光实验显示HEK细胞(左)和npc(右)的发光信号,取决于使用的启动子。E:转导npc的荧光图像。矩形显示了一个放大的部分,如右侧所示。F:未转导细胞(左图)和转导细胞(右图)中GFP +细胞的流式细胞术。GFP +细胞的定量(右图)。箱线图表示数据的25-75%的四分位数。图中的每个点很好地代表一个细胞培养,使用Tukey的HSD评估组间平均差异的显著性。星号表示显著性:*** p < 0.001。rfLuc:红萤火虫荧光素酶;hPGK:人磷酸甘油激酶;巨细胞病毒:巨细胞病毒;EF1α:伸长因子1;比例尺:10µm; Line graphs are plotted as mean.
npc的移植和追踪在活的有机体内
为了对npc进行深入的体内表征,我们移植了1.6 × 105细胞定向进入wt小鼠的右皮层(AP: + 0.5 mm, ML: + 1.5 mm, DV:相对于小叶苞- 0.8 mm)和基因免疫抑制的NSG或Rag2−−/老鼠。
由于我们使用的是刚解冻的细胞进行移植,而移植各种动物可能很耗时,因此确保NPC在解冻后和移植前几小时内的存活率稳定是非常重要的。因此,我们分析了npc在解冻后的生存能力。将npc解冻,在冰上保存24小时,并在不同时间点使用Vi-Cell XR细胞活力分析仪测量细胞活力。在解冻后的前10小时内,存活率略有下降,但在接下来的14小时内仍保持在> 75%不变(附加文件4:图S4)。
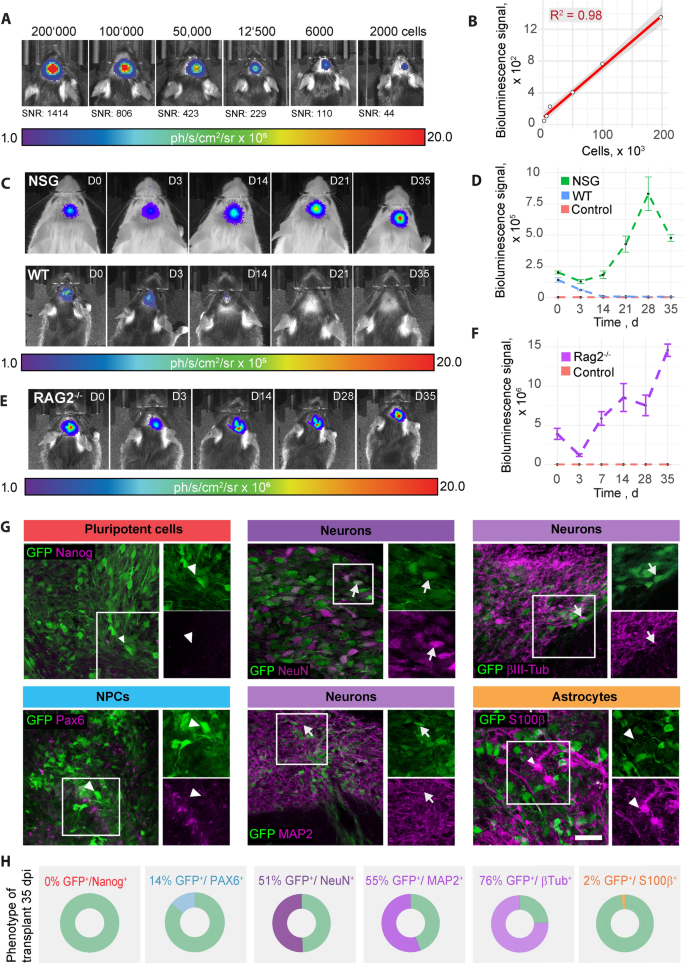
为了确定生物发光成像(BLI)在体内可检测到的最小细胞数,将(2 × 105, 1 × 105, 6 × 104, 1.2 × 104, 6 × 103., 2 × 103.)移植并使用生物发光成像。值得注意的是,即使移植的细胞数量最低,2 × 103.可检测到npc(图;5A).生物发光信号与移植细胞数量呈线性关系2= 0.98(图5B)。
移植npc的分析和体内跟踪。一个:不同数量的rf鲁克表达npc移植到C57/Bl6小鼠大脑1.5 h后的生物发光。B:生物发光信号与移植细胞数量关系的线性回归散点图。C:通过体内生物发光成像测量,移植到NSG(上行)和C57/Bl6小鼠(下行)的表达rfuck的npc在35d内的生物发光。1.6 × 105细胞被移植了。D: BLI信号强度随时间的变化(每株平均±SEM, SBR)。E:移植到中风的Rag2-/-小鼠的rf鲁克表达npc的生物发光。F: BLI信号强度随时间的变化(每株平均±SEM, SBR)。G:中风Rag2中移植npc的代表性组织学染色,移植后35d−−/老鼠。箭头表示表达gfp的细胞,这些细胞对各自的制造者来说是阴性的。箭头表示标记物和绿色荧光蛋白阳性。比例尺= 50um。H:定量各自标记物和GFP阳性的细胞。BLI生物荧光成像,信噪比信噪比,WT野生型,NSG: NOD scid gamma。折线图绘制为均值±sem
在wt和NSG小鼠的35d时间过程中,分析双记者表达npc的存活率。虽然在wt小鼠中BLI信号随着时间的推移不断降低,并在d12至d21之间完全衰减,但NSG小鼠中的BLI信号增加,直到在d21至d35之间达到一个平台期(图2)。5C, D).这表明免疫抑制对于移植的人类npc的存活至关重要。
为了模拟更加临床相关的场景,我们立体定向地将rfook - egfp npc移植到中风Rag2的缺血性大脑中−−/老鼠。行程体积约为1mm3.受伤后42天(附加文件5:图S5)。我们使用生物发光成像证实了移植物的长期存活时间为35天,与未受伤的动物相似(图2)。5E、F)。
为了评估移植NPCs的长期分化情况,我们对中风小鼠移植后35天NPCs的表型进行了组织学表征。大多数移植的是GFP+细胞表达多种神经元命运标志物(55% Map2, 76% βIII-Tubulin;51% NeuN)(图;5G, H), 14%移植GFP+细胞仍表达神经祖细胞标记物Pax6,仅2%的细胞表达星形胶质细胞标记物S100β。重要的是,移植后35天没有检测到nanog阳性细胞。观察苏木精-伊红(HE)染色冰冻切片(植入部位皮层冠状切片)。他们证实存在卵圆形核和稀疏细胞质的单形小细胞群。未观察到有丝分裂征,且无坏死、炎症反应或明显间质或新血管形成的证据(附加文件)6:图S6)。此外,将移植细胞与抗Ki67(增殖细胞标记物)和抗人细胞核(HuNu;标记移植的人类细胞)抗体显示只有1%的双阳性细胞,表明非常低的增殖率(附加文件7:图S7)。也观察到少量内源性(hunu阴性)增殖细胞。这些发现与肿瘤没有转化和生长一致。
总之,我们从无异种诱导多能干细胞中生成了高纯的npc。这些细胞可以在体内进行纵向追踪,并使用双报告系统在大脑切片中进行识别。这些npc在体内和体外都具有自发分化为功能性神经元的能力.
讨论
尽管神经退行性疾病和脑损伤的发病率很高,但临床治疗仍然有限。iPSC技术的进步使细胞疗法重新成为大脑治疗方案的焦点。5].在这里,我们描述了用于体内应用的ipsc衍生npc的生成。通过修改先前建立的单层协议[10,23我们生成了高度可扩展的NPC文化18npc从10开始经过15个通道6ipscs -无xeno和化学定义。因此,这种简单的单层方案,不需要细胞选择和纯化,可以顺利适应gmp级临床应用。这是非常重要的,因为在从研究级到符合gmp标准的临床级细胞生产的过渡过程中,培养基成分或细胞涂层的变化会强烈影响iPSC分化潜力和产生的细胞的特征,这将使潜在的临床转化复杂化。我们将三个iPSC克隆系分化为NPC,并显示所有系之间经典NPC标记蛋白的表达水平相当。基因表达分析显示细胞类型依赖的聚类,可以清楚地区分iPSCs、npc和神经细胞,而在npc中未观察到基于细胞克隆的聚类。虽然典型的NPC标记增加,但其他细胞系标记(即中胚层和内胚层)的mRNA水平在所有传代中保持较低,表明NPC身份稳定。为了确定NPCs自发分化为神经细胞的潜力,我们从干细胞维持培养基中提取GSK-3β抑制剂CHIR99021、TGF-β抑制剂SB431542、hLIF和FGF2,并培养4周。我们发现细胞的增殖速度减慢,并分化为神经元、星形胶质细胞和少突胶质细胞。钙传感器GcAMP6在突触素启动子下的表达表明,细胞对KCl刺激有活性,并有反应,提示细胞分化为功能神经元培养物。基因表达分析进一步显示,分化的神经细胞与人脑裂解物紧密聚类,证实了ipsc来源的npc的高翻译方面。
除了可扩展性,细胞治疗的另一个关键点是分化细胞的纯度。治疗产品中残留的多能细胞可导致畸胎瘤形成[5].通过应用高效的分化和纯化方案,可以大大降低肿瘤的风险。虽然本研究中iPS细胞系的分化非常有效,在NPC培养中多能性基因大幅减少,且oct4阳性细胞≤0.4%,但不能排除其他iPS细胞系分化为NPC时可能不会产生如此高的纯度。因此,我们测试了获得的npc与合成RNA开关的兼容性,这是一种最先进的细胞纯化技术。RNA开关技术是在混合培养中富集或消除特定细胞类型的强大工具[24].当我们向NPC培养物中添加iPSCs(10-20%)时,RNA开关导致iPSCs的消除回到基线信号。重要的是,当我们将RNA开关应用于不添加iPSC的npc时,我们没有观察到差异-流式细胞仪仍然显示0.2-0.4%的oct4阳性细胞。这表明本研究中使用的NPC培养物已经非常纯净,RNA开关技术无需进一步提高其纯度。因此,移植后4周,我们在体内未观察到肿瘤形成的迹象。
最近,越来越多的研究报告了使用gmp兼容技术从胚胎干细胞或诱导多能干细胞中生产npc或神经干/祖细胞(NSPCs) [7,25- - - - - -27].使用ipsc来源的nspc治疗脊髓损伤的首次人体研究目前正在庆应义塾大学准备Hospital,东京,日本[27].目前正在对ipsc衍生的多巴胺能前体细胞进行进一步的试验,以治疗帕金森病[28].由于大多数临床策略依赖于异基因细胞疗法(细胞来源于健康供体),基于ipsc的疗法将需要长时间的一般免疫抑制,例如使用他克莫司抑制T细胞活化[16,28].
而许多NPC的分化方案都是费力而繁琐的,需要形成胚状体、神经莲座选择或菌落选择[7,25- - - - - -27],这里应用的方案仅仅是基于单层培养和定义的神经诱导介质的治疗。一些研究进一步限制了NPSc在体内的应用,是由于缺乏适当的移植存活的长期体内成像技术而依赖于终点测量。为了解决这一问题,我们使用慢病毒介导的由rFluc和eGFP组成的双报告基因的表达,通过生物发光成像在体内跟踪移植细胞,并通过eGFP信号识别脑切片中的移植细胞。不同启动子的比较表明,EF1α在npc中发出的发光信号最高,而cmv介导的表达最低。有趣的是,这与我们在HEK细胞中的发现相反,即不同类型的细胞具有不同的启动子活性。这一发现与先前的观察相一致,这些观察表明干细胞可以沉默外源性启动子,如CMV [29].
虽然我们在体内生物发光成像中达到了高灵敏度和强信号,但不可能解决相邻大脑区域的局部细胞迁移。此外,其他细胞类型/细胞系的生物发光信号可能因启动子强度或荧光素代谢的差异而变化。在需要静脉/全身注射细胞的实验设置中,细胞检测也可能变得更具挑战性,因为预期在血脑屏障(BBB)的低传输率。这些影响在神经退行性变或脑损伤患者和动物模型中可能不那么明显,这些患者和动物模型通常与血脑屏障损伤和通透性增加有关[19,30.].此外,我们在本研究中重点研究了移植细胞在健康和中风小鼠中的植入和表型。我们没有进行行为实验,也没有评估移植细胞是否有助于改善功能恢复。然而,细胞疗法在实验性中风后的功能益处以前已经被彻底描述过[31- - - - - -33].
在我们的研究中,我们植入了新鲜解冻的npc,而不需要在移植前将细胞进行培养。因此,这些细胞代表了一种潜在的细胞移植现货产品。移植后14天,C57/BL6小鼠的细胞存活率显著下降,而非损伤小鼠和中风免疫缺陷小鼠的细胞存活率则呈上升趋势。这表明移植的人类细胞在未受到免疫抑制的小鼠中受到了免疫系统的攻击。这进一步表明,即使在缺血性中风的恶劣环境中,移植的npc也能存活。为了排除NSG小鼠中生物荧光信号的增加是由肿瘤形成引起的,我们分析了脑组织切片。我们在组织学切片中未发现肿瘤形成的证据。相反,大多数egfp阳性的移植物npc分化为神经元,神经元标志物NeuN, MAP2和βIII-Tubulin的高阳性证明了这一点。因此,我们得出结论,生物发光信号的增加要么是由于在分化细胞中表达的增加和/或由于神经元覆盖的区域比较小的npc更大。
我们移植到中风小鼠大脑的大部分npc都分化成神经元,只有2%的细胞星形胶质细胞标记呈阳性。一些体外研究表明,氧气水平有助于决定神经元和星形胶质细胞的比例,从npc分化。20%的氧气产生了3:1比例的神经元和星形胶质细胞,来源于ipsc - npc [34],在低氧条件下观察到星形胶质细胞比例增加[35,36].这与我们研究中移植到中风小鼠大脑的npc产生的少量星形胶质细胞形成了鲜明对比。然而,降低细胞培养中的氧气水平可能不能完全模拟复杂的环境和移植物暴露在中风大脑中的条件。因此,确定体外和体内缺氧条件如何影响我们的npc的分化潜力将是有趣的。此外,还需要后续研究来确定移植的细胞是否能功能地整合到神经网络中,并诱导中风小鼠的功能恢复。
结论
综上所述,我们报道了体外游离的人类npc的产生,这些npc可以功能化以允许随着时间的推移对移植物进行无创体内跟踪。1个月后,移植细胞以神经元表型为主,部分npc残留。未发现肿瘤形成的迹象。这种简单的分化方案与体内细胞跟踪能力相结合,为开发安全有效的脑损伤细胞疗法提供了有价值的工具。
数据和材料的可用性
所有原始数据均可根据相关作者的要求提供。
参考文献
Rust R, Grönnert L, Weber RZ, Mulders G, Schwab ME。缺血中枢神经系统的补充:血管修复的指导分子。神经科学2019;42(9):644-56。
李志强,陈志强,陈志强,等。中风早期临床试验中干细胞疗法的安全性和有效性:系统回顾和荟萃分析。中国生物医学工程学报,2017;8(1):191。
Borlongan简历。简要回顾:中风患者的干细胞治疗:我们还在吗?中国生物医学杂志,2019;8(9):983-8。
段蓉,高原,何瑞,景林,李勇,龚忠,等。诱导多能干细胞治疗缺血性中风。前沿神经科学。2021;15:628663。
基于多能干细胞的细胞治疗——希望与挑战。细胞干细胞。2020;27(4):523-31。
Fusaki N, Ban H, Nishiyama A, Saeki K, Hasegawa M.使用基于仙台病毒(一种不整合到宿主基因组的RNA病毒)的载体有效诱导无转基因人类多能干细胞。中国生物医学工程学报,2009;30(8):348-62。
Bohaciakova D, Hruska-Plochan M, Tsunemoto R, Gifford WD, Driscoll SP, Glenn TD,等。从ES前体中分离人类多能临床级神经干细胞的可扩展解决方案。中国生物医学工程学报,2019;10(1):83。
帕尔CJ,片山S,三木K,匡Y,吉田Y,森根A,等。MicroRNA-302开关识别和消除未分化的人类多能干细胞。科学通报2016;9(6):32532。
Miki K,远藤K,高桥S, Funakoshi S,武井I,片山S,等。利用合成MicroRNA开关高效检测和纯化细胞群。细胞干细胞,2015;16(6):699-711。
桑乔-马丁内斯I, Nivet E, Xia Y, Hishida T, Aguirre A, Ocampo A,等。建立基于人ipsc的胶质瘤起始细胞研究和靶向模型。Nat community . 2016;22(7):10743。
Birnbaum JH, Wanner D, Gietl AF, Saake A, Hock C, Nitsch RM,等。散发性阿尔茨海默病患者ipsc来源神经元中无β淀粉样蛋白和tau病理的氧化应激和线粒体蛋白表达的改变干细胞研究。2018;27:21 - 30。
Fujita Y, Hirosawa M, Hayashi K, Hatani T, Yoshida Y, Yamamoto T, Saito H.一种多功能和强大的细胞净化系统,具有由microrna响应的ON和OFF开关组成的仅rna电路。Sci Adv 2022。https://doi.org/10.1126/sciadv.abj1793
王晓明,王晓明,王晓明,王晓明,等。免疫缺陷小鼠脑卒中病理的分子生物学和解剖学研究进展。bioRxiv。2022.https://doi.org/10.1101/2022.07.28.501836.
韦伯RZ, Bodenmann C, Uhr D, Zürcher KJ, Wanner D, Nitsch RM,等。人神经祖细胞在小鼠脑内的脑内移植和体内生物发光追踪。J Vis Exp. 2022。https://doi.org/10.3791/63102.
Kelly S, Bliss TM, Shah AK, Sun GH, Ma M, Foo WC,等。移植的人胎儿神经干细胞在缺血大鼠大脑皮层中存活、迁移和分化。中国科学(自然科学版),2004;29(3):344 - 344。
干细胞治疗损伤脑的修复:五个原则。神经学家》2022。https://doi.org/10.1177/10738584221110100.
Rust R, Grönnert L, Gantner C, Enzler A, Mulders G, Weber RZ,等。nogo -一种靶向治疗促进中风后血管修复和功能恢复。中国科学院学报(自然科学版),2019;36(4):344 - 344。
Rust R, Weber RZ, Grönnert L, Mulders G, Maurer MA, Hofer AS,等。抗nogo -a抗体预防脑卒中后血管渗漏,并作为促血管生成因子。科学通报2019;9(1):20040。
韦伯RZ, Grönnert L, Mulders G, Maurer MA, Tackenberg C, Schwab ME,等。光血栓性中风模型中血脑屏障破坏的特征。前沿物理。2020;11:586226。
韦伯RZ, Mulders G, Kaiser J, Tackenberg C, Rust R.基于深度学习的鼠类中风恢复行为分析。Biorxiv》2021。https://doi.org/10.1101/2021.08.11.455647v1.
Aswendt M, Adamczak J, Couillard-Despres S, Hoehn M.增强生物发光神经成像:脑研究的优化方案。PLoS ONE。2013; 8 (2): e55662。
Nakanishi H, Saito H.利用microrna反应性合成信使rna纯化从干细胞分化的特定细胞群。方法Mol生物学2021;2312:73-86。
李伟,孙伟,张勇,魏伟,Ambasudhan R,夏鹏,等。小分子抑制剂对人胚胎干细胞原始神经前体的快速诱导和长期自我更新中国环境科学学报,2011;29(2):379 - 379。
Karagiannis P, Fujita Y, Saito H.基于rna的细胞调节基因回路。中国生物医学工程学报(自然科学版);2016;29(3):344 - 344。
Vitillo L, Durance C, Hewitt Z, Moore H, Smith A, Vallier L.临床级人类胚胎干细胞的gmp级神经祖细胞的衍生和分化。中国生物医学工程学报。2020;11(1):406。
vtillo L, Vallier L.从人类胚胎干细胞衍生多能神经祖细胞用于细胞治疗和生物医学应用。入:Turksen K,编辑。分子生物学的方法。新泽西州克里夫顿:施普林格;2021.
Sugai等,ipsc来源的NS/PCs移植在亚急性完全性脊髓损伤中的首次人体临床试验:研究方案。2021.回复你。https://doi.org/10.1016/j.reth.2021.08.005.
高桥J.帕金森氏病的iPS细胞疗法:京都试验。2020; 13:18-22。
夏霞,张勇,张顺生。慢病毒载体介导的转基因基因在人胚胎干细胞中以启动子依赖方式被抑制。中国生物医学工程杂志,2007;16(1):167-76。
Nation DA, Sweeney MD, Montagne A, Sagare AP, D 'Orazio LM, Pachicano M,等。血脑屏障破坏是人类认知功能障碍的早期生物标志物。中华医学杂志2019;25(2):270-6。
李志强,李志强,李志强,等。人神经干细胞增强缺血脑的结构可塑性和轴突转运。大脑。2011;134(Pt 6): 1777-89。
张晓明,李志强,张晓明,等。系统优化的工程水凝胶允许选择性控制中风脑移植后人类神经干细胞的生存和分化。生物材料。2016;105:145-55。
王艳,赵忠,王敏,司光,周艳,等。3k3a活化蛋白C对人神经干细胞缺血后神经元修复的影响。中国医学杂志,2016;22(9):1050-5。
陈振华,陈振华,陈振华,陈振华,等。定义人类多能干细胞子代的性质。中国生物医学工程学报,2012;22(1):178-93。
谢勇,张杰,林勇,Gaeta X,孟X, Wisidagama DRR,等。定义氧张力在人类神经祖细胞命运中的作用。干细胞研究,2014;3(5):743-57。
张志刚,张志刚,张志刚,张志刚,等。患者来源的神经胶质富集祖细胞修复啮齿类动物白质中风和血管性痴呆引起的功能缺陷。中国生物医学工程学报,2015;29(5):544 - 544。
确认
我们感谢Yoshihiko Fujita博士,iPS细胞研究和应用中心(CiRA),京都大学,京都,日本,提供rna开关质质体。我们也感谢Anja Kipar教授,动物模型病理学实验室,兽医病理学研究所,Vetsuisse学院,苏黎世大学,为组织学检查。我们进一步感谢苏黎世大学再生医学研究所Sarina Seiter提供的核型分析和医学遗传学研究所使用其实验室设备的帮助。
资金
作者感谢Mäxi基金会、瑞士3R能力中心(OC-2020-002)和瑞士国家科学基金会(CRSK-3_195902)的资助。
作者信息
作者及隶属关系
贡献
Ruslan生锈:构思和设计,资金支持,数据收集和/或汇编,数据分析和解释,稿件撰写,稿件审批。丽贝卡·韦伯:构思和设计,数据的收集和/或汇编,数据分析和解释,稿件撰写,稿件批准。梅勒妮忠利:构思和设计,数据的收集和/或汇编,数据分析和解释,稿件的批准。黛博拉凯尔:数据的收集和/或汇编,数据分析和解释,稿件的批准。尚塔尔Bodenmann:构思和设计,数据的收集和/或汇编,数据分析和解释,稿件的批准。丹妮拉表:构思和设计,数据的收集和/或汇编,数据分析和解释,稿件的批准。黛博拉万纳:构思和设计,数据的收集和/或汇编,数据分析和解释,稿件的批准。凯瑟琳的消息:构思和设计,数据的收集和/或汇编,数据分析和解释,稿件的批准。Hirohide齐藤:资料的提供,稿件的批准。Simon P. Hoerstrup:构思设计,资金支持,稿件审批。罗杰·m·尼奇:构思设计,资金支持,稿件审批。基督教Tackenberg:构思和设计,资金支持,数据收集和/或汇编,数据分析和解释,稿件撰写,稿件审批。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
人体iPSC系的使用已获得苏黎世州伦理委员会的批准(批准号:2014-0430)。动物实验是根据政府和机构(苏黎世大学)的指导方针进行的,并已得到苏黎世州兽医办公室的批准(许可证号:31687)。
发表同意书
不适用。
相互竞争的利益
Hirohide Saito拥有aceRNA Technologies, Ltd.的股份和外部董事。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1
:图S1。不同细胞谱系标记在npc中的表达。qPCR检测来自三个克隆系的iPSCs和npc在不同传代的外胚层(PAX6)、中胚层(HAND1)和内胚层(FOXA2)细胞系以及多能细胞(NANOG和OCT4)标记物的基因表达。箱形图显示-CT值。
附加文件2
:图S2。人大核型.不同传代npc的q带核型。
附加文件3
:图S3。另外两个iPSC克隆系中iPSC来源的npc的鉴定。A:通过qPCR检测15代iPSC克隆系2(上)和3(下)的NPC中多能性标记(NANOG和OCT4)和NPC标记(PAX6, SOX1, CXCR4)的基因表达。B:流式细胞术分析Oct4、Pax6和Sox1不同传代iPSC克隆系2和3的iPSCs(上排)和npc。饼图说明了各自标记物和细胞类型的阳性百分比(浅/深蓝色)。N.t:未测试。
附加文件4
:图S4。体外细胞活力。使用Vi-Cell XR细胞活力分析仪测量在冰上25小时内新鲜解冻的存活npc的百分比。
附加文件5
:图S5.病变的大小。在42 dpi处定量描边面积(标绘为平均值±sem)和描边容积。箱线图表示数据的25%到75%的四分位数。
附加文件6
:图S6.他染色。鼻咽癌移植术后35d小鼠脑HE染色。红色:描边半球;绿色:对侧,完整半球;黑色:细胞移植区
附加文件7
:图S7.增殖细胞的定量。A:移植的npc对增殖标记物Ki67(蓝色)和人核(绿色)的代表性组织学染色;移植物细胞),移植后35d在中风Rag2-/-老鼠。箭头表示表达ki67的细胞为HuNu阴性。B: HuNu和Ki67阳性细胞定量。
附加文件8
:表S1.细胞培养介质和物质的详细清单。
附加文件9
:表S2.qPCR引物列表。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
鲁斯特,R,韦伯,R。z,忠利,M。et al。体内应用的无异种诱导多能干细胞衍生神经前体细胞。翻译医学杂志20., 421(2022)。https://doi.org/10.1186/s12967-022-03610-5
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-022-03610-5
关键字
- npc
- 神经干细胞
- 万能
- 细胞疗法
- Intraparenchymal移植
- 生物荧光成像
- 体内成像
- 临床应用
- 再生
- 中风
- 脑损伤
- 细胞移植