摘要
背景
NAFLD和NASH正在成为慢性肝病的主要原因,表明需要有效的治疗。Mutaflor®益生菌,一种感兴趣的微生物治疗,对溃疡性结肠炎患者的持续缓解有效。
客观的
构建与HSC信号通路相关的遗传-表观遗传网络,作为NAFLD/NASH发病机制的调节剂,然后评估Mutaflor的作用®在这个网络上。
方法
首先,在硅分析中被用于构建与HSC信号相关的遗传-表观遗传网络。二是用大鼠进行研究,包括HFHSD诱导的NASH和Mutaflor®经过处理的动物。实验程序包括大鼠血液和肝脏样本的生化和组织病理学分析。在分子水平上,通过real-time PCR检测遗传(FOXA2、TEAD2和LATS2 mrna)和表观遗传(miR-650、RPARP AS-1 LncRNA)网络的表达。PCR结果经免疫组化(α-SMA和LATS2)验证。ELISA法检测靶效应蛋白IL-6和TGF-β。
结果
Mutaflor®给药减少了NAFLD/NASH引起的生化和组织病理学改变。通过抑制hedgehog和hippo通路,可以降低HSC的活化和纤维原IL-6和TGF-β效应蛋白的表达。通路可能通过上调RPARP AS-1 LncRNA而被抑制,进而下调miR-650、FOXA2 mRNA和TEAD2 mRNA的表达,上调LATS2 mRNA的表达。
结论
Mutaflor®可能通过调节与HSC信号相关的遗传-表观遗传网络来减缓NAFLD/NASH的进展。益生菌可能是预防和治疗NAFLD/NASH的有效方式。
背景
非酒精性脂肪性肝病(NAFLD)及其侵袭性形式非酒精性脂肪性肝炎(NASH)是卫生保健系统的财政负担[1].NAFLD/NASH可以无声地[2]发展为肝硬化、肝衰竭和肝细胞癌[3.].尽管全球流行率不断上升,目前为25%,而且并发症严重[1], NAFLD/NASH直到最近才得到满意的治疗[4].
NASH导致进行性炎症,然后再生,最终纤维化[5,6].虽然许多细胞类型都涉及到这种状态,但肝星状细胞(hsc)是明确的[7].它们是肝脏炎症、再生的关键参与者,在纤维化中的作用是明确的[8].造血干细胞是鼻窦周围祖细胞[9]可以转化成纤维细胞[10].活化的造血干细胞被认为是NAFLD和其他慢性肝病肝纤维化的核心,而消除活化的造血干细胞是解决纤维化的关键[8].涉及多种信号通路;然而,肝脏中HSC激活和消除的完整发病机制仍不清楚[11,12,13,14,15].hedgehog (Hh)信号通路刺激和调节造血干细胞的反应[16].Hh靶向许多转录因子,包括叉头盒A2 (FOXA2),在胚胎发生期间肝脏发育的启动器[17].该途径由TEA结构域转录因子2 (TEAD2)直接激活,TEAD2增加了造血干细胞中原纤维蛋白原因子的表达[18].Hippo信号及其核心成分,大型肿瘤抑制激酶2 (LATS2),另一种新兴的HSC通路[19].此外,转化生长因子β (TGF-β) [20.]和白细胞介素-6 (IL-6)信号被认为是核心纤维性HSC激活因子[21].
表观遗传学包括影响造血干细胞的多种信号通路之间的联系[22].外突变是解释NASH发病机制不可缺少的因素[23].microRNAs (miRs)和长非编码rna (LncRNAs)是两大表观遗传家族[24],在信号通路的可逆微调中起着关键作用[25],使它们成为监测疾病进展和治疗效果的有吸引力的生物标志物[26].
临床试验中益生菌治疗NAFLD的应用已增加[27,28,29].大肠埃希菌尼氏(EcN),一种非致病性革兰氏阴性菌株和Mutaflor的活性成分®(Ardeypharm GmbH, Herdecke,德国和EcN, Cadigroup,意大利)用于治疗胃肠道疾病[30.,31,32].EcN是维持溃疡性结肠炎缓解的美沙拉嗪替代品[33,34].
我们有动力去研究Mutaflor的治疗效果®对NAFLD/NASH患者造血干细胞的影响。最初,我们使用硅片数据评估了参与造血干细胞激活的hedgehog和河马相关遗传因子(TEAD2, FOXA2, LATS2)、表观遗传修饰因子(miR-650和RPARP AS-1 LncRNA)和造血干细胞效应蛋白(IL-6和TGF-β)。然后我们比较了Mutaflor的影响®这些因子在NASH模型大鼠和健康对照组血清和组织中的表达。
方法
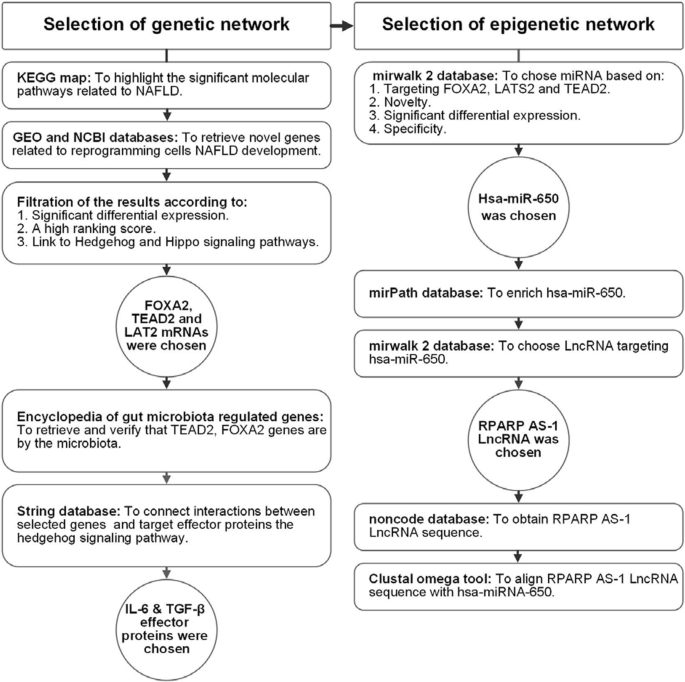
最初,我们在硅片数据分析中通过评估刺猬和河马相关的遗传因子(TEAD2, FOXA2, LATS2 mrna)来识别NASH中激活hsc的标记。α-平滑肌肌动蛋白(α-SMA)作为活化造血干细胞的标记物。然后,我们提取表观遗传修饰物(miR-650和RPARP as -1 LncRNA)(图2)。1,2而且3.).最后,我们对这些网络进行了验证,并比较了Mutaflor的效果®在nash诱导的动物和对照组的血清和组织中的表达。
基于生物信息学的遗传和表观遗传网络选择
遗传网络的选择(图;1最初,我们使用KEGG地图(可在https://www.genome.jp/kegg-bin/show_pathway?hsa04932),以强调与NAFLD相关的重要分子途径(附加文件1:图S1A, B)。接下来,我们使用GEO和NCBI数据库检索与细胞重编程和NAFLD发展相关的新基因。筛选结果识别出基因FOXA2, TEAD2和LATS2具有显著的差异表达,得分较高,并与刺猬和河马信号id(分别为51565912,10634719和106305647)有关1:图S2A-C)。所选基因的二次验证使用肠道菌群调节基因百科全书(可在http://microbiota.wall.gu.se/)来检索肠道微生物群调节的特定基因(TEAD2, FOXA2),作为针对这些微生物群的潜在步骤(附加文件)1:图S3A-B)。字符串(可在https://string-db.org/)用于连接所选基因(TEAD2, FOXA2, LATS2),靶效应蛋白(IL-6和TGF-β)和hedgehog信号通路之间的相互作用(附加文件)1:图S4)。
表观遗传调控因子的选择:基于新颖性、显著差异表达和对肝脏的特异性,从mirwalk 2数据库中选择hsa-miR-650http://mirwalk.umm.uni-heidelberg.de/interactions/?mirnaid=hsa-miR650&genesymbol=&bindingp=0.95&position=3UTR&targetscan=0&mirdb=0&mirtarbase=0&submit=set+filter).mirPath数据库用于富集hsa-miR-650(可在http://snf-515788.vm.okeanos.gr/#mirnas=hsa-miR-650;hsa-miR-650 & methods = TargetScan;Tarbase & selection = 0),这表明miR-650与Hh、NAFLD和MAPK信号有关(附加文件1:图S5),并针对FOXA2, LATS2和TEAD2(附加文件1:图S6 A-C)。最后,通过使用mirwalk2 (http://zmf.umm.uniheidelberg.de/apps/zmf/mirwalk2/mir2ret/mir2mwlnc.php).然后我们对从非编码中获得的LncRNA序列进行比对http://www.noncode.org/)使用欧洲生物信息学研究所的Clustal omega工具(可在https://www.ebi.ac.uk/Tools/services/web/toolresult.ebi?jobId=clustalo-I20210209-113823-0177-82478586-p1m&analysis=alignments)(附加文件1:图S7A-D)。
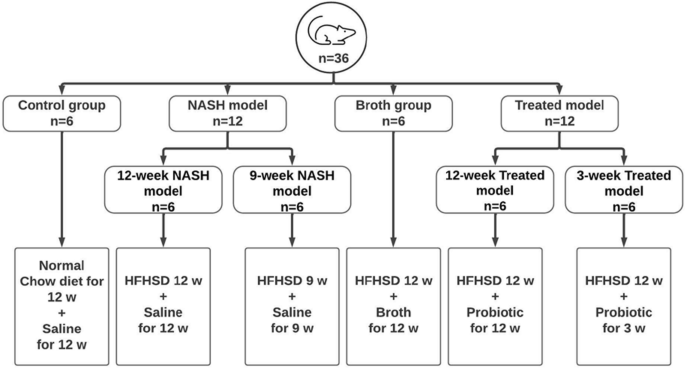
实验动物(图;2)
36只成年雄性Wistar大鼠(150-200 g)购自埃及国立研究所(开罗,埃及),驯化一周。老鼠饲料是从埃及El-Obour的Meladco购买的。除非另有说明,可随意提供颗粒和自来水。饲养动物在22±2°C, 55±5%相对湿度,12小时明暗循环(6:00 am-6:00 pm)。笼子每天都要清洗。所有的努力都是为了尽量减少动物的痛苦,并减少动物的数量。实验结束时,对大鼠称重,麻醉(1.2 g/kg氨水蒸馏水;腹腔内)然后安乐死。采集和处理血液样本,称重和处理肝脏样本。
所有程序均经艾因沙姆斯大学医学院研究伦理委员会(FMASU- rec)要求(FMASU MD 85/2020)批准并执行。FMASU-REC根据联邦广泛担保编号000017585运营。
实验小组
动物被分为四大类。所有治疗均采用灌胃口服。第1组(对照组)大鼠喂食标准饮食,每天给予1 mL无菌生理盐水,持续12周(n = 6)。2组(NASH模型)大鼠进一步细分为2A组(NASH模型9周)大鼠,喂食高脂高蔗糖饲料(HFHSD),每天给予无菌生理盐水1 mL,连续9周(n = 6);2B组(12周NASH模型)大鼠给予HFHSD,每天给予无菌生理盐水1ml,连续12周(n = 6)。第3组(处理)大鼠又分为2组。3A组大鼠(治疗12周模型)饲喂高脂高脂饲料,同时给予益生菌(1 × 108菌落形成单位(CFU)/mL)从第一天开始,连续12周(n = 6);3B组大鼠(3周治疗模型)喂HFHSD 12周,后3周从第10周开始每天给予益生菌(n = 6)。第4组(肉汤)大鼠喂食HFHSD 12周,并从第一天开始每天给予1 mL Luria Bertani肉汤,持续12周(n = 6)。
化学药品和饮食制剂
益生菌大肠杆菌Nissle 1917菌株(Mutaflor®, Ardeypharm GmbH, Herdecke, Germany)在Luria Bertani (LB)培养基上生长(HiMedia,孟买,印度)。用平板计数法测定每毫升活菌细胞数,计算为每毫升菌落形成单位(CFU/ mL) = no。菌落×稀释因子[35].1 × 10的剂量8CFU/mL每日灌胃给药[36,37,38,39].胆固醇和胆盐购自Ralin BV(荷兰利金班)(目录编号81254)。LB肉汤购自HiMedia(孟买,印度,目录号:M1245)。
以68.75%标准饲料、20%猪油、10%蔗糖、1%胆固醇和0.25%胆盐组成的HFHSD喂养大鼠诱发NASH [40].这些成分用水混合,制成颗粒,然后晾干。饮食每五天准备一次,储存在冰箱里。
实验程序
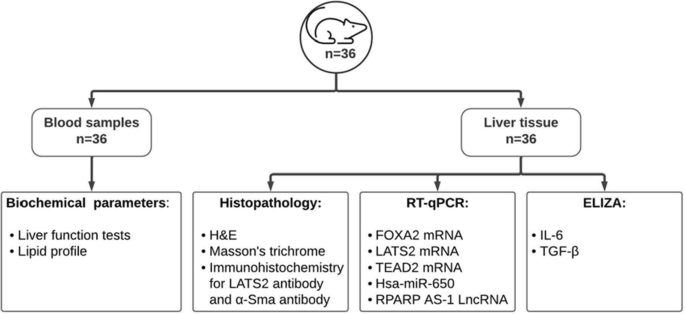
步骤总结见图。3..
血液样本的处理
研究结束时大鼠禁食12小时,然后在死亡前用单剂量脲烷(1.2 g/kg, IP)麻醉。从眶后静脉采集血液样本,3000转/分离心10分钟,进行血清分离。等分的血清储存在−20°C,用于后续的生化分析。
生化参数
血清天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)、γ -谷氨酰转移酶(GGT)、碱性磷酸酶(ALP)、白蛋白、总胆红素、直接胆红素(分别为TB和DB)、甘油三酯(tg)、总胆固醇(Tc)、低密度脂蛋白(LDL)和高密度脂蛋白(HDL)胆固醇使用商用试剂盒,使用Beckman Coulter AU680自动分析仪(Beckman Coulter Inc, CA)进行评估。
组织学检查
整个肝脏被迅速取出,称重并解剖。肝组织样本立即储存在−80°C用于RNA和蛋白质评估。剩余组织在10%中性缓冲福尔马林中快速固定,用于组织病理学和免疫组化分析。
RT-qPCR定量表达RNA
总RNA, lncRNA和miRNA的提取:miRNeasy Mini Kit (Cat。编号217004,Qiagen)用于按照制造商的方案从组织样本中提取总RNA。使用美国Thermo Scientific公司的Nanodrop来评估RNA的完整性和浓度;分离得到的RNA纯度为1.8 ~ 2。
cDNA逆转录:总RNA立即逆转录为互补DNA (cDNA)使用RT2 First-Strand试剂盒(Cat。no . 303404, Qiagen)用于mRNAs和LncRNA和mi Script II RT Kit (Cat。编号218160,218161,Qiagen)用于miRs。使用Thermo Hybaid PCR快速热循环仪(Thermo Fisher, Massachusetts, USA)按照制造商的方案进行。
RT-qPCR定量表达mRNA/miR/LncRNA网络:定量SYBR®绿色PCR试剂盒(Cat。采用No. 204143, Qiagen, Germany)和定量引物法(NM 021784, NM 003598, NM 014572)检测肝组织样品中FOXA2, TEAD2和LATS2 mrna的表达。RT2 SYBR Green Rox qPCR Master Mix (Cat。采用No. 330500, Qiagen, Germany)和RT2 LncRNA qPCR法(ENST00000473970, Catalog No. 33070, Qiagen, Germany)定量肝组织中RPARP AS-1 LncRNA。miScript SYBR绿色PCR试剂盒(Cat。No. 218073, Qiagen, Germany)和miR650 miScript引物分析针对成熟miR:miR650 (MIMAT0003320, Cat。No. 218300, Qiagen, Germany)被用于评估miR-650在组织样本中的表达,遵循制造商的程序。GAPDH和SNORD72作为管家基因对原始数据进行标准化,然后与参考数据进行比较。应用SYBR绿色qPCR软件在应用生物系统公司的7500 FAST实时PCR机上进行qPCR(应用生物系统公司,美国)。反应条件为95°C变性15分钟,94°C变性10秒,55°C退火30秒,循环40次。 Final extension was at 70 °C for 30 s. Each reaction was performed in duplicate. Applied Biosystems Stepone plusTM Software v2.2.2 was used to calculate threshold cycles (Ct) for each sample. Ct greater than 36 is considered negative. RQ of RNA expression was calculated using the Livak technique, where RQ = 2−ΔΔCt.熔融曲线检测以确定SYBR绿色PCR扩增的扩增子特异性。
免疫组织化学
石蜡组织切片用二甲苯脱蜡,用一系列降低酒精浓度的方法水化。在3%双氧水(H2O2)在甲醇溶液中浸泡10分钟2O2用磷酸盐缓冲盐水(PBS)冲洗掉。将一组组织切片与稀释后的1:40 00小鼠单克隆抗sma抗体(Sigma Aldrich®,目录A2547-0.5ML,美国)。另一组组织切片在室温下用1:400稀释的抗lats2抗体(abcam®(目录ab111054L, UK),然后用PBS冲洗。然后将组织切片与生物素化的二抗孵育30分钟,然后在二氨基联苯胺(DAB)溶液中(Vector Laboratories, Inc., Burlingame, CA, USA)重新激活过氧化物酶。用苏木精反染色,然后用自来水冲洗10分钟。最后,组织脱水并检查颜色变化。α-SMA和LATS2抗体染色阳性的细胞核呈深褐色。
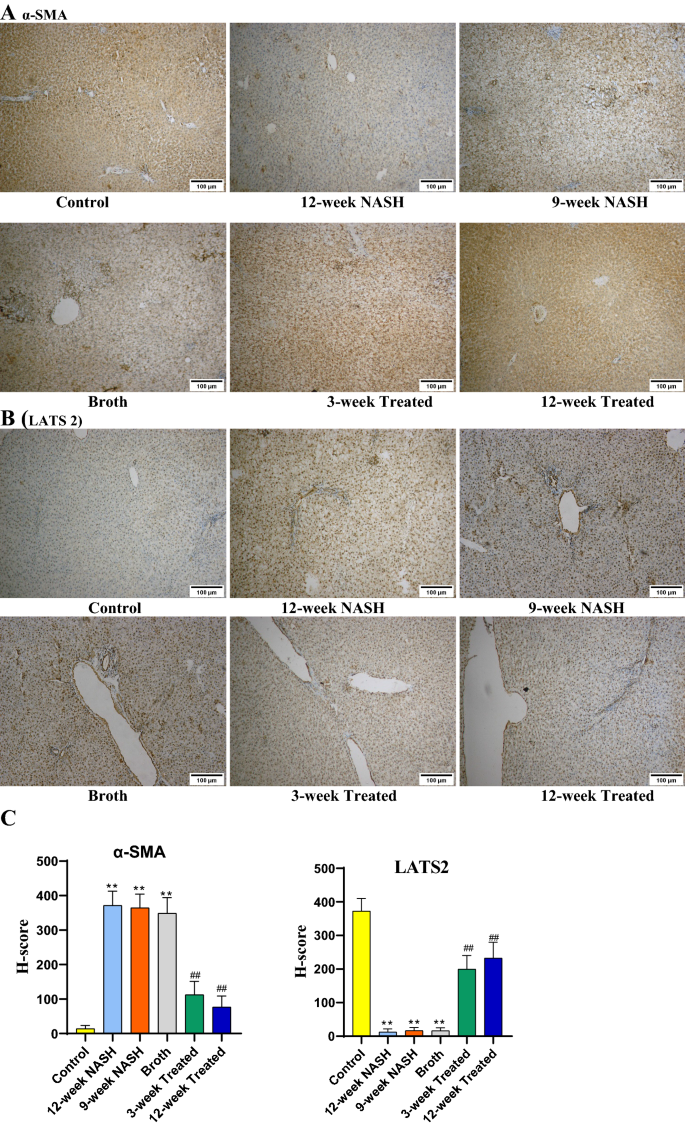
Histoscore (H-score)的计算方法如Khatun等所述[41[H-score =(染色细胞百分比)×(染色等级强度+ 1)],其中细胞染色强度0为未染色,1为弱染色,2为中染色,3为强染色。用Image J软件计算α-SMA和LATS2阳性细胞百分比为分数面积。
肝组织中IL-6和TGF-β蛋白水平的估计
使用大鼠IL-6试剂盒(目录号:E0079r, EIAAB SCIENCE INC, WUHAN)和大鼠TGF-β酶联免疫吸附测定试剂盒(目录号:E0124r, EIAAB SCIENCE INC, WUHAN),按照制造商的协议,分别定量研究组织样本中IL-6和TGF-β蛋白的表达。
统计分析
数据以均数±标准差表示。采用Kolmogorov-Smirnov检验和Shapiro-Wilk检验评估数据分布的正态性。数据比较使用GraphPad(版本8)进行单向方差分析,并进行事后Bonferroni的分析。计算箱线图及IL-6、TGF-β含量。相关性评估采用SPSS软件(version 20)。
结果
NAFLD患者身体和肝脏重量的变化:
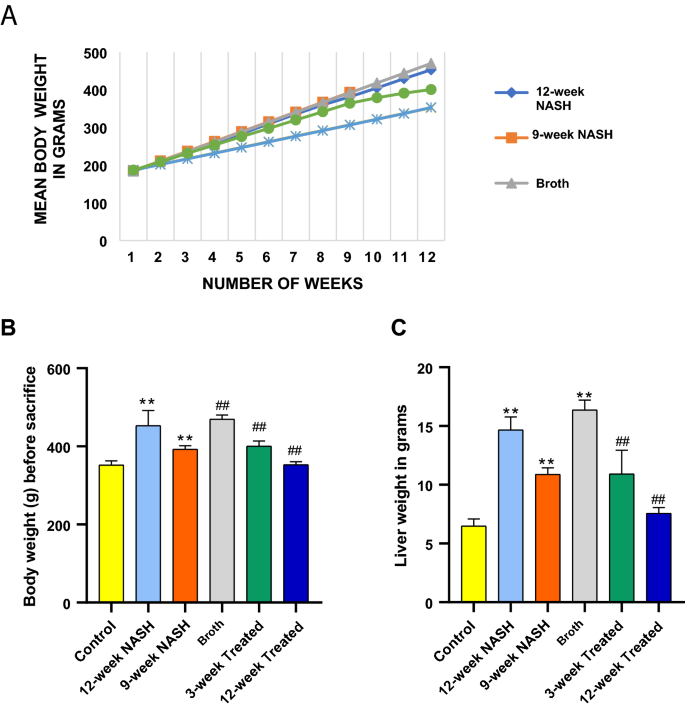
在实验开始时,各组大鼠的体重没有明显差异(体重从150到200 g, F = 0.126,p= 0.985)。每周分别测量每只大鼠的体重。在整个研究过程中,所有动物的体重都稳步增加。各组大鼠体重增加的显著差异首次出现在第三周(F = 4.5*, p = 0.04)。1).这些差异一直持续到研究结束。诱导NASH增加体重增加;肉汤大鼠的体重增幅最大,其次是12周,9周NASH大鼠分别增加了原始体重的256%、246%和213%。对照组的老鼠体重只增加了190%。12周NASH组动物的最终体重比对照组高100.8 g,而9周NASH组动物的最终体重比对照组高40.8 g。4B)。
肝脏在牺牲后立即称重。各组大鼠肝脏重量有显著差异(F = 56.2*,p< 0.01)(图;4C). NASH诱导大鼠肝脏重量增加,肉汤组大鼠平均肝脏重量最大达16 g。12周的NASH动物比对照组多8.2 g,而9周的NASH动物比对照组多4.4 g。4C). 12周、9周NASH大鼠终体重与肝脏重量呈正相关(r = 0.9*, p < 0.01)。
生化参数
肝功能
6组大鼠血清AST、ALT、GGT、ALP、TB、DB水平差异均有统计学意义(F分别为39.3*、78.1*、93.9*、8.38*、8*;p < 0.001)。与对照组相比,12周和9周NASH组动物的肝细胞损伤指标随着NASH诱导显著增加(p < 0.001,除TB和DB外,p分别= 0.01和0.004)。肉汤组大鼠与NASH组大鼠比较差异无统计学意义(p > 0.05)。NASH的诱导破坏了正常的脂质谱。与对照组相比,12周NASH组、9周NASH组和Broth组大鼠空腹tg、总胆固醇和LDL血清水平显著升高,HDL水平显著降低(p < 0.001)1).
NAFLD的组织病理学改变
新鲜切除的大鼠肝脏大体检查显示,对照组大鼠与Broth组和NASH组动物相比有显著差异。对照组的肝脏呈现闪亮的红色外观,而Broth和NASH模型的肝脏呈现暗红色外观,并分布在肝脏表面的白黄色斑点。
根据Takahashi等人对NAFLD进行组织病理学分级。42].镜下用苏木精-伊红(H&E)评价脂肪变性和炎症程度,用马松三色染色评价纤维化程度。对照组肝脏结构正常,有典型的六角形肝小叶,无炎症或纤维化迹象。相反,Broth组和NASH组大鼠表现出肝小叶结构扭曲,有证据表明大泡和微泡性肝脂肪变性、小叶炎症、细胞浸润、肝细胞膨大以及中央静脉和门静脉扩张。肝细胞周围和门静脉周围的肝窦呈纤维化(表2)2和无花果。5).
NAFLD中LATS2和α-SMA的免疫组化分析
采用免疫组化方法评估α-SMA的表达,并评估和确认LATS2的表达。诱导NASH显著增加α-SMA表达,表明激活的造血干细胞数量增加。在NASH组大鼠12周、NASH组大鼠9周和Broth组大鼠中观察到这种效应。相反,与对照组相比,NASH诱导降低了NASH 12周、NASH 9周和Broth组大鼠的LATS2表达(图2)。6).
FOXA2、TEAD2和LATS2 mrna、miR-650和RPARP AS-1 LncRNA在NAFLD中的表达改变
与对照组相比,NASH诱导增加了FOXA2、TEAD2 mrna和miR-650的表达。12周NASH组、9周NASH组和Broth组大鼠FOXA2 mRNA的RQs分别与对照组显著增加(16.5-、15-和16倍;p-values分别为0.016、0.035和0.02)(图7).此外,12周NASH组、9周NASH组和Broth组动物与对照组相比TEAD2 mRNA RQs显著增加(分别为16、15和15倍;p< 0.01)。同样,miR-650在12周NASH组、9周NASH组和Broth组动物与对照组的RQ表达分别显著增加22倍、18倍和23倍;p< 0.01。
相反,诱导NASH显著降低LATS2 mRNA和RPARP AS-1 LncRNA的RQs;12周NASH组、9周NASH组和Broth组动物LATS2 mRNA的RQ分别与对照组显著降低(分别为45、14和50倍;p< 0.01)。同一组大鼠RPARP AS-1 LncRNA的RQ分别显著降低67-、31-和23倍;p< 0.01。
NAFLD中靶效应蛋白IL-6和TGF-β相对浓度的改变
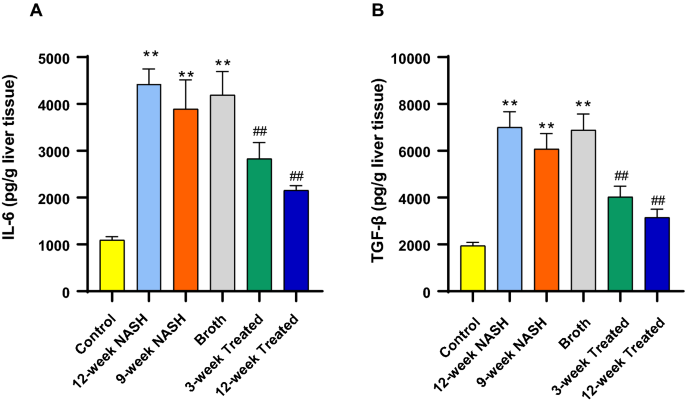
与正常对照组相比,诱导NASH显著增加IL-6和TGF-β水平。例如,12周NASH组动物的IL6和TGF-β浓度分别增加了约4倍和3.6倍(p < 0.01);在9周的NASH大鼠中,IL6和TGF-β浓度分别增加了3.6倍和3倍(p < 0.01)。此外,Broth组动物IL-6和TGF-β浓度分别增加3.8倍和3.5倍(p < 0.01)(图。8).
mRNA、miRNA、LncRNA、靶效应蛋白定量表达水平与造血干细胞活化的相关性
FOXA2 mRNA与TEAD2 mRNA和miR-650显著相关(r = 0.77, 0.74,p< 0.01)。与LATS2 mRNA和RPARP AS-1 LncRNA呈显著负相关(r分别为- 0.75和- 0.74;p< 0.01)。同样,IL6和TGF-β浓度与FOXA2、TEAD2 mrna和miR-650表达显著正相关(p< 0.01)。LATS2 mRNA和RPARP-AS1 LncRNA的浓度及表达均呈显著负相关(p< 0.01)。α-SMA h评分升高表明,hsc的激活与FOXA2、TEAD2 mrna和miR-650表达的增加显著相关(r分别为0.7、0.9和0.7。p< 0.01)。LATS2 mRNA和RPARP-AS1 LncRNA表达下降(r分别为- 0.8和- 0.75,p< 0.01)(表3.).
益生菌可以防止体重和肝脏重量的增加
益生菌治疗12周后NASH对体重增加的影响恢复正常。益生菌降低了12周NASH大鼠的平均体重增加,从24.5克/周降低到12周治疗大鼠的15克/周。治疗12周的NASH大鼠和治疗9周的NASH大鼠在第3周首次观察到显著的益生菌作用(平均差异=−20.3* g, p值= 0.03)。虽然,在治疗12周的大鼠和治疗12周的NASH大鼠之间出现在第四周(平均差异=−27* g, p值< 0.01),但这种效应在整个实验过程中是一致的。12周治疗大鼠体重增加189.3%,显著低于12周NASH大鼠(平均差值=−100* g, p值< 0.01)。12周处理大鼠与对照组终体重无显著差异(p值= 1)。益生菌治疗3周也降低了NASH对体重增加的影响。处理后的大鼠体重稳定增加,直到最后3周益生菌将平均体重增加从22克/周降低到14.8克/周。三星期的(图。4A)。处理后的大鼠体重增加215%,显著低于12周的NASH动物(平均差值=−52.5* g, p值< 0.01),但仍显著高于对照组(平均差值= 48.5*g, p值< 0.01)(图。4B)。
与12周的NASH相比,治疗3周和12周的动物肝脏重量均显著降低(平均差值分别为−3.8*和−7 * g, p值< 0.01)。与9周组相比,3周和12周组动物肝脏重量显著降低(平均差值分别为−5.4*和−5.2 * g, p值< 0.01)。然而,经益生菌处理的大鼠肝脏重量仍显著高于对照组(p < 0.05)。4B).治疗12周和3周大鼠终末体重与肝脏重量也呈正相关(r = 0.9*, p < 0.01)。
益生菌可防止NAFLD的生化和组织病理改变
益生菌降低了血液和肝脏样本的NASH变化。治疗组大鼠肝细胞损伤指标恢复;与12周的NASH组大鼠相比,治疗12周的动物观察到AST、ALT、GGT、ALP、TB和DB血清水平显著降低(平均差值=−84.8、−101、−49.5、−0.56和−0.21,pl < 0.001,除TB和DB分别为0.19和0.006)。益生菌归一化脂质谱。治疗3周和12周的动物血清tg、总胆固醇和LDL水平均显著降低。此外,与12周的NASH组大鼠相比,HDL水平显著增加(p< 0.001)(表1).治疗组大鼠肝脏检查显示与对照组肝脏相似的光泽抛光外观。益生菌减少了治疗大鼠脂肪变性、炎症和纤维化的数量。虽然NASH的组织病理学影响被最小化,但肝细胞的残余纤维化和气球仍然存在(表1和无花果。5).免疫组织化学分析显示,给予益生菌可使NASH对HSC的影响最小化。在治疗12周和治疗3周时,α-SMA的表达均显著降低,表明治疗组的无活性造血干细胞增多。同时,与nash -12周组大鼠相比,他们显示LATS2表达增加(图2)。6).
益生菌消除了NAFLD对FOXA2、TEAD2、LATS2 mrna、miR650和RPARP AS-1 LncRNA表达的影响
益生菌消除了NASH对FOXA2、TEAD2、LATS2 mrna、miR650和RPARP AS-1 LncRNA表达的影响;与12周NASH组大鼠相比,治疗3周和12周时,FOXA2、TEAD2 mRNA和miR-650的RQ表达显著降低(p < 0.01), LATS2 mRNA和RPARP AS-1 LncRNA的RQ表达显著升高(p < 0.01)。7).
益生菌消除了NAFLD对靶效应蛋白、IL6和TGF-β浓度的影响
使用益生菌可降低IL6和TGF-β浓度。12周治疗组大鼠。与12周NASH大鼠相比,IL6和TGF-β浓度显著降低2倍和2.2倍(p < 0.01)。与12周的NASH大鼠相比,3周治疗组的浓度降低了1.6倍和2倍(p < 0.01)。8).
讨论
肥胖症的流行和NAFLD/NASH患病率的同时增加仍在继续,NAFLD/NASH现在被认为是肝移植的首要原因[43].不过,目前还没有得到FDA批准的治疗方法。44].肠道菌群失衡被认为是NAFLD/NASH发病机制的基础[27].这一解释强调了需要利用益生菌来逆转肠道生态失调,以预防和治疗NAFLD/NASH [28].
本研究成功诱导了大鼠的NASH,肝功能异常、脂质谱和肝脏组织病理学特征证明了NAFLD/NASH的宏观和微观泡状脂肪变性特征,不同程度的炎症和纤维化增加。Mutaflor®给药后肝功能测试和血脂水平均有改善。治疗后的大鼠脂肪变性、炎症和纤维化明显减少。
NAFLD/NASH的发病机制涉及一系列损害[45],从而引发慢性炎症过程,导致肝细胞损伤、免疫细胞激活[46],以及再生过程的刺激[45].再生主要由造血干细胞介导[46].造血干细胞的活化诱导原纤维胶原蛋白和α-SMA,导致细胞外基质沉积[43].Hh信号是肝脏再生的主要调节因子,并控制着造血干细胞的命运[15].NAFLD中Hh通路的持续和过度激活是推动NASH纤维化进展的关键[47]、肝硬化及肝细胞癌[48].
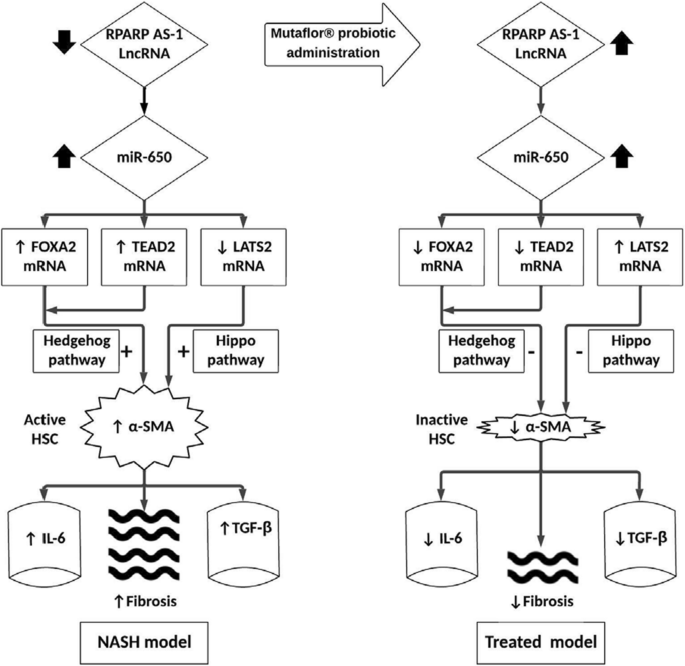
我们利用计算机分析构建了一个遗传(FOXA2, TEAD2, LATS2)和表观遗传网络(miR-650和RPARP AS-1 LncRNA),该网络与在NAFLD/NASH中刺激刺猬和河马信号通路,随后激活hsc及其效应蛋白(L-6和TGF-β)有关。然后,我们在NASH动物模型的肝组织样本中验证了该网络的表达。我们观察到构建的网络及其效应蛋白在NASH肝组织中的表达改变,(FOXA2、TEAD2 mRNA、miR-650)、蛋白(IL-6和TGF-β)的表达高度显著升高,LATS2 mRNA和RPARP AS-1 LncRNA下调。我们还验证了Mutaflor的效果®在网络上。在NASH 12周模型大鼠中,这种益生菌可调节网络向正常表达模式的表达。
FOXA2,又称肝细胞核因子3-Β和转录因子3B [49],位于染色体20:22,580,998 - 22,585,455反向链上[50].的FOXA进化保守的肝脏富集转录因子家族[50,51]参与肝脏发育和分化[52].FOXA2在胚胎发生过程中对hh诱导的肝前细胞规范至关重要[51].我们检测了FOXA2 mRNA作为Hh通路的标记物。同样,Wang等人的一项研究表明FOXA2也是Hh信号的靶点,但在小鼠胚胎的食管上皮中[53].FOXA2对ccl4诱导的小鼠肝纤维化的保护作用归因于FOXA2在肝细胞中的下调。然而,同样的研究报告活化的造血干细胞中FOXA2上调与肝纤维化之间没有相关性[54].尽管如此,造血干细胞在纤维化发展中的重要性似乎已经确立。55,56,57].
TEAD2是一个蛋白质编码基因,位于染色体19:49,340,595 - 49,362,457 [58].的TEAD2基因被认为是一种癌基因,其mRNA的稳定性在多种肿瘤中受到影响[56,59,60].Joo等研究显示,TEAD2 mRNA表达增加在HCC中预后较差[61].在NAFLD中,TEAD2是河马通路中与HSC激活密切相关的下游效应分子[62].LATS2是一种河马信号通路激酶,在肝脏分化和成熟过程中起重要的抑制作用[19].成人肝脏LATS2缺失与纤维化甚至致死性肝损害相关[63].相反,LATS2抑制胆固醇在肝脏内的积聚[64],解释了lats2缺陷小鼠脂肪肝发病率的增加[65].Ye等人的研究表明,直接抑制LATS2活性可增加NASH向HCC的进展[66].
IL-6,一种184个氨基酸的多效细胞因子,在肝脏再生中起重要作用[21]是一种有效的促进肝细胞增殖的物质。此外,IL-6增加肝脏中纤维生成基因的表达[67].hsc直接受到IL-6信号的影响,因为它们是少数表达IL-6膜结合受体的细胞之一[68].此外,造血干细胞分泌IL-6,最终导致I型胶原蛋白产生增加,从而在培养中纤维化[62].越来越多的证据确定了IL-6通路在HSC激活中的主导作用,这对肝纤维化的进展至关重要[69,70,71,72,73].TGF-β是肝脏中最有效的纤维细胞因子[20.].有报道称肝损伤后活性造血干细胞中TGF-β表达增加[74].此外,Dewair等人.发现TGF-β信号通路是肝脏疾病中驱动HSC激活和纤维化的关键成纤维途径[10].实验表明,抑制TGF-β活性可降低大鼠肝纤维化[75].我们的研究结果与上述所有研究的结果一致。
表观遗传学在NAFLD的发病机制中起着关键作用,表明其作为一种可能的治疗靶点的重要性[22].我们的硅质模型确定miR-650和RPARP-AS1 LncRNA是所选mrna的重要表观遗传调节因子。miR-650在特发性肺纤维化中上调,参与纤维化[76].Estep等发现与非NASH NAFLD患者相比,NASH患者内脏脂肪组织中hsa-miR-650表达显著下调,证明其在肝纤维化中的作用[77].miR-650参与活动性溃疡性结肠炎的炎症和细胞凋亡[78].Han等人鉴定LATS2是miR-650的直接靶标;LATS2可抵消miR-650在HCC中的作用[79].同样,Zhou等人证明LncRNAs在hsc激活中发挥关键作用,从而增加肝脏疾病中的纤维化[80].我们发现RPARP-AS1 LncRNA是一个与miR-650相互作用的新因子。反义LncRNA位于10q24.32染色体上[81]与促进结直肠癌细胞增殖、迁移和侵袭有关[82].
活化的造血干细胞转分化为表达α-SMA的收缩性成纤维肌成纤维细胞[83].在丙型肝炎感染中,造血干细胞与病毒感染的肝细胞之间的相互作用增加了有害的抗病毒炎症反应[84].然而,在急性肝损伤后,活跃的造血干细胞通过协助细胞外基质沉积和炎症信号传导发挥保护作用[85].因此,我们认为活性造血干细胞是我们的主要治疗靶点,认识到其在NAFLD/NASH发病机制中的作用。我们的研究结果一致显示,NASH模型大鼠中α-SMA表达显著增加,作为活性造血干细胞的指标,Mutaflor®使其逆转至正常,同时活性造血干细胞数量减少。
FOXA2、TEAD2 mRNA与miR-650、IL-6、TGF-β效应蛋白呈显著强正相关,与LATS2 mRNA、RPARP AS1-LncRNA呈显著负相关。我们假设,在NAFLD/NASH中,miR-650表达的增加上调了FOXA2和TEAD2 mRNA,下调了LATS2 mRNA。同时刺激hedgehog和hippo信号通路,激活HSC并增加HSC纤维原信号(IL-6和TGF-β效应蛋白)的表达。从而增加肝纤维化和NAFLD/NASH进展。在Mutaflor®给药后,RPARP AS-1 LncRNA表达增加会抑制miR-650。这下调了FOXA2和TEAD2 mRNA,上调了LATS mRNA。抑制hedgehog和hippo信号,使HSC失活并降低HSC纤维原信号(IL-6和TGF-β效应蛋白)的表达。最终,益生菌减少了肝纤维化和NAFLD/NASH的进展(图。9).
结论
益生菌临床试验的应用前景广阔。在NAFLD中,停止hsc激活将阻止进展并使现有的纤维化退化。如上所述,造血干细胞活性受肠道生态失调控制。因此,使用益生菌靶向造血干细胞可能是NAFLD的一种潜在的预防和治疗策略。在本研究中,我们得出结论,Mutaflor®显示出对抗HSC激活和降低HSC纤维蛋白原基因(IL-6和TGF-β蛋白)上调的显著能力。这些作用与通过FOXA2、TEAD2和LATS2 mrna及其表观遗传修饰物(RPARP AS-1和miR-650 miRNA)调节刺猬和河马信号通路有关。该益生菌制剂对NAFLD动物模型有显著改善,提示其对NAFLD/NASH的预防和治疗有一定的应用价值。
限制
本研究的局限性包括缺乏大鼠的体力活动和能量消耗的数据,这可以弥补大鼠的HSHFD消耗。未来的研究应该测量大鼠的活动,这可以与肝脏的任何组织病理学变化相关联。其次,研究其中一个已探索的基因网络的沉默对NASH发病机制的影响。最后,尽管在大鼠中研究了益生菌作为NASH管理工具,但有必要强调的是,将动物研究结果转化为人类有过失败的历史[86].因此,更多的随机临床研究和延长随访可以阐明益生菌在预防和治疗人类NASH中的作用。
数据和材料的可用性
所有数据均可按要求提供。
缩写
- 高山:
-
碱性磷酸酶
- AST:
-
天冬氨酸转氨酶
- ALT:
-
丙氨酸氨基转移酶
- αsma:
-
平滑肌肌动蛋白
- CFU / mL:
-
菌落形成单位每毫升
- 轻拍:
-
Diaminobenzidine
- DB:
-
直接胆红素
- ELISA:
-
酶联免疫吸附试验
- EcN:
-
大肠杆菌Nissle
- Foxa2:
-
叉头箱A2
- FMASU:
-
艾因沙姆斯大学医学院
- GGT:
-
Gamma-glutamyl转移酶
- 高密度脂蛋白:
-
高密度脂蛋白
- Hh:
-
刺猬
- ):
-
苏木精和伊红
- 肝星状细胞:
-
肝星状细胞
- 肝细胞癌:
-
肝细胞癌
- HFHSD:
-
高脂肪高蔗糖饮食
- 过氧化氢:
-
过氧化氢
- LATS2:
-
大肿瘤抑制激酶2
- 磅:
-
仅有Bertani
- il - 6:
-
白细胞介素- 6
- 低密度脂蛋白:
-
低密度脂蛋白
- LncRNA:
-
长链非编码RNA
- 大鹏:
-
小分子核糖核酸
- mir - 650:
-
650年微
- mL:
-
毫升
- 信使rna:
-
信使rna
- 非酒精性脂肪肝:
-
非酒精性脂肪肝
- 纳什:
-
非酒精性脂肪肝炎
- PBS:
-
磷酸盐缓冲盐水
- 矩形:
-
研究伦理委员会
- 转:
-
每分钟速率
- RT-qPCR:
-
实时定量聚合酶链式反应
- 结核病:
-
总胆红素
- Tc:
-
总胆固醇
- TEAD2:
-
TEA区域转录因子2
- TGF -β:
-
转化生长因子β
- TGs:
-
甘油三酸酯
参考文献
李志强,李志强,李志强,等。非酒精性脂肪性肝炎的临床研究进展。药典通报2020;72(1):1 - 12。https://doi.org/10.1007/s43440-019-00020-1(Epub 2020年1月8日).
张晓明,马可恩,张晓明,张晓明。非酒精性脂肪肝的临床流行病学与疾病负担。世界胃肠杂志,2017;23(47):8263-76。https://doi.org/10.3748/wjg.v23.i47.8263.
Negro F. NASH和HCC的自然史。肝脏杂志2020;40(增刊1):72-6。https://doi.org/10.1111/liv.14362.
Burra P, Becchetti C, Germani G. NAFLD和肝移植:疾病负担,当前管理和未来挑战。JHEP代表2020;2(6):100192。https://doi.org/10.1016/j.jhepr.2020.100192.
方丽丽,陈红,王春林,梁磊。儿童青少年非酒精性脂肪肝发病机制:从“两击理论”到“多击模型”。世界胃肠杂志,2018;24(27):2974-83。https://doi.org/10.3748/wjg.v24.i27.2974.
李霞,朱琳,王波,袁敏,朱瑞。纤维化的药物及靶点。前沿药典,2017;23(8):855。https://doi.org/10.3389/fphar.2017.00855.
Zisser A, Ipsen DH, Tveden-Nyborg P. nash纤维化中的肝星状细胞激活和失活-可能的治疗靶点?共同参与。2021;9(4):365。https://doi.org/10.3390/biomedicines9040365.
Schwabe RF, Tabas I, Pajvani UB。非酒精性脂肪性肝炎纤维化发展的机制。胃肠病学。2020;158(7):1913 - 28。https://doi.org/10.1053/j.gastro.2019.11.311(Epub 2020 2月8日).
Friedman SL, Neuschwander-Tetri BA, Rinella M, Sanyal AJ。NAFLD的发生机制及治疗策略。中国医学杂志,2018;24(7):908-22。https://doi.org/10.1038/s41591-018-0104-9(Epub 2018 7月2日).
杜伟达B,梅耶C,杜利S,梅德尔-拜克AN。TGF-β在肝星状细胞活化和肝纤维化中的作用——2019年更新。8细胞。2019;(11):1419。https://doi.org/10.3390/cells8111419.
Marcher AB, Bendixen SM, Terkelsen MK, Hohmann SS, Hansen MH, Larsen BD, Mandrup S, Dimke H, Detlefsen S, Ravnskjaer K. NASH中肝星状细胞激活的转录调控。科学通报2019;9(1):2324。https://doi.org/10.1038/s41598-019-39112-6.
Heyens LJM, Busschots D, Koek GH, Robaeys G, Francque S.非酒精性脂肪性肝病中的肝纤维化:从肝活检到诊断和治疗中的非侵入性生物标志物。前沿医学2021;14(8):615978。https://doi.org/10.3389/fmed.2021.615978.
Kiagiadaki F, Kampa M, Voumvouraki A, Castanas E, Kouroumalis E, Notas G. Activin-A通过在Kupffer细胞中诱导TNFα和TGFβ引起肝星状细胞激活。生物化学学报,2018;1864(3):891-9。https://doi.org/10.1016/j.bbadis.2017.12.031(Epub 2017 12月26日).
陈奕婷,王宁,谭海燕,李松,冯云。天然产物靶向肝星状细胞治疗肝纤维化:是新时代的曙光吗?前沿药典,2020;30(11):548。https://doi.org/10.3389/fphar.2020.00548.
侯伟,Syn WK。代谢在肝星状细胞活化和纤维化中的作用。前沿细胞发育生物学,2018;12(6):150。https://doi.org/10.3389/fcell.2018.00150.
高丽,张震,张鹏,于敏,杨涛。典型刺猬信号通路在肝脏中的作用。国际生物学杂志,2018;14(12):1636-44。https://doi.org/10.7150/ijbs.28089.
μT,徐L,钟Y,刘X, Z,黄C,局域网X, Lufei C,周Y, Y,徐L,姜米,周H,林X,吴L,彭年代,刘年代,白利糖度的年代,迪安米,邓恩NR, Zaret KS,傅XY,侯Y胚胎肝RNA单细胞测序的发展轨迹显示Foxa2eGFP鼠标。中国生物医学工程学报。2020;3(1):642。https://doi.org/10.1038/s42003-020-01364-8.
河马肝脏中的信号——一个漫长而不断扩展的故事。前沿细胞发育生物学。2019;12(7):33。https://doi.org/10.3389/fcell.2019.00033.
易俊,陆磊,杨格K,王伟,孙bh, Stanger BZ,张明,Martin JF, Ajani JA,陈杰,Lee JS,宋s, Johnson RL。大肿瘤抑制同源物1和2通过拮抗共激活因子YAP和TAZ调节小鼠肝祖细胞增殖和成熟。肝脏病学。2016;64(5):1757 - 72。https://doi.org/10.1002/hep.28768.
田建平,李建平。肝星状细胞活化机制的研究。中华胃肠病杂志,2017;14(7):397-411。https://doi.org/10.1038/nrgastro.2017.38(Epub 2017年5月10日).
Naseem S, Hussain T, Manzoor S.白细胞介素-6:一种有前途的细胞因子,支持肝脏再生和适应性免疫在肝脏病变。细胞因子生长因子rev 2018; 39:36-45。https://doi.org/10.1016/j.cytogfr.2018.01.002(Epub 2018 1月12日).
Ashraf NU, Altaf M.表观遗传学:非酒精性脂肪肝发病机制的新兴领域。Mutat Res. 2018; 778:1-12。https://doi.org/10.1016/j.mrrev.2018.07.002(Epub 2018 8月8日).
Eslam M, Valenti L, Romeo S. NAFLD和NASH的遗传学和表观遗传学:临床影响。中华肝病杂志,2018;68(2):268-79。https://doi.org/10.1016/j.jhep.2017.09.003(Epub 2017 11月6日).
Finotti A, Fabbri E, Lampronti I, Gasparello J, Borgatti M, Gambari R.遗传疾病中的microrna和长非编码rna。分子病理学杂志,2019;23(2):155-71。https://doi.org/10.1007/s40291-018-0380-6.
林海燕,杨丽丽,王培文,王福生,黄永华。microrna在NAFLD中的新兴作用:microRNA-29a在调节氧化应激、炎症等方面的突出作用。细胞。2020;9(4):1041。https://doi.org/10.3390/cells9041041.
Hanson A, Wilhelmsen D, DiStefano JK。长链非编码rna (lncRNAs)在非酒精性脂肪性肝病(NAFLD)相关纤维化发生和进展中的作用非编码RNA。2018; 4(3): 18。https://doi.org/10.3390/ncrna4030018.
Iacono A, Raso GM, Canani RB, Calignano A, Meli R.益生菌作为一种治疗NAFLD的新兴治疗策略:关注分子和生化机制。生物化学学报。2011;22(8):699-711。https://doi.org/10.1016/j.jnutbio.2010.10.002(Epub 2011年2月2日).
Perumpail BJ, Li AA, John N, salam S, Shah ND, Kwong W, Cholankeril G, Kim D, Ahmed A.肠道微生物群和益生菌在NAFLD患者中的治疗意义。疾病。2019;7(1):27。https://doi.org/10.3390/diseases7010027.
梅洛妮,龙戈,唐乔凡尼。益生菌在非酒精性脂肪性肝病中的作用:对治疗策略的新见解。营养。2019;11(11):2642。https://doi.org/10.3390/nu11112642.
Duseja, Acharya SK, Mehta M, Chhabra S, Rana S, Das A, Dattagupta S, Dhiman RK, Chawla YK。高效多菌株益生菌改善非酒精性脂肪性肝病(NAFLD)的肝组织:一项随机、双盲、概念证明研究英国医学杂志,2019;6(1):e000315。https://doi.org/10.1136/bmjgast-2019-000315.
Scaldaferri F, Gerardi V, Mangiola F, Lopetuso LR, Pizzoferrato M, Petito V, Papa A, Stojanovic J, Poscia A, Cammarota G, Gasbarrini A大肠杆菌溃疡性结肠炎患者维持缓解的Nissle 1917:一项更新。世界胃肠杂志,2016;22(24):5505-11。https://doi.org/10.3748/wjg.v22.i24.5505.
Wassenaar TM。来自100年益生菌研究的见解大肠杆菌.中华微生物学杂志,2016;6(3):147-61。https://doi.org/10.1556/1886.2016.00029.
Hungin AP, Mulligan C, Pot B, Whorwell P, Agréus L, Fracasso P, Lionis C, Mendive J, de Foy JMP, Rubin G, Winchester C, de Wit N.系统综述:临床实践中益生菌在下消化道症状管理中的应用——基于证据的国际指南。中国药物学杂志,2013;38(8):864-86。https://doi.org/10.1111/apt.12460(Epub 2013 8月27日).
Praveschotinunt P, Duraj-Thatte AM, Gelfat I, Bahl F, Chou DB, Joshi NS。工程大肠杆菌Nissle 1917用于递送基质系结治疗域到肠道。地理学报。2019;10(1):5580。https://doi.org/10.1038/s41467-019-13336-6(Epub 2013 8月27日).
Reynolds J, Farinha M.计数细菌。生物学2420实验室手册:微生物学。里奇兰学院,达拉斯,美国。2005; 1 - 10。
李国强,李国强,李国强大肠杆菌慢性实验性肝损伤并发症的研究。兽医医学。2007;52(3):121-9。
aribas B, Rodríguez-Cabezas ME, Camuesco D, Comalada M, Bailón E, Utrilla P, Nieto A, Concha A, Zarzuelo A, Gálvez j大肠杆菌, Nissle 1917,口服对脂多糖诱导的小鼠败血症产生局部和全身抗炎作用。中国药物学杂志,2009;157(6):1024-33。https://doi.org/10.1111/j.1476-5381.2009.00270.x(Epub 2009 5月26日).
Briskey D, Heritage M, Jaskowski LA, Peake J, Gobe G, Subramaniam VN, Crawford D, Campbell C, Vitetta L.益生菌在非酒精性脂肪肝动物模型中修饰紧密连接蛋白。中国消化内科杂志,2016;9(4):463-72。https://doi.org/10.1177/1756283X16645055(Epub 2016年5月1日).
沙山,徐斌,孔霞,魏楠,刘杰,吴凯大肠杆菌不同疗程、不同剂量的菌株Nissle 1917对结肠炎模型小鼠肠道炎症的影响。中国生物医学工程学报,2014;29(3):344 - 344。https://doi.org/10.1007/s00011-014-0761-1(Epub 2014年8月14日).
郭建华,韩德伟,李小强,张勇,赵永春。小剂量LPS对高糖高脂饮食诱导大鼠NASH的影响。欧洲医学与药物科学2014;18(18):2742-7。
张志刚,张志刚,张志刚。ETS-1表达在卵巢癌血管生成中的临床意义。中华癌症杂志2003;94(9):769-73。https://doi.org/10.1111/j.1349-7006.2003.tb01517.x.
高桥Y,福岛T.非酒精性脂肪性肝病/非酒精性脂肪性肝炎组织病理学。世界胃肠杂志。2014;20(42):15539-48。https://doi.org/10.3748/wjg.v20.i42.15539.
成人非酒精性脂肪肝的无创诊断和医疗管理的最新进展。埃及肝脏J. 2020;10:37。https://doi.org/10.1186/s43066-020-00043-x.
黄大众,辛格尔AK。非酒精性脂肪性肝病和酒精性肝炎的新医学疗法。中华胃肠病杂志,2019;19(4):53。https://doi.org/10.21037/tgh.2019.06.06.
Kaufmann B, Reca A, Wang B, Friess H, Feldstein AE, Hartmann D.非酒精性脂肪肝的发病机制及手术意义。Langenbecks Arch外科杂志。2021;39(1):1 - 17。https://doi.org/10.1007/s00423-020-01965-1(Epub 2020 8月24日).
张志刚,张志刚,张志刚。肝星状细胞在肝纤维化中的作用。Adv Drug Deliv rev 2017; 121:27-42。https://doi.org/10.1016/j.addr.2017.05.007(Epub 2017 5月12日).
Della Corte CM, Viscardi G, Papaccio F, Esposito G, Martini G, Ciardiello D, Martinelli E, Ciardiello F, Morgillo F. Hedgehog基因通路在肝细胞癌中的意义世界胃肠杂志,2017;23(24):4330-40。https://doi.org/10.3748/wjg.v23.i24.4330.
鼠标(GRCm39) ensemble release 103 - 2月2021©EMBL-EBI: ENSMUSG00000037025。http://www.ensembl.org/Mus_musculus/Info/Index?db=core;g=ENSMUSG00000037025;r=2:147884797-147888889.2021年7月访问。
Human (GRCh38) ensemble release 103 - 2021年2月©EMBL-EBI: ENSG00000125798。http://www.ensembl.org/Homo_sapiens/Info/Index?db=core;g=ENSG00000125798;r=20:22580998-22585455.2021年7月访问。
高森ML, Kaestner KH。狐狸转录因子:从发育到疾病。发展。2016;143(24):4558 - 70。https://doi.org/10.1242/dev.112672.
Bernardo GM, Keri RA。FOXA1:在发育和癌症中具有平行功能的转录因子。生物科学通报2012;32(2):113-30。https://doi.org/10.1042/BSR20110046.
张志刚,张志刚,张志刚。肝脏中的刺猬信号。中华肝病杂志,2011;54(2):366-73。https://doi.org/10.1016/j.jhep.2010.10.003.
Wang DH, Tiwari A, Kim ME, Clemons NJ, Regmi NL, Hodges WA, Berman DM, Montgomery EA, Watkins DN, Zhang X, Zhang Q, Jie C, Spechler SJ, Souza RF。刺猬信号在食管胚胎发生和Barrett化生中调控FOXA2。中华临床医学杂志,2014;29(9):369 - 369。https://doi.org/10.1172/JCI66603.
王伟,姚丽娟,沈伟,丁凯,史敏,陈峰,何俊,丁俊,张欣,谢文峰。FOXA2通过保护小鼠肝细胞缓解ccl4诱导的肝纤维化。科学通报2017;7(1):15532。https://doi.org/10.1038/s41598-017-15831-6.
Wilhelm A, Aldridge V, Haldar D, Naylor AJ, Weston CJ, Hedegaard D, Garg A, Fear J, Reynolds GM, Croft AP, Henderson NC, Buckley CD, Newsome PN。CD248/endosialin在慢性肝损伤过程中通过pdgf调控机制调控肝星状细胞增殖。肠道。2016;65(7):1175 - 85。https://doi.org/10.1136/gutjnl-2014-308325(Epub 2015 6月15日).
Henderson NC, Arnold TD, Katamura Y, Giacomini MM, Rodriguez JD, McCarty JH, Pellicoro A, Raschperger E, Betsholtz C, Ruminski PG, Griggs DW, Prinsen MJ, Maher JJ, Iredale JP, Lacy-Hulbert A, Adams RH, Sheppard D. αv整合素靶向识别了调节多个器官纤维化的核心分子途径。中华外科杂志,2013;19(12):1617-24。https://doi.org/10.1038/nm.3282(Epub 2013年11月10日).
陈玲,李娟,张娟,戴超,刘鑫,王洁,高志,郭辉,王锐,陆松,王峰,张辉,陈辉,范霞,王松,秦铮。S100A4通过激活肝星状细胞促进肝纤维化。中华肝病杂志,2015;62(1):156-64。https://doi.org/10.1016/j.jhep.2014.07.035(Epub 2014年8月9日).
Human (GRCh38/hg38) ensemble release 103 - 2月2021©EMBL-EBI: ENSG00000074219。http://www.ensembl.org/Homo_sapiens/Gene/Summary?g=ENSG00000074219;r=19:49340595-49362457.2021年7月访问。
赵忠,陈娟,马晓霞,夏强,张娟,张娟,赵忠。肝脏疾病外延转录组学的基本概念及治疗潜力。中华肝病杂志2020;73(3):664-79。https://doi.org/10.1016/j.jhep.2020.04.009(Epub 2020年4月21日).
荣志祥,李志,何俊杰,刘丽丽,任XX,高洁,穆勇,管宇德,段玉明,张雪平,张德胜,李楠,邓玉珍,孙丽强。脂肪量和肥胖相关(FTO)的下调促进肝内胆管癌的进展。前沿工程,2019;9(9):369。https://doi.org/10.3389/fonc.2019.00369.
Joo JS, Cho SY, Rou WS, Kim JS, Kang SH, Lee ES, Moon HS, Kim SH, Sung JK, Kwon IS, Eun HS, Lee BS。TEAD2作为一种新的肝细胞癌预后因素。中国农业科学,2020;43(6):1785-96。https://doi.org/10.3892/or.2020.7578(Epub 2020年4月6日).
舒燕,刘旭,黄红,文强,舒娟。天然化合物通过影响肝星状细胞自噬抗肝纤维化的研究进展。Mol生物学杂志2021;48(2):1915-24。https://doi.org/10.1007/s11033-021-06171-w(Epub 2021 2月20日).
Lee DH, Park JO, Kim TS, Kim SK, Kim TH, Kim MC, Park GS, Kim JH, Kuninaka S, Olson EN, Saya H, Kim SY, Lee H, Lim DS。LATS-YAP/TAZ在肝脏发育过程中通过调节TGFβ信号通路和Hnf4α表达来控制谱系规范。地理学报。2016;30(7):11961。https://doi.org/10.1038/ncomms11961.
Aylon Y, Gershoni A, Rotkopf R, Biton IE, Porat Z, Koh AP, Sun X, Lee Y, Fiel MI, Hoshida Y, Friedman SL, Johnson RL, Oren M. LATS2肿瘤抑制因子抑制SREBP并抑制肝脏胆固醇积累。基因开发,2016;30(7):786-97。https://doi.org/10.1101/gad.274167.115(Epub 2016 3月24日).
Furth N, Aylon Y. LATS1和LATS2肿瘤抑制因子:超越Hippo途径。细胞死亡差异。2017;24(9):1488-501。https://doi.org/10.1038/cdd.2017.99(Epub 2017 6月23日).
叶娟,李涛,徐刚,赵玉梅,张乃楠,范军,吴娟。JCAD通过抑制LATS2激酶活性促进非酒精性脂肪性肝炎向肝癌发展。癌症学报,2017;77(19):5287-300。https://doi.org/10.1158/0008-5472.CAN-17-0229(Epub 2017年8月3日).
肝脏中的IL-6通路:从生理病理到治疗。中华肝病杂志,2016;64(6):1403-15。https://doi.org/10.1016/j.jhep.2016.02.004(Epub 2016年2月8日).
Fazel Modares N, Polz R, Haghighi F, Lamertz L, Behnke K, Zhuang Y, Kordes C, Häussinger D, Sorg UR, Pfeffer K, Floss DM, Moll JM, Piekorz RP, Ahmadian MR, Lang PA, Scheller J. IL-6反转导信号控制部分肝切除术后肝脏再生。肝脏病学。2019;70(6):2075 - 91。https://doi.org/10.1002/hep.30774(Epub 2019 7月8日).
项大敏,孙伟,宁宝峰,周廷峰,李晓峰,钟伟,程志,夏美美,王旭,邓霞,王伟,李海燕,崔晓玲,李顺生,吴波,谢伟峰,王海燕,丁杰。HLF/IL-6/STAT3前馈电路驱动肝星状细胞活化促进肝纤维化。肠道。2018;67(9):1704 - 15所示。https://doi.org/10.1136/gutjnl-2016-313392(Epub 2017年7月28日).
王华,孔霞,高斌。肝脏疾病的信号转导和转录激活因子3:一种新的治疗靶点。中国生物医学杂志,2011;7(5):536-50。https://doi.org/10.7150/ijbs.7.536.
孔霞,堀口N, Mori M,高b。细胞因子与肝纤维化的相关性研究。前沿物理。2012;3(3):69。https://doi.org/10.3389/fphys.2012.00069.
Granzow M, Schierwagen R, Klein S, Kowallick B, Huss S, Linhart M, Mazar IG, Görtzen J, Vogt A, Schildberg FA, gonzales - carmona MA, Wojtalla, Krämer B, Nattermann J, Siegmund SV, Werner N, Fürst DO, Laleman W, Knolle P, Shah VH, Sauerbruch T, Trebicka J.血管紧张素ii型1受体介导的Janus激酶2激活诱导肝纤维化。肝脏病学。2014;60(1):334 - 48。https://doi.org/10.1002/hep.27117.
Lakner AM, Moore CC, Gulledge AA, Schrum LW。每日基因分析表明JAK/STAT信号通路促进早期肝星状细胞转分化。中华胃肠病杂志。2010;16(40):5047-56。https://doi.org/10.3748/wjg.v16.i40.5047.
Fabregat I, Caballero-Díaz D.转化生长因子-β诱导细胞可塑性在肝纤维化和肝癌发生中的作用。前沿工程学报,2018;10(8):357。https://doi.org/10.3389/fonc.2018.00357.
刘娟,孔东,邱娟,谢燕,卢震,周超,刘霞,张荣,王莹。吡喹酮通过上调肝星状细胞Smad7抑制TGF-β/Smad信号通路,改善ccl4诱导的小鼠肝纤维化。中国药物学杂志,2019;26(4):466 - 466。https://doi.org/10.1111/bph.14831.
Rajasekaran S, Rajaguru P, Sudhakar Gandhi PS. MicroRNAs作为进展性肺纤维化的潜在靶点。前沿药典,2015;5(6):254。https://doi.org/10.3389/fphar.2015.00254.
Estep M, Armistead D, Hossain N, Elarainy H, Goodman Z, Baranova A, Chandhoke V, Younossi ZM。非酒精性脂肪肝患者内脏脂肪组织中mirna的差异表达食品药物学杂志2010;32(3):487-97。https://doi.org/10.1111/j.1365-2036.2010.04366.x(Epub 2010 5月22日).
王晓明,王晓明,王晓明,等。微rna在炎症性肠病中的应用。中华胃肠杂志。2015;21(43):12274-82。https://doi.org/10.3748/wjg.v21.i43.12274.
韩玲,尹小荣,张淑琪。miR-650通过直接抑制LATS2的表达促进肝细胞癌的转移和上皮-间质转化。中国生物医学工程学报。2018;51(3):1179-92。https://doi.org/10.1159/000495495(Epub 2018 11月27日).
周超,陈建勇,彭迪克·金炜,Motola DL, Chung RT, Mullen AC.人肝星状细胞长链非编码rna与细胞外基质蛋白形成网络。基因组医学。2016;8(1):31。https://doi.org/10.1186/s13073-016-0285-0.
Human (GRCh38.p13) ensemble release 103 - 2021年2月©EMBL-EBI: ENSG00000269609。http://www.ensembl.org/Homo_sapiens/Gene/Summary?g=ENSG00000269609;r=10:102449816-102461106#.
任艳,赵超,何艳,闵霞,徐红,胡霞。RPARP-AS1/miR125a-5p轴促进结肠癌细胞增殖、迁移和侵袭。科学通报。2021;12(14):5035-43。https://doi.org/10.2147/OTT.S304494.
李志强,李志强,李志强。肝纤维化过程中肝星状细胞代谢特征的研究。细胞。2019;9(1):24。https://doi.org/10.3390/cells9010024.
李浩,黄明明,姜东德,彭志刚。丙型肝炎:从炎症发病机制到抗炎/保肝治疗。世界胃肠杂志,2018;24(47):5297-311。https://doi.org/10.3748/wjg.v24.i47.5297.
李娟,赵友尔,田忠。肝星状细胞在急性肝衰竭中的作用:从炎症和纤维化的角度。世界肝病杂志,2019;11(5):412-20。https://doi.org/10.4254/wjh.v11.i5.412.
马凡·赫尔克,L冯希亚,SM弗兰克。非酒精性脂肪肝的动物模型——初学者指南。营养。2017;9(10):1072。https://doi.org/10.3390/nu9101072.
确认
作者感谢Manal M. El Mahdy教授在组织学检查和免疫组织化学研究方面的努力。
资金
由科学、技术和创新基金管理局(STDF)与埃及知识银行(EKB)合作提供的开放获取资金。stdf -科学和技术发展基金,用于认可的科学卓越中心。,埃及开罗(批准号4118 51)。
作者信息
作者及隶属关系
贡献
NMH, MM:他们分享了研究设计,Insilco分析,实际应用,最后起草了手稿。SE:分享研究设计方案,分析获得的数据,起草修订,并批准最终版本的手稿出版。AHH、YMA-E、NMAE共同参与动物模型实验设计与实施。MAA:参与化学分析和修改稿件。MB、IFM、PJS:共同参与稿件的起草和修改。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
这项研究得到了亚利桑那州立大学医学院伦理委员会的批准。FWA000017585)。该研究是根据reach指南进行报道的。
发表同意书
所有作者均已阅读稿件并批准出版。
相互竞争的利益
作者没有报告任何利益声明。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1
:数字S1-S7.检索和验证数据的数据库屏幕截图,演示了生物信息学工作流程的每个步骤。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
哈尼,n.m.,艾莎,S.,巴斯尤尼,M。et al。Mutaflor对肝星状细胞的调节作用®益生菌在非酒精性脂肪肝治疗中的应用翻译医学杂志20., 342(2022)。https://doi.org/10.1186/s12967-022-03543-z
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-022-03543-z
关键字
- 非酒精性脂肪肝
- 纳什
- 益生菌
- 大肠杆菌
- 肝星状细胞
- 肝纤维化
- 刺猬
- 河马