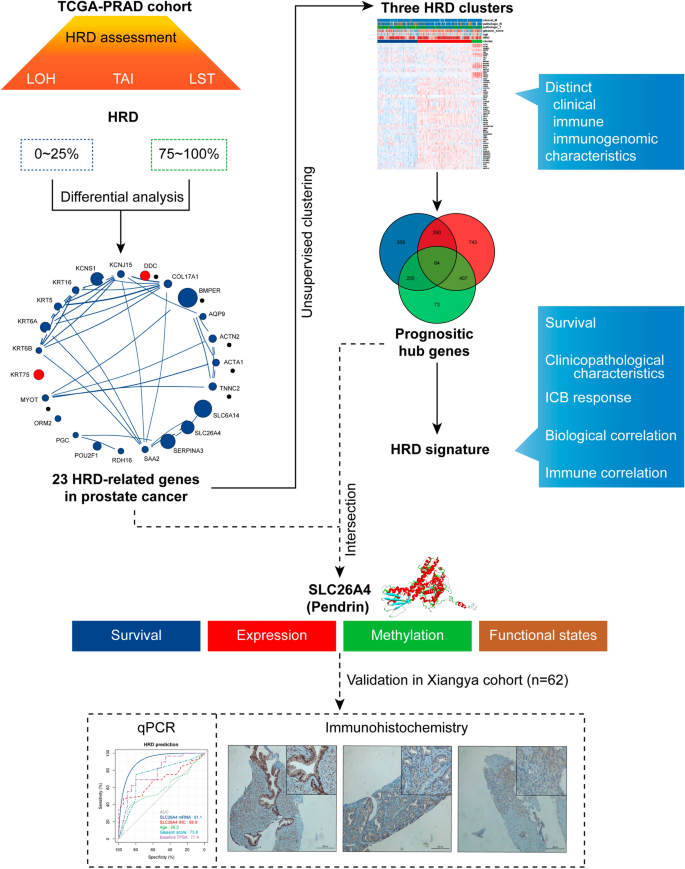
摘要
背景
同源重组缺陷(Homologous recombination deficiency, HRD)与前列腺癌患者的预后和治疗方案密切相关。然而,目前尚缺乏与HRD相关的定量指标来准确预测PCa的预后。
方法
我们根据HRD评分筛选HRD相关基因,并构建了HRD聚类系统,以探索聚类之间不同的临床病理、基因组和免疫基因组模式。建立风险特征HRDscore,并通过多变量Cox回归分析进行评估。我们注意到SLC26A4该模型基因在预测前列腺癌预后和HRD方面具有独特的潜力。通过多组学分析探讨其在PCa中的作用,并通过qRT-PCR和免疫组化验证结果。
结果
三种HRD聚类在患者预后、临床病理特征、生物学途径、免疫浸润特征和免疫调节剂的调节方面存在显著差异。进一步分析表明,构建的HRDscore系统是PCa患者的独立预后因素,稳定性较好。最后,我们确定了一个基因,SLC26A4在三个独立的队列中,这与预后显著相关。重要的是,SLC26A4证实了PCa的区分(AUC为mRNA 0.845;免疫组化评分AUC为0.769)和HRD (mRNA AUC为0.911;在我们的队列中,免疫组化评分为0.689)的RNA和蛋白质水平的AUC。
结论
本研究引入HRDscore来量化个体PCa患者的HRD模式。与此同时,SLC26A4是一种新型的生物标志物,可以合理预测前列腺癌的预后和HRD。
简介
前列腺癌(PCa)是一种常见的恶性肿瘤,是全球男性癌症相关死亡的第二大原因[1].可转移至骨骼(80%-100%)、淋巴结、肝脏、肾上腺或肺[2].虽然大多数早期局限性前列腺癌通过前列腺切除术或放疗可以取得满意的结果,5年生存率为98.9%,但转移主要出现在初诊时,阻碍了良好预后的途径。转移性前列腺癌的治疗仍然有限,目前的标准治疗是雄激素剥夺治疗(ADT)联合化疗[3.,4].虽然ADT最初有效,但大多数患者在2-3年内不可避免地发展为致命性转移性去势抵抗性前列腺癌(mCRPC) [5], 5年生存率仅为28.2% [1].因此,改善前列腺癌患者的分层,使高危患者能够更早发现并接受积极治疗,是人们极大的热情。
同源重组通路在DNA修复中起着至关重要的作用,涉及许多基因[6),包括BRCA(BRCA1/2),自动取款机,CHEK2等。积累的证据揭示了同源重组缺陷(homologous recombination deficiency, HRD)在前列腺癌中的价值,代表着前列腺癌发生和侵袭性的高风险。四分之一复发或晚期前列腺癌患者携带hrd相关基因的种系或体细胞突变[7].前列腺癌中hrd相关基因最常见的改变是BRCA2, mCRPC患者种系水平的患病率为5-6% [8,9].之前的一项研究表明BRCA2突变携带者患前列腺癌的风险增加5.0 - 8.6倍,绝对风险增加15% [10,11].此外,BRCA2与非携带者相比,突变携带者从局部疾病到全身疾病的进展率更高,Gleason评分更高,无转移生存期更短,总体生存率更低[12,13,14].一般而言,HRD与前列腺癌预后较差密切相关。
通过从癌症基因组图谱前列腺腺癌队列(TCGA-PRAD)中提取HRD评分和其他信息,我们建立了一个HRD签名来区分高危和低危前列腺癌患者。通过深入分析,我们鉴定并验证了溶质载体家族26成员4 (SLC26A4),这可能指导多聚(adp -核糖)聚合酶(PARP)抑制剂在PCa中的应用,以补充常见的hdd相关基因突变。
材料与方法
前列腺癌数据集和预处理
2021年8月22日,从癌症基因组图谱(TCGA)、纪念斯隆凯特林癌症中心(MSKCC)和基因表达综合(GEO)数据库中检索了三个包含前列腺癌样本、多组学数据和完整临床信息的开放数据集,其中包括TCGA- prad [15], mskcc-prad [16],及GSE116918 [17军团。然后将外显子模型每百万映射片段(FPKM)值转换为每千碱基百万转录本(TPM)值并进行对数转换。HRD,包括杂合性缺失(LOH)、端粒等位基因失衡(TAI)和大规模状态转变(LST),以及基因水平拷贝数、PARADIGM整合途径、免疫亚型、基因水平非沉默突变,从UCSC Xena的泛癌症(PANCAN)队列中下载。https://xenabrowser.net/)[18,19].TCGA-PRAD组中没有特定HRD评分的患者被排除在外进行进一步分析。
hrd相关基因图谱
HRD评分和全基因组DNA损伤足迹于2017年6月13日更新。从那时起,TCGA-PRAD队列中没有特定HRD评分的患者被排除在外进行进一步分析。我们根据HRD评分将患者分为TCGA-PRAD组。第1季度和第4季度分别被定义为底层HRD组和顶级HRD组。利用“limma”R包对两组转录组数据进行差异分析。选择| log2(fold change) |> 0.5且p值< 0.05的基因进行后续单因素Cox分析,将与患者无进展间期(PFI或PFS)显著相关的基因定义为hdd相关基因。研究其突变和表达谱。我们还根据他们的mRNA表达水平计算了他们的Spearman相关性,并将其作为一个内部相关图显示。
hrd相关基因的无监督聚类
基于上述HRD预后相关基因的表达,应用无监督聚类分析来识别不同的HRD模式,并对患者进行分类以便进一步分析。共识聚类算法决定了聚类的数量及其稳定性。我们使用ConsensuClusterPlus包来执行上述步骤,并进行了1000次重复,以保证分类的稳定性[20.].
每个hrd相关基因的mRNA表达水平在聚类中被描述。采用主成分分析(PCA)和Kaplan-Meier生存分析评价聚类效果。评估了组间临床病理特征的分布,包括诊断年龄、Gleason评分、主要结局、生化复发(BCR)、病理T分期、病理N分期、癌原部位和免疫亚型。
转录组和蛋白质组水平的途径量化
PARADIGM算法集成了通路、表达式和拷贝数数据,以推断叠加通路(SuperPathway)网络结构中通路特征的激活。SuperPathway系统包括来自NCI-PID、BioCarta和Reactome(最后更新于2013年5月5日)三个通路数据库的1387个组成通路,包含19K个通路特征,代表7369个基因、9354个复合物、2092个家族、82个rna、15个mirna和592个抽象过程。该数据集是1387个组成路径的ssGSEA评分[19].
来自PANCAN队列的反相蛋白阵列(RPPA)数据用于计算10种癌症相关通路的通路活性评分。RPPA是一种高通量抗体为基础的技术,程序如Western blots。从肿瘤组织或培养细胞中提取蛋白质,用SDS变性,打印在涂有硝化纤维的载玻片上,然后用抗体探针检测。这些术语包括凋亡、细胞周期、DNA损伤反应、上皮-间充质转化(Epithelial-Mesenchymal Transition, EMT)、激素a、激素b、PI3K/AKT、RTK和TSC/mTOR通路。简而言之,RBN RPPA数据以中位数为中心,对每个组分在所有样本上的标准差进行归一化,得到相对蛋白水平。途径活性分数为特定途径中所有正调控元件的相对蛋白水平减去负调控元件的相对蛋白水平之和[21].
肿瘤纯度和免疫细胞组分的估计
利用表达数据估计肿瘤组织中的基质和免疫成分以及肿瘤纯度,使用“ESTIMATE”R包[22].随后,使用包括MCP计数器(10种细胞类型)在内的三种知名算法估算组织浸润免疫细胞和基质细胞群体的群体丰度(分数)[23],免疫细胞ai(24种细胞类型)[24],以及赛博排序(22种细胞类型)[25].
肿瘤的基本分子特征
我们从综合和深入的生物信息学研究中提取了恶性肿瘤的重要分子特征[26],包括增殖、白细胞分数、B细胞受体(BCR)均匀度、T细胞受体(TCR)均匀度、Th1、Th2和Th17细胞、非整倍体评分、瘤内异质性(ITH)、单核苷酸变异(SNV)新抗原、插入和删除(indel)新抗原、癌睾丸抗原(CTA)评分、同源重组缺陷和改变基因组的分数。微卫星不稳定性(MSI) MANTIS评分从cBioPortol for Cancer Genomics下载(https://www.cbioportal.org/).
免疫调节剂鉴定与分析
78个免疫调节基因的列表来自先前的一项研究,该研究由TCGA免疫反应工作组内的免疫肿瘤学专家进行的文献综述[26].用相应的中位mRNA表达水平来总结每个聚类中的表达。我们进行了跨聚类的limma差异分析,以检查免疫调节基因表达的差异,并发现基因表达显著差异。PANCAN队列还输出了每个免疫调节基因的深度扩增(2)、浅扩增(1)、未改变(0)、浅缺失(−1)和深度缺失(−2)的免疫调节拷贝数。然后在HRD聚类中比较每种拷贝数改变类型的样本比例。
预后中枢基因和降维分析
我们在该队列的HRD聚类中进行了对之间的差异表达分析,并在获得结果的差异表达基因的交集后进行了Cox生存分析。将具有生存意义的基因作为预后中枢基因,将其表达模式作为后续PCA分析的基础。风险特征称为“HRDscore”,计算公式如下:
,“表达式\({}_{风险}\)"代表危险基因的表达水平"表达式\({}_{防护}\)代表保护基因。
根据X-tile软件确定的最佳分界点,将患者分为高HRDscore组和低HRDscore组。建立了HRD聚类、免疫亚型与HRDscore之间的内在关系的桑基图。此外,我们还探讨了HRDscore与临床病理特征(包括生存期)之间的相关性。亚组分析根据年龄(≤45岁或> 45岁)、Gleason评分(< 8或≥8)将TCGA-PRAD患者分为不同组。最后,进行多变量Cox分析以检验所建立的HRDscore的稳健性。
免疫治疗反应的预测及与免疫细胞的相关性
基于转录组数据,ImmuCellAI用于预测免疫检查点封锁(ICB)治疗的反应[24].建立受试者工作特征(ROC)曲线来说明HRDscore在预测免疫治疗反应中的作用。
我们计算了HRDscore与免疫细胞分数和这些细胞类型的预后价值之间的相关性。接下来,在hrd相关基因和预后中枢基因交叉后,获得了几个基因。还测量了它们与免疫细胞的关系,以寻找连接HRD评分、免疫浸润和患者预后的关键基因。
实时荧光定量PCR检测
采用SYBR Green PCR混合液(Roche lightcycler 480系统)按标准方案进行实时定量PCR。PCR条件为:95℃下5 min 1个循环,95℃下10 s 45个循环,60℃下10 s, 72℃下10 s。的表达式SLC26A4用比较CT法将基因归一化为GAPDH基因的表达。所用引物为:SLC26A4(f: 5 ' - aggaaatatgcactgctcact - 3 ';接待员:5 ' -AGTATTCCCGCAGTTTGCTGA-3 ');GAPDH(F: 5“-CAAGGCTGAGAACGGGAAG-3”;R: 5“-TGAAGACGCCAGTGGACTC-3”)。
前列腺癌标本及免疫组化
前列腺癌标本取自中南大学湘雅医院。一名医生获得了患者的知情同意。人体实验相关程序经中南大学湘雅医院伦理委员会批准。将组织固定在10%的缓冲福尔马林中,然后转移到70%的酒精中。石蜡包埋组织切片(4 μm),用抗SLC26A4抗体(HPA042860, Atlas antibody)染色。根据制造商的协议,执行以下检测和可视化程序。为了量化免疫组化(IHC)阳性染色结果,每个组织样本中随机五个区域由经验丰富的病理学家进行显微镜检查和分析。用阳性区域除以整个区域计算平均染色分数。
统计分析
进行单因素和多因素Cox分析以检测预后因素。Kaplan-Meier曲线与log-rank检验用于评估组间的生存差异。采用Spearman相关分析计算相关性。使用X-tile软件(3.6.1版本)确定截止值。所有统计分析均使用R软件(4.1.2版本)进行,大部分可视化使用“ggplot2”R包实现。P < 0.05为差异有统计学意义。
结果
前列腺癌hrd相关基因的遗传变异图景
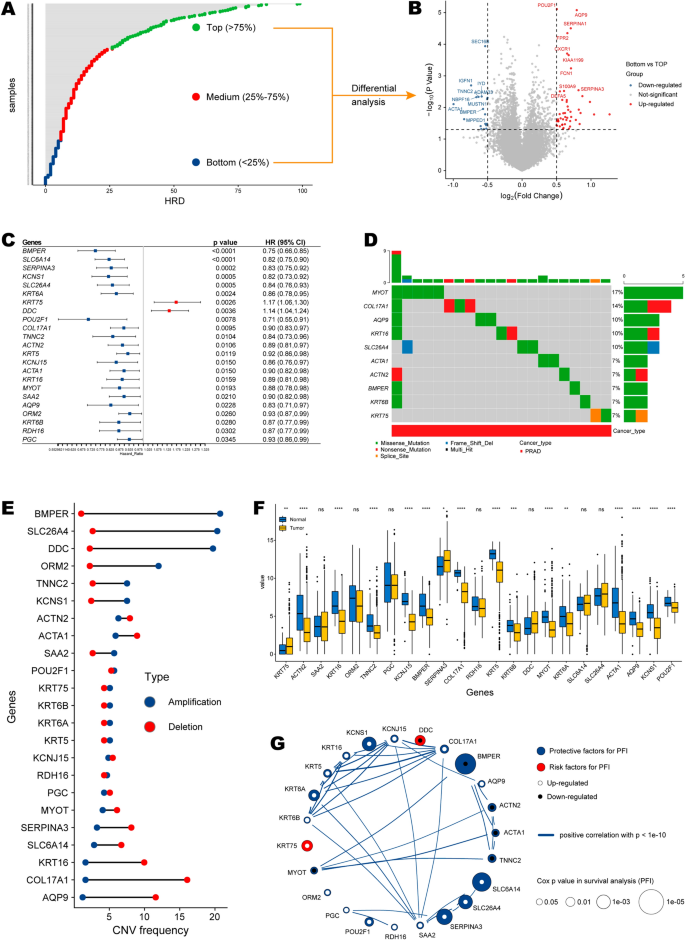
本文的研究流程图如图所示。1.我们首先将TCGA-PRAD队列中的患者(n = 472)按照HRD评分从高到低的顺序进行排序,然后将他们在第一和第四四分位数(四分位数4 vs.四分位数1)中的转录组数据进行差异表达分析(附加文件)4:表S1;无花果。2获得66个差异表达基因,后续单因素Cox分析发现其中23个与预后相关(p < 0.05;额外的文件5:表S2;无花果。2C),定义为hdd相关基因。
hrd相关基因图谱。一个根据HRD的前列腺癌样本分布。绿点为顶级HRD样本(Q1, > 75%),蓝点为底部HRD样本(Q4, < 25%),红点为中等HRD样本(Q2-3, 25% ~ 75%)。B顶部和底部组间差异表达基因的火山图。C具有显著预后价值的差异表达基因森林图。红色方块表示风险效应(HR > 1),蓝色方块表示保护效应(HR < 1)。D显示TOP 10 hrd相关基因SNV突变状态的癌图。E显示hrd相关基因的CNV频率的哑铃图。红点表示缺失频率,蓝点表示扩增频率。F前列腺癌组织与正常组织hrd相关基因的表达差异Ghrd相关基因之间的相关性。红点代表危险因素,蓝点代表保护因素。统计学意义用星号(*)表示,*p < 0.05, **p < 0.01, ***p < 0.001, ns:不显著
在23个hrd相关基因中,除KRT5和DDC外,大多数是前列腺癌患者PFS的保护因子。此外,SLC26A4、KRT16、COL17A1和AQP9基因不稳定。简单地说,MYOT、COL17A1、AQP9、KRT16和SLC26A4中的SNV频率较高,等于或超过10%(图2)。2D).拷贝数变异(copy number variation, CNV)状态中,BMPER、SLC26A4、DDC扩增频率较高,KRT16、COL17A1、AQP9缺失频率较高(附加文件6:表S3;无花果。2E),并且大多数基因在前列腺癌组织和相邻的正常对照之间存在差异表达(图。2F).这些hrd相关基因之间的内在相关性如图所示。2G(附加文件)7:表S4)。
由23个hrd相关基因介导的分子模式
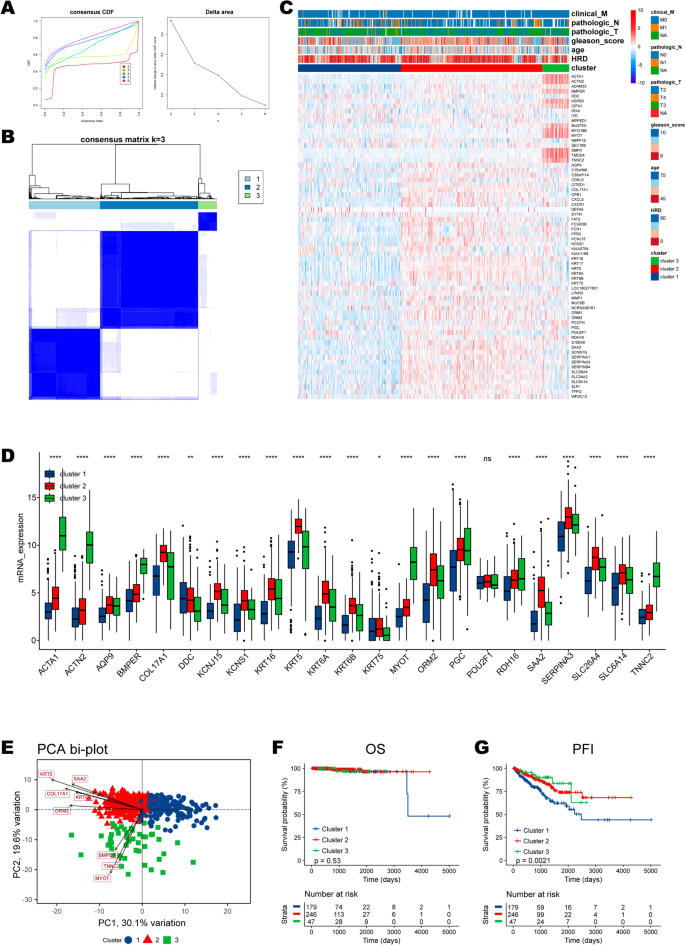
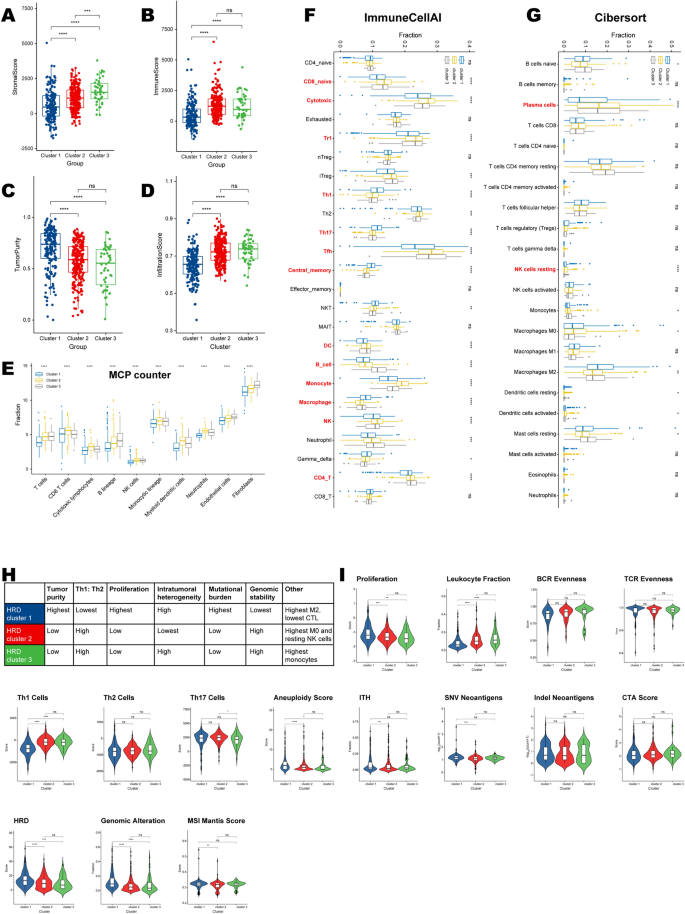
基于23个HRD相关基因的表达模式,无监督聚类将TCGA-PRAD队列中的患者分为三个不同的聚类,其中HRD聚类1至3的样本分别为179、246和47个(图3)。3.A, b, e;额外的文件8:表S5)。HRD相关基因的表达模式和HRD集群背景下的临床病理特征分布如图所示。3.C.我们发现,在热图和箱线图中,所有基因都在HRD簇1中以最低水平表达(图2)。3.C, D)。虽然HRD聚类不能区分患者的总生存期(p = 0.53;无花果。3.F),聚类1的病例表现出最差的无进展间隔(p = 0.0021;无花果。3.此外,我们根据MSKCC-PRAD队列中23个差异表达基因的表达对样本进行聚类,并生成三个聚类。集群1始终表现出最差的PFI(附加文件1:图S1)。
HRD聚类区分临床病理特征和生物学途径
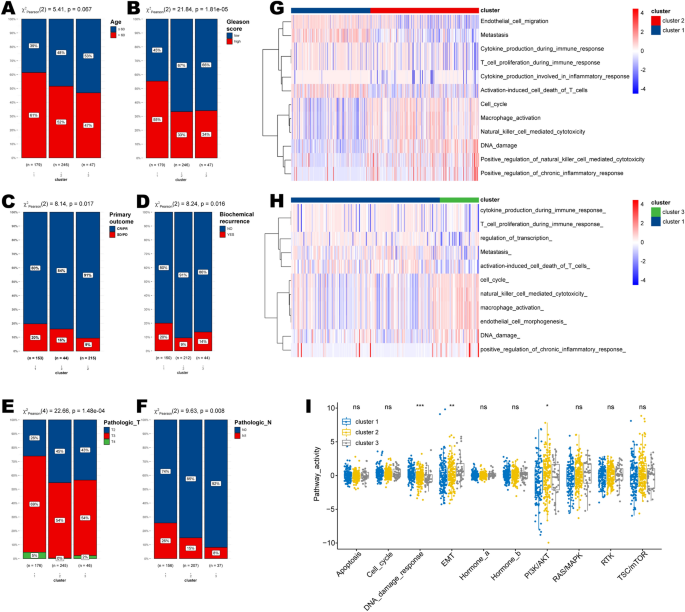
3个HRD聚类之间的卡方分析显示,聚类1的患者年龄更高,Gleason评分更高(图2)。4此外,HRD聚类1中的前列腺癌样本表现出更多的恶性特性,因为它们表现出较低的完全或部分缓解比例(CR/PR),但较高的生化复发比例(图2)。4C, D),以及较高的病理T和N期(图。4E、F)。
与聚类2和聚类3相比,HRD聚类1的转移、免疫应答中细胞因子的产生、T细胞增殖等途径得分较高,而细胞周期、巨噬细胞激活、DNA损伤、自然杀伤细胞介导的细胞毒性等PARADIGM途径得分较低(图2)。4重要的是,使用蛋白质表达数据对激活通路进行量化也表明,我们的HRD聚类可以很好地反映基因改变,因为它在“DNA损伤反应”通路方面唯一地区分了患者(p < 0.001;无花果。4我)。
不同HRD簇的免疫浸润特征
HRD集群1明显显示基质评分最低,免疫评分最低,肿瘤纯度最高(图2)。5得了;额外的文件9:表S6)。ImmuneCellAI估计的浸润丰度显示了一致的结果,因为簇1的浸润评分最低(图2)。5D)。具体来说,每种基质细胞或免疫细胞类型的分数在HRD簇1中最低(图1)。5eg;额外的文件9:表S6)。但有一个矛盾的情况,我们观察到Th1、Th17、中央记忆细胞和巨噬细胞在簇1中最丰富(基于ImmuneCellAI算法;无花果。5F).同时,M2巨噬细胞在聚类1中的分数最高(基于Cibersort算法;无花果。5G)。
基于肿瘤样本的显性样本特征,HRD聚类显示出不同的遗传和免疫特征(图2)。5HRD簇1具有最高的肿瘤突变负担,因为它具有最高的非整倍体评分和SNV新抗原计数(图1)。5同时,聚类1在基因组上是不稳定的,因为我们发现基因组改变的部分和MSI Mantis评分在聚类1中最高(图1)。5H, I)。关于免疫浸润(特征),HRD聚类1显示M2巨噬细胞浸润丰度最高,而细胞毒性T细胞浸润丰度最低(图。5H),并且显示出最高的Th1/Th2比值偏向于适应性免疫浸润(图。5H)。此外,HRD cluster1增殖率最高(图。5H, I)。TCR和BCR的克隆均匀性、indel新抗原的数量和CTA评分在三个HRD集群之间没有显著差异(图。5我)。
免疫调节剂的调节
免疫调节剂(IMs)是癌症免疫治疗的关键,许多IM激动剂和拮抗剂正在临床肿瘤学中进行评估。为了进一步推进这一研究,需要了解它们在肿瘤微环境(TME)不同状态下的表达和控制模式。我们检测了IM基因表达、CNVs和SNVs。
im的基因表达(附加文件10:表S7,附加文件2:图S2A)在HRD集群中有所不同,这可能表明它们在形成TME方面的作用。一般来说,编码im的基因在HRD簇1中处于低表达水平。簇间差异最显著的基因(附加文件2:图S2B)包括CX3CL1 (BH-adjusted p < 10)5),在聚类1和TNFSF4中表达最少(BH-adjusted p = 0.004),在聚类1中表达最多。
拷贝数变化影响多个im,并且在HRD集群中有所不同。簇1表现出频繁的IM基因扩增和缺失,与它们更大的基因组不稳定性相一致。特别是,BTLA在聚类1中扩增最频繁,而TIGIT缺失在聚类3中富集(附加文件2:图S2C)。总的来说,这些IM拷贝数的显著差异可能反映了癌细胞对TME的更直接的调节。观察到的im调控差异可能对治疗发展和联合免疫治疗有影响,在唤起它们的多重机制中进一步强调了它们的生物学重要性。
HRD签名的降维和构造
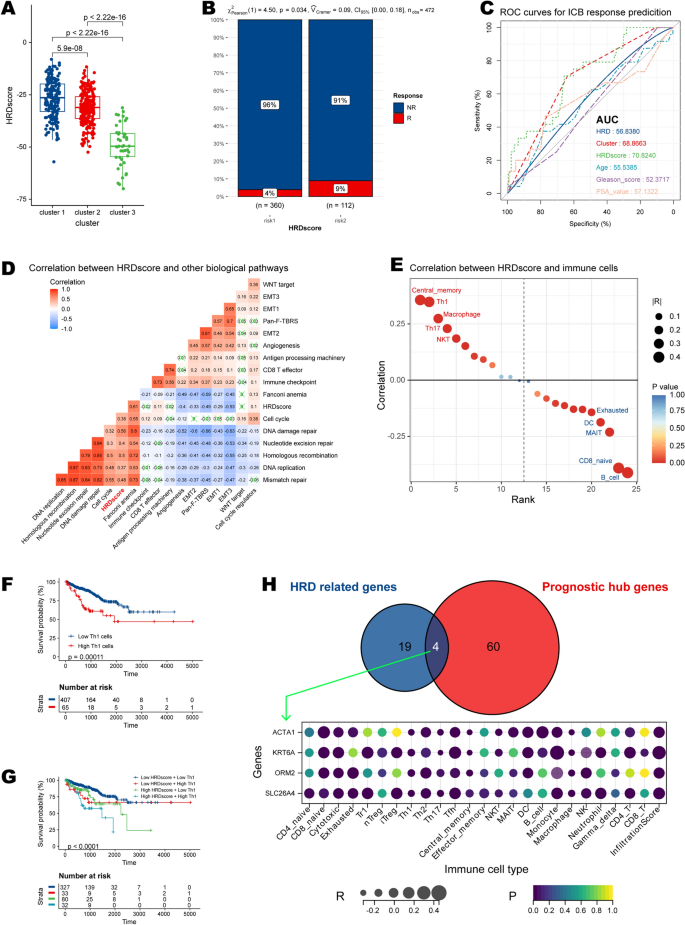
为了准确量化HRD聚类的预测能力,我们应用了一种方法来建立HRD特征并计算所有前列腺癌患者的HRDscore。在交叉三组配对差异表达分析(DEGs)时,我们获得了64个预后中枢基因(图。6一个;额外的文件11:表S8)。使用“方法”部分介绍的公式,我们根据转录组数据计算每个患者的HRDscore。我们发现,HRDscores (X-tile确定的阈值)越高的患者,PFI事件(复发、转移或死亡)的倾向越高(55/360 vs. 33/112;p = 0.0013)(图6B).为了更好地理解个体HRD聚类与HRD特征(HRDscore)及其他特征之间的内在关系,我们建立了一个桑基图(Sankey plot)。6C)。直观地显示,HRDscores较高的患者多来自HRD聚类1,以C3(炎症)和C4(淋巴细胞耗尽)免疫亚型为主。随后的特异性分析发现,Gleason评分较高(≥8)、病理T期和N期以及有PFI事件的患者hrd评分较高(图2)。6D),表明我们的HRD特征具有代表恶性特征的能力。
我们研究的一个重要发现是,建立的HRDscore可以区分前列腺癌患者的生存结局。在总生存期(OS) (p = 0.049)、无病生存期(DSS) (p = 0.025)、无病间期(DFI) (p = 0.0013)和PFI (p < 0.0001)的情况下,HRDscore较高的患者预后较差。6E)。按患者年龄和Gleason评分分层的亚组分析证实了我们的HRD特征的稳定性,因为较高的hrd评分始终与不良预后相关(图。6此外,多变量Cox分析揭示了我们的特征的稳健性,因为它表明Gleason评分、病理T分期和hrd评分是患者DFI和PFI的独立预测因素(图2)。6H, I)。
HRDscore与免疫治疗反应、基因组不稳定性和免疫浸润相关
先前被分配到HRD集群1的患者具有最高水平的HRDscore(图2)。7A).使用大量转录组数据,我们通过ImmuneCellAI算法获得患者对ICB的反应(附加文件)12:表S9)。高hrdscore组对ICB的有效率高于低hrdscore组(9% vs 4%, p = 0.034)。7此外,HRDscore在预测ICB反应方面优于其他指标,AUC = 70.82(图2)。7C).为了更好地说明HRD签名的特征,我们还测试了已知签名和HRDscore之间的相关性(附加文件13:表S10)。采用聚类方法后“病房”。D2”, our HRD signature was clustered with recognized signatures related to genomic instability. In brief, it was strongly correlated with Fanconi anemia, cell cycle, DNA damage repair, Nucleotide excision repair, Homologous recombination, DNA replication, and mismatch repair (Fig.7D)。
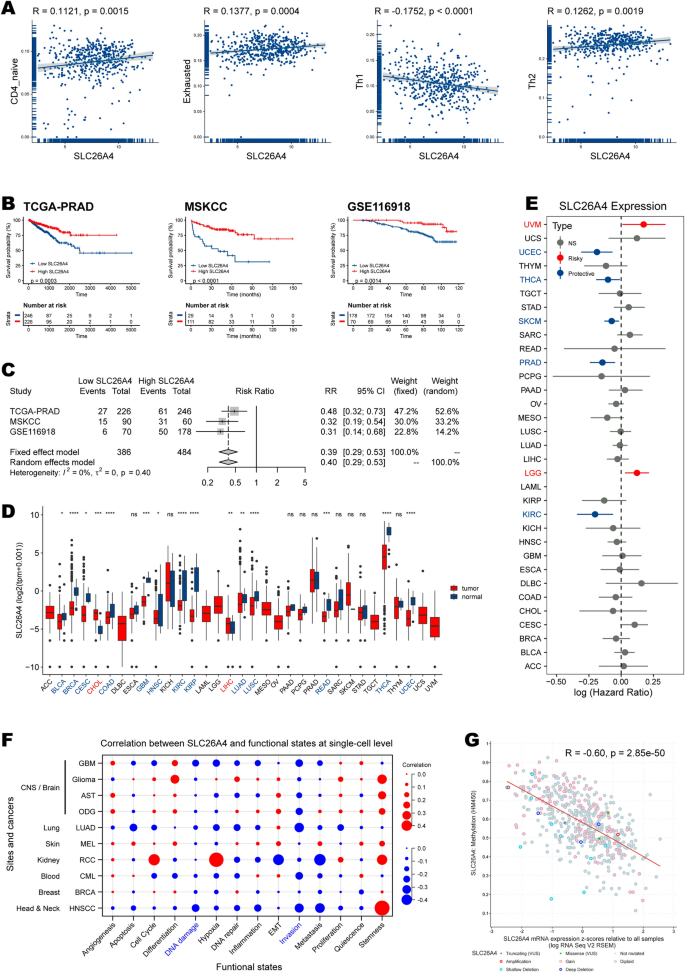
接下来,我们探讨了HRD特征与免疫浸润的关系(图2)。7E,表)。HRDscore与中央记忆细胞、Th1、Th17、巨噬细胞和自然杀伤t细胞(NKT)呈正相关。相反,它与B细胞、CD8 naïve细胞、树突状细胞(DC)和耗尽的T细胞呈负相关。单因素Cox分析发现CD4 naïve T细胞、衰竭T细胞和Th2是保护性细胞,而Th1与PCa患者的不良预后唯一相关(附加文件)14:表S11)。具体来说,Th1丰度较高的患者生存结局较差(图2)。7F),与HRDscore组联合使用效果更显著(图。7G)。
为了更好地关注单个基因因素,我们将hrd相关基因与预后中枢基因交叉,得到四个候选基因:肌动蛋白α 1、骨骼肌(ACTA1)、角蛋白6A (KRT6A), orosomucoid 2 (ORM2),以及溶质载体家族26成员4 (SLC26A4).我们检查了它们与22种免疫细胞的联系。7H),发现只有SLC26A4与四种预后免疫细胞类型(CD4 naïve T细胞、耗尽T细胞、Th1和Th2)显著相关,但不强相关。说明相关性的散点图如图所示。8一个。
SLC26A4是影响免疫浸润和临床预后的关键基因
SLC26A4与保护性免疫细胞(CD4 naïve T细胞、衰竭T细胞和Th2)呈正相关,与危险细胞类型(Th1)呈负相关(图1)。8重要的是,在TCGA-PRAD (p = 0.0003)、MSKCC (p < 0.0001)和GSE116918 (p = 0.0014)队列中,SLC26A4始终是PFI的保护因素(图2)。8B).一项meta分析显示,与低slc26a4组相比,高slc26a4组发生PFI事件的风险更高(风险比= 0.39,95% CI 0.29-0.53)。合并估计显示没有异质性我2= 0%, tau-square = 0(图;8C)。
针对SLC26A4的泛癌分析发现,它在大多数癌症类型中存在差异表达(图2)。8D).胆管癌(CHOL)和肝细胞癌(LIHC)与相应正常组织相比升高。而SLC26A4在膀胱尿路上皮癌(BLCA)、乳腺浸润性癌(BRCA)、宫颈鳞状细胞癌及宫颈内腺癌(CESC)、大肠腺癌(COAD)、多形性胶质母细胞瘤(GBM)、头颈部鳞状细胞癌(HNSC)、肾肾透明细胞癌(KIRC)、肾肾乳头状细胞癌(KIRP)、肺腺癌(LUAD)、肺鳞状细胞癌(LUSC)、直肠腺癌(READ)、甲状腺癌(THCA)、子宫肌体子宫内膜癌(UCEC)。此外,SLC26A4是葡萄膜黑色素瘤(UVM)和LGG的风险因子。它对UCEC、THCA、SKCM、PRAD和KIRC具有保护作用(图2)。8E)。
为了更好地理解该基因在癌症中的功能,我们接下来在CancerSEA数据库中获得单细胞水平的表达数据和功能状态评分(附加文件)15:表S12)。在所有可用的队列中,SLC26A4具有负相关的“DNA损伤”和“入侵”功能(图2)。8F).不幸的是,那里的前列腺癌单细胞队列没有提供SLC26A4的表达数据,阻碍了我们对前列腺癌相关性的理解。最后,前列腺癌组织中SLC26A4的DNA甲基化(通过Illumina HumanMethylation450 BeadChip)比正常对照组增加3.:图S3)。在TCGA-PRAD队列中,甲基化与其mRNA表达呈负相关(R = -0.60, p = 2.85e−50;无花果。8G),表明表观遗传沉默。甲基化探针ID为cg15320854,甲基化位点为cpg 107660494。
在独立的外部验证中,SLC26A4在HRD的前列腺癌样本中下调
湘雅医院纳入的62例患者中,9例(14.5%)诊断为良性前列腺增生(BPH)。其余53例前列腺癌患者中,33例携带HRD突变16:表S13)。
与BPH组织相比,前列腺癌样本中SLC26A4 mRNA表达水平和IHC评分降低(图2)。9A). SLC26A4 mRNA在预测前列腺癌方面优于基线总前列腺特异性抗原(PSA)值(AUC = 0.845;无花果。9B)。此外,与不存在HRD的前列腺癌组织相比,存在HRD的前列腺癌组织中的SLC26A4在mRNA和蛋白水平上均显著下调(图。9C), SLC26A4在预测前列腺癌背景下的HRD方面表现出色(AUC = 0.911;无花果。9D).三种组织类型的代表性IHC结果如图所示。9eg。
讨论
多年来,人们一直在探索前列腺癌的发生、发展和治疗。Gleason评分和血清PSA水平仍是前列腺癌最重要的预后因素。近年来,越来越多的证据表明,HRD在各种肿瘤的生物学过程和治疗反应中起着关键作用,是影响肿瘤预后的最重要因素之一[27].此外,许多研究发现,具有hrd相关基因突变的mCRPC患者对PARP抑制剂表现出令人印象深刻的反应,即使在非常晚期的疾病环境中[28,29,30.,31,32].前列腺癌中常见的hrd相关基因突变有BRCA2,自动取款机,CHEK2,所有这些都被包括在几乎所有涉及mCRPC患者的PARP抑制剂试验的分子资格标准中[33].然而,它们的种系突变分别在5-6%、1-2%和1-2%的mCRPC患者中发现[8,9].的refore, new biomarkers need to be developed for molecular typing of PCa patients. In this study, we deeply analyzed the molecular characteristics of PCa patients with different HRD scores and identified a biomarker that could be complementary to the HRD scores.
HRD评分整合了三个指标,重点是基于dna的基因组不稳定性,这在前列腺癌中研究较少。先前的研究发现,原发性前列腺癌患者的HRD评分较低,而种系前列腺癌患者的HRD评分较低BRCA2突变具有更高的HRD评分[34].自BRCA2突变是最近被食品和药物管理局(FDA)批准用于治疗PCa的两种PARP抑制剂的适应症,HRD评分分析可能有助于改善治疗方案。在本研究中,通过分析TCGA-PRAD队列的HRD评分,我们获得了23个与HRD评分相关的基因,定义为HRD相关基因。基于这些基因,我们鉴定出三种具有明显临床病理特征的分子模式,其中HRD聚类1与较差的临床病理类型和不良预后尤其相关。
HRD集群显示出不同的免疫景观。总的来说,T细胞、CD8 T细胞、细胞毒性淋巴细胞和自然杀伤细胞在HRD聚类1中较低富集,这表明抑制的免疫反应可能是聚类1患者预后较差的原因。HRD聚类也表现出不同的免疫基因组特征。具体而言,HRD簇1具有最高的突变负担、最高的增殖潜力和最低的基因组稳定性,表明具有产生突变和随后致癌的绝对潜力。此外,HRD簇1的白细胞丰度最低,但M2巨噬细胞浸润最高。实体瘤巨噬细胞浸润与不良预后相关[35].既往研究发现,浸润PCa的巨噬细胞以M2型为主,与侵袭性和不良预后相关。我们还注意到,在聚类1中Th1与Th2的比值最低。Th1介导的细胞免疫主要发挥抗肿瘤作用。一旦它从Th1转移到Th2,导致免疫抑制。这样会严重干扰机体的抗肿瘤免疫功能。Yamamura等和Kharkevitch等首次发现Th2细胞在肿瘤患者中占优势[36,37],然后发现Th2移位发生在非小细胞肺癌、绒毛膜癌、胶质瘤、胃癌、卵巢癌、黑色素瘤、结直肠癌、淋巴瘤等多种肿瘤中。上述结果定义了前列腺癌的免疫抑制微环境表型和HRD集群1的不稳定基因组条件。
鉴于IM在癌症免疫治疗中的重要性,我们比较了这三个聚类之间IM基因表达的差异。聚类间差异最明显的基因。总体而言,大多数im在HRD聚类1中的表达水平低于聚类2和聚类3,这表明由膜检查点调控的免疫反应在HRD聚类1中较不常见。一致地,在HRD集群1中,im的拷贝数变异在扩增和缺失方面更为频繁,证实了不稳定的基因组表型。虽然SNV的这种趋势不明显,但几个不典型的检查点仍然有较高的变异频率,如GZMA,PRF1,ENTPD1,__arg1.矛盾的是,TNFSF4在HRD集群1中显著上调。最近的研究表明,刺激TNFSF4的配体OX40有助于癌症的治疗性免疫策略[38].已发现TNFSF4在骨转移性前列腺癌中富集[39].结合我们的研究结果,它可能成为前列腺癌的一个新的治疗靶点,特别是对那些高表达的患者。
此外,我们建立了一个具有良好预测预后能力的特征(称为HRDscore)。基于蛋白质组学数据,HRDscore与现有的与基因组不稳定性相关的特征紧密相关,包括同源重组、DNA损伤修复和范可尼贫血(相关系数≥0.5,p < 0.001)。这一结果表明hrd衍生的风险系统可以代表基因组缺陷的特征。此外,HRDscore与不利细胞类型巨噬细胞呈正相关,与上述假设一致。最近的一篇文章探讨了PCa中的HRD评分,重点是HRD评分与突变之间的相关性BRCA2而且自动取款机[34].然而,这些突变在PCa中并不常见,特别是在非mcrpc中,因此HRD评分对许多没有这些突变的PCa患者价值不大。相比之下,我们的HRDscore在预测前列腺癌预后甚至指导治疗方面具有很好的价值。
为了进一步探索有价值的生物标志物,我们最终将重点放在与免疫浸润和临床诊断相关的单个基因SLC26A4上。在几个独立的PRAD队列中显示了保护作用(RR 0.39, 95% CI 0.29-0.93,我2= 0)。功能单细胞分析表明,SLC26A4与“DNA损伤”和“入侵”功能呈负相关。然而,缺乏具有SLC26A4表达的前列腺癌单细胞队列数据阻碍了我们对其在前列腺癌中的功能的理解。以往的研究大多认为SLC26A4在维持正常听力中起重要作用,而从未探讨其在恶性肿瘤中的意义[40].我们的研究首次揭示了其在肿瘤发生和发展中的潜在价值,值得在今后的研究中深入探索。
SLC26A4编码一种叫做pendrin的膜蛋白,允许细胞质和细胞外空间之间的阴离子交换,维持听觉感觉细胞的正常功能。主要表达于内耳和甲状腺,其突变与激素原性甲状腺肿和Pendred综合征有关[41,42].SLC26A4的高甲基化常发生在甲状腺癌和急性肌样白血病等癌症中[43,44],与我们的结果一致。以上结果提示SLC26A4的表观遗传变化可能参与了肿瘤的发生。我们的研究独特地发现,SLC26A4与前列腺癌中的HRD高度相关。
在我们湘雅队列中,无论在mRNA水平还是蛋白水平上,PCa样本中的SLC26A4表达均低于良性前列腺增生组织,这与TCGA-PRAD队列的结果不一致。这可能是由于我们队列的样本量不足。因此,还需要进一步的确认。重要的是,我们发现SLC26A4在预测前列腺癌患者的HRD方面表现良好。hrd相关基因突变的患者通常对PARP抑制剂敏感,因此我们提出SLC26A4可能是一种新的生物标志物,用于筛选对PARP抑制剂敏感的患者。
因此,我们在此为PARP抑制剂治疗前列腺癌提供了一种潜在的生物标志物。然而,在我们的研究中有几个局限性需要解决。首先,在前面已经提到的前列腺癌单细胞队列中缺乏SLC26A4的表达数据。其次,我们的分析也受到样本量相对较小的限制。最后,由于队列中缺乏预后和治疗信息,我们未能彻底验证SLC26A4在提示预后和指导治疗方面的价值。因此,有必要在大队列的基础上进行进一步的验证。
结论
我们引入HRDscore量化个体PCa患者的HRD模式,能够稳定、普适地预测PCa的预后,对指导治疗有一定的价值。一种新的生物标志物SLC26A4在前列腺癌中发挥保护作用,可以筛选适合PARP抑制剂治疗的患者。
数据和材料的可用性
本研究中使用和/或分析的数据集可根据合理要求从通讯作者处获得。
参考文献
王晓燕,王晓燕,王晓燕。癌症统计,2018。中华癌症杂志,2018;30(1):7-30。
布登多夫L, Schopfer A, Wagner U, Sauter G, Moch H, Willi N,等。前列腺癌的转移模式:1589例患者的尸检研究。中国病理学杂志,2000;31(5):578-83。
莫赫勒JL, Antonarakis ES, Armstrong AJ, D 'Amico AV, Davis BJ, Dorff T,等。前列腺癌,2019年版,NCCN肿瘤学临床实践指南。中华自然科学杂志,2019;17(5):479-505。
Cornford P, van den Bergh RCN, Briers E, van den Broeck T, Cumberbatch MG, De Santis M,等。前列腺癌EAU-EANM-ESTRO-ESUR-SIOG指南。第二部分-2020更新:复发性和转移性前列腺癌的治疗。中国地质大学学报,2011;29(2):366 - 366。
宗毅,郭士坦。去势抵抗性前列腺癌的适应或选择机制。中国地质大学学报,2013;10(2):90-8。
Hoppe MM, Sundar R, Tan DSP, Jeyasekharan AD。癌症中同源重组缺陷的生物标志物。中华肿瘤学杂志,2018;30(7):344 - 344。
郑俊华,杜华,李志强,李志强,等。原发性和转移性前列腺肿瘤的前瞻性综合基因组分析。JCO Precis Oncol, 2019。https://doi.org/10.1200/PO.18.00283.
马特奥,马特奥,马德华,马德华,马德华,等。转移性前列腺癌患者的遗传dna修复基因突变。中华实用医学杂志,2016;37(5):344 - 344。
倪志强,李志强,杨志强,李志强,等。前列腺癌生殖系变异的患病率和对当前基因检测指南的影响。中国医学杂志2019;5(4):523-8。
梅士J,杰克逊MA,帕克M, Nebgen D,彼得森SK, Singletary C,等。与BRCA1和BRCA2突变相关的癌症,而不是乳腺癌和卵巢癌。癌症。2015;121(2):269 - 75。
De Felice F, Tombolini V, Marampon F, Musella A, Marchetti C.前列腺癌DNA修复机制缺陷:奥拉帕尼的影响。中国医药科学。2017;11:547-52。
卡斯特罗E, Goh C, leongamorlert D, Saunders E, Tymrakiewicz M, Dadaev T,等。BRCA突变对局部前列腺癌根治性治疗后转移性复发和病因特异性生存的影响中国生物医学工程学报,2015;29(2):344 - 344。
Castro E, Goh C, Olmos D, Saunders E, leongamorlert D, Tymrakiewicz M,等。生殖系BRCA突变与前列腺癌较高的淋巴结受累风险、远处转移和较差的生存结果相关。中华临床杂志,2013;31(14):1748-57。
Gallagher DJ, Gaudet MM, Pal P, Kirchhoff T, Balistreri L, Vora K,等。生殖系BRCA突变表明前列腺癌的临床病理亚群。临床癌症杂志2010;16(7):2115-21。
原发性前列腺癌的分子分类学研究。细胞。2015;163(4):1011 - 25所示。
肖燕,李志强,李志强,等。人类前列腺癌的综合基因组分析。中华肿瘤杂志,2010;18(1):11-22。
Jain S, Lyons CA, Walker SM, McQuaid S, Hynes SO, Mitchell DM,等。一项使用活组织检查的转移试验在接受根治性放射治疗的前列腺癌患者中改善风险分层的验证。中国科学院学报,2018;29(1):215-22。
高德曼MJ, Craft B, Hastie M, Repecka K, McDade F, Kamath A,等。通过Xena平台可视化和解释癌症基因组数据。中国生物工程学报。2020;38(6):675-8。
霍德利,邱C, Hinoue T, Wolf DM, Lazar AJ, Drill E,等。来自33种癌症的10,000个肿瘤的分子分类中,细胞起源模式占主导地位。细胞。2018;173(2):291 - 304。
Wilkerson MD, Hayes DN。ConsensusClusterPlus:一个具有置信度评估和项目跟踪的类发现工具。生物信息学,2010,26(12):1572 - 3。
Akbani R, Ng PK, Werner HM, Shahmoradgoli M, Zhang F, Ju Z,等。癌症基因组图谱的泛癌症蛋白质组学视角。Nat Commun. 2014;5:3887。
吉原K, Shahmoradgoli M, Martinez E, Vegesna R, Kim H, Torres-Garcia W,等。从表达数据推断肿瘤纯度、基质和免疫细胞混合物。Nat Commun. 2013;4:2612。
贝希特E,吉拉尔多NA,拉克鲁瓦L, Buttard B, Elarouci N, Petitprez F,等。利用基因表达估计组织浸润免疫细胞和基质细胞群体的丰度。中国生物工程学报。2016;17(1):218。
苗烨,张强,雷强,罗敏,谢光元,王辉,等。ImmuCellAI:一种独特的综合t细胞亚群丰度预测方法及其在癌症免疫治疗中的应用。Adv Sci (Weinh)。2020; 7(7): 1902880。
陈B, Khodadoust MS, Liu CL, Newman AM, Alizadeh AA。用CIBERSORT分析肿瘤浸润免疫细胞。方法Mol生物学,2018;1711:243-59。
王志强,王志强,王志强,等。癌症的免疫图景。免疫力。2018;48 (4):812 - 30. - e14灯头。
阮玲,马志刚,范浩克,李志刚,等。同源重组缺陷的泛癌研究进展。网络通信。2020;11(1):5584。
Mutetwa T, Foulkes WD, Polak P. Olaparib用于转移性去势抵抗性前列腺癌。中华实用医学杂志,2015;29(3):344 - 344。
Abida W, Campbell D, Patnaik A, Shapiro JD, Sautois B, Vogelzang NJ,等。转移性去势抵抗性前列腺癌中非brca DNA损伤修复基因改变和对parp抑制剂rucaparib的反应:来自TRITON2 II期研究的分析临床癌症杂志2020;26(11):2487-96。
张晓东,刘志强,张志强,张志强,等。尼拉帕尼在转移性去势抵抗性前列腺癌(mCRPC)和双等位基因dna修复基因缺陷(DRD)患者中的II期研究:GALAHAD的初步结果中华临床医学杂志,2019;37(7):342。
Bono JSD, Mehra N, Higano CS, Saad F, Buttigliero C, Mata M,等。TALAPRO-1: talazoparib (TALA)在DNA损伤修复突变(DDRmut)和转移性前列腺癌(mCRPC)患者中的II期研究-首次中期分析(IA)。中华临床医学杂志,2020;38(6):419。
张晓东,张晓东,张晓东,等。Rucaparib用于转移性去势抵抗性前列腺癌男性患者,携带BRCA1或BRCA2基因改变。中华临床杂志,2020;38(32):3763-72。
Marshall CH, Antonarakis ES。前列腺癌DNA损伤反应的治疗靶向。中华医学杂志,2020;32(3):216-22。
Lotan TL, Kaur HB, Salles DC, Murali S, Schaeffer EM, Lanchbury JS,等。生殖系BRCA2-与atm改变前列腺癌的同源重组缺陷(HRD)评分。中国生物医学工程学报。2021;34(6):1185-93。
卡塞塔L,波拉德JW。靶向巨噬细胞:癌症的治疗方法。中国医药科学,2018;17(12):887-904。
山村M,莫德林,大门JD,莫伊。肿瘤中抗炎因子的局部表达。中华临床医学杂志,1993;29(3):344 - 344。
Kharkevitch DD, Seito D, Balch GC, Maeda T, Balch CM, Itoh K.转移性黑色素瘤患者肿瘤浸润淋巴细胞中自体肿瘤特异性T辅助2细胞的特征。中华癌症杂志1994;58(3):317-23。
陆霞。OX40与OX40L在癌症中的相互作用。中国中医药大学学报(自然科学版),2018;29(3):344 - 344。
Ihle CL, Provera MD, Straign DM, Smith EE, Edgerton SM, Van Bokhoven A,等。前列腺癌患者溶骨和母细胞骨转移的不同肿瘤微环境。中华免疫杂志,2019;7(1):293。
本田K,格里菲斯AJ。slc26a4相关听力损失的遗传结构和表型格局。《中华人民大学学报》;2021;34(3):455-64。
dosena S, Rodighiero S, Vezzoli V, Nofziger C, Salvioni E, Boccazzi M,等。野生型和突变penddrin (SLC26A4)的功能特征,涉及Pendred综合征的阴离子转运蛋白。分子内分泌杂志,2009;43(3):93-103。
张志强,张晓明,张志强,张志强,等。SLC26A7纯合子功能缺失突变导致甲状腺肿性先天性甲状腺功能减退症。JCI Insight, 2018;3(20):e99631。
邢敏,Tokumaru Y,吴g, Westra WB, Ladenson PW, Sidransky D. Pendred综合征基因SLC26A4高甲基化是甲状腺肿瘤发生的早期事件。癌症研究,2003;63(9):2312-5。
郭志强,刘志强,杨晓明,等。急性髓系白血病中异常CpG岛甲基化在复发时加重。血。2008;112(4):1366 - 73。
确认
不适用。
资金
本研究由湖南省重点研发计划项目(2021SK2014)、国家自然科学基金项目(81902606)、湖南省国家自然科学基金项目(2020JJ5882、2020JJ5891)资助。
作者信息
作者及隶属关系
贡献
数据采集:CL, YZ, WY。数据分析和解释:CL, ZL, YG,概念和设计:CL, YZ, WY, YC。数据管理:XG和XZ。方法开发:WY和YC。撰写稿件:CL和WY。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
人体实验相关程序已按照《赫尔辛基宣言》进行,并经中南大学湘雅医院伦理委员会批准。我们已经获得了所有参与者的知情同意。
发表同意书
不适用。
相互竞争的利益
没有披露潜在的利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:图S1。
MSKCC-PRAD队列中hdd相关基因的共识聚类。(左)k = 3时的共识矩阵。(右)三组关于PFI的生存率差异。
附加文件2:图S2。
不同HRD集群中的免疫检查点景观。(A)免疫调节剂在不同HRD集群中的调控。从左至右:mRNA表达量(中位归一化表达量);扩增频率(在特定亚型中免疫调节剂被扩增的样本比例与所有样本中的扩增比例之间的差异);HRD聚类检测75个免疫调节基因的缺失频率(如扩增)。(B)不同HRD集群中具有代表性的mRNA表达水平(CX3CL1和TNFSF4)。(C)不同HRD集群中具有代表性的CNV频率(BTLA和TIGIT)。统计学意义用星号(*)表示,*p < 0.05, **p < 0.01, ***p < 0.001, ns,不显著。
附加文件3:图S3。
在TCGA-PRAD队列中前列腺癌组织和配对正常组织中SLC26A4的DNA甲基化水平。
附加文件4:表S1.1.;
PANCAN队列中前列腺癌患者的HRD评分。表S1.2。差异表达基因。
附加文件5:表S2。
差异表达基因的单因素Cox分析结果。
附加文件6:表S3。
PCa中hrd相关基因的详细CNV百分比。
附加文件7:表S4。
hrd相关基因之间的相关性。
附加文件8:表S5。
HRD集群和患者生存信息。
附加文件9:表S6.1。
估计分数。表S6.2基于ImmuCellAI算法的免疫细胞分数。表S6.3基于ImmuCellAI算法的免疫细胞分数。表S6.4基于CIBERSORT算法的免疫细胞分数。
附加文件10:表S7。
前列腺癌中im的mRNA表达。
附加文件11:表S8.1. 1。
HRD集群1和集群2间差异表达基因。表S8.2。HRD集群1和集群3间差异表达基因。表S8.3 HRD聚类2和聚类3差异表达基因
附加文件12:表S9。
对免疫检查点封锁的估计反应。
附加文件13:表S10。
基于蛋白质组学数据的HRDscore和现有著名的生物学通路。
附加文件14:表S11。
基于Cox分析的免疫细胞类型与患者生存的相关性
附加文件15:表S12。
SLC26A4表达与多种癌症类型单细胞水平肿瘤功能状态的相关性
附加文件16:表S13。
湘雅队列样本的临床特征、病理诊断、HRD基因突变及SLC26A4表达。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
罗成,刘智,甘,杨。et al。SLC26A4与前列腺癌同源重组缺陷及患者预后相关翻译医学杂志20., 313(2022)。https://doi.org/10.1186/s12967-022-03513-5
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-022-03513-5
关键字
- 同源重组缺陷
- 前列腺癌
- SLC26A4
- 预后
- PARP抑制剂