- 研究gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
来自骨髓来源抑制细胞的外泌体通过S100A9/circMID1/miR-506-3p/MID1促进去势抵抗性前列腺癌进展gydF4y2Ba
转化医学杂志gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba,文章号:gydF4y2Ba346gydF4y2Ba(gydF4y2Ba2022gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
去势抵抗性前列腺癌(CRPC)是前列腺癌患者复发和死亡的主要原因。髓源性抑制细胞(MDSCs)调节前列腺癌的去势抵抗。此前已有研究表明外泌体(exosomes, Exos)能够有效地介导细胞间通信,但mdsc衍生的Exos在CRPC进展中的作用和机制尚不清楚。gydF4y2Ba
方法gydF4y2Ba
在这项研究中,使用circRNA芯片研究了MDSC-Exo处理过的PC3细胞和对照细胞中的circRNA表达谱。gydF4y2Ba
结果gydF4y2Ba
数据显示,经MDSC-Exo处理的PC3细胞中circMID1 (hsa_circ_0007718)表达升高。此外,circMID1在PCa中与良性前列腺增生(BPH)组织和CRPC患者中与激素敏感性前列腺癌(HSPC)患者相比高表达。进一步的研究表明,MDSC-Exo加速了PCa细胞的增殖、迁移和侵袭,而circMID1缺陷抑制了MDSC-Exo调控的CRPC在体外和体内的进展gydF4y2Ba.gydF4y2Ba机制上,mdsc衍生的外泌体S100A9增加了circMID1表达到海绵miR-506-3p,导致MID1表达增加并加速肿瘤进展。gydF4y2Ba
结论gydF4y2Ba
总之,我们的研究结果表明,在MDSC-Exo调控的CRPC进展中存在S100A9/circMID1/miR-506-3p/MID1轴,这为MDSC-Exo在CRPC进展中的调控机制提供了新的见解。gydF4y2Ba
背景gydF4y2Ba
前列腺癌是一种恶性肿瘤,在西方国家多发生于男性[gydF4y2Ba1gydF4y2Ba].虽然前列腺癌最初对雄激素剥夺治疗(ADT)有反应,但ADT后发生去势抵抗性前列腺癌(CRPC)是一个主要的临床问题,因为这种复发性疾病对替代疗法反应不佳[gydF4y2Ba2gydF4y2Ba].CRPC患者的预后仍然很差,CRPC被认为是不可治愈的[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba].因此,确定雄激素独立信号通路的新的分子机制可以确定更有效的治疗CRPC的方法。gydF4y2Ba
癌细胞可能通过激活免疫抑制机制或抑制免疫反应来削弱免疫防御,从而形成肿瘤微环境,导致癌细胞生长、存活和转移扩散。髓源性抑制细胞(MDSCs)是浸润CRPC微环境的重要免疫细胞亚群[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba].在前列腺癌患者的肿瘤组织和外周血中检测到MDSCs水平升高,其水平与疾病进展相关[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].MDSCs是一种未成熟的髓系细胞,在肿瘤微环境(TME)中具有有效的免疫抑制机制。它们通过将巨噬细胞极化为促进肿瘤的表型来介导免疫抑制[gydF4y2Ba10gydF4y2Ba]和阻止肿瘤反应性T淋巴细胞激活,从而促进肿瘤血管生成[gydF4y2Ba11gydF4y2Ba].在这些机制中,有些需要靶细胞与MDSCs相互作用,或者需要可溶性介质的释放。MDSCs产生的IL23可激活PCa细胞中的雄激素受体(AR)通路,促进雄激素缺失条件下的细胞增殖和生存。抗体介导的IL-23失活恢复小鼠对ADT的敏感性,提示mdsc介导的去势抵抗机制[gydF4y2Ba6gydF4y2Ba].然而,mdscs介导的去势抵抗机制在很大程度上仍然未知。gydF4y2Ba
公认的是,细胞间通讯与可溶性介质或细胞间接触无关,而可以由外泌体(Exos)有效地介导[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba].来源于免疫细胞的外显子是TME的主要组成部分,导致肿瘤细胞与免疫细胞之间异质而复杂的相互作用。事实上,mdscs脱落的Exos含有促炎介质,如S100A9和S100A8 [gydF4y2Ba14gydF4y2Ba],促进肿瘤进展并抑制抗肿瘤反应。最近的报道显示MDSCs衍生的Exos具有调节化疗耐药和肿瘤进展的生物学能力[gydF4y2Ba15gydF4y2Ba].尽管越来越多的研究表明mdscs释放的外泌体在免疫抑制中起作用,但尚不清楚mdscs来源的外泌体是否在去势抵抗和前列腺肿瘤进展调节方面具有特定的生物学活性。因此,识别mdsc - exo调控CRPC进展的新的分子机制可能为改善CRPC治疗提供有希望的方法。此外,外泌体正在成为一种新型的癌症生物标志物。大量研究表明,肿瘤源性外泌体的明确标记物可能是临床评估疾病进展的一种非常敏感的诊断方法[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba].拉希德的研究表明,放射性同位素在体内的分布差异gydF4y2Ba131gydF4y2Ba来自不同细胞来源的i标记外泌体,例如,经过或未经治疗的肿瘤细胞、MDSCs和内皮祖细胞[gydF4y2Ba19gydF4y2Ba].外泌体蛋白质或核酸谱的改变与包括癌症在内的许多疾病的病理过程相关,因此,跟踪这一变化可用于监测疾病进展、转移和基于外泌体的靶向治疗。gydF4y2Ba
环状rna (circRNAs)最近被证明是内源性非编码rna,在许多癌症进展中起着重要作用,包括Pca [gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba].环状rna调控基因表达的主要方式之一是作为miRNA“海绵”,通过隔离来修饰miRNA活性,从而改变mRNA靶基因的表达[gydF4y2Ba22gydF4y2Ba].环状rna来自gydF4y2Ba基于“增大化现实”技术gydF4y2Ba基因已在CRPC中鉴定[gydF4y2Ba23gydF4y2Ba],这表明了其作为生物标志物或治疗靶点的潜在作用。Wu等人报道circRNA17作为抑制因子,通过海绵miR-181c-5p调节Arv7表达,改变enzalutamide敏感性和CRPC细胞侵袭[gydF4y2Ba24gydF4y2Ba].然而,环状rna在前列腺癌进展中的功能和作用尚不清楚。gydF4y2Ba
在当前的研究中,使用circRNA微阵列分析,我们发现circMID1 (hsa_circ_0007718)表达在MDSCs的Exos处理的PC3细胞中显著升高。此外,circMID1在前列腺癌中与良性前列腺增生组织相比高表达,在CRPC患者中与激素敏感性前列腺癌(HSPC)患者相比高表达gydF4y2Ba.gydF4y2Ba体外和体内研究表明,circMID1缺失可抑制mdsc - exo调控的CRPC进程。从机制上看,我们发现mdsc来源的外泌体S100A9增加了circMID1在海绵miR-506-3p上的表达,这可能导致MID1表达增加并加速肿瘤进展。这些结果为研究MDSC-Exo在CRPC进程中的调控机制提供了新的见解。gydF4y2Ba
方法gydF4y2Ba
细胞培养gydF4y2Ba
雄激素不依赖的人PCa细胞系(PC3)和DU145从美国类型培养收藏(ATCC, Manassas, VA, USA)中获得,并根据ATCC指南进行维护。PC3细胞在含100iu /mL青霉素、10%胎牛血清(FBS)和100 μg/mL链霉素的rmi -1640培养基中培养,并在含5% CO的湿润培养箱中保存gydF4y2Ba2gydF4y2Ba95%空气在37°C。gydF4y2Ba
MDSCs衍生外源性细胞的分离和鉴定gydF4y2Ba
如前所述,我们在体外从人外周血单个核细胞(pmcs)中生成人MDSCs [gydF4y2Ba6gydF4y2Ba,gydF4y2Ba25gydF4y2Ba].简单地说,我们通过静脉穿刺从健康供体中分离出pmcs,然后进行差异密度梯度分离(Ficoll HyPaque;西格玛奥尔德里奇,圣路易斯,密苏里州,美国)。pmcs (1 × 10gydF4y2Ba6gydF4y2Ba细胞/mL)在T25烧瓶中培养,RPMI 1640培养基中含有10%热灭活FBS,颗粒-巨噬细胞集落刺激因子(PeproTech, Rocky Hill, NJ, USA) 10 ng/mL, IL-6 10 ng/mL,培养1周。体外培养的多形核MDSCs (PMN-MDSCs)通过流式细胞仪检测CD15、CD11b和CD14的表达。PMN-MDSCs为CD15gydF4y2Ba+gydF4y2BaCD14gydF4y2Ba−/低gydF4y2BaCD11bgydF4y2Ba+gydF4y2Ba(排序策略在附加文件中的绿色方框中表示gydF4y2Ba1gydF4y2Ba:图S1A)。我们收集并使用这些细胞进行进一步的实验。gydF4y2Ba
我们培养分离的MDSCs (2 × 10gydF4y2Ba6gydF4y2Ba细胞/mL)在含有10%外泌体耗尽FBS的rmi -1640培养基中培养2天。通过10万倍超离心至少半天,从污染牛外泌体中消耗FBSgydF4y2BaggydF4y2Ba.我们使用0.22 μm过滤器(BD Falcon;Corning, Corning, NY, USA),并通过ExoQuick外泌体沉淀溶液(System Biosciences, Palo Alto, CA, USA)按照标准程序提取Exos。外显子在200 μL的培养基中重悬。透射电镜(Tecnai-12;飞利浦,阿姆斯特丹,荷兰)。采用BCA蛋白检测试剂盒定量外泌体。免疫印迹法检测蛋白标志物CD9、CD63、Hap70、calnexin。使用纳米颗粒跟踪分析仪(NTA, Malvern Panalytical, Malvern, UK)直接测量外泌体的大小和浓度。mdsc -外泌体的鉴定见附加文件gydF4y2Ba1gydF4y2Ba:图S1。gydF4y2Ba
环状rna微阵列分析gydF4y2Ba
我们使用Arraystar人类环状rna阵列2.0版(Arraystar, Rockville, MD, USA)进行了环状rna微阵列分析。我们按照标准程序进行RNA提取和微阵列杂交。我们使用TRIzol试剂(Life Technologies, Carlsbad, CA, USA)按照标准程序从经磷酸缓冲盐水(PBS)或mdsc衍生的Exos (50 μg/mL)处理的PC3细胞中提取总RNA。我们使用RNAse R (Epicentre, Madison, WI, USA)消化总RNA以去除线性RNA并富集环状RNA。然后,利用Arraystar超级RNA标记试剂盒(Arraystar)对富集的环状RNA进行随机启动扩增,转录成荧光crna,并使用Arraystar人类环状RNA阵列(Arraystar Human circRNA Array, version 2 (8 × 15 K)进行杂交。最后,用G2505C扫描仪(Agilent, Santa Clara, CA, USA)对载片进行清洗和扫描,并对获得的阵列图像进行分析。采用R软件limma包进行分位数归一化和后续数据处理。通过Volcano Plot筛选,发现MDSC-Exo-PC3与control-PBS-PC3之间表达差异有统计学意义(fold-change (FC)≥2,p≤0.05)的CircRNAs。通过层次聚类来显示样本间环状rna的可区分表达模式。gydF4y2Ba
临床前列腺标本gydF4y2Ba
收集杭州中医院经尿道前列腺切除术行前列腺根治性前列腺癌(n = 56)和良性前列腺增生(n = 31)的患者(年龄49 ~ 78岁,中位年龄64岁)。所有组织标本经两名经验丰富的病理学家病理证实为PCa。杭州市中医医院伦理委员会批准了这项研究,我们在研究前获得了每位参与者的书面同意。gydF4y2Ba
实时定量PCRgydF4y2Ba
按照标准说明,我们使用TRIzol试剂(Invitrogen, Karlsruhe, Germany)和mirVana miRNA分离试剂盒(Ambion, Austin, TX, USA)从培养的细胞和组织中提取RNA和miRNA。然后,我们使用高容量cDNA逆转录试剂盒(Thermo Fisher Scientific, Waltham, MA, USA)合成了cDNA。我们使用ABI PRISM 7500序列检测系统(Life Technologies, Grand Island, NY, USA)进行qPCR分析。我们使用U6 snRNA作为内源性mirna对照,并将环状rna水平归一化至甘油醛3-磷酸脱氢酶(GAPDH)。我们计算相对基因表达水平使用2gydF4y2Ba−ΔΔCtgydF4y2Ba方法。RT-PCR所用引物见表gydF4y2Ba1gydF4y2Ba.gydF4y2Ba
细胞转染gydF4y2Ba
靶向人circMID1 (si-circMID1)、MID1 (si-MID1)和非特异性阴性对照寡核苷酸(si-control)、mir -506-3p模拟物和相应的阴性对照模拟物(miR-NC)、anti-miR-506-3p和anti-miR-ctl质粒介导的过表达circMID1 (overcircmid1)或MID1 (overmid1)载体以及靶向S100A9 (si-S100A9)的siRNA (siRNA)从Gene Pharma(上海,中国)获得。以circMID1为靶点的慢病毒(sh-circMID1)购自GeneChem(中国上海)。我们按照标准说明使用Lipofectamine 3000 (Invitrogen)进行转染。用转染后2天提取的RNA进行RT-qPCR检测过表达或敲低效应。gydF4y2Ba
对于处理,我们用si-control、si-circMID1或si-MID1、anti-miR-ctl或anti-miR- 506-3p、miR-NC或miR-506-3p、over-circMID1或over-MID1预孵育PC3细胞30分钟,然后用或不用mdsc衍生的Exos (50 μg/mL)处理它们。gydF4y2Ba
细胞增殖试验gydF4y2Ba
我们使用细胞计数试剂盒-8 (CCK-8)检测(Dojindo, Shanghai, China)评估细胞增殖。简而言之,我们将细胞(3 × 10gydF4y2Ba4gydF4y2Ba)分别装入96孔板中,37℃孵育1天后转染。转染后2 d每孔加入CCK-8溶液(10 μL)。在指定的时间点,我们使用Spectra Max 250分光光度计(Molecular Devices, San Jose, CA, USA)在450nm波长下测量5天的吸光度。实验一式三次。gydF4y2Ba
迁移和入侵分析gydF4y2Ba
我们在8.0µm Boyden腔内24孔进行了PC3和DU145细胞侵袭和迁移的Transwell测定。在入侵实验中,用Matrigel和细胞(3 × 10gydF4y2Ba4gydF4y2Ba)在无血清培养基中播种到腔室的上层。我们在下腔中加入充分的培养基作为趋化剂。37°C, 5% CO孵育1天后gydF4y2Ba2gydF4y2Ba时,用甲醇固定膜,用0.1%结晶紫染色。我们随机选取5个视野(200×),用光学显微镜计数入侵细胞的数量。我们还进行了迁移试验,没有预涂腔室。gydF4y2Ba
细胞摄取外泌体gydF4y2Ba
从MDSCs中提取的外泌体(20 mg)用CFSE染料标记,以1:1000的比例稀释。37°C孵育15 min后,收集外泌体,用PBS离心(100,000×gydF4y2BaggydF4y2Ba, 70分钟)。将cfse标记的外泌体或未标记的外泌体添加到PC3和DU145细胞中,在37℃下孵育48 h,使用共聚焦荧光显微镜观察细胞摄取情况。样品以同样的方式处理,并用作溶液中残留的任何游离CFSE染料的对照。免疫荧光显微镜检查如前所述[gydF4y2Ba26gydF4y2Ba].一抗为小鼠IgG抗α -微管蛋白DM1A (1:2000) (Sigma)。二抗为驴抗小鼠IgG AlexaFluor 594 (1:500) (Molecular Probes)。gydF4y2Ba
荧光素酶报告试验gydF4y2Ba
使用mir- glo载体(Promega, Madison, WI, USA)将含有野生型(WT)或突变型(MUT) cirMID1序列或含有WT或突变miR-506-3p结合位点的MID1 3'-UTR亚克隆到荧光素酶基因中。我们使用Lipofectamine 2000 (Invitrogen和Thermo Fisher Scientific)将100 ng荧光素酶报告载体与miRNAs模拟物/NC或miR-506-3p模拟物/NC (200 pmol)联合转染HEK293或PCa细胞。转染2天后,我们使用双荧光素酶报告系统(Promega)检测萤火虫和Renilla荧光素酶活性,并将特异性活性表达为萤火虫与Renilla荧光素酶的相对活性。实验一式三次。gydF4y2Ba
RNA免疫沉淀(RIP)分析gydF4y2Ba
我们使用Magna RIP rna结合蛋白免疫沉淀试剂盒(Millipore, Bedford, MA, USA)按照标准方案进行了RIP检测。PC3细胞(2 × 10gydF4y2Ba7gydF4y2Ba)在RIP裂解缓冲液中裂解,细胞裂解液孵育,将其分为两个等效部分,分别用同型匹配的抗igg抗体(Millipore)或5 μg人抗argonaute2 (AGO2)抗体(Millipore)在4℃旋转过夜。加入磁珠,在4℃下继续孵育1 h。在55℃下用蛋白酶K免疫沉淀1 h,然后用TRIzol试剂(Life Technologies)处理RNA配合物进一步纯化。我们利用纯化的RNA,利用qRT-PCR检测circMID1和miR-506-3p的表达水平。gydF4y2Ba
Western blot分析gydF4y2Ba
简而言之,对于western blot,我们收集了不同处理组的细胞,并在RIPA缓冲液(Beyotime Biotechnology,南通,中国)中裂解,包括1%蛋白酶抑制剂(Cell Signaling Technology)。使用BCA蛋白测定试剂盒(Beyotime Biotechnology)测定蛋白浓度,使用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE;10%),并转移到聚偏二氟乙烯(PVDF)膜(Millipore)。在室温下用5%脱脂牛奶在Tris-buffered salin - tween (TBST)缓冲液中阻塞1小时后,我们用抗S100A9, DHX9, QKI, MID1的一抗(1:1000;Abcam, Cambridge, MA, USA),在4°C下孵育1天,然后用酶标二抗(1:5000;Rockland, Limerick, PA, USA)在室温下放置1小时。Affinity, Cambridge, MA, USA), β-actin或Hsp70 (1:1000;Abcam)测定了GAPDH、β-actin或Hsp70作为蛋白质负荷对照。我们使用化学发光反应系统(ECL;Beyotime,上海,中国)。gydF4y2Ba
小鼠异种移植模型试验gydF4y2Ba
所有雄性BALB/c (nu/nu)小鼠购自浙江大学实验动物中心。动物饲养在标准条件下,随意提供水和食物。浙江大学附属第二医院动物护理与使用委员会批准了该动物研究。异种移植动物实验:4 ~ 6周龄BALB/c裸鼠皮下注射5 × 10gydF4y2Ba6gydF4y2Ba细胞进入右侧(每组5只小鼠)。我们每5天测量一次肿瘤大小,持续1个月,体积计算公式:体积=(长×宽gydF4y2Ba2gydF4y2Ba) × 0.5。1个月后,我们采用二氧化碳窒息法对小鼠实施安乐死,并切除肿瘤并称重。最后,肿瘤组织立即在液氮中快速冷冻,并在−80°C保存,直到分析。gydF4y2Ba
免疫组化染色gydF4y2Ba
肿瘤切除后用4%多聚甲醛固定,石蜡包埋,切成5 μm切片。切片用二甲苯脱蜡,用分级乙醇脱水,然后用3%双氧水阻断内源性过氧化物酶。抗原提取后,将切片与抗MMP-2的一抗(1:1000;Abcam,剑桥,英国)或Ki67 (1:1000;Abcam)在4°C过夜。然后,用山根过氧化物酶标记的二抗(1:1000,Abcam)孵育1小时。用二氨基联苯胺(DAB)检测试剂盒(Dako Cytomation, Glustrop, Denmark)孵育。用苏木精反染后,用光学显微镜(Olympus, Tokyo, Japan)观察样品。gydF4y2Ba
统计分析gydF4y2Ba
数据以平均值±标准差(SD)表示。学生的gydF4y2BatgydF4y2Ba-test用于比较两组。多组间数据比较采用单因素方差分析(ANOVA),然后采用Bonferroni事后检验。我们通过皮尔逊相关计算相关系数。p值< 0.05为差异有统计学意义。我们至少做了三次实验。gydF4y2Ba
结果gydF4y2Ba
用骨髓来源抑制细胞的外泌体处理的PC3细胞中环状rna的表达谱gydF4y2Ba
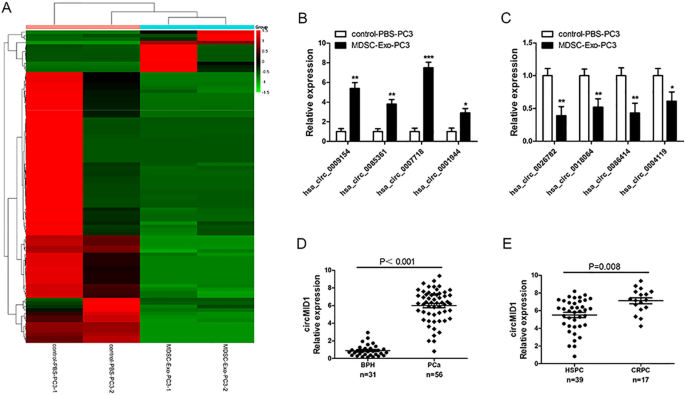
为了确定MDSC-Exo在前列腺癌进展中的作用和分子机制,将PC3细胞与MDSC-Exo或对照- pbs共培养,然后收集PC3细胞,使用circRNA微阵列分析其circRNA谱。我们共检测到4248个环状rna。其中90种环状rna存在差异表达(fold-changes > 2.0;MDSC-Exo-PC3细胞与对照- pbs - pc3细胞间的差异(P < 0.05, FDR < 0.05)。gydF4y2Ba1gydF4y2BaA).在90个环状rna中,与对照组相比,MDSC-Exo-PC3细胞中12个环状rna上调,78个下调。为了进一步评估微阵列数据,我们选择了4个上调最多和4个下调最多的circrna,通过qRT-PCR来确认它们在不同处理的PC3细胞中的表达(图。gydF4y2Ba1gydF4y2Ba在MDSC-Exo-PC3细胞中,hsa_circ_0007718是上调最多的环状rna。通过浏览hg19/GRCh37参考基因组,假设位于chrX: 10491131-10535643的hsa_circ_0007718来源于hg19/GRCh37gydF4y2BaMID1gydF4y2Ba基因(中线1),位于Xp22.2染色体上。按照这种方式,我们将hsa_circ_0007718称为“circMID1”。gydF4y2Ba
MDSC-Exo-PC3细胞中circRNA的表达谱。gydF4y2Ba一个gydF4y2BaMDSC-Exo-PC3细胞与对照- pbs - pc3细胞间差异表达的环状rna的层次聚类分析。红色代表高表达水平,而绿色代表低表达水平。gydF4y2BaBgydF4y2Ba,gydF4y2BaCgydF4y2Ba4种上调幅度最大的基因(gydF4y2BaBgydF4y2Ba)和4种下调最多的环状rna (gydF4y2BaCgydF4y2Ba通过qRT-PCR在MDSC-Exo-PC3细胞和control-PBS-PC3细胞中验证。gydF4y2Ba*gydF4y2Bap < 0.05;gydF4y2Ba**gydF4y2Bap < 0.01;gydF4y2Ba***gydF4y2BaP < 0.001 vs对照pbs - pc3。gydF4y2BaDgydF4y2BacircMID1在良性前列腺增生(BPH;(n = 31)和前列腺癌组织(n = 56)。gydF4y2BaEgydF4y2BacircMID1在HSPC (n = 39)和去势抵抗性前列腺癌(CRPC;n = 17)。所有实验至少进行三次。MDSC:髓源性抑制细胞gydF4y2Ba
为了证实circMID1在前列腺癌中存在差异表达,我们使用qRT-PCR检测了前列腺癌患者和良性前列腺增生(BPH)的前列腺切除术标本。我们发现circMID1在PCa中的表达明显高于BPH组织(p < 0.01,图2)。gydF4y2Ba1gydF4y2BaD)。circMID1在CRPC患者中的表达也高于HSPC患者(p = 0.008,图。gydF4y2Ba1gydF4y2BaE).综上所述,结果提示circMID1上调可能与前列腺癌的进展有关。gydF4y2Ba
CircMID1缺陷抑制髓源性抑制细胞(MDSC)外泌体(Exo)处理的PC3细胞增殖、侵袭和迁移gydF4y2Ba
由于circMID1在MDSC-Exo-PC3细胞中表达上调,我们利用RNA干扰来下调circMID1的表达,并验证其在mdsc - exo调控CRPC繁殖过程中的生物学机制。qRT-PCR分析显示circMID1在PC3细胞系中的表达被siRNAs成功抑制(图。gydF4y2Ba2gydF4y2BaA).体外研究显示MDSC-Exo促进PC3细胞迁移、增殖和侵袭(图。gydF4y2Ba2gydF4y2Ba罪犯)。然而,CCK-8检测发现circMID1下调显著抑制了MDSC-Exo诱导的PC3细胞增殖(图。gydF4y2Ba2gydF4y2BaB).接下来,我们使用Transwell检测评估circMID1在前列腺癌迁移和侵袭中的作用。circMID1的下调抑制了MDSC-Exo诱导的PC3细胞的侵袭和迁移(图。gydF4y2Ba2gydF4y2BaC, D)。gydF4y2Ba
CircMID1的敲除抑制了mdsc - exo处理的PC3细胞的增殖、侵袭和迁移。gydF4y2Ba一个gydF4y2BacircMID1特异性sirna转染PC3细胞中circMID1的相对表达(gydF4y2Ba**gydF4y2Bap < 0.01)。gydF4y2BaBgydF4y2Ba用CCK-8检测对照组PC3细胞和转染si-control或si-circMID1的MDSC-Exo-PC3细胞的增殖情况(gydF4y2Ba**gydF4y2Bap < 0.01)。gydF4y2BaCgydF4y2Ba,gydF4y2BaDgydF4y2BaTranswell测定法用于测定细胞迁移(gydF4y2BaCgydF4y2Ba)和入侵(gydF4y2BaDgydF4y2Ba对照组PC3细胞和转染si-control或si-circMID1的MDSC-Exo-PC3细胞。比例尺,100 μM。gydF4y2Ba*gydF4y2Ba,gydF4y2Ba#gydF4y2Bap < 0.05;gydF4y2Ba**gydF4y2Ba,gydF4y2Ba# #gydF4y2Bap < 0.01,gydF4y2Ba*gydF4y2Ba与控制,gydF4y2Ba#gydF4y2Ba与精彩。所有实验都至少重复了三次gydF4y2Ba
来自MDSC的外泌体S100A9促进了PC3细胞circMID1的表达gydF4y2Ba
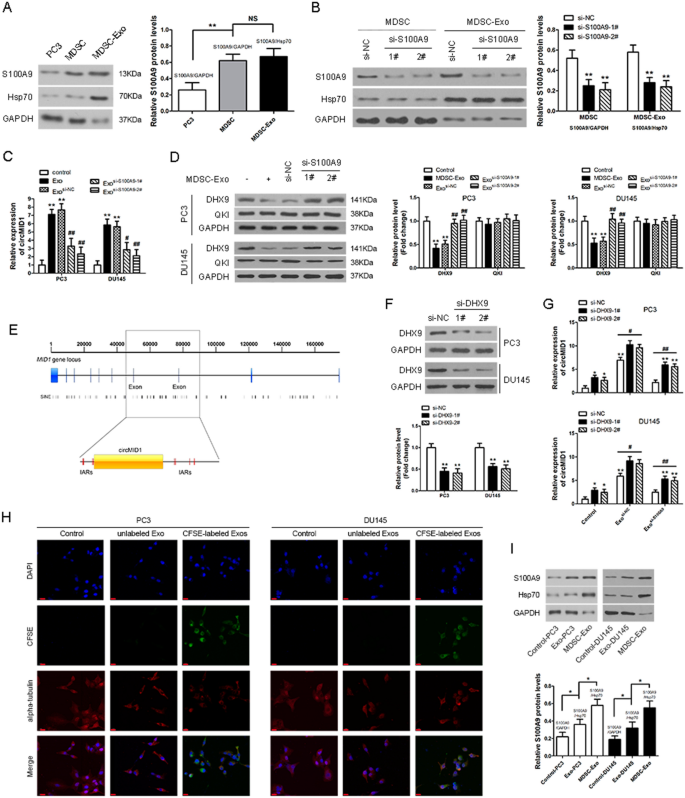
接下来,我们研究了PC3细胞circMID1增加的潜在机制。促炎蛋白S100A9先前被证明在MDSCs脱落的外泌体中含量丰富,并对MDSCs具有趋化功能[gydF4y2Ba27gydF4y2Ba].如图所示。gydF4y2Ba3.gydF4y2BaA,在MDSC-Exo中检测到丰富的S100A9蛋白。然后利用siRNA在MDSCs中敲除S100A9的表达。MDSC-ExogydF4y2Basi-S100A9gydF4y2BaS100A9在外泌体中表达较低,被分离纯化(图。gydF4y2Ba3.gydF4y2BaB).敲除S100A9显著降低mdsc - exo处理的PC3和DU145细胞中circMID1的表达水平(图。gydF4y2Ba3.gydF4y2BaC).由于RNA结合蛋白(RBPs)是circRNA所必需的[gydF4y2Ba28gydF4y2Ba],然后我们检测了调控许多环状rna生物发生的RBPs DHX9和QKI [gydF4y2Ba29gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba],它们负责circMID1的生物发生。在mdsc - exo处理的PC3和DU145细胞中,S100A9的敲除显著增加了DHX9蛋白的表达水平。gydF4y2Ba3.gydF4y2BaD). DHX9是一种众所周知的RNA解旋酶,它可以与倒立Alu重复序列(IARs)相互作用,降低一部分circRNAs的表达[gydF4y2Ba29gydF4y2Ba].在MID基因位点中发现了大量的iar,其中一些位于外显子7 - 8周围(图7 - 8)。gydF4y2Ba3.gydF4y2BaE).结果证实,沉默DHX9后circMID1丰度增加(图。gydF4y2Ba3.gydF4y2BaF, G),提示DHX9可能是一种潜在的调控因子。gydF4y2Ba
来自MDSC的外泌体S100A9促进了PC3细胞circMID1的表达。gydF4y2Ba一个gydF4y2Ba采用具有代表性的western blot方法检测MDSC-Exo中S100A9的表达,并定量分析S100A9的表达。GAPDH是细胞的控制蛋白,Hsp70是外泌体的控制蛋白。**P < 0.01, NS:无显著意义。gydF4y2BaBgydF4y2Ba用siRNA (si-NC)或S100A9 siRNA (si-S100A9)处理MDSCs和MDSC-Exo,对S100A9表达进行代表性western blot检测,并定量分析S100A9表达。** p < 0.01,gydF4y2Ba*gydF4y2Ba与si-NC。gydF4y2BaCgydF4y2BacircMID1在MDSC-Exo或MDSC-Exo处理的PC3和DU145细胞中的相对表达gydF4y2Basi-S100A9gydF4y2Ba.gydF4y2Ba**gydF4y2Ba,gydF4y2Ba# #gydF4y2Bap < 0.01,gydF4y2Ba*gydF4y2Ba与控制,gydF4y2Ba#gydF4y2Ba与精彩。gydF4y2BaDgydF4y2Bawestern blotting检测MDSC-Exo和MDSC-Exo处理的PC3和DU145细胞中rna结合蛋白DHX9和Quaking (QKI)的表达gydF4y2Basi-S100A9gydF4y2Ba.DHX9和QKI蛋白western blot结果分析。gydF4y2Ba**gydF4y2Ba,gydF4y2Ba# #gydF4y2Bap < 0.01,gydF4y2Ba*gydF4y2Ba与控制,gydF4y2Ba#gydF4y2Ba与精彩。gydF4y2BaEgydF4y2Baiar的分布gydF4y2BaMID1gydF4y2Ba基因位点。上图为MID1全长,下图为外显子7和外显子8之间区域±500 bp。gydF4y2BaFgydF4y2BaDHX9 sirna转染PC3和DU145细胞后,通过western blotting检测DHX9的表达水平,并定量分析S100A9的表达。** p < 0.01,gydF4y2Ba*gydF4y2Ba与si-NC。gydF4y2BaGgydF4y2Ba在DHX9沉默后,检测mdsc - exo处理的PC3和DU145细胞中circMID1的相对水平。gydF4y2Ba*gydF4y2Ba,gydF4y2Ba#gydF4y2Bap < 0.05;gydF4y2Ba**gydF4y2Ba,gydF4y2Ba# #gydF4y2Bap < 0.01,gydF4y2Ba*gydF4y2Bavs. control + si-NC。gydF4y2BaHgydF4y2BaPC3和DU145细胞在48小时内摄取mdsc来源的外泌体。游离CFSE处理的细胞用作对照(control)。绿色为cfse标记的外泌体;红色,α -微管蛋白,微管标记物(比例尺,20 μm)。gydF4y2Ba我gydF4y2Bawestern blotting检测MDSC-Exo孵育48 h后PC3和DU145细胞中S100A9的表达水平。S100A9基因western blot结果分析。gydF4y2Ba*gydF4y2Bap < 0.05gydF4y2Ba
此外,为了研究mdsc来源的外泌体S100A9被PCa细胞内化,MDSC-Exo被羧基荧光素二乙酸琥珀酰亚酯(CFSE)荧光染料标记。用共聚焦显微镜观察MDSC-Exo S100A9的摄取。我们发现CFSE标记的外泌体定位在细胞质中,在48小时,PCa细胞对CFSE外泌体的摄取是明显的,这表明PC3和DU145细胞吸收了CFSE外泌体的数量,但在用游离CFSE染料处理或培养未标记的外泌体的对照细胞中没有观察到。gydF4y2Ba3.gydF4y2BaH)。然后检测与CFSE外泌体孵育48小时后PC3细胞中S100A9的水平(图。gydF4y2Ba3.gydF4y2BaI),表明S100A9在mdsc - exo处理的PC3和DU145细胞中高表达。gydF4y2Ba
CircMID1发挥miR-506-3p海绵的作用gydF4y2Ba
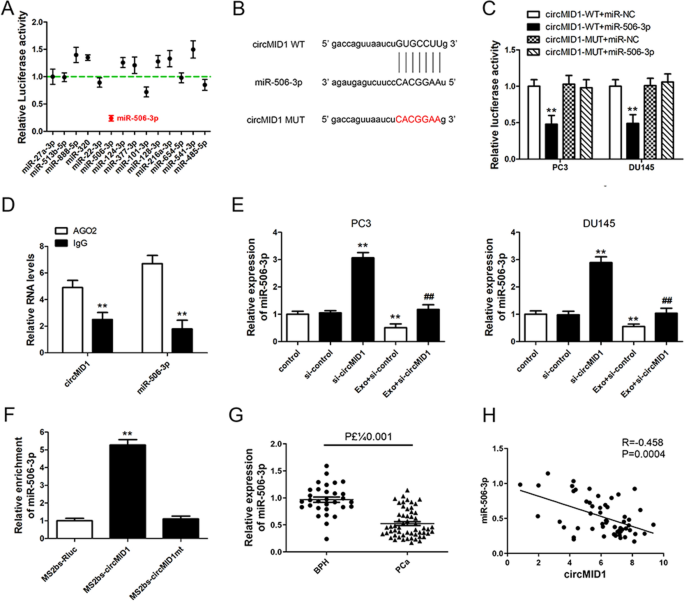
为了研究与circMID1相关的潜在miRNAs,使用两个公共领域的数据库:STARBASE 3.0和CIRCBASE进行生物信息学分析,预测circMID1可能的结合伙伴。生物信息学数据显示circMID1可与miR-27a-3p、miR-513b-5p、miR-888-5p、miR-320、miR-22-3p、miR-506-3p、miR-124-3p等多种miRNAs相互作用。构建包含circMID1序列的荧光素酶报告载体,与多种miRNA模拟物转染HEK293细胞。结果显示,miR-506-3p仅显著降低荧光素强度(图。gydF4y2Ba4gydF4y2BaA). circMID1具有miR-506-3p的结合位点(图。gydF4y2Ba4gydF4y2BaB),表明circMID1与miR-506-3p存在稳定的相互作用。因此,我们进行了双荧光素酶报告检测,以确定miR-506-3p是否在PCa细胞中作为circMID1靶点。当细胞共转染荧光素酶报告物circMID1-WT和miR-506-3p模拟物时,荧光素酶活性显著降低,同时,共转染突变的荧光素酶报告物circMID1-MUT和miR-506-3p模拟物对PC3和DU145细胞中的荧光素酶活性没有显著影响(图5)。gydF4y2Ba4gydF4y2BaC).先前的研究结果表明,Argonaute 2 (Ago2)蛋白与miRNAs和circRNAs结合形成rna诱导的沉默复合体。因此,我们在PC3细胞中进行了RNA免疫沉淀(RIP)实验,以拉低与Ago2结合的RNA转录本。我们发现miR-506-5p和circMID1被抗ago2有效地拉低,而不是被非特异性抗igg抗体拉低(图2)。gydF4y2Ba4gydF4y2BaD).随后,我们验证了circMID1对PCa细胞miR-506-3p表达的影响。敲低结果显示,si-circMID1在没有MDCS-Exo处理或与MDCS-Exo处理的PC3和DU145细胞中上调miR-506-3p的表达。gydF4y2Ba4gydF4y2BaE).为了进一步验证circMID1与miR-506-3p之间的直接结合,我们在PC3细胞中进行了基于MS2bp-MS2bs的RIP实验。如图所示。gydF4y2Ba4gydF4y2BaF,与从MS2bs-circMID1mt或对照MS2bs-Rluc提取的rna相比,从MS2bs-circMID1提取的rna中miR-506-3p显著富集,表明circMID1与miR-506-3p之间存在特异性相互作用。此外,miR-506-3p在PCa样本中的表达水平明显低于BPH组织(图。gydF4y2Ba4gydF4y2BaG), miR-506-5p在PCa组织中与circMID1呈负相关(图。gydF4y2Ba4gydF4y2BaH).结果与观察到的circMID1在PCa中的过表达一致,并证明circMID1在PCa中是一个miR-506-3p海绵。gydF4y2Ba
circMID1充当miR-506-3p的海绵。gydF4y2Ba一个gydF4y2BaHEK293细胞共转染miRNAs模拟物或对照miRNAs (miR-NC)和含有circMID1 (circMID1- wt)或突变体(circMID1- mut)的荧光素酶报告基因。进行双荧光素酶报告检测。gydF4y2BaBgydF4y2BamiR-506-3p与野生型(WT)或突变型(MUT,红色)circMID1的预测结合位点如图所示。gydF4y2BaCgydF4y2BaPC3和DU145细胞共转染miR-506-3p模拟物或对照miR-506-3p (miR-NC)和含有circMID1 (circMID1- wt)或突变结构(circMID1- mut)的荧光素酶报告物。进行双荧光素酶报告检测(gydF4y2Ba**gydF4y2Bap < 0.01)。gydF4y2Ba*gydF4y2Bavs. circMID1-WT + miR-NC。gydF4y2BaDgydF4y2BaAgo2 RIP显示Ago2显著富集circMID1和miR-506-3p (gydF4y2Ba**gydF4y2Bap < 0.01)。gydF4y2BaEgydF4y2Ba在MDSC-Exo处理后的PC3和DU145细胞中,用si-control或si-circMID1通过RT-PCR检测miR-506-3p的表达水平。gydF4y2Ba**gydF4y2Ba,gydF4y2Ba# #gydF4y2Bap < 0.01,gydF4y2Ba*gydF4y2Ba# vs. Exo + si-control。gydF4y2BaFgydF4y2Ba以MS2bs-circMID1、MS2bs-circMID1mt或MS2bs-Rluc转染的PC3细胞为基础的RIP检测(gydF4y2BaGgydF4y2Ba通过qRT-PCR检测miR-506-3p在良性前列腺增生(BPH, n = 31)和前列腺增生(PCa, n = 56)组织中的相对表达。gydF4y2BaHgydF4y2BaPearson相关性分析显示miR-506-3p与circMID1呈正相关(R = 0.458;P = 0.0004)。所有实验至少进行三次gydF4y2Ba
CircMID1和MID1通过miR-506-3p的调控在PCa中发挥ceRNAs的作用gydF4y2Ba
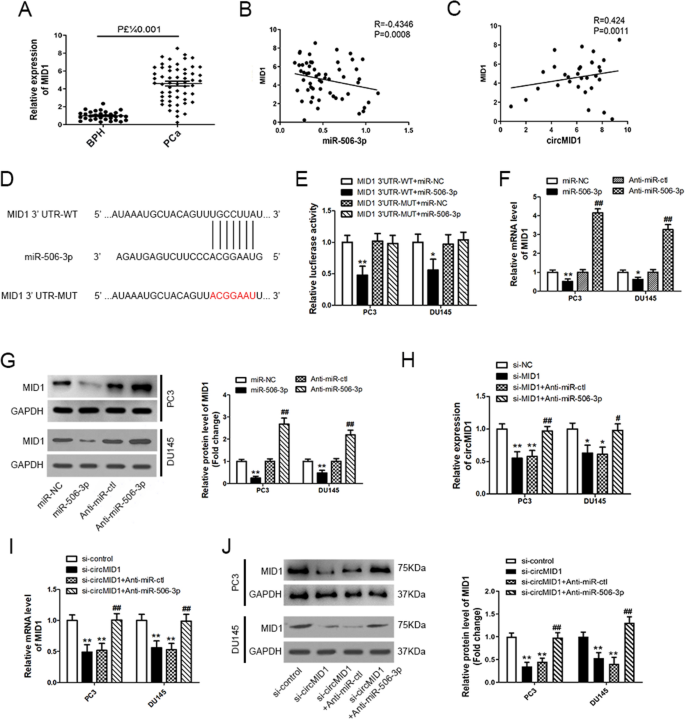
为了检测circMID1是否作为ceRNA释放MID1表达并隔离miR-506-3p,我们随后表征了PCa组织中的MID1表达。这些数据证实了MID1在PCa组织中上调(图。gydF4y2Ba5gydF4y2BaA). Pearson相关性分析表明,MID1与miR-506-3p呈负相关,与circMID1呈正相关(图。gydF4y2Ba5gydF4y2Ba此外,我们利用TargetScan对miR-506-3p推测的靶基因进行了标记,结果显示MID1被预测(图5 -3)。gydF4y2Ba5gydF4y2BaD)。为了验证这一发现,我们进行了荧光素酶报告分析,结果显示,在PC3和DU145细胞中,当与miR-506-3p模拟物和含有WT MID1 3 ' -UTR的荧光素酶报告物共转染时,荧光素酶活性显著降低,但与突变的荧光素酶报告物共转染时,荧光素酶活性没有显著降低(图5)。gydF4y2Ba5gydF4y2BaE)。Western blotting和qRT-PCR证实,在PC3和DU145细胞中,miR-506-3p模拟物降低了MID1蛋白和mRNA的表达水平,而其antiagomir减少了miR-506-3p,则增加了MID1蛋白和mRNA的表达水平(图。gydF4y2Ba5gydF4y2Ba总之,这些结果表明MID1是miR-506-3p的直接靶点,它也可能隔离miR-506-3p。gydF4y2Ba
CircMID1和MID1通过调控miR-506-3p在PCa中作为ceRNAs。gydF4y2Ba一个gydF4y2Ba通过qRT-PCR检测前列腺增生(BPH, n = 31)和前列腺增生(PCa, n = 56)组织中MID1的表达水平。(B-C) Pearson相关分析分析MID1 mRNA与miR-506-3p的关系(R = -0.4346, P = 0.0008,gydF4y2BaBgydF4y2Ba), MID1 mRNA和circMID1 (R = 0.424, P = 0.0011,gydF4y2BaCgydF4y2Ba).gydF4y2BaDgydF4y2BamiR-506-3p在人MID1 mRNA 3 ' -UTR上的潜在结合位点显示。红色表示突变的mir -506-3p结合位点的序列。gydF4y2BaEgydF4y2BaPC3和DU145细胞共转染miR-506-3p模拟物或对照模拟物以及含有野生型(WT)或突变miR-506-3p结合位点(MUT)的荧光素酶报告载体MID1 3 ' -UTR。进行荧光素酶报告检测。gydF4y2Ba*gydF4y2Bap < 0.05;gydF4y2Ba**gydF4y2Bap < 0.01,gydF4y2Ba*gydF4y2Bavs. MID1 3 ' -UTR-WT + miR-NC。gydF4y2BaFgydF4y2Ba,gydF4y2BaGgydF4y2BaPC3和DU145细胞分别转染miR-506-3p mimic或anti-miR-506-3p及其对应对照(miR-NC或anti-miR-ctl), mRNA (gydF4y2BaFgydF4y2Ba)和蛋白质(gydF4y2BaGgydF4y2Ba)分别用qRT-PCR和western blotting分析MID1的表达水平。gydF4y2Ba*, #gydF4y2Bap < 0.05;gydF4y2Ba* *, # #gydF4y2Bap < 0.01,gydF4y2Ba*gydF4y2Ba与miR-NC,gydF4y2Ba#gydF4y2Ba与Anti-miR-ctl。gydF4y2BaHgydF4y2Ba用si-NC、si-MID1、si-MID1和anti-miR-ctl或anti-miR-506-3p转染PC3和DU145细胞,通过qRT-PCR检测circMID1的表达。gydF4y2Ba*, #gydF4y2Bap < 0.05;gydF4y2Ba* *, # #gydF4y2Bap < 0.01,gydF4y2Ba*gydF4y2Ba与si-NC,gydF4y2Ba#gydF4y2Ba与si-MID1。gydF4y2Ba我gydF4y2Ba,gydF4y2BaJgydF4y2BaPC3和DU145细胞分别转染si-control、si-circMID1或si-circMID1和Anti-miR-ctl或Anti-miR-506-3p, mRNA (gydF4y2Ba我gydF4y2Ba)和蛋白质(gydF4y2BaJgydF4y2Ba)分别用qRT-PCR和western blotting法检测MID1基因的表达。所有实验至少进行三次(gydF4y2Ba**gydF4y2Ba,gydF4y2Ba# #gydF4y2Bap < 0.01)。gydF4y2Ba*gydF4y2Ba与si-control,gydF4y2Ba#gydF4y2Ba与si-circMID1gydF4y2Ba
然后,我们鉴定了MID1敲除后circMID1的表达,发现circMID1被抑制(图2)。gydF4y2Ba5gydF4y2BaH)。为了验证MID1是否起到ceRNA的作用,我们共转染si-MID1和miR-506-3p抑制剂,并发现PC3和DU145细胞中circMID1的抑制被逆转(图5)。gydF4y2Ba5gydF4y2BaH)。我们检测circMID1敲低后MID1 mRNA和蛋白的表达,并观察到两者的表达降低。在PC3和DU145细胞中,miR-506-3p抑制剂共转染后,表达逆转(图5)。gydF4y2Ba5gydF4y2BaI, J).这些数据表明MID1和circMID1通过含有miR-506-3p而发挥ceRNAs的作用。gydF4y2Ba
MDSC-Exo通过调节S100A9/circMID1/miR-506-3p/MID1信号通路促进前列腺癌细胞增殖、侵袭和迁移gydF4y2Ba
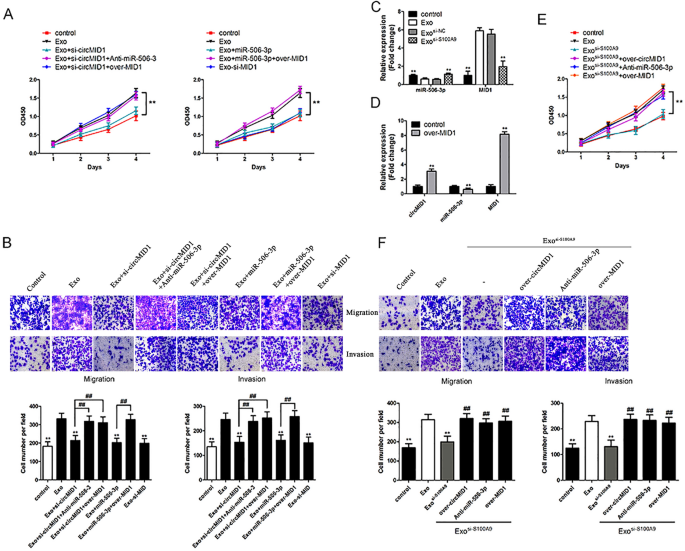
为了确定circMID1/miR-506-3p/MID1通路对MDSC-Exo调控的CRPC增殖的影响,在MDSC-Exo处理的PC3细胞中通过敲低阻断或过表达circRNA-miRNA-mRNA轴,然后通过功能分析进行分析。数据表明,circMID1敲低或miR-506-3p过表达或MID1敲低抑制了MDSC-Exo处理的PC3细胞的增殖、侵袭和迁移,而miR-506-3p抑制或MID1过表达则挽救了MDSC-Exo处理后circMID1缺陷或miR-506-3p过表达的细胞增殖、侵袭和迁移缺陷(图)。gydF4y2Ba6gydF4y2Ba此外,我们发现在mdsc - exo处理的PC3细胞中,敲低S100A9显著增加了miR-506-3p水平,并降低了MID1表达水平(图5)。gydF4y2Ba6gydF4y2BaC)。在mid1过表达的PC3细胞中,circMID1表达水平升高,miR-506-3p水平降低(图。gydF4y2Ba6gydF4y2BaD)。S100A9的下调抑制了mdsc - exo处理的PC3细胞的增殖、迁移和侵袭,而circMID1过表达或miR-506-3p抑制或MID1过表达挽救了S100A9下调的抑制效果(图。gydF4y2Ba6gydF4y2Ba此外,我们还发现在mdsc - exo处理的DU145细胞中,circMID1和MID1表达水平升高,miR-506-3p表达水平降低,而敲低S100A9则显著升高miR-506-3p水平,降低circMID1和MID1表达水平(补充文件)gydF4y2Ba2gydF4y2Ba:图S2A)。circMID1敲低或miR-506-3p过表达或MID1敲低抑制mdsc - exo处理的DU145细胞的增殖、侵袭和迁移(补充文件)gydF4y2Ba2gydF4y2Ba:图S2B和S2D)。S100A9的下调抑制了mdsc - exo处理的DU145细胞的增殖、迁移和侵袭,而circMID1过表达或miR-506-3p抑制或MID1过表达挽救了S100A9下调的抑制效果(补充文件)gydF4y2Ba2gydF4y2Ba:图S2C和S2E)。因此,结果表明MDSC-Exo通过S100A9/circMID1/miR-506-3p/MID1信号通路促进前列腺癌细胞迁移、增殖和侵袭。gydF4y2Ba
MDSC-Exo通过调节S100A9/circMID1/miR-506-3p/MID1信号通路促进PC3细胞增殖、侵袭和迁移。gydF4y2Ba一个gydF4y2Ba,gydF4y2BaBgydF4y2Ba用si-circMID1、miR-506-3p、si-MID1、si-circMID1和anti-miR-506-3p或over-MID1、miR-506-3p和over-MID1转染PC3细胞,然后用MDSC-Exo处理。细胞增殖(gydF4y2Ba一个gydF4y2Ba)用CCK-8法检测不同处理的PC3细胞。细胞迁移及侵袭(gydF4y2BaBgydF4y2Ba)用Transwell法对PC3细胞进行评价。比例尺,100 μM。gydF4y2BaCgydF4y2BaMDSC-Exo或MDSC-Exo处理的PC3细胞中miR-506-3p和MID1的相对表达gydF4y2Ba如果−S100A9gydF4y2Ba.gydF4y2Ba**gydF4y2Bap < 0.01,gydF4y2Ba*gydF4y2Ba与精彩。gydF4y2BaDgydF4y2BacircMID1、miR-506-3p和MID1在转染over-MID1的PC3细胞中的相对表达。gydF4y2Ba**gydF4y2Bap < 0.01,gydF4y2Ba*gydF4y2Ba与控制。gydF4y2BaEgydF4y2Ba,gydF4y2BaFgydF4y2BaPC3细胞转染over-circMID1、anti-miR-506-3p和over-MID1,再用MDSC-Exo处理gydF4y2Ba如果−S100A9gydF4y2Ba.细胞增殖(gydF4y2BaEgydF4y2BaCCK-8法检测细胞迁移和侵袭(gydF4y2BaFgydF4y2Ba)用Transwell法对这些PC3细胞进行评价。gydF4y2Ba* *, # #gydF4y2Bap < 0.01,gydF4y2Ba*gydF4y2Ba与外逸,gydF4y2Ba#gydF4y2Ba与精彩gydF4y2Ba如果−S100A9gydF4y2Ba.所有实验至少进行三次gydF4y2Ba
CircMID1缺失在体内抑制了mdsc - exo诱导的前列腺癌生长gydF4y2Ba
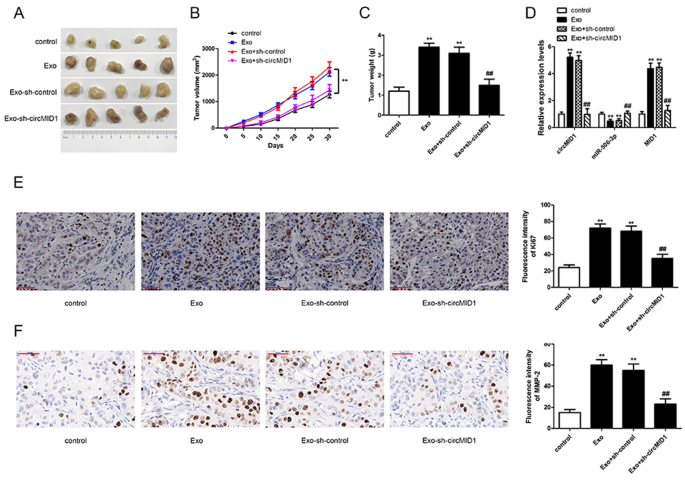
在前人研究成果的基础上,通过异种移植裸鼠成瘤实验,评价MDSC-Exo和circMID1在PC3体内肿瘤生长中的作用。裸鼠注射对照组或mdsc - exo处理的PC3细胞,或转染si-control或si-circMID1的MDSC-Exo-PC3细胞,测量肿瘤生长情况。我们发现MDSC-Exo促进肿瘤生长,而抑制circMID1导致肿瘤生长显著降低(图。gydF4y2Ba7gydF4y2Baa - c)。在肿瘤组织中,si-circMID1抑制了mdsc - exo上调的circMID1和MID1的表达,而si-circMID1增加了下调的miR-506-3p的表达(图5)。gydF4y2Ba7gydF4y2BaD).免疫组化染色检测增殖标志物Ki67和侵袭相关因子MMP-2的表达。Exo组Ki67、MMP-2表达较对照组明显升高;与Exo组相比,Exo-sh- circmid1组Ki67和MMP-2的表达明显降低(图。gydF4y2Ba7gydF4y2BaE, F).总之,这些结果表明沉默circMID1可以通过调控miR-506-3p/MID1信号通路抑制MDSC-Exo对前列腺癌生长的促进作用。gydF4y2Ba
CircMID1缺失在体内抑制了mdsc - exo诱导的前列腺癌生长gydF4y2Ba.gydF4y2Ba一个gydF4y2Ba裸鼠异种移植瘤代表性图像(n = 5/组)。gydF4y2BaBgydF4y2Ba每5天监测一次肿瘤体积,共30天。gydF4y2Ba**gydF4y2Bap < 0.01。gydF4y2BaCgydF4y2Ba在异种移植实验结束时确定肿瘤重量。gydF4y2Ba* *, # #gydF4y2Bap < 0.01,gydF4y2Ba*gydF4y2Ba与控制,gydF4y2Ba#gydF4y2Ba与精彩。gydF4y2BaDgydF4y2Ba采用qRT-PCR方法分析circMID1、miR-506-3p和MID1在肿瘤组织中的相对表达情况。gydF4y2BaEgydF4y2Ba免疫组织化学免疫荧光法(标度棒,50 μM)检测各组增殖标志物Ki67的表达。gydF4y2BaFgydF4y2Ba免疫组化检测各组侵袭相关因子MMP-2的表达(标度条,50 μM)。gydF4y2Ba* *, # #gydF4y2Bap < 0.01,gydF4y2Ba*gydF4y2Ba与控制,gydF4y2Ba#gydF4y2Ba与精彩。测量数据以均数±标准差(SD)表示。所有实验至少重复三次gydF4y2Ba
讨论gydF4y2Ba
有证据表明,癌细胞与MDSCs之间的串扰可诱导癌症进展[gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba].mdsc衍生的外泌体被发现具有细胞间信使的功能。有研究分析了肿瘤环境下MDSCs衍生的Exo活性[gydF4y2Ba27gydF4y2Ba,gydF4y2Ba33gydF4y2Ba],但其潜在机制仍不清楚。我们的结果表明,与之前无偏质谱分析的结果一致[gydF4y2Ba27gydF4y2Ba],表明S100A9在MDSC-Exo中表达丰富。此外,S100A9的下调抑制了mdsc - exo处理的PC3细胞的迁移、增殖和侵袭。据报道,mdsc来源的Exos极化巨噬细胞,促进肿瘤进展,并具有S100A8/A9趋化活性[gydF4y2Ba27gydF4y2Ba,gydF4y2Ba33gydF4y2Ba],这表明MDSC脱落了外泌体,外泌体在肿瘤微环境中起着交流者的作用。在ADT之后,大多数PCa发展为CRPC,这是一个主要的临床问题,因为这种复发性疾病对替代疗法反应不佳。因此,利用目前的基因组方法识别雄激素非依赖性信号通路的分子机制将有助于改善这种疾病的治疗。gydF4y2Ba
因此,本研究选择雄激素不依赖性PCa细胞株PC3和DU145。然而,这可能是一个限制。由于缺乏来自雄激素依赖性PCa细胞系的可用数据,现有的关于前列腺癌进展机制的研究并不全面。本研究通过微阵列分析分析了MDSC-Exo-PC3细胞与对照细胞中circRNA的表达谱,并重点研究了circMID1表达增加在mdsc - exo调控的CRPC进展中的作用和潜在机制。总的来说,我们的结果表明,外泌体介导的S100A9从MDSCs转移到PCa细胞,通过上调circMID1促进了PCa细胞的增殖、迁移和侵袭,最终加速了CRPC的进展。gydF4y2Ba
CircRNAs作为一类新型的非编码rna,被认为参与癌症的进展[gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba].研究表明circAMOTL1L在人前列腺癌中下调,这种下调促进了前列腺癌细胞的迁移和侵袭,从而导致上皮-间充质转变和前列腺癌的进展[gydF4y2Ba36gydF4y2Ba].Huang等发现circABCC4在PCa细胞系和组织中上调,并通过miR-1182海绵作用促进FOXP4表达,促进PCa恶性行为[gydF4y2Ba37gydF4y2Ba].虽然circrna在CRPC中的生物学功能和表达尚不清楚,但目前的研究已经确定circMID1在MDSCs的Exos处理的PC3细胞中上调。此外,circMID1在前列腺癌组织中表达高于BPH,在CRPC患者中表达高于HSPC患者。后续研究表明,circMID1的敲除降低了细胞增殖,抑制了PC3细胞与MDSC-Exo的侵袭和迁移。我们进一步在小鼠异种移植模型中验证了肿瘤的生长。这些发现支持了MDSC-Exo引起的circMID1表达增加可能在CRPC进程的调节中发挥功能作用的概念。Ding Y及其同事最近研究发现circMID1在PCa细胞中表达上调,在体外可抑制PCa细胞增殖、迁移、侵袭,在体内可抑制PCa的肿瘤发生[gydF4y2Ba38gydF4y2Ba],这与我们的发现一致。然而,我们的研究也有局限性。由于我们仅使用这两个样本进行了生物信息学分析,筛选出circMID1,并且两个对照样本之间存在较大的变异性,其他重要的circrna可能会被忽略。gydF4y2Ba
本研究表明,经s100a9沉默的MDSC-Exo处理的PC3细胞circMID1表达降低,DHX9表达增加。DHX9是一种丰富的核RNA解旋酶,特异性地与IARs结合,DHX9的缺失增加了环状RNA亚类的形成[gydF4y2Ba29gydF4y2Ba,gydF4y2Ba39gydF4y2Ba].Alu元件是众所周知的反转录转座子,是重复元件短穿插核元件(sin)家族的成员,外显子周围的IARs促进环状crna的形成[gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba].我们发现多个iar位于gydF4y2BaMID1gydF4y2Ba其中一些基因位于外显子7 ~ 8周围,circMID1就是在这里形成的。通过沉默DHX9, CircMID1的表达进一步升高,这表明DHX9影响了细胞的圆形化gydF4y2BaMID1gydF4y2Ba基因具有Alu元素依赖性。gydF4y2Ba
circRNA-miRNA-mRNA轴是一个不可或缺的调控模型,circrna可以通过调控mirna发挥cerna的功能,在转录控制中发挥关键作用[gydF4y2Ba22gydF4y2Ba,gydF4y2Ba42gydF4y2Ba].基于生物信息学分析,我们假设circMID1/miR-506-3p/MID1轴在mdsc - exo调控的CRPC进展中起主要作用。生物信息学分析和荧光素酶报告分析表明circMID1吸附miR-506-3p, MID1是miR-506-3p的靶标。细胞学功能实验证实circMID1和miR-506-3p可以逆转对细胞表型的影响。miR-506-3p antagomir可以挽救circMID1沉默诱导的生物学改变。具体而言,我们从机制上证明circMID1通过作为miR-506-3p海绵参与了mdsc - exo调控的CRPC进程。然而,根据生物信息学分析,circMID1也可能与其他mirna相互作用。因此,其他mirna是否在circmid1调控的肿瘤发生中发挥作用,未来还需要进一步研究。gydF4y2Ba
在PCa组织中,circMID1的上调伴随着miR-506-3p的下调和MID1的上调。有研究证实,MID1在PCa中过表达,具有分期依赖性,ADT中持续上调MID1促进AR,导致PCa进展为去势抵抗[gydF4y2Ba43gydF4y2Ba].在本研究中,MID1在PCa中过表达,而在PC3细胞中,miR-506-3p与MID1结合并抑制MID的表达。circMID1通过海绵miR-506-3p调节MID1表达,因为miR-506-3p抑制释放了circMID1缺陷对MID1表达的抑制作用。circRNA通过MID1增强了PCa的进展,因为MID1过表达挽救了MDSC-Exo-PC3细胞中circMID1缺陷介导的进展缺陷。此外,circMID1过表达或miR-506-3p抑制或MID1过表达挽救了s100a9敲除MDSC-Exo对PC3和DU145细胞的抑制作用。因此,该研究证实了在mdsc - exo调控的CRPC进程中存在S100A9/circMID1/miR-506-3p/MID1轴。gydF4y2Ba
结论gydF4y2Ba
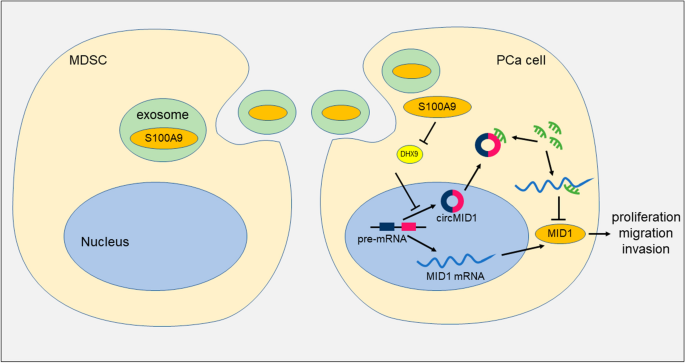
总之,我们的数据表明,circMID1在MDSC-Exo调控的CRPC进程中上调,circMID1的下调抑制了MDSC-Exo的生长和前列腺癌细胞的侵袭和迁移。circRNAs表达的新变化的鉴定是更好地理解circRNAs在CRPC中的作用的关键的第一步。然后,破译circRNA功能的确切分子机制将是理解CRPC进展和开发新的潜在治疗靶点的关键。来自MDSC的外泌体S100A9促进了PC3细胞中circMID1的表达,circMID1作为ceRNA通过miR-506-3p调节MID1的表达(图。gydF4y2Ba8gydF4y2Ba).我们在mdsc - exo调控的CRPC进展中发现了一个重要的S100A9/circMID1-miR-506-3p-MID1轴,并发现了circRNAs在疾病进展中的关键功能。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
本研究中使用和/或分析的数据集可根据合理要求从通讯作者处获得。gydF4y2Ba
缩写gydF4y2Ba
- CRPC:gydF4y2Ba
-
去势抵抗性前列腺癌gydF4y2Ba
- 主成分分析:gydF4y2Ba
-
前列腺癌gydF4y2Ba
- MDSCs:gydF4y2Ba
-
骨髓来源的抑制细胞gydF4y2Ba
- 外:gydF4y2Ba
-
液gydF4y2Ba
- 良性前列腺增生:gydF4y2Ba
-
良性前列腺增生gydF4y2Ba
- 公司:gydF4y2Ba
-
激素敏感性前列腺癌gydF4y2Ba
- 时差:gydF4y2Ba
-
肿瘤微环境gydF4y2Ba
- 基于“增大化现实”技术:gydF4y2Ba
-
雄性激素受体gydF4y2Ba
- circRNAs:gydF4y2Ba
-
圆形rnagydF4y2Ba
- GAPDH:gydF4y2Ba
-
甘油醛3-磷酸脱氢酶gydF4y2Ba
- Ago2:gydF4y2Ba
-
Argonaute 2gydF4y2Ba
- 撕裂:gydF4y2Ba
-
RNA免疫沉淀反应gydF4y2Ba
参考文献gydF4y2Ba
sigel RL, Miller KD, Jemal A.癌症统计,2019。中华癌症杂志2019;49:7 - 34。gydF4y2Ba
Katzenwadel A, Wolf P.前列腺癌雄激素剥夺:导致治疗的死胡同。癌症杂志2015;367:12-7。gydF4y2Ba
Nuhn P, De Bono JS, Fizazi K, Freedland SJ, Grilli M, Kantoff PW, Sonpavde G, Sternberg CN, Yegnasubramanian S, Antonarakis ES。全身前列腺癌治疗的最新进展:精准肿瘤学时代转移性去势抵抗性前列腺癌的管理。欧洲,2019;75:88-99。gydF4y2Ba
Sartor O, de Bono JS。转移性前列腺癌。中华外科杂志,2018;gydF4y2Ba
沃森PA,阿罗拉VK,索耶斯CL。前列腺癌对雄激素受体抑制剂耐药的新兴机制。癌症杂志。2015;15:701-11。gydF4y2Ba
Calcinotto A, Spataro C, Zagato E, Di Mitri D, Gil V, Crespo M, De Bernardis G, Losa M, Mirenda M, Pasquini E, Rinaldi A, Sumanasuriya S, Lambros MB, Neeb A, Luciano R, Bravi CA, Nava-Rodrigues D, Dolling D, pray - galetti T, Ferreira A, Briganti A, Esposito A, Barry S, Yuan W, Sharp A, De Bono J, Alimonti A骨髓细胞分泌IL-23驱动去势抵抗性前列腺癌。大自然。2018;559:363-9。gydF4y2Ba
卢X, Horner JW, Paul E,尚X, Troncoso P,邓P,蒋S,常青,Spring DJ, Sharma P, Zebala JA, Maeda DY,王亚,DePinho RA。去势抵抗性前列腺癌的有效联合免疫治疗。大自然。2017;543:728-32。gydF4y2Ba
Hossain DM, Pal SK, Moreira D, Duttagupta P, Zhang Q, Won H, Jones J, D 'Apuzzo M, Forman S, Kortylewski M. tlr9靶向STAT3沉默消除前列腺癌患者骨髓源性抑制细胞的免疫抑制活性临床癌症决议2015;21:3771-82。gydF4y2Ba
Idorn M, Kollgaard T, Kongsted P, Sengelov L, Thor Straten P.去势抵抗性转移性前列腺癌患者血液单核细胞骨髓来源抑制细胞、调节性T细胞频率与阴性预后标志物的相关性。中华癌症杂志2014;63:1177-87。gydF4y2Ba
骨髓来源的抑制细胞:抑制抗肿瘤免疫的更多机制。中国生物医学工程杂志,2010;gydF4y2Ba
默多克C,穆萨纳M,科菲特SB,刘易斯CE。髓系细胞在促进肿瘤血管生成中的作用。癌症杂志,2008;8:618-31。gydF4y2Ba
Camisaschi C, Vallacchi V, Vergani E, Tazzari M, Ferro S, Tuccitto A, Kuchuk O, Shahaj E, Sulsenti R, Castelli C, Rodolfo M, Rivoltini L, Huber V.靶向免疫调节网络对抗癌症中的免疫抑制。疫苗。2016;38。gydF4y2Ba
格林DW, Gopal SK,徐瑞,Simpson RJ,陈伟。外泌体在免疫调节和癌症中的作用。中国生物医学工程学报,2015;gydF4y2Ba
geis - astggiante L, Dhabaria A, Edwards N, Ostrand-Rosenberg S, Fenselau C.小鼠骨髓来源抑制细胞脱落外泌体低质量蛋白的自上而下分析。中国生物医学工程学报,2015;gydF4y2Ba
邓智,荣勇,滕勇,庄欣,Samykutty A,穆杰,张磊,曹萍,闫娟,Miller D,张宏宏。DOX治疗诱导MDSC释放外泌体miR-126a促进肺转移。致癌基因。2017;36:639-51。gydF4y2Ba
Iaccino E, Mimmi S, Dattilo V, Marino F, Candeloro P, Di Loria A, Marimpietri D, Pisano A, Albano F, Vecchio E, Ceglia S, Golino G, Lupia A, Fiume G, Quinto I, Scala G。《肿瘤杂志》2017;16:19 9。gydF4y2Ba
李伟,李超,周涛,刘霞,刘霞,李霞,陈东。外泌体蛋白在癌症诊断中的作用。Mol Cancer, 2017;16:145。gydF4y2Ba
Maisano D, Mimmi S, Russo R, Fioravanti A, Fiume G, Vecchio E, Nistico N, Quinto I, Iaccino E.揭示外泌体多样性:肿瘤进展监测的机会之窗。药品。2020;13:180。gydF4y2Ba
拉希德MH, Borin TF, Ara R, Angara K,蔡杰,Achyut BR,刘勇,Arbab AS。来自不同细胞来源的(131)i标记外泌体的体内生物分布差异及其对治疗应用的意义。纳米医学。2019;21:102072。gydF4y2Ba
Kristensen LS, Hansen TB, Veno MT, Kjems J.癌症中的环状rna:该领域的机遇和挑战。致癌基因。2018;37:555 - 65。gydF4y2Ba
Vo JN, Cieslik M, Zhang Y, Shukla S, Xiao L, Zhang Y, Wu YM, Dhanasekaran SM, Engelke CG, Cao X, Robinson DR, Nesvizhskii AI, Chinnaiyan AM。环状RNA在癌症中的分布。Cell. 2019;176(869-881): e13。gydF4y2Ba
Hansen TB, Jensen TI, Clausen BH, Bramsen JB, Finsen B, Damgaard CK, Kjems J.天然RNA环作为高效microRNA海绵的功能。大自然。2013;495:384-8。gydF4y2Ba
曹s, Ma T, Ungerleider N, Roberts C, Kobelski M, Jin L, Concha M, Wang X, Baddoo M, Nguyen HM, Corey E, Fazli L, Ledet E, Zhang R, Silberstein JL, Zhang W, Zhang K, Sartor O, Dong X, Flemington EK, Dong Y.环形rna增加去势抵抗性前列腺癌雄激素受体亚型的多样性。致癌基因。2019;38:7060 - 72。gydF4y2Ba
吴刚,孙勇,向志,王凯,刘波,肖刚,牛勇,吴东,常昌。环状RNA 17和微RNA 181c-5p抑制enzalutamide耐药前列腺癌进展的临床前研究。细胞死亡,2019;10:37。gydF4y2Ba
Bronte V, Brandau S, Chen SH,科伦坡议员,Frey AB, Greten TF, Mandruzzato S, Murray PJ, Ochoa A, Ostrand-Rosenberg S, Rodriguez PC, Sica A, Umansky V, Vonderheide RH, Gabrilovich DI。髓源性抑制细胞命名法和表征标准的建议。Nat Commun. 2016;7:12150。gydF4y2Ba
李志强,李志强,李志强,等。卵巢癌细胞对外泌体的吸收作用。BMC癌症,2011;11:108。gydF4y2Ba
Burke M, Choksawangkarn W, Edwards N, Ostrand-Rosenberg S, Fenselau C.骨髓来源抑制细胞的外泌体携带生物活性蛋白。中国生物工程学报,2014;13:836-43。gydF4y2Ba
李霞,杨玲,陈丽玲。环状rna的生物成因、功能和挑战。Mol Cell, 2018; 71:428-42。gydF4y2Ba
Aktas T, Avsar Ilik I, Maticzka D, Bhardwaj V, Pessoa Rodrigues C, Mittler G, Manke T, Backofen R, Akhtar A. DHX9抑制来自人类基因组Alu入侵的RNA处理缺陷。大自然。2017;544:115-9。gydF4y2Ba
Conn SJ, Pillman KA, Toubia J, Conn VM, Salmanidis M, Phillips CA, Roslan S, Schreiber AW, Gregory PA, Goodall GJ。RNA结合蛋白震动调节环状RNA的形成。细胞。2015;160:1125-34。gydF4y2Ba
Limagne E, Euvrard R, Thibaudin M, Rebe C, Derangere V, Chevriaux A, Boidot R, Vegran F, Bonnefoy N, Vincent J, Bengrine-Lefevre L, Ladoire S, Delmas D, Apetoh L, Ghiringhelli F转移性结直肠癌患者MDSC和Th17细胞的积累预测folfox -贝伐珠单抗药物治疗方案的疗效。癌症决议2016;76:5241-52。gydF4y2Ba
Panni RZ, Sanford DE, Belt BA, Mitchem JB, Worley LA, Goetz BD, Mukherjee P, Wang-Gillam A, Link DC, Denardo DG, Goedegebuure SP, Linehan DC。单核细胞骨髓来源抑制细胞中肿瘤诱导的STAT3激活增强了人胰腺癌的干性和间充质特性。中国生物医学工程杂志,2014;gydF4y2Ba
王艳,尹凯,田娟,夏霞,马娟,唐霞,徐红,王松。粒细胞性骨髓源性抑制细胞通过外泌体S100A9促进结直肠癌细胞干性。Adv science 2019;6:1901278。gydF4y2Ba
Arnaiz E, Sole C, Manterola L, Iparraguirre L, Otaegui D, Lawrie CH.环状rna与癌症:生物标志物和主要调控因子。Semin Cancer biology 2019; 58:90-9。gydF4y2Ba
苏敏,肖勇,马娟,唐勇,田波,张勇,李旭,吴忠,杨东,周勇,王宏,廖强,王伟。癌症中的环状rna:在特征、茎干、抗性中的新兴功能及其作为潜在生物标志物的作用。《Mol Cancer》2019;18:90。gydF4y2Ba
杨铮,曲晓波,张颖,张伟峰,王德旺,高春林,马琳,陈建军,刘克林,郑波,张晓华,张明兰,王晓玲,温建科,李伟。p53- rbm25介导的circAMOTL1L生物发生异常通过circAMOTL1L- mir -193a-5p- pcdha通路参与前列腺癌进展。致癌基因。2019;38:2516-32。gydF4y2Ba
黄超,邓红,王艳,姜红,徐瑞,朱霞,黄卓,赵霞。环状RNA circABCC4作为miR-1182的ceRNA,通过促进FOXP4表达促进前列腺癌的进展。中华医学杂志2019;23:6112-9。gydF4y2Ba
丁艳,王敏,杨娟。环状RNA midline-1 (circMID1)促进前列腺癌增殖、迁移、侵袭和糖酵解。生物工程。2022;13:6293 - 308。gydF4y2Ba
徐志刚,王志刚,王志刚,王志刚。人类生存运动神经元基因产生了大量的环状rna。核酸res 2019; 47:2884-905。gydF4y2Ba
Jeck WR, Sorrentino JA, Wang K, Slevin MK, Burd CE, Liu J, Marzluff WF, Sharpless NE。环状rna丰富,保守,与ALU重复序列相关。RNA。2013; 19:141-57。gydF4y2Ba
张晓宇,王海波,张勇,陆霞,陈丽丽,杨玲。互补序列介导的外显子环状化。细胞。2014;159:134-47。gydF4y2Ba
Patop IL, Wust S, Kadener S.环状rna的过去,现在和未来。EMBO J. 2019;38: e100836。gydF4y2Ba
Kohler A, Demir U, Kickstein E, Krauss S, Aigner J, arada - orgilles B, Karagiannidis AI, Achmuller C, Bu H, Wunderlich A, Schweiger MR, Schaefer G, Schweiger S, Klocker H, Schneider R.激素依赖的反馈环通过限制MID1控制雄激素受体水平,MID1是一种新型翻译增强子和致癌信号的启动子。Mol Cancer, 2014;13:146。gydF4y2Ba
确认gydF4y2Ba
一个也没有。gydF4y2Ba
资金gydF4y2Ba
本研究由浙江省中医药管理局科研基金(2018ZQ036)和浙江省临床肿瘤药理与毒理学研究重点实验室(2020E10021)资助。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
FG、QX、YH和ZL对研究构想和设计有贡献。所有作者收集数据并进行数据分析。所有作者都对数据的解释和图表的完成做出了贡献。所有作者都参与了文章的起草和提交版本的最终批准。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
杭州市中医医院伦理委员会批准了这项研究,我们在研究前获得了每位参与者的书面同意。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
所有作者都声明他们没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
mdsc -外泌体鉴定。(A)代表pmcs的PMN-MDSCs的门控和排序策略的点图(绿框)。(B) MDSC-Exo代表性透射电镜图(比例尺= 200 nm)。(C) western blotting检测MDSC-Exo中CD9、CD63、Hsp70和calnexin的表达水平。(D)用纳米颗粒跟踪分析仪分析外泌体的大小和浓度。gydF4y2Ba
附加文件2:图S2。gydF4y2Ba
MDSC-Exo通过调控S100A9/circMID1/miR-506-3p/MID1信号通路促进DU145细胞增殖、侵袭和迁移。(A) circMID1、miR-506-3p和MID1在MDSC-Exo或mdsc - exsi - s100a9处理的DU145细胞中的相对表达。** P < 0.01, * vs. Exo。(B)用si-circMID1、miR-506-3p和si-MID1转染DU145细胞,然后用MDSC-Exo处理。采用CCK-8法检测不同处理DU145细胞的细胞增殖情况。(C) DU145细胞转染over-circMID1、anti-miR-506-3p和over-MID1,然后用MDSC-Exo处理gydF4y2Ba如果−S100A9gydF4y2Ba.采用CCK-8法检测细胞增殖。(D-E)通过Transwell检测这些DU145细胞的迁移和侵袭情况。比例尺,100 μM。**, ## P < 0.01, * vs. Exo, # vs. ExogydF4y2Ba如果−S100A9gydF4y2Ba.所有实验至少进行三次。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条所提供的资料,除非在资料的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
高飞,徐强,唐智。gydF4y2Baet al。gydF4y2Ba来自骨髓来源抑制细胞的外泌体通过S100A9/circMID1/miR-506-3p/MID1促进去势抵抗性前列腺癌进展gydF4y2Ba翻译医学杂志gydF4y2Ba20.gydF4y2Ba, 346(2022)。https://doi.org/10.1186/s12967-022-03494-5gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12967-022-03494-5gydF4y2Ba
关键字gydF4y2Ba
- 去势抵抗性前列腺癌gydF4y2Ba
- 前列腺癌(PCa)gydF4y2Ba
- 骨髓来源抑制细胞(MDSCs)gydF4y2Ba
- 液gydF4y2Ba
- 环状rna (circRNAs)gydF4y2Ba
- mir - 506 - 3 - pgydF4y2Ba