- 研究gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
n -糖蛋白组位点定位分析揭示食管癌中糖蛋白的改变gydF4y2Ba
转化医学杂志gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba,文章号:gydF4y2Ba285gydF4y2Ba(gydF4y2Ba2022gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
异常糖基化被认为是癌症的一个标志,而n -糖基化是真核生物中糖基化的主要类型之一。虽然n -糖蛋白组学对多种癌症的生物标志物的发现做出了贡献,但对食管鳞状细胞癌(ESCC)中异常糖基化特征的了解较少。gydF4y2Ba
方法gydF4y2Ba
在本研究中,我们报道了8对ESCC组织和邻近正常组织的蛋白质组学和n -糖蛋白组学位点定位分析。通过zic-HILIC富集、tmt等压标记、LC-MS /MS分析,定量表征了差异表达的n -糖基化。采用凝集素亲和富集联合western blot方法验证ESCC中潜在的生物标志物。gydF4y2Ba
结果gydF4y2Ba
发现了一系列差异表达的糖蛋白(如LAMP2, PLOD2)和丰富的信号通路(如代谢相关通路,ecm受体相互作用,局灶性粘附)。此外,在鉴定的n -糖基化位点上发现了7个显著富集的基序。在对淋巴结转移进展过程中的糖蛋白变化进行动态分析后,确定了三个集群。进一步验证发现ITGB1、CD276聚焦化水平升高参与了ESCC的发生发展,可能是ESCC潜在的生物标志物。gydF4y2Ba
结论gydF4y2Ba
总之,我们描述了与ESCC相关的n -糖基化和n -糖蛋白改变。在我们的研究中发现的糖蛋白表达和糖基化占用的典型变化不仅将被用作ESCC生物标志物,而且还将提高对ESCC生物学的理解。gydF4y2Ba
简介gydF4y2Ba
食管癌是世界上最常见的恶性肿瘤之一。全球约50%的食管癌患者在中国,主要组织学类型为食管鳞状细胞癌(ESCC)。ESCC患者预后极差,5年生存率低于30% [gydF4y2Ba1gydF4y2Ba].虽然联合使用鳞状细胞癌抗原(SCC)、癌胚抗原(CEA)、细胞角蛋白-19片段(CYFRA21-1)等标志物有助于ESCC患者的诊断和预后预测[gydF4y2Ba2gydF4y2Ba],有限的标志物用于ESCC的早期诊断。根治性手术通常被认为是临床治疗的较好选择。然而,ESCC患者初诊时大多处于中晚期,复发仍是其临床难题。虽然曲妥珠单抗、ramucirumab等药物已在临床得到应用,但与其他癌症类型相比,ESCC仍缺乏特异性有效的治疗靶点[gydF4y2Ba3.gydF4y2Ba].gydF4y2Ba
异常糖基化已被认为是癌症的标志之一,这为癌症研究提供了新的视角[gydF4y2Ba4gydF4y2Ba].糖基化作为一种突出的蛋白质修饰类型,在细胞转化、分化、生长、侵袭、肿瘤免疫监测等多种生物过程中发挥着关键作用[gydF4y2Ba5gydF4y2Ba].最常见的糖基化类型是n -链糖基化,在天冬酰胺中加入特定的糖基残基[gydF4y2Ba5gydF4y2Ba].gydF4y2Ba
超过一半的癌症生物标志物是糖化蛋白,它们可以作为早期发现或治疗和预后疗效评估的生物标志物。因此,糖蛋白组学已经成为一个热门领域,可以为发现疾病的生物标志物做出贡献。迄今为止,对细胞系、组织和体液的糖蛋白组分析在胰腺癌、前列腺癌、乳腺癌、结直肠癌、卵巢癌等多种癌症中显示出巨大的应用前景[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba].除了临床上常用的一些经典糖蛋白(如卵巢癌的CA125、肝癌的AFP和结肠癌的CEA)或糖相关蛋白(如胃肠道癌和胰腺癌的CA19-9)外,这些研究还发现了一些新的糖蛋白,这些糖蛋白可能是潜在的有前景的癌症生物标志物[gydF4y2Ba14gydF4y2Ba].例如,聚焦触珠蛋白(Fut-Hpt)可作为结直肠癌和胰腺癌肝转移的生物标志物[gydF4y2Ba15gydF4y2Ba].此外,聚焦的Le Y抗体也被用作上皮来源肿瘤免疫治疗的潜在药物[gydF4y2Ba16gydF4y2Ba].糖蛋白组学发现HOMER3是膀胱癌缺氧和葡萄糖剥夺引发的潜在靶向生物标志物[gydF4y2Ba17gydF4y2Ba].高级别浆液性卵巢癌的糖蛋白组学描述了三个主要的聚类,显示了间充质亚型与病灶化之间的强烈关系,这预示着癌症患者预后不良[gydF4y2Ba18gydF4y2Ba].因此,进一步研究癌症特别是ESCC的糖基化变化可能为临床应用提供新的途径。gydF4y2Ba
糖基化异常通常包括糖基化异常修饰引起的糖蛋白表达水平的变化和糖基因改变决定的糖蛋白聚糖结构的变化。然而,糖蛋白组学和糖组学的研究由于多糖的复杂特性和研究方法的局限性而严重滞后。迄今为止,对ESCC中异常糖基化特征的了解较少。在此,我们进行了n -糖蛋白组位点定位分析,以研究ESCC中差异表达的糖蛋白。由于糖蛋白的变化可能是由蛋白质浓度的变化引起的[gydF4y2Ba19gydF4y2Ba],我们整合了蛋白质组学和n -糖蛋白组学数据,对确定的糖基化变化进行蛋白质归一化。此外,我们研究了淋巴结转移过程中糖蛋白的动态谱变化,并验证了ESCC中一些潜在的生物标志物。本研究为ESCC的早期诊断和分子靶向治疗提供了新的思路。gydF4y2Ba
材料与方法gydF4y2Ba
患者组织样本gydF4y2Ba
本研究中用于n -糖蛋白组位点定位和蛋白质组学分析的8对肿瘤组织和邻近的正常组织,均来自于山西省肿瘤医院(太原,中国)接受手术切除的ESCC患者。UEA-I凝集素亲和层析中使用的5对组织均来自上述同一来源。这些患者术前未进行化疗、放疗或其他治疗。所有被招募的患者在参与我们的研究前都有知情同意。本研究按照《赫尔辛基宣言》进行,方案由山西医科大学伦理委员会批准(批准号2017LL037)。病例的临床病理特征的细节总结在附加文件中gydF4y2Ba1gydF4y2Ba:表S1。gydF4y2Ba
蛋白质提取和胰蛋白酶消化gydF4y2Ba
将样品在液氮中研磨成细胞粉后,加入4倍体积的裂解缓冲液(1%蛋白酶抑制剂、3 μM TSA、1% TritonX-100、10 mM二硫苏糖醇、50 mM NAM和2 mM EDTA),用超声波处理器在冰块上进行超声处理。加入等体积的三饱和苯酚(pH 8.0)。然后,将混合物进一步涡旋5分钟。离心(4°C, 10分钟,5000 g)后,将上层苯酚相转移到新的离心管中。通过添加至少4体积的硫酸铵饱和甲醇来沉淀蛋白质,并在−20℃下孵卵至少6小时。在4℃下离心10分钟后,丢弃上清液。剩余的沉淀物用冰冷的甲醇清洗,然后用冰冷的丙酮清洗三次。蛋白质在8 M尿素中重新溶解,并根据制造商的说明用BCA试剂盒测定蛋白质浓度。然后用5 mM二硫苏糖醇在56℃下还原样品30 min,加入碘乙酰胺使最终浓度为11 mM,在室温下黑暗中孵育15 min。最后将尿素浓度稀释至2 m以下,第一次消化以胰酶与蛋白质质量比1:50过夜,第二次消化以胰酶与蛋白质质量比1:100持续4 h,使消化更加充分。gydF4y2Ba
n -糖基化的TMT标记和PTM富集gydF4y2Ba
每个样品初始量为200 μg。消化肽采用Strata X C18固相萃取柱(Phenomenex)脱盐,真空干燥。然后,肽在0.5 M TEAB缓冲液中重组,并根据制造商的协议使用TMT试剂盒进行标记。简单地说,将肽与乙腈重组的TMT在室温下孵育2小时,然后混合,脱盐和干燥。将多肽溶解在含有80%乙腈/1%三氟乙酸的40 μ l富集缓冲液中。然后将上清液转移到亲水(HILIC, Click maltose)微柱中。在4000度离心后gydF4y2BaggydF4y2Ba清洗HILIC微柱3次,清洗15 min。随后,糖肽用10%乙腈洗脱,并收集洗脱液。样品真空冷冻干燥后,溶解于50 μl重氧水中溶解的50mm碳酸氢铵缓冲液中。最后加入PNGase F 2 μl(1000单位),37℃消化过夜。对于LC-MS /MS分析,根据制造商的说明,用C18 ZipTips (Millipore)对所得肽进行脱盐。gydF4y2Ba
HPLC分馏和LC-MS /MS分析gydF4y2Ba
采用Agilent 300Extend C18反相高效液相色谱法(5 μm颗粒,4.6 mm ID, 250 mm长),高pH条件下对tryptic肽进行分离。首先,用8-32%乙腈(pH = 9.0)梯度分离多肽60分钟以上,分离成60个馏分。然后,将多肽组合成18个组分,并通过真空离心干燥。上述所有过程、LC-MS /MS及后续生物信息学分析均在中国杭州晶街PTM生物实验室进行。将多肽溶解于0.1%甲酸(溶剂A)中,直接装入反相分析柱(75 μm i.d, 25 cm长)。梯度由溶剂B(0.1%甲酸在90%乙腈中)在40分钟内从5%逐渐增加到20%,在12分钟内从20%增加到35%,在4分钟内上升到80%,然后在最后4分钟保持在80%。以上都是在700 nl/min的恒流量下在易- nlc 1000 UPLC系统上运行。多肽被提交到NSI源,并在Orbitrap Fusion (Thermo)中通过串联质谱(MS/MS)进行分析。m/z扫描范围为350-1550进行全扫描,使用Orbitrap以60,000的分辨率检测完整的多肽。然后选择多肽,在NCE设置为35的情况下进行MS/MS分析,使用Orbitrap以30,000的分辨率检测片段。自动增益控制(AGC)设置为5E4。 Fixed first mass was set as 100 m/z.
数据库搜索gydF4y2Ba
使用Maxquant搜索引擎(v1.5.2.8)检索质谱仪数据。参数设置如下。数据库为SwissProt Human(20130条序列),加入反向诱饵数据库,计算随机匹配导致的假阳性率(false positive rate, FDR)。使用一个常见的污染数据库来消除污染蛋白的影响。胰蛋白酶/P是允许多达2个缺失裂解的特定酶。最小所需肽段长度设置为7个氨基酸,肽段最大修饰数设置为5个。在第一次搜索中,前体离子的质量耐受性设置为20ppm。在主要搜索中,前体离子的质量耐受性设置为4.5 ppm。二次片段离子的质量容差设置为0.02 Da。Cys上的甲酰胺甲基被指定为固定修饰。 The variable modification was defined as oxidation on Met, deamidation 18O (N), deamidation (NQ), and acetylation of the N-terminal of the protein. The quantitative method was set to TMT-10plex. FDR of proteins and PSM identification was adjusted to 1% and minimum score for modified peptides was set > 40.
基因本体(GO)和KEGG通路注释gydF4y2Ba
蛋白质的基因本体(GO)注释来自UniProt-GOA数据库(gydF4y2Bahttp://www.ebi.ac.uk/GOA/gydF4y2Ba).系统首先将蛋白质ID转换为UniProt ID,然后利用UniProt ID匹配GO ID,并根据GO ID从UniProt- goa数据库中提取相应信息。如果UniProt-GOA数据库中没有相应的蛋白质信息,则使用基于蛋白质序列的InterProScan软件对蛋白质的GO功能进行标注。然后根据细胞成分、生物过程和分子功能对蛋白质进行分类。利用京都基因与基因组百科(KEGG)数据库对蛋白质信号通路进行了注释。首先,我们使用KEGG在线服务工具KAAS对KEGG数据库蛋白质描述进行标注。然后使用KEGG制图器、KEGG在线服务工具将标注结果映射到KEGG路径数据库中。Wolfpsort是PSORT/PSORT II的更新版本,用于预测亚细胞定位。gydF4y2Ba
主题分析gydF4y2Ba
应用软件MoMo (motif-x算法)分析n -糖基化位点的motif特征。其中,分析了所有n -糖基化位点上下游10个氨基酸的肽序列。所有数据库蛋白序列均作为后台数据库参数。当某一特定序列的肽段数大于20个,且p值小于0.00000 1时,认为该特征序列为修饰肽基序。计算方法为:(识别出某基序的肽数/识别出Ng的肽数)/(数据库中识别出该基序的肽数/数据库中出现Ng的理论肽数)gydF4y2Ba
UEA-I凝集素亲和层析gydF4y2Ba
在液氮中充分研磨足够的组织样本。将蛋白裂解液(Beyotime, #P0013)和蛋白酶抑制剂添加到样品中。样品在冰上孵育1 h, 4℃离心20 min。上清液为总蛋白溶液,采用BCA法测定蛋白浓度。取50µg总蛋白作为输入,将2000µg总蛋白与100µl生物素化UEA-I凝集素混合。接下来,用含有1mm CaCl2, MgCl2和MnCl2的磷酸盐缓冲盐水(PBS)将混合物固定到1ml。在旋转摇床上4℃孵育过夜后,将50 μ l琼脂糖链霉霉素珠(Vector laboratories, #SA-5010)加入到混合物中,继续孵育4小时。离心后用PBST (PBS与0.05% twein -20混合)洗涤5次,加入蛋白负载,100℃煮沸5分钟,然后进行western blotting。gydF4y2Ba
免疫印迹gydF4y2Ba
所有蛋白质样品经8% SDS-PAGE电泳分离,转移到PVDF膜上。用5%脱脂牛奶阻断1小时后,用一抗在4℃下孵育过夜,再用二抗在室温下孵育2小时。使用的抗体如下:ITGB1 (1:10 00, Proteintech, #12594-1-AP), CD276 (1:10 00, Proteintech, #66481-1-lg), GAPDH (1:20 00, Proteintech, #60004-1-lg)。采用IRDye 800CW偶联山羊抗小鼠(或兔)IgGs,利用Odyssey红外成像系统进行蛋白检测。最后利用ImageJ软件(v1.52i)对信号进行数字化处理。gydF4y2Ba
Soft-clustering分析gydF4y2Ba
采用基于开源统计语言R(3.6.3版本)的Mfuzz包(2.36.0版本)进行软聚类分析。Mfuzz包提供的模糊c均值算法是目前应用最广泛的软聚类方法之一,该算法具有较强的噪声鲁棒性,可以避免对基因/蛋白质进行先验预过滤,从而避免了在数据分析中排除生物相关基因/蛋白质[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba].FCM聚类采用欧氏距离作为距离度量,需要两个主要参数(c =聚类数量,m =模糊化参数)。与k-means聚类不同,FCM聚类中每个元素都有一组隶属度系数,对应于在给定聚类中的存在程度。gydF4y2Ba
对于n -糖位点的定量信息,我们首先去除原始数据中含有缺失值的n -糖位点,以确保每个样本中的每个基因都能被量化。计算每对样本中n -糖基的定量比例,对每对样本的定量比例进行log2变换,然后对z-score进行归一化,使均值为零,标准差为1。归一化后的数据确保了n个时间模式相似的糖位点在欧几里得空间中是接近的[gydF4y2Ba22gydF4y2Ba].然后使用Mfuzz包对转换后的概要文件进行集群。在此分析中,导出了c和m的最佳值。最后采用参数c = 15, m = 1.48进行聚类。然后筛选出与LNM程度相关的类群,设置相应的隶属度系数,使这些类群中其余基因具有相似的变化趋势(隶属度≥0.30)。gydF4y2Ba
结果gydF4y2Ba
ESCC的研究设计和整体蛋白质组学分析gydF4y2Ba
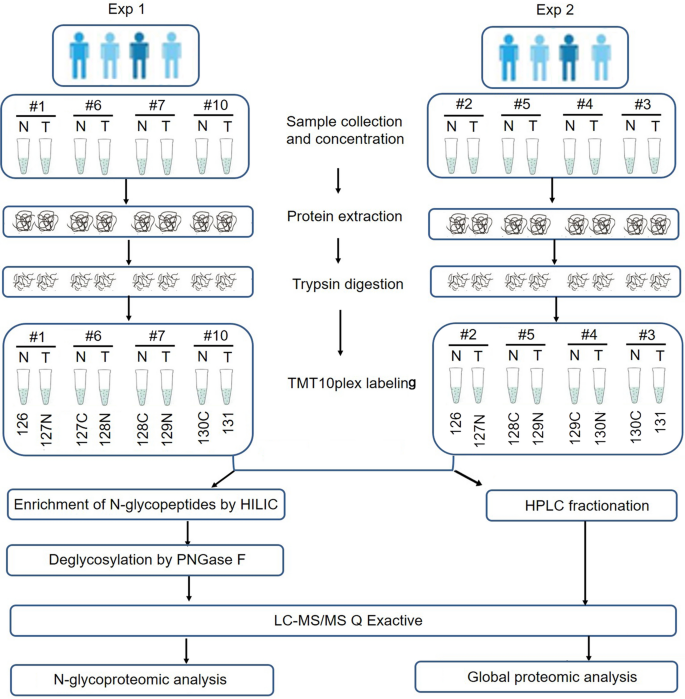
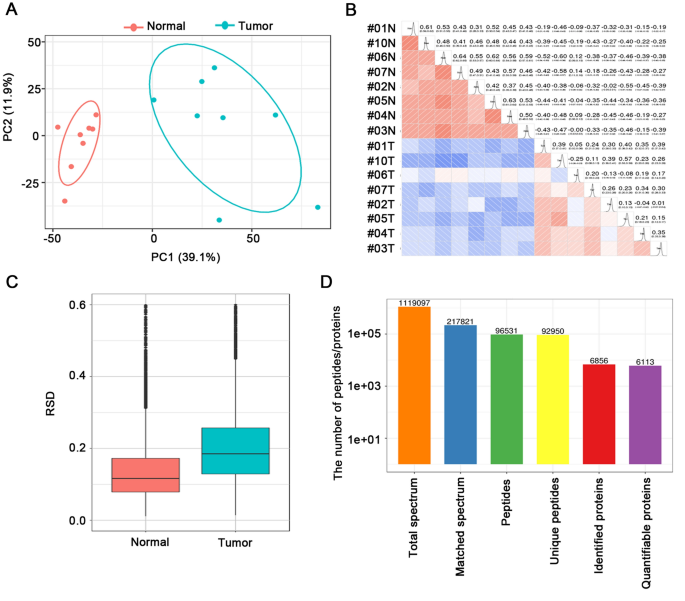
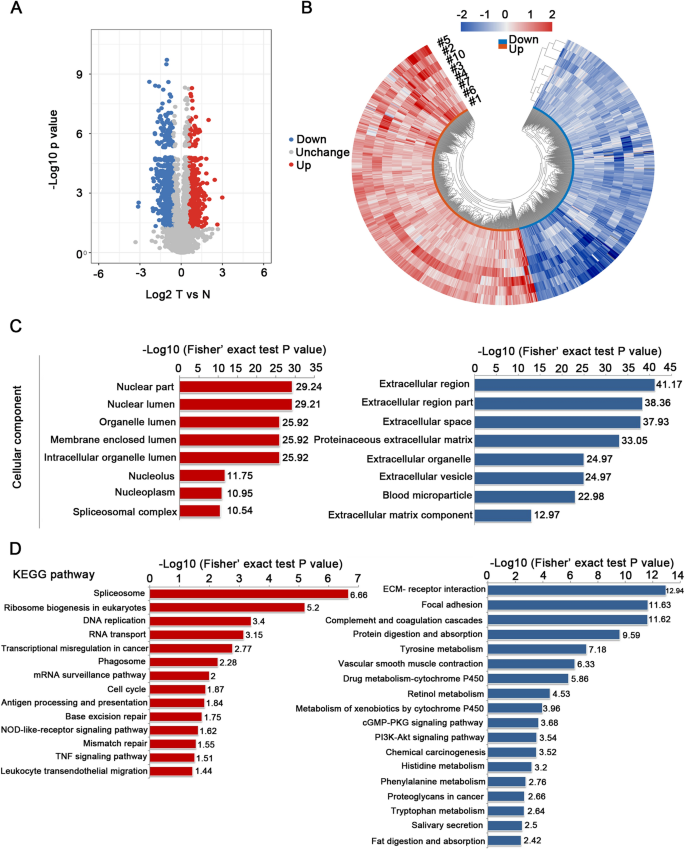
数字gydF4y2Ba1gydF4y2Ba显示了ESCC肿瘤和匹配正常组织的整体n -糖蛋白组学和蛋白质组学分析的工作流程。用来自同一患者的ESCC组织和配对的正常组织样本来反映不同个体的水平。来自8名患者的16个蛋白质样本被分配到两次TMT标记实验中,并用胰蛋白酶消化以进行进一步分析。在n -糖蛋白组学分析中,实际上测量了PNGase F处理后的去糖基化肽。这种去n -糖蛋白组学的目的是分析糖基化蛋白,而不关注糖基结构,相当于n -糖基化位点的定位。在附加文件中详细描述了分析样本的临床特征gydF4y2Ba1gydF4y2Ba:表S1。为了避免蛋白质样本量的变化导致糖蛋白的意外变化,我们首先使用基于TMT标记的定量蛋白质组学分析研究了8对肿瘤和正常组织的整体蛋白质组谱。主成分分析(PCA)和Pearson相关分析显示escc与正常食管组织有明显区别。gydF4y2Ba2gydF4y2BaA, B)。两组相对标准偏差(RSD)均小于20%,重复性理想(图。gydF4y2Ba2gydF4y2BaC).质谱基本统计分析中对应肽/蛋白的数量如图所示。gydF4y2Ba2gydF4y2BaD.这些质量控制过程的结果表明我们的蛋白质组学分析系统是稳健的。从所选样品中共鉴定出6856个蛋白,其中定量6113个蛋白。6113个蛋白定量比值的平均值为1.11,表明蛋白表达水平没有明显变化。以折叠变化值> 1.5和p值< 0.05为阈值,共有596个蛋白表达上调,495个蛋白表达下调(图。gydF4y2Ba3.gydF4y2BaA).所有这些数据都列在附加文件中gydF4y2Ba1gydF4y2Ba:表S2。图中描述了显著上调/下调的蛋白质。gydF4y2Ba3.gydF4y2BaB.从细胞组成来看,上调蛋白主要分布在染色体、核腔、剪接体复合体和胞内细胞器腔内,而下调蛋白主要分布在细胞外区域、细胞外基质和囊泡(图2)。gydF4y2Ba3.gydF4y2BaC).据此,基于kegg的富集分析显示,上调蛋白富集的主要途径包括剪接体、DNA复制、RNA转运、癌症转录错调、细胞周期、碱基切除修复和错配修复过程。相比之下,细胞通路中的蛋白质表达包括ecm受体、局部粘附、代谢(如蛋白质消化和吸收;酪氨酸、组氨酸、苯丙氨酸和色氨酸代谢;药物代谢-细胞色素P450)、相互作用和蛋白多糖过程降低(图;gydF4y2Ba3.gydF4y2BaD).根据蛋白质组学数据,通过相应的蛋白表达进行归一化,得到以下n -糖蛋白组位点映射数据。gydF4y2Ba
n -糖蛋白组的Motif分析gydF4y2Ba
糖基化是一种经典的转录后修饰(PTM),已被证实对调节细胞功能至关重要。虽然n -糖蛋白组在某些癌症类型中已被发现,但在ESCC中仍未报道。在本研究中,n -糖蛋白组的质量控制结果表明,我们优化的方法具有较高的可信度。大多数鉴定出的肽分布在8-20个氨基酸的大小,这与胰蛋白酶处理后的常见模式一致(图2)。gydF4y2Ba4gydF4y2BaA).大多数谱图的质量误差在5ppm以内,说明质谱仪的精度是可靠的,蛋白质的定性分析不会受到较大质量偏差的影响(图;gydF4y2Ba4gydF4y2BaB).通过主成分分析和Pearson相关分析,LC-MS /MS的结果具有可靠的重现性和准确性(图。gydF4y2Ba4gydF4y2BaC, D)。总的来说,n -糖蛋白组数据质量控制表明分析系统具有鲁棒性。gydF4y2Ba
为了描述可能的特定序列,我们进行了motif分析,以发现n -糖基化位点周围氨基酸类型过多或不足的可能性。鉴定出7个显著富集的基序。Motif logo按得分排序包括N-X-T, N-C-S, R-XXXXXX-N-X-S, N-A-S, R-N-X-S, N-X-S, N-G-X (X代表随机氨基酸残基;N、T、A、G、C、S、R分别代表天冬酰胺、苏氨酸、丙氨酸、甘氨酸、胱氨酸、丝氨酸、精氨酸。gydF4y2Ba4gydF4y2BaE).为了验证n-糖基化位点周围是否存在位置特异性氨基酸,我们使用motif模型评估了n-糖基化位点两侧序列的氨基酸频率(图。gydF4y2Ba4gydF4y2BaF).除了N-X-T/S的典型n -链糖肽序列外,我们发现+ 1和+ 3位点的半胱氨酸残基、−1和+ 1位点的甘氨酸残基、−1、−2和−7位点的精氨酸残基和+ 1位点的丙氨酸残基均有过量表达。有趣的是,尽管N-X-C和N-X-V已被发现是非典型的n -糖基化序列[gydF4y2Ba23gydF4y2Ba],胱氨酸和缬氨酸在n -糖基化位点的+ 3位置被耗尽。这些motif的评分、相对频率等详细信息在附加文件中进行了说明gydF4y2Ba1gydF4y2Ba:表S3。gydF4y2Ba
n -糖蛋白的特征:鉴定与定量分析gydF4y2Ba
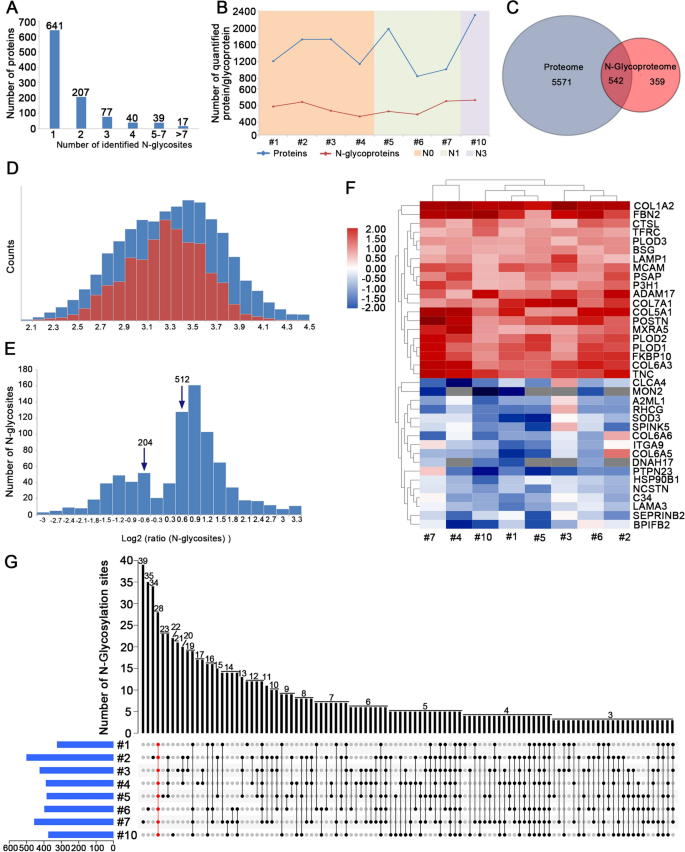
平均在1021个糖蛋白中共鉴定出1839个n -糖基化位点,其中901个糖蛋白中1588个位点是定量的。数字gydF4y2Ba5gydF4y2BaA显示了每个糖蛋白中识别的n -糖基化位点的数量分布。在所有鉴定的糖蛋白中,约62.8%(641/1021)只含有一个n -糖基化位点,20.3%(207/1021)含有两个n -糖基化位点,5.5%(56/ 1021)含有四个以上n -糖基化位点。值得注意的是,有6种糖蛋白有9个以上的n-糖基化位点,分别是LDL受体相关蛋白1(23个位点)、层粘连蛋白亚基α -2(14个位点)、纤颤蛋白-1(13个位点)、层粘连蛋白亚基γ -1(12个位点)、腱蛋白C(10个位点)和层粘连蛋白亚基α - 5(10个位点)。gydF4y2Ba
ESCC与配对正常组织n -糖蛋白组学和蛋白质组学的比较分析。gydF4y2Ba一个gydF4y2Ba在n -糖蛋白组学分析中,每个蛋白质识别的n -糖基化位点的数量。gydF4y2BaBgydF4y2BaESCC不同阶段定量蛋白及n -糖蛋白的研究进展。gydF4y2BaCgydF4y2Ba在蛋白质组学和n -糖蛋白组学中发现的蛋白质重叠。gydF4y2BaDgydF4y2Ba所有仅在n -糖蛋白组数据中识别的糖位点的强度分布(红色柱状)与蛋白组数据中也识别出相应蛋白的n个糖位点的强度分布(蓝色柱状)重叠。gydF4y2BaEgydF4y2Ba分析n -糖基的Log2比分布,大于0.584或小于- 0.584的值被认为是显著的。gydF4y2BaFgydF4y2Ba37种常见蛋白质的热图,在所有8个比较中表现出显著上调,在超过4个比较中表现出下调。颜色表示蛋白质的表达水平,其中红色表示高表达,蓝色表示低表达。gydF4y2BaGgydF4y2Ba在不同样品中鉴定出n -糖基化位点的数量gydF4y2Ba
为了探讨全球n -糖蛋白与蛋白质之间的关系和差异,我们比较了定量n -糖蛋白组学的位点定位和蛋白质组学的数据集。结果表明,ESCC的定量蛋白多于糖蛋白。此外,定量蛋白的数量没有变化趋势,而糖蛋白的数量随着淋巴结转移的进展而增加(图。gydF4y2Ba5gydF4y2BaB).图中重叠部分。gydF4y2Ba5gydF4y2BaC代表n -糖蛋白组和蛋白质组中都确定的蛋白质组。在我们的结果中,共鉴定出542个重叠蛋白。换句话说,在n -糖蛋白组位点定位分析中鉴定的糖化蛋白中,只有60.2%(542/901)也在蛋白质组分析中被发现。事实上,一些糖化蛋白,如表面受体和分泌蛋白,丰度相对较低,这使得在蛋白质组学分析中很难检测到它们。仅在n -糖蛋白组数据中识别的去糖苷蛋白的强度低于在全球蛋白质组数据中发现的相应蛋白的强度,这一结果支持了这一点(图2)。gydF4y2Ba5gydF4y2BaD)。gydF4y2Ba
在我们的n -糖蛋白组位点定位分析中,441个蛋白质中共鉴定了716个n -糖基化差异表达位点(截止位点变化为1.5倍,p值< 0.05)。我们发现326个糖蛋白中512个n-糖基化位点显著上调,115个糖蛋白中204个n-糖基化位点显著下调(图2)。gydF4y2Ba5gydF4y2BaE).众所周知,糖基化修饰的变化可能归因于总蛋白表达的变化。因此,我们主要关注在蛋白质组学和n -糖蛋白组学中都有定量信息的542个糖蛋白。gydF4y2Ba
我们评估了542种蛋白质中1107个n -糖蛋白位点的n -糖蛋白组比,并将其按相应的蛋白质量归一化。n -糖基化修饰的变化可能是由蛋白质丰度的变化引起的,因此n -糖基化修饰的变化与蛋白质比值之间存在显著的相关性(Pearson r = 0.84)。共鉴定出179个蛋白中264个n-糖基化差异表达位点,其中162个糖蛋白中243个n-糖基化位点显著上调,18个糖蛋白中21个n-糖基化位点显著下调。差异表达的糖蛋白和糖基化位点在附加文件中列出gydF4y2Ba1gydF4y2Ba:表S4。20种蛋白质的24个糖基化位点在所有样品中一致上调,17种蛋白质的19个糖基化位点在超过4个样品中一致下调(图2)。gydF4y2Ba5gydF4y2BaF).其中,胶原原-赖氨酸、2-氧戊二酸5-双加氧酶2 (PLOD2)、胶原α -3 (VI)链(COL6A3)、肽酰脯氨酸顺反异构酶(FKBP10)和腱素(TNC)在所有样品中均存在2个或2个以上的差异糖基化位点。在两个实验的个体中鉴定出的差异表达n -糖基化位点的数量如图所示。gydF4y2Ba5gydF4y2BaG。gydF4y2Ba
n -糖蛋白的特征:功能分析gydF4y2Ba
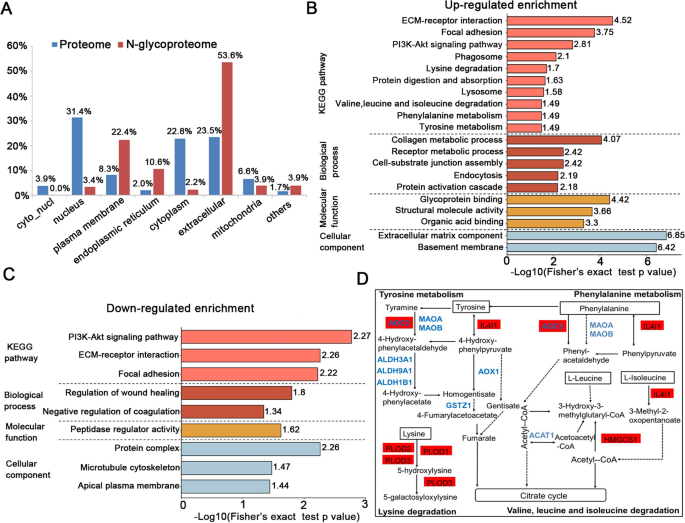
亚细胞定位分析显示,大部分差异表达的糖蛋白(折叠变化> 1.5,p值< 0.05)分布在细胞外区(53.6%)、质膜(22.4%)和内质网(10.6%)。然而,只有少数糖蛋白定位于细胞质(2.2%)和细胞核(3.4%)。这与糖蛋白的生物学功能高度一致,完全不同于蛋白质组学中的蛋白质定位(图。gydF4y2Ba6gydF4y2BaA).然后对差异表达的糖蛋白进行富集分析,以确定显著的基因本体术语和KEGG通路。大多数上调的糖蛋白富集在与细胞底物相关的代谢过程中,包括胶原代谢过程、受体代谢过程、蛋白激活级联。对于KEGG通路富集,一些已知的糖基化影响的癌症相关通路,包括ecm受体相互作用,局灶粘附,吞噬体和溶酶体富集在上调的糖蛋白中。有趣的是,ESCC中一些氨基酸代谢相关通路包括赖氨酸降解、酪氨酸代谢、苯丙氨酸代谢、缬氨酸、亮氨酸和异亮氨酸降解被糖基化,相应的糖蛋白显著上调(图)。gydF4y2Ba6gydF4y2BaB).在Procollagen-lysine, 2- oxglutarate 5-dioxygenase 2 (PLOD2)中鉴定出三个n-糖苷位点(N63, N209和N696),据报道,它们催化胶原样肽中赖氨酸残基的羟基化。其他与氨基酸代谢相关的上调糖蛋白包括原胶原-赖氨酸、2-氧戊二酸5-双加氧酶1和3 (PLOD1和PLOD3)、含铜胺氧化酶3 (AOC3)、白介素4诱导的1(IL4I1)、3-羟基-3-甲基戊二酸辅酶a合成酶1(HMGCS1)等。相反,这些在n-糖蛋白组位点定位中上调的通路在蛋白质组中被下调,表明这些通路在ESCC中实际上可以通过糖基化修饰进行调控。许多下调的术语与肽酶调节活性相关。KEGG通路分析显示,我们的结果中ecm受体相互作用、局灶粘附和PI3K-Akt信号通路呈负富集(图2)。gydF4y2Ba6gydF4y2BaC).除此之外,图中描述了一些氨基酸代谢相关途径中的差异糖基化蛋白。gydF4y2Ba6gydF4y2BaD。gydF4y2Ba
ESCC和配对正常组织之间糖蛋白显著改变的验证gydF4y2Ba
为了进一步鉴定ESCC中潜在的有前景的生物标志物,我们进一步验证了ESCC和配对正常组织之间的179个显著改变的糖蛋白。首先,97.7%的蛋白质(179个中的175个)已经在ESCC的其他蛋白质组学研究中被识别和验证。广泛的文献检索发现179种糖蛋白中有53种(29.6%)与ESCC直接相关。此外,文献综述和糖位点数据库搜索分别发现60个(33.5%)和174个(97.2%)糖蛋白(附加文件)gydF4y2Ba1gydF4y2Ba:表S5)。这些数据至少为重叠的糖蛋白可能作为ESCC标记提供了证据。gydF4y2Ba
此前,我们还系统地分析了两种ESCC细胞系的无标记定量蛋白质组和n -糖蛋白组。相应的方法和质量控制结果已在之前的研究中显示[gydF4y2Ba24gydF4y2Ba].蛋白定量归一化后,575个糖蛋白中共鉴定出1100个n -糖基化位点(附加文件)gydF4y2Ba1gydF4y2Ba:表S6)。我们将ESCC组织水平显著改变的糖蛋白与ESCC细胞水平鉴定的糖蛋白整合在一起。共有88个糖蛋白被鉴定为重叠的(附加文件gydF4y2Ba1gydF4y2Ba:表S5)。所鉴定的重叠蛋白可能确实是ESCC特异性的。gydF4y2Ba
此外,我们之前使用凝集素亲和层析和LC/MS/MS分析来阐明ESCC细胞系的糖基化模式。菜晶状体凝集素(LCA;甘露糖,葡萄糖,核心焦点结合)和ulex europaeus凝集素1 (UEA-I;焦点绑定)的应用[gydF4y2Ba24gydF4y2Ba].分别鉴定出707和956个糖蛋白(附加文件gydF4y2Ba1gydF4y2Ba:表S7及S8)。我们对本研究中显著改变的179个糖蛋白和之前研究中富集凝集素的糖蛋白进行了联合分析。共鉴定出21个和40个糖蛋白分别重叠(附加文件gydF4y2Ba1gydF4y2Ba:表S5)。这些数据可能有助于粗略估计ESCC的聚糖模式和候选生物标志物,以区分癌症患者和健康个体。gydF4y2Ba
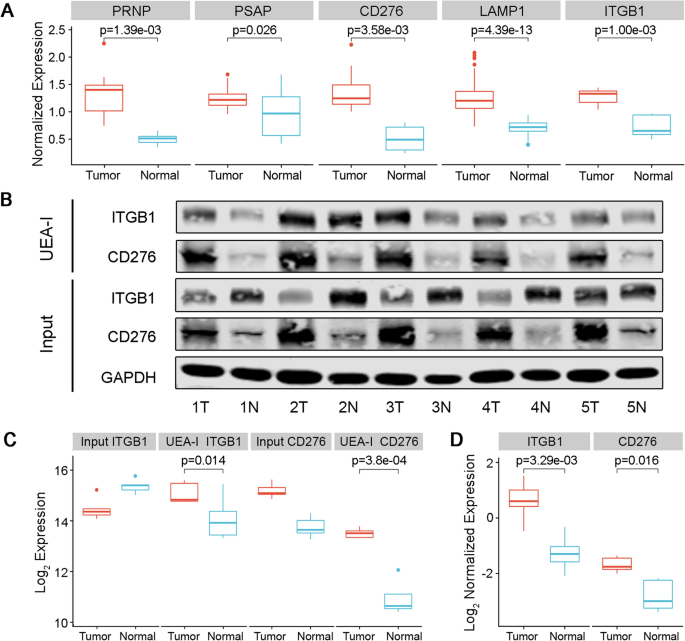
接下来,我们使用凝集素亲和富集和western blot进一步验证ESCC的生物标志物。我们在此阶段选择PRNP、PSAP、CD276、LAMP1、ITGB1,主要基于以下考虑:(1)在组织水平的n -糖蛋白组位点定位分析中,它们作为ESCC与配对正常组织之间表达显著改变的糖蛋白(经总蛋白定量归一化后,折变> 1.5,图;gydF4y2Ba7gydF4y2Ba一个);(2)在ESCC细胞水平通过n -糖蛋白组学和基于凝集素的质谱分析鉴定了糖蛋白;(3)所有糖蛋白均在糖位点数据库中鉴定;(4)通过SignalP程序预测其为分泌蛋白。该值预测在血流中远程检测蛋白质的可能性很大,并可能作为ESCC的生物标志物;(5)据我们所知,它们还没有作为ESCC的糖蛋白标记物进行测试。UEA-I凝集素富集后western blot显示ESCC中ITGB1和CD276的集中水平明显高于配对正常组织,而蛋白表达水平的变化低于集中水平(图2)。gydF4y2Ba7gydF4y2BaB, C)。ImageJ软件灰度分析也显示,归一化聚焦的ITGB1和CD276在肿瘤组织中的表达水平明显高于正常组织(图。gydF4y2Ba7gydF4y2BaD).验证结果表明,ITGB1和CD276集中表达的升高参与了ESCC的发生和发展,这可能是ESCC潜在的生物标志物。gydF4y2Ba
ESCC中糖蛋白显著改变的验证。gydF4y2Ba一个gydF4y2Ban -糖蛋白组中5个变化显著的糖蛋白(PRNP、PSAP、CD276、LAMP1、ITGB1)的归一化表达水平。gydF4y2BaBgydF4y2Ba对ESCC组织和配对正常组织样本进行UEA-I凝集素亲和层析,然后用ITGB1或CD276抗体进行western blot。输入:从组织中提取的总蛋白。UEA-I:聚焦的ITGB1/CD276被UEA-I凝集素亲和层析拉下。gydF4y2BaCgydF4y2Ba的灰度分析结果gydF4y2BaBgydF4y2Ba用log2转换。gydF4y2BaDgydF4y2Ba归一化聚焦的ITGB1和CD276糖蛋白表达水平的箱线图gydF4y2Ba
ESCC相关分期进展动态聚类分析gydF4y2Ba
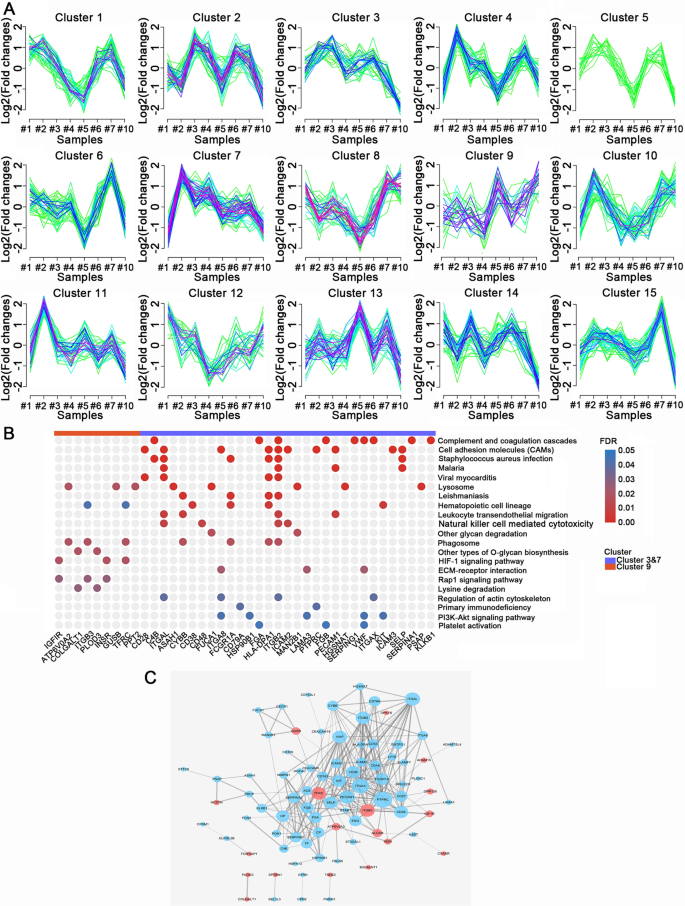
由于淋巴结状态是影响ESCC患者临床分期和生存的主要因素之一,因此我们对ESCC发展过程中糖蛋白表达的动态过程,特别是在淋巴结转移(LNM)过程中很感兴趣。为了研究动态变化的类型,我们根据糖蛋白数量进行了动态聚类分析。我们捕获了一系列糖蛋白簇,其折叠变化随着淋巴结转移的进展而增加或减少。gydF4y2Ba
我们进一步研究了癌症进展过程中糖蛋白失调的簇,在我们的数据中一共发现了15个簇。簇#3、#7和#9代表了一系列表达改变的糖蛋白(图2)。gydF4y2Ba8gydF4y2BaA).聚类#3和#7代表了一系列随着疾病发展,折叠变化趋于减少的糖蛋白,而#9是折叠变化增加的糖蛋白聚类。这些糖蛋白的富集途径和相互作用网络如图所示。gydF4y2Ba8gydF4y2BaB和C.簇#9的糖蛋白富集在HIF-1信号通路(INSR, IGF1R, TFRC), RAP1信号通路(INSR, IGF1R, ITGB3)和赖氨酸降解通路(PLOD3和COLGALT1)中,表明这些通路可能在ESCC的LNM过程中发挥重要作用。此外,聚类#3和#7的糖蛋白在细胞粘附分子(CAMs)、补体和凝血级联以及白细胞跨内皮细胞迁移中富集。CAMs糖基化水平降低可促进肿瘤细胞与原发肿瘤分离,促进肿瘤转移。对于白细胞迁移和补体系统来说,低糖基化水平可能会影响它们对癌细胞的免疫监视和清除能力。gydF4y2Ba
讨论gydF4y2Ba
众所周知,异常蛋白糖基化与癌症的发生和发展有关,包括细胞转化、侵袭和转移[gydF4y2Ba25gydF4y2Ba].聚糖通常附着在细胞膜上或细胞外基质中的蛋白质上。n-链糖基化是在Asn-X- ser /Thr氨基酸序列中的天冬酰胺(Asn)残基上添加一个低聚糖链(X不应该是脯氨酸)。o键糖基化是糖链转移到丝氨酸(Ser)、羟基(Tyr)或苏氨酸(Thr)残基的氧原子上[gydF4y2Ba26gydF4y2Ba].虽然一些糖蛋白已被确定为各种癌症类型的潜在生物标志物,但有关ESCC的研究和生物标志物很少。本研究鉴定了ESCC中一系列差异表达的糖蛋白,这些糖蛋白可能作为ESCC的潜在生物标志物。gydF4y2Ba
本研究的亮点之一是将n -糖蛋白组数据通过相应的蛋白质组数据归一化。不同于我们之前更大队列的蛋白质组学研究[gydF4y2Ba27gydF4y2Ba],本研究将TMT标记技术应用于一对一配对样本,以排除n -糖基化修饰的变化是由同一ESCC患者的蛋白质丰度变化引起的可能性。当然,之前的一些蛋白质组学结果已经在这个较小的队列中得到了证实。例如,ESCC的主要特征是剪接体、DNA复制和细胞周期通路中的蛋白质组学水平升高。gydF4y2Ba
正如预期的那样,许多糖蛋白的变化伴随着相应的总蛋白水平的变化。经蛋白表达归一化后,共鉴定并定量了901个糖蛋白。所有鉴定的糖蛋白均主要位于亚细胞区室,与n -糖蛋白形成过程的分布特征一致。此外,参与ecm受体相互作用、局灶性粘附的糖蛋白(如层粘连蛋白、整合素和纤连蛋白家族)和溶酶体(如LAMP1、GNS、LGMN、MAN2B1)也得到富集,这与之前的报道一致[gydF4y2Ba19gydF4y2Ba,gydF4y2Ba28gydF4y2Ba].在我们之前的ESCC蛋白质组学研究中,这三种途径也显著富集[gydF4y2Ba27gydF4y2Ba],但同时相关蛋白表达显著降低,说明糖基化水平对其功能影响显著。有趣的是,参与氨基酸代谢的蛋白质既上调又富集。PLOD2, PLOD3和PLOD1属于赖氨酸羟化酶,催化胶原赖氨酸羟化,在我们的研究中都发现它们是上调的糖蛋白。尽管在结直肠癌中也观察到这些蛋白的糖基化增加[gydF4y2Ba29gydF4y2Ba],糖基化在癌变中的具体机制仍未阐明。HMGCS1和AOC3蛋白的糖基化在任何癌症类型中都没有报道。HMGCS1介导甲羟戊酸途径,酮发生[gydF4y2Ba30.gydF4y2Ba]并参与胆固醇的生物合成[gydF4y2Ba31gydF4y2Ba].AOC3催化伯胺转化为醛[gydF4y2Ba32gydF4y2Ba].AOC3蛋白的糖基化水平在Asn137上调,而总蛋白水平下调,说明AOC3 n-糖基化占用的整体增加对生物功能有重要影响。所有这些结果都支持了糖基化在细胞代谢和ESCC进展中的作用[gydF4y2Ba33gydF4y2Ba].gydF4y2Ba
大多数具有多个糖基化位点的差异糖蛋白是层粘连蛋白、整合素、胶原蛋白和纤维连接蛋白相关蛋白。整合素β -1 (Integrin β -1, ITGB1)是整合素家族的一员,已被证明在多种癌症的细胞粘附、迁移和侵袭中起着至关重要的作用[gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba],而其糖基化修饰对肿瘤的影响尚未见报道。有趣的是,我们发现ITGB1蛋白在ESCC肿瘤组织中的表达水平明显低于正常组织,这与之前报道的ESCC蛋白质组学数据一致[gydF4y2Ba27gydF4y2Ba],而ITGB1集中水平则恰恰相反。在我们的研究中,聚焦CD276的表达水平与ITGB1相似。CD276是一种属于免疫球蛋白超家族的高度糖基化蛋白,参与肿瘤细胞增殖、迁移、侵袭和血管生成,甚至在调节免疫反应中发挥双重作用[gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba].CD276的异常集中化在三阴性乳腺癌(TNBC)和口腔鳞状细胞癌中已被报道,并可抑制TNBC中的免疫反应[gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba].我们的研究预示着ITGB1和CD276的异常聚集将成为ESCC新的前瞻性诊断和治疗特征。但其影响ESCC发生发展的具体分子机制仍有待进一步研究。gydF4y2Ba
在其他已鉴定的糖蛋白中,溶酶体相关膜糖蛋白1 (LAMP1)已被报道通过在癌细胞质膜上的异常定位而成为癌症进展的促侵袭因子[gydF4y2Ba41gydF4y2Ba].这可能是溶酶体融合和细胞外相互作用形成的膜修复机制[gydF4y2Ba42gydF4y2Ba].另一方面,LAMP1在质膜上的定位通过唾液酸- lex残基提供了与e -选择素的结合能力,从而促进癌细胞粘附在细胞外基质上[gydF4y2Ba43gydF4y2Ba].过表达的LAMP1还可以通过增加溶酶体胞吐和溶酶体大小来影响溶酶体膜内的癌症发展[gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba].在本研究中,LAMP1的n -糖基化水平上调,但蛋白表达水平未发生变化。这表明糖基化修饰而非表达改变可能参与ESCC的发展。LAMP1的糖基化是否影响ESCC的定位,以及LAMP1的6个差异糖基化位点(Asn84, 103, 261, 76, 62, 249)在ESCC中的作用,还有待进一步研究。转铁蛋白受体是一种膜糖蛋白,通过与转铁蛋白结合来导入铁。TFRC在各种肿瘤组织中均有中至强的细胞质表达。表达水平与肿瘤分期一致[gydF4y2Ba46gydF4y2Ba].TFRC下调可降低人和小鼠乳腺腺癌细胞内总铁含量,抑制肿瘤生长和转移[gydF4y2Ba46gydF4y2Ba].基质重塑相关5 (MXRA5)是一种新的细胞外蛋白,在几种类型的癌症中也被上调[gydF4y2Ba47gydF4y2Ba].MXRA5在非小细胞肺癌中频繁突变,MXRA5的高表达与肿瘤进展相关[gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba].然而,没有报道阐明该蛋白的n -糖基化修饰在任何癌症类型中的作用。gydF4y2Ba
通过动态分析鉴定了15个在淋巴转移(LNM)过程中发生折叠改变的糖蛋白簇。随着LNM状态升高的糖蛋白富集在HIF-1信号通路、RAP1信号通路和赖氨酸降解通路。HIF-1信号通路是与肿瘤生长、血管生成、转移和死亡率相关的经典致癌途径。近期研究表明HIF-1信号通路通过诱导乳腺癌血小板衍生生长因子B (PDGF-B)参与淋巴浸润[gydF4y2Ba50gydF4y2Ba],血管内皮生长因子C (VEGF-C) [gydF4y2Ba51gydF4y2Ba]和SP1在ESCC [gydF4y2Ba52gydF4y2Ba].INSR和IGF1R属于胰岛素/IGF系统,已知胰岛素/IGF系统影响癌细胞的恶性行为,受糖聚糖调控[gydF4y2Ba53gydF4y2Ba].癌症中INSR/IGF1R升高与LNM相关[gydF4y2Ba54gydF4y2Ba].抑制n -连锁糖基化会损害受体(INSR和IGF1R)的糖基化,并降低它们在细胞表面的丰度[gydF4y2Ba55gydF4y2Ba].ITGB3作为一种重要的细胞黏附分子,已被报道在几种癌症中与LNM相关[gydF4y2Ba56gydF4y2Ba].细胞附着ECM需要n -糖基化[gydF4y2Ba57gydF4y2Ba].RAP1通路也是细胞黏附和连接、细胞迁移和极化的重要调节因子[gydF4y2Ba58gydF4y2Ba].据报道,RAP1在ESCC中表达与LNM相关,其下调可通过AKT信号通路降低ESCC细胞的迁移和侵袭能力[gydF4y2Ba59gydF4y2Ba].赖氨酸降解途径在癌症中的作用很少报道。在结直肠癌中,已知血栓生成素(TPO)通过激活赖氨酸降解,促进CD110+肿瘤起始细胞(TICs)的自我更新和转移到肝脏[gydF4y2Ba60gydF4y2Ba].在这里,我们发现两个参与赖氨酸降解的基因PLOD3和COLGALT1参与胶原糖基化。PLOD3在某些类型的癌症中上调,并促进肿瘤恶性进展[gydF4y2Ba61gydF4y2Ba,gydF4y2Ba62gydF4y2Ba,gydF4y2Ba63gydF4y2Ba,gydF4y2Ba64gydF4y2Ba,gydF4y2Ba65gydF4y2Ba].据报道,ICOLGALT2在转移性卵巢癌中也过表达,并与PLOD3相互作用[gydF4y2Ba66gydF4y2Ba].gydF4y2Ba
本研究在一定程度上填补了ESCC糖蛋白组学研究领域的空白。然而,本研究中发现的异常糖基化修饰和糖蛋白生物标志物如何影响ESCC的发生发展,还有待进一步探讨。gydF4y2Ba
结论gydF4y2Ba
我们的研究揭示了ESCC中一系列差异表达的糖蛋白和信号通路。几种转移相关的糖蛋白和信号通路也被鉴定出来。本研究结果可能为ESCC患者的诊断和治疗提供一些潜在的生物标志物和治疗靶点。gydF4y2Ba
缩写gydF4y2Ba
- ESCC:gydF4y2Ba
-
食管鳞状细胞癌gydF4y2Ba
- 鳞状细胞癌:gydF4y2Ba
-
鳞状细胞癌gydF4y2Ba
- 东航:gydF4y2Ba
-
癌胚抗原gydF4y2Ba
- CYFRA21-1:gydF4y2Ba
-
Cytokeratin-19-fragmentgydF4y2Ba
- Fut-Hpt:gydF4y2Ba
-
focusylated触珠蛋白gydF4y2Ba
- 女士/小姐:gydF4y2Ba
-
串联质谱法gydF4y2Ba
- 自动增益控制:gydF4y2Ba
-
自动增益控制gydF4y2Ba
- 罗斯福:gydF4y2Ba
-
假阳性率gydF4y2Ba
- 走:gydF4y2Ba
-
基因本体论gydF4y2Ba
- KEGG:gydF4y2Ba
-
京都基因与基因组百科全书gydF4y2Ba
- FCM:gydF4y2Ba
-
模糊c均值算法gydF4y2Ba
- 铝:gydF4y2Ba
-
转录后修饰gydF4y2Ba
- PLOD2:gydF4y2Ba
-
原胶原-赖氨酸,2-氧戊二酸5-双加氧酶gydF4y2Ba
- COL6A3:gydF4y2Ba
-
胶原α -3(VI)链gydF4y2Ba
- FKBP10:gydF4y2Ba
-
肽酰脯氨酸顺反异构酶gydF4y2Ba
- 过渡委员会:gydF4y2Ba
-
TenascingydF4y2Ba
- PLOD1:gydF4y2Ba
-
原胶原-赖氨酸,2-氧戊二酸5-双加氧酶gydF4y2Ba
- PLOD3:gydF4y2Ba
-
前胶原-赖氨酸,2-氧戊二酸5-双加氧酶gydF4y2Ba
- ACO3:gydF4y2Ba
-
含铜的胺氧化酶3gydF4y2Ba
- IL4I1:gydF4y2Ba
-
白细胞介素4诱导1gydF4y2Ba
- HMGCS1:gydF4y2Ba
-
3-羟基-3-甲基戊二酰辅酶a合成酶1gydF4y2Ba
- LCA:gydF4y2Ba
-
菜晶状体凝集素gydF4y2Ba
- UEA-I:gydF4y2Ba
-
欧豆凝集素gydF4y2Ba
- ITGB1:gydF4y2Ba
-
整合素beta 1gydF4y2Ba
- 小鼠:gydF4y2Ba
-
小鼠分子gydF4y2Ba
- LNM:gydF4y2Ba
-
淋巴结转移gydF4y2Ba
- 摄像头:gydF4y2Ba
-
细胞粘附分子gydF4y2Ba
- MXRA5:gydF4y2Ba
-
基质重塑相关5gydF4y2Ba
- LAMP1:gydF4y2Ba
-
溶酶体相关膜糖蛋白1gydF4y2Ba
- TFRC:gydF4y2Ba
-
转铁蛋白受体蛋白1gydF4y2Ba
- PDGF-B:gydF4y2Ba
-
血小板衍生生长因子BgydF4y2Ba
- VEGF-C:gydF4y2Ba
-
血管内皮生长因子CgydF4y2Ba
- 抽搐:gydF4y2Ba
-
肿瘤起始细胞(TICs)gydF4y2Ba
参考文献gydF4y2Ba
陈伟,郑睿,Baade PD,张晟,曾华,Bray F, Jemal A,余晓青,何杰。2015年中国癌症统计。中华癌症杂志。2016;66:115-32。gydF4y2Ba
郑旭,邢松,刘小明,刘伟,刘东,迟德鹏,陈辉,戴淑琪,钟琴,曾明梅,刘伟林。血清YKL-40联合SCCA诊断食管鳞状细胞癌的探讨BMC Cancer. 2014;14:490。gydF4y2Ba
法特希·哈萨纳巴德A,切哈德R,面包纳D, Raphael J.食管癌的靶向治疗。Cell Oncol (Dordr)。2020; 43:195 - 209。gydF4y2Ba
Peixoto A, Relvas-Santos M, Azevedo R, Santos LL, Ferreira JA。蛋白质糖基化和肿瘤微环境改变导致癌症特征。Front Oncol. 2019;9:380。gydF4y2Ba
大坪K,马丁JD。健康和疾病的细胞机制中的糖基化。细胞。2006;126:855 - 67。gydF4y2Ba
曹玲,黄超,崔周东,胡勇,Lih T, Savage S, Krug K, Clark D, Schnaubelt M,陈林,等。胰腺导管腺癌的蛋白质基因组学特征。细胞。2021;184:5031 e5026——5052.。gydF4y2Ba
董敏,李涛,Höti N,陈s, Ponce S, Partin A,张慧。利用尿糖蛋白检测侵袭性前列腺癌平行反应监测方法的建立。蛋白质组学杂志,2021;20:3590-9。gydF4y2Ba
Kyselova Z, Mechref Y, Kang P, Goetz J, Dobrolecki L, Sledge G, Schnaper L, Hickey R, Malkas L, Novotny M.血清聚糖谱定量检测乳腺癌诊断与预后临床化学。2008;54:1166-75。gydF4y2Ba
李勇,文涛,朱敏,李玲,魏健,吴霞,郭明,刘松,赵辉,夏松,等。应用凝集素微阵列和nanoLC-MS/MS分析结肠癌患者组织的糖蛋白组学。摩尔BioSyst。2013; 9:1877 - 87。gydF4y2Ba
Takeda Y, Shinzaki S, Okudo K, Moriwaki K, Murata K, Miyoshi E.聚焦珠蛋白是一种与结直肠癌手术后预后相关的新型癌症生物标志物。癌症。2012;118:3036-43。gydF4y2Ba
吴娟,谢霞,刘艳,何娟,Benitez R, Buckanovich R, Lubman D.应用凝集素阵列和LC-MS/MS鉴定卵巢癌患者血清中差异表达的集中糖蛋白。蛋白质组学杂志,2012;gydF4y2Ba
Fujihira H, Takakura D, Matsuda A, Abe M, Miyazaki M, Nakagawa T, Kajino K, dda - nagai K, Noji M, Hino O, iriura T. Asn388上的bisectin - glcnac是上皮样间皮瘤细胞上表达的ERC/间皮素的特发性。生物化学学报。2021;17:317 - 26。gydF4y2Ba
沈玲,夏敏,邓霞,柯青,张超,彭峰,董霞,罗哲。一种基于凝集素的糖聚糖方法确定FUT8在食管癌中是放射耐药的驱动因素。Cell Oncol, 2020; 43:695-707。gydF4y2Ba
癌症中的糖基化标记物。临床化学杂志2019;89:189-213。gydF4y2Ba
糖科学在胰腺癌早期诊断中的应用。癌症科学2016;107:1357-62。gydF4y2Ba
Burvenich IJ, Lee FT, O 'Keefe GJ, Makris D,曹d, Gong S, Rigopoulos A, Allan LC, Brechbiel MW,刘智,等。改进治疗比的工程抗lewis - y hu3S193抗体用于上皮性癌症的放射免疫治疗。EJNMMI Res. 2016;6:26。gydF4y2Ba
Peixoto A, Ferreira D, Azevedo R, Freitas R, Fernandes E, Relvas-Santos M, Gaiteiro C, Soares J, Cotton S, Teixeira B,等。糖蛋白组学鉴定HOMER3是膀胱癌中由缺氧和葡萄糖剥夺引发的潜在靶向生物标志物。临床癌症杂志2021;40:191。gydF4y2Ba
潘杰,胡勇,孙松,陈琳,Schnaubelt M, Clark D,敖明,张震,陈东,钱娟,张慧。基于糖蛋白组学的高级别浆液性卵巢癌肿瘤分型特征及临床预后预测。Nat Commun. 2020;11:6139。gydF4y2Ba
Raghunathan R, Sethi MK, Klein JA, Zaia J.母体分子的蛋白质组学,糖组学和糖蛋白组学。《Mol细胞蛋白质组学》2019;18:2138-48。gydF4y2Ba
王志强,王志强,王志强,等。基因表达时间过程数据的噪声鲁棒软聚类。中国生物医学工程学报。2005;3:965-88。gydF4y2Ba
Kumar L, Futschik ME。Mfuzz:微阵列数据软聚类的软件包。信息学手段。2007;2:5-7。gydF4y2Ba
宋勇,王杰,程志,高鹏,孙军,陈鑫,陈超,王勇,王铮。定量的全局蛋白质组和赖氨酸琥珀酰酶组分析为胃癌代谢调控和淋巴结转移提供了新的视角。科学代表2017;7:42053。gydF4y2Ba
孙珊,张慧。非典型n -糖基化位点的鉴定与验证。《肛肠化学》2015;87:11948-51。gydF4y2Ba
张玲,高原,张旭,郭明,杨健,崔华,孔鹏,牛鑫,毕勇,徐洁,等。TSTA3通过调节LAMP2和ERBB2的集中化促进食管鳞状细胞癌的进展。开展。2020;10:11339-58。gydF4y2Ba
糖基化定义恶性肿瘤:旧瓶装新酒。美国国家科学研究院。2002; 99:10231-3。gydF4y2Ba
杨松,胡勇,张慧。固相法同时定量N-和o -聚糖的研究。Nat protocol . 2017; 12:1229-44。gydF4y2Ba
李艳,杨波,马艳,彭霞,王铮,盛斌,魏震,崔艳,刘震。食管癌的磷酸化蛋白组学研究信号传输目标Ther. 2021;6:381。gydF4y2Ba
芒克利J,米尔斯IG,埃利奥特DJ。糖在前列腺癌发生和发展中的作用。《中国日报》2016;13:324-33。gydF4y2Ba
Nicastri A, Gaspari M, Sacco R, Elia L, Gabriele C, Romano R, Rizzuto A, Cuda G. n -糖蛋白分析发现结直肠癌组织中新的上调糖蛋白。中国生物工程学报(自然科学版)2014;gydF4y2Ba
Talman V, Teppo J, Poho P, Movahedi P, Vaikkinen A, Karhu ST, Trost K, Suvitaival T, Heikkonen J, Pahikkala T,等。出生后小鼠心脏发育的分子图谱。J Am心脏协会。2018;7:e010378。gydF4y2Ba
刘珊珊,景峰,余春,高玲,秦艳,赵娟。aicar诱导AMPK激活对肝脏TSH/SREBP-2/HMGCR通路的抑制作用。PLoS ONE。2015; 10: e0124951。gydF4y2Ba
杨华,罗丽丽,王文杰,王文杰,王文杰,王文杰,王文杰,王文杰,王文杰,王文杰,王文杰,王文杰,王文杰,王文杰。铜依赖性氨基氧化酶3调控脂肪细胞代谢燃料的选择。公共科学图书馆。2018;16:e2006519。gydF4y2Ba
李志强,李志强。糖基化在癌症中的作用机制。癌症杂志。2015;15:540-55。gydF4y2Ba
谭晓霞,刘霞,于军,李淑娟,安勇,克莱顿。肺腺癌中胶原沉积和粘附过程的转录控制。JCI Insight, 2022年。gydF4y2Bahttps://doi.org/10.1172/jci.insight.153948gydF4y2Ba.gydF4y2Ba
Edwards L, Woolard K, Son M, Li A, Lee J, Ene C, Mantey S, Maric D, Song H, Belova G,等。脑和肿瘤来源的结缔组织生长因子对胶质瘤侵袭的影响。中华肿瘤学杂志,2011;23(3):344 - 344。gydF4y2Ba
周娟,林娟,Brenot A, Kim J, Provot S, Werb Z. GATA3通过调控microRNA-29b表达抑制肿瘤转移和调节微环境。中国生物医学工程学报。2013;15:01 - 13。gydF4y2Ba
张晓明,张晓明,张晓明。CD276靶向B7-H3在人类癌症免疫治疗中的作用。临床癌症决议2016;22:3425-31。gydF4y2Ba
杨松,魏伟,赵强。B7-H3分子作为肿瘤免疫治疗的靶点。中国生物医学工程学报(自然科学版)2020;gydF4y2Ba
黄燕,张宏,李志,杜涛,陈勇,王勇,倪红,张凯,麦杰,胡斌,等。fut8介导的B7H3的异常n -糖基化抑制三阴性乳腺癌的免疫反应Nat Commun. 2021;12:2672。gydF4y2Ba
陈娟,陈超,郭坤,肖敏,蒋超,徐涛,陈敏,黄晨。口腔癌中糖蛋白B7-H3过表达与异常糖基化的关系。美国国家科学研究院。2015; 112:13057 - 62。gydF4y2Ba
alessandriini F, Pezze L, ciribili Y. lamp:揭示癌症生物学。谢明·昂科尔,2017;44:39 - 53。gydF4y2Ba
Corrotte M, Castro-Gomes T, Koushik AB, Andrews NW。质膜损伤方法及溶酶体介导的修复反应评估。方法细胞生物学杂志,2015;126:139-58。gydF4y2Ba
阿加瓦尔,李志刚,李志刚,李志刚,李志刚。肿瘤细胞表面溶酶体相关膜蛋白-1 (LAMP1)及其碳水化合物在肺转移中的作用。中华肿瘤学杂志,2015;gydF4y2Ba
Gotink KJ, Rovithi M, de Haas RR, Honeywell RJ, Dekker H, Poel D, Azijli K, Peters GJ, Broxterman HJ, Verheul HM。对临床使用的酪氨酸激酶抑制剂舒尼替尼、索拉非尼和帕佐帕尼的交叉耐药性。中国生物医学工程学报。2015;39:119 - 29。gydF4y2Ba
Machado E, White-Gilbertson S, van de Vlekkert D, Janke L, Moshiach S, Campos Y, Finkelstein D, Gomero E, Mosca R, Qiu X,等。调节溶酶体胞吐介导癌症进展。科学通报2015;1:e1500603。gydF4y2Ba
高桥M, Shibutani M, Woo GH, Inoue K, Fujimoto H, Igarashi K, Kanno J, Hirose M, Nishikawa a .大鼠两期肝癌模型早期肿瘤促进过程特异性表达改变分子的细胞分布。致癌作用。2008;29:2218-26。gydF4y2Ba
罗宾斯JE,卡佩哈特AA。在鸟类发育过程中,躯干和肢体的基质重塑相关表达。中国生物医学杂志,2018;gydF4y2Ba
熊D,李,李K,徐问潘Z,丁F, Vedell P, P,崔P,华X, et al。外显子组测序发现MXRA5是中国非小细胞肺癌患者中频繁突变的一种新型癌症基因。致癌作用。2012;33:1797 - 805。gydF4y2Ba
何艳,陈晓霞,刘红,肖红,郭芳蓉,梅娟。基质重塑相关5作为一种新型组织生物标志物预测非小细胞肺癌不良预后。癌症生物标记。2015;15:645-51。gydF4y2Ba
Schito L, Rey S, Tafani M, Zhang H, Wong CC, Russo A, Russo MA, Semenza GL.低氧诱导因子1依赖表达的血小板衍生生长因子B促进低氧乳腺癌细胞的淋巴转移。美国国家科学研究院。2012; 109: e2707 - 2716。gydF4y2Ba
Katsuta M, Miyashita M, Makino H, Nomura T, Shinji S, Yamashita K, Tajiri T, Kudo M, Ishiwata T, Naito Z.缺氧诱导因子-1 α与血管内皮生长因子- c在人食管癌中淋巴转移的相关性中华药理学杂志,2005;29(2):344 - 344。gydF4y2Ba
胡欣,林杰,姜敏,何欣,王凯,王伟,胡超,沈震,何忠,林华,等。HIF-1alpha通过靶向SP1促进食管鳞癌的转移。中华癌症杂志。2020;11:29 - 40。gydF4y2Ba
De-Freitas-Junior JCM, Andrade-da-Costa J, Silva MC, Pinho SS.聚糖作为胰岛素/IGF系统的调节元件:对癌症进展的影响。中华分子化学杂志2017;。gydF4y2Bahttps://doi.org/10.3390/ijms18091921gydF4y2Ba.gydF4y2Ba
孙娟,陆震,邓勇,王伟,何强,闫伟,王安华。C-myc上调INSR/IGF1R通过NF-kappaB通路促进TSCC肿瘤发生和转移。生物化学学报,2018;1864:1873-82。gydF4y2Ba
赵萍,李文杰,赵鹏,李文杰,李文杰,李文杰,李文杰,李文杰,李文杰。选择性抑制n-链糖基化对受体酪氨酸激酶加工的影响。Dis模型机械。2019。gydF4y2Bahttps://doi.org/10.1242/dmm.039602gydF4y2Ba.gydF4y2Ba
Meves A, Nikolova E, Heim JB, Squirewell EJ, Cappel MA, Pittelkow MR, Otley CC, Behrendt N, Saunte DM, Lock-Andersen J,等。肿瘤细胞粘附是原发性皮肤黑色素瘤前哨淋巴结转移的危险因素。中华临床医学杂志,2015;33:2509 - 1515。gydF4y2Ba
辛格C, Shyanti RK,辛格V, Kale RK, Mishra jn,辛格RP。整合素表达和糖基化模式调节细胞-基质粘附并随乳腺癌进展而改变。生物化学与物理学报,2018;49:374 - 80。gydF4y2Ba
张丽玲,王荣荣,程凯,Ring BZ,苏玲。Rap1信号通路在肿瘤细胞迁移和侵袭中的作用。中国生物医学杂志,2017;14:90-9。gydF4y2Ba
李强,徐安,褚勇,陈涛,李华,姚玲,周鹏,徐敏。Rap1A通过AKT信号通路促进食管鳞癌转移。Oncol代表2019;42:1815-24。gydF4y2Ba
吴震,魏东,高伟,徐勇,胡震,马震,高成,朱霞,李强。tpo诱导的代谢重编程驱动结直肠癌CD110+肿瘤起始细胞肝转移。细胞干细胞。2015;17:47-59。gydF4y2Ba
谢东,李娟,魏珊珊,齐萍,季华,苏娟,杜楠,张旭。下调PLOD3通过降低TWIST1表达抑制肾癌恶性进展中国生物医学工程学报。2020;53:101608。gydF4y2Ba
王斌,徐磊,葛勇,蔡旭,李强,于珍,王杰,王勇,陆超,王东,等。PLOD3在胃癌中上调,并与临床病理特征相关。临床实验室。2019。gydF4y2Bahttps://doi.org/10.7754/Clin.Lab.2018.180541gydF4y2Ba.gydF4y2Ba
门敏JH Yun HS, Kwon GT,李J,金正日司法院,乔Y,曹JM,李CW,歌曲司法院,安J,等。抑制PLOD3通过调节PKC-delta信号通路对人肺癌细胞产生抗肿瘤作用。细胞死亡,2019;10:156。gydF4y2Ba
白志辉,尹海生,权高泰,金志勇,李长泉,宋志勇,严高德,姜春明,朴继科,金金杰,等。PLOD3通过调节STAT3促进肺转移。细胞死亡,2018;9:1138。gydF4y2Ba
蔡昌强,黄立龙,蔡文伟,黄明明,李俊涛,黄永元。PLOD3过表达促进胶质瘤肿瘤进展和不良预后。Oncotarget。2018;9:15705-20。gydF4y2Ba
郭涛,李波,康燕,顾超,方芳,陈霞,刘霞,陆刚,冯超,徐超。COLGALT2在卵巢癌中过表达并与PLOD3相互作用。临床翻译医学2021;11:e370。gydF4y2Ba
确认gydF4y2Ba
我们非常感谢京杰PTM生物实验室(杭州)进行的蛋白质组学和n -糖蛋白组学分析。我们非常感谢穆秀倩教授(美国纽约布法罗大学罗斯眼科研究所眼科系)的有益讨论。gydF4y2Ba
资金gydF4y2Ba
国家自然科学基金(U21A20372, 81773150, 82072746)、国家重点研发计划(2021YFC2501000)、山西省“1331工程”基金资助。中国山西省奖学金管理委员会(2021-082)和广东省自然科学基金(2020A1515010431)资助研究项目gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
CYP和ZL设计了这项研究。ZL、GYZ、CHY对数据进行整合分析。CYP、CXL和ZL获得资助。GYZ、SLY、DTY进行糖蛋白验证。SLY, DTY和YX准备数字。ZL和KPZ撰写了手稿。MYC和GYL在样品分选过程中提供了帮助。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
本研究按照《赫尔辛基宣言》进行,方案由山西医科大学伦理委员会批准(批准号2017LL037)。gydF4y2Ba
发表同意书gydF4y2Ba
不适用。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:表S1。gydF4y2Ba
ESCC患者队列的临床特征。gydF4y2Ba表S2。gydF4y2Ba蛋白质组学差异表达蛋白(折叠变化> 1.5,p值< 0.05)。gydF4y2Ba表S3。gydF4y2Ba主题标志和模型。gydF4y2Ba表S4。gydF4y2Ba归一化n -糖蛋白组中差异表达的糖蛋白和糖基化位点(折叠变化> 1.5,p值< 0.05)。gydF4y2Ba表S5。gydF4y2BaESCC中179个显著调控糖蛋白的细节。gydF4y2Ba表S6。gydF4y2BaESCC细胞系无标记的n -糖蛋白组研究。gydF4y2Ba表S7。gydF4y2BaLCA在ESCC细胞系中富集糖蛋白。gydF4y2Ba表S8。gydF4y2BaUEA-I在ESCC细胞系中富集糖蛋白。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本条所提供的资料,除非在资料的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
高勇,沈良,董涛,董涛。gydF4y2Baet al。gydF4y2Ban -糖蛋白组位点定位分析揭示食管癌中糖蛋白的改变。gydF4y2Ba翻译医学杂志gydF4y2Ba20.gydF4y2Ba285(2022)。https://doi.org/10.1186/s12967-022-03489-2gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12967-022-03489-2gydF4y2Ba
关键字gydF4y2Ba
- ESCCgydF4y2Ba
- 糖蛋白gydF4y2Ba
- N-glycosylationgydF4y2Ba
- N-glycoproteomicsgydF4y2Ba
- 淋巴结转移gydF4y2Ba