摘要
背景
肿瘤引流淋巴结(tumor- drain lymph nodes, TDLNs)是肿瘤的原发部位,其中的抗肿瘤淋巴细胞被激发到肿瘤特异性抗原,并在对抗肿瘤的免疫应答中发挥关键作用。虽然有报道使用TDLNs分离的淋巴细胞进行过养细胞治疗(ACT),但TDLNs中淋巴细胞对肿瘤细胞的免疫活性表征尚未全面进行。在这里,我们证明了tdln作为免疫治疗的细胞来源具有非常高的潜力。
方法
术中切除的tdln淋巴细胞与自体肿瘤细胞一起培养2周,用IFNγ ELISPOT法评价肿瘤反应性。我们研究了与肿瘤细胞共培养扩增的T细胞受体(TCR)克隆型与肿瘤浸润淋巴细胞(TILs)克隆型的共同性。
结果
我们发现TCR克隆型表达pd -1的CD8+当非转移性淋巴结与自体肿瘤细胞共培养时,可诱导原发肿瘤中与TILs共有的淋巴结中的T细胞以及与TILs共有的肿瘤反应性和TCR克隆型的淋巴细胞。
结论
我们的结果表明,肿瘤反应效应T细胞甚至存在于病理上未转移的淋巴结中,并且可以在自体肿瘤细胞存在的情况下在体外扩增,并可能应用于ACT。
背景
结直肠癌在世界范围内发病率很高,是日本女性癌症相关死亡的最常见原因[1].尽管所有结直肠癌患者的5年生存率约为70%,但在有远处转移的患者中,生存率急剧下降至20%左右。因此,迫切需要开发新的治疗方式来改善晚期结直肠癌患者的预后。目前,结直肠癌的治疗方案主要基于分期;早期结直肠癌患者通常在III期(或IIb期)接受手术后化疗,晚期患者在肿瘤可切除时接受手术,或在手术前接受化疗和放疗联合作为新辅助治疗[1,2].最近,免疫疗法,特别是免疫检查点抑制剂被确定为治疗方案之一,但其疗效仅限于一小部分CRC患者,这些患者的肿瘤具有与错配修复(MMR)基因缺陷相关的微卫星不稳定性(MSI) [3.,4].其他类型的免疫疗法包括癌症特异性疫苗(肽疫苗、树突状细胞疫苗等)和acts [5,6].已建立的联合疗法之一包括使用TILs, TILs可在体外被激活和扩展,随后可用于患者。TIL疗法已显示出对某些癌症类型的临床益处,特别是黑素瘤[7,8,9,10]及肾癌[11],但对其他类型的癌症并不那么有效[5,12].
另外,工程化的CAR(嵌合抗原受体)T细胞具有嵌合基因,由对抗细胞表面分子的抗体和T细胞信号域(嵌合抗原受体)获得的单链可变片段组成,如抗b细胞淋巴瘤或白血病的cd19抗体,已被临床证明非常有效。另一方面,在接受her2特异性或cea特异性CAR-T细胞治疗的患者中,报告了严重的副作用,这可能是由于靶向脱瘤效应,因为这些分子在正常细胞中表达水平较低[13,14,15].因此,应该开发一种覆盖更广泛患者群体的更安全有效的新方法。
在结直肠癌手术过程中,切除肿瘤组织及其含有肿瘤特异性T细胞的tdln。这些tdln是宿主抗肿瘤免疫反应的重要原发位点[16,17,18,19].此外,有报道称发生转移的tdln含有与原发肿瘤组织共享T细胞受体克隆型的淋巴细胞[20.].前哨淋巴结淋巴细胞的细胞治疗也有报道[21].tdln可能含有高水平的肿瘤反应性T细胞,tdln中的淋巴细胞可能比til消耗得少。因此,在本研究中,我们研究了利用非转移性淋巴结作为细胞来源获得肿瘤反应性T细胞的可能性。我们在此报道,非转移性淋巴结中的肿瘤反应性T细胞可以在体外扩增,并提出了一种新的过继细胞治疗方法。
材料与方法
病人
纳入接受手术治疗的结直肠癌患者。术前均取得书面知情同意书。肿瘤分期依据日本第八版大肠癌分类[1].从个别患者身上收集原发肿瘤的部分和多个淋巴结。该研究方案由日本癌症研究基金会癌症研究所医院机构审查委员会(2018-1021)批准。
患者源性肿瘤细胞系的建立
使用gentleMACS™Dissociator (Miltenyi Biotec)将肿瘤组织机械分离成小的肿瘤块,并用100 IU/ml胶原酶(Thermo Fisher Scientific)和50 ng/ml DNase I (Veritas)在37℃下处理60分钟。细胞球用含抗生素(1 ×青霉素链霉素(Wako))和0.5% BSA的PBS洗涤后,在CRC培养基的胶原包被板中培养。CRC培养基由StemPro hESC SFM培养基(Gibco)添加0.1 mM 2-巯基乙醇、10 μM Y-27632 (LC Laboratories)、8 ng/ml bEGF (Peprotech)和青霉素-链霉素-两性霉素B (Wako)组成。肿瘤细胞株在37℃、5% CO下培养2实验采用传代数小于10的肿瘤细胞系[22].
淋巴细胞从淋巴结分离培养
手术切除淋巴结,并将其一分为二。其中一半用于病理评价,另一半切成2 ~ 3 mm3.每片置于24孔板中2 ml淋巴细胞中高剂量重组人IL-2 (6000 IU/ml) (R&D Systems, Minneapolis, USA)。淋巴细胞培养基由rmi -1640 (Wako)/AIM V (Gibco)添加12.5 mM HEPES、2-巯基乙醇和5%人AB血清组成。单个片段在37℃、5% CO下培养22到3周。每2 - 3天更换一半培养基。当淋巴细胞超过1 × 10时6/ml或接近汇合,细胞分裂[9,23].
淋巴细胞免疫学评价
采用IFNγ (Mabtech)和Perforin (immunospot)的酶联免疫斑点(ELISPOT)检测试剂盒对肿瘤特异性T细胞进行评价。淋巴细胞(1 × 105/well)接种于96孔板中,与自体肿瘤细胞(1 × 105/well)或抗cd3抗体(1 μg/ml)(用于IFNγ ELISPOT试验)或PMA (50 ng/ml) /Ionomycin (1 μg/ml)(用于Perforin ELISPOT试验)。培养24小时后,按照标准方案建立测定方法。膜被风干,并用ImmunoSpot平板阅读器及其相关软件(Cellular Technologies Ltd.)对斑点进行评估。
淋巴细胞与肿瘤细胞的培养
共培养前1天,将淋巴细胞解冻,在含200 IU/ml IL-2的淋巴细胞培养基中37℃培养过夜。淋巴细胞培养基为rmi -1640 (Wako)/AIM V(Gibco),添加12.5 mM HEPES、2-巯基乙醇和5%人AB血清。用200iu /ml人重组IFNγ刺激肿瘤细胞过夜,以促进HLA表达。96孔u型底板涂5 μg/ml抗cd28(克隆CD28.2), 4℃过夜。次日用TrypLE (Gibco)将肿瘤细胞分离成单细胞,重悬于淋巴细胞培养基中。淋巴细胞以10的密度接种5细胞/孔(共1 × 106细胞),与肿瘤细胞以20:1的比例共培养(淋巴细胞:癌细胞)。在200 IU/ml IL-2和10 μg/ml抗pd -1抗体(克隆EH12.2H7, Biolegend)中共培养。一半的培养基每周更换两到三次。共培养1周后,收集淋巴细胞计数,以10的浓度重复培养5细胞/新鲜肿瘤细胞[24].
流式细胞分析
针对人TCRαβ (IP26)、CD3 (HIT3a)、CD4 (RPA-T4)、CD8α (RPA-T8)、CD19 (HIB19)、CD56 (HCD56)、PD-1(EH12.2H.7)、tim3 (F38-2E2)、CTLA4 (BNI3)、LAG3 (7H2C65)和HLA II类(Tü39)的荧光色素偶联单克隆抗体购自Biolegend。所有样品重悬于含0.5% BSA的PBS染色缓冲液中,用FcR阻断剂(Miltenyi Biotec)预孵育4℃,然后用各特异性单抗在4℃下洗涤染色20 min。数据在FACS verse (BD Biosciences)上收集,并使用FlowJo (Tree Star)软件进行分析。
转录组分析
使用TrueSeq RNA外显子组试剂盒(Illumina, San Diego, USA)制备文库,并使用Illumina NovaSeq 6000 SP Reagent kit v1.5(300个周期)在Nova Sex 6000上进行150个对端测序模块的测序。为了获得表达式配置文件,Subio平台程序。1.24 (Subio Inc., Amami,日本)。我们使用R包(edgeR和limma)分析rna测序数据,并使用edgeR包导入,然后使用voom方法、线性建模和经验贝叶斯校正的limma包评估差异表达,并使用GSEA进行基因集检测,统计截断如下:q值小于0.05;日志2折叠变化大于1 [25,26].
T细胞受体测序分析
采用前面描述的方法进行TCR测序[20.,27,28].简而言之,我们从2 × 10中提取了总rna5T细胞或肿瘤组织,cDNA用SMART文库构建试剂盒(Clontech)用5 ' -Race适配器从总RNA合成。使用SMART适配器的正向引物和对应于TCRα和TCRβ恒定区域的反向引物进行PCR扩增TCRα和TCRβ cdna。使用Nextra XT index kit (Illumina)将Illumina索引序列与条形码添加后,使用MiSeq Reagent v3 600-cycles kit (Illumina)在Illumina MiSeq平台上进行300 bp对端测序。利用Tcrip软件对获得的序列进行分析。
mRNA表达分析
根据制造商说明书(应用生物系统公司),在QuantStudio™5 Real-Time PCR系统上使用TaqMan基因表达测定对转录物进行定量。所用探针:TBX21;Hs00203436_m1 GATA3;Hs00231122_m1 ACTB;Hs01060665_g1。mRNA水平归一化至ACTB水平。使用QuantStudio Design and Analysis Software (Applied Biosystems)从扩增图中确定平均周期阈值(n = 2)。
肿瘤组织C215的基因组分析
采用AllPrep DNA/RNA Mini Kit (Qiagen)从乙状结肠和直肠肿瘤组织以及相应的邻近正常组织中提取基因组DNA (gnas)。将提取的DNA进行机械剪切(Covaris),使其平均片段大小为150 bp。随后,根据制造商的协议(Life Technologies),使用Ion AmpliSeq™综合癌症小组构建了综合基因组分析文库,输入40 ng DNA。Ion AmpliSeq™综合癌症小组由四个池中的16,000个引物对组成,覆盖409个癌症相关基因的所有外显子[29].BAM文件使用Ion Reporter软件(版本5.10.3)中提供的AmpliSeq CCP w1.2-Tumor-Normal对工作流程进行分析。
KRAS G12/G13 C177的滴式数字PCR (ddPCR)
的突变状态喀斯特在密码子G12/G13上,使用C177肿瘤组织及其相邻4个淋巴结的gDNA进行ddPCR。该检测采用ddPCR™喀斯特筛选Multiplex试剂盒(#1,863,506,BioRad)如前所述[30.].
统计分析
正态分布数据比较采用双侧非配对学生t检验。如果数据不符合正态性标准,则进行Mann-Whitney U检验。数据以均数±均数标准误差(SEM)表示。
结果
非转移性淋巴结肿瘤反应性T细胞的体外富集
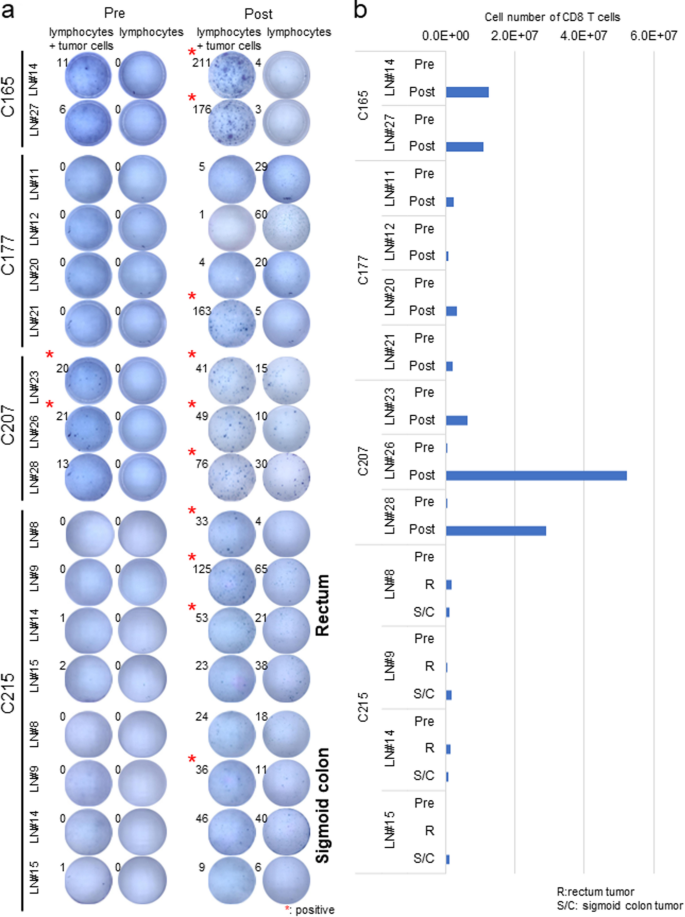
为了评估淋巴结中的肿瘤反应性T细胞,从7例结直肠癌患者的结肠肿瘤组织及其相应的tdln中建立了自体肿瘤细胞系,总结见表1.对于3例CRC病例(C126、C149和C152),我们将非转移性淋巴结和转移性淋巴结的淋巴结切成小块,并像从肿瘤组织中培养TILs一样培养淋巴细胞[23].在用自体肿瘤细胞刺激淋巴细胞后,我们通过IFNγ ELISPOT法从C126非转移性淋巴结分离的淋巴细胞中鉴定出肿瘤反应性T细胞,但我们在其余两个病例的转移性淋巴结分离的淋巴细胞中发现了肿瘤反应性T细胞(附加文件)1:图S1a及表格2).另外4例CRC (C165、C177、C207和C215),我们在制备细胞悬液后立即用自体肿瘤细胞刺激非转移性淋巴结淋巴细胞,然后用IFNγ ELISPOT法检测肿瘤反应性T细胞。C215有两个肿瘤,一个在乙状结肠,另一个在直肠,通过体细胞突变分析,基因上符合独立(附加文件5:表S1)。本例中,我们分别用直肠和乙状结肠肿瘤细胞刺激单个淋巴结的淋巴细胞。尽管我们在C207预刺激的淋巴细胞中也检测到了肿瘤反应性T细胞,但在其他病例中我们没有检测到肿瘤反应性T细胞,如图“Pre”所示。1a.由于C207患者被诊断为Lynch综合征,肿瘤反应性T细胞可能作为高免疫原性肿瘤在体内被激活和扩增。
非转移性淋巴结中肿瘤反应性T细胞的筛选和扩增。一个淋巴细胞(1 × 105/well)制成细胞悬液后,用自体肿瘤细胞(1 × 105/well)和IFNγ分泌物用ELISPOT法检测,见Pre。淋巴细胞与自体肿瘤细胞共培养2周,无肿瘤细胞静置2天。随后,淋巴细胞(1 × 105用自体肿瘤细胞(1 × 105/well)和IFNγ分泌物用elisa法检测如Post所示。斑点数(淋巴细胞+肿瘤细胞)大于15,且大于阴性对照(仅淋巴细胞)1.5倍的样本为阳性。实验是重复进行的。b计数与自体肿瘤细胞共培养前和2周后的绝对活细胞数。部分淋巴细胞用抗cd3、CD4、CD8α、CD56、CD19抗体染色,流式细胞仪检测其表达。数字表示CD8+T细胞与自体肿瘤细胞共培养1 × 106总淋巴细胞
为了进一步研究非转移性淋巴结中肿瘤反应性T细胞的存在与否,我们尝试通过与自体肿瘤细胞共培养2周在体外富集肿瘤反应性T细胞(附加文件)1:图S1b)。有趣的是,在这种培养条件下,我们通过IFNγ ELISPOT检测淋巴细胞中的肿瘤反应阳性,如图“Post”所示。1a和附加文件2:图S2a和CD8+除C215外,其余4例均以T细胞扩增为主+T细胞主要在4个淋巴结中扩增(图。1b),表明与自体肿瘤细胞共培养可能是从非转移性淋巴结中扩增罕见肿瘤反应T细胞所必需的。
影响抗肿瘤反应性差异的因素
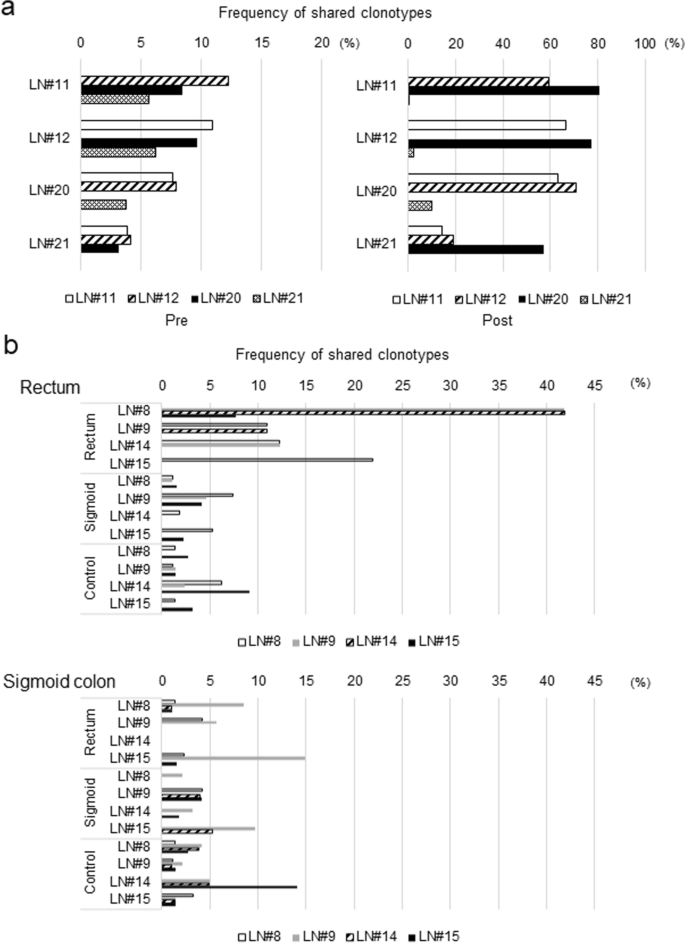
为了研究可能导致抗肿瘤反应性差异的因素,我们重点研究了病例C177,因为来自四个淋巴结的淋巴细胞在IFNγ产生方面表现出不同的反应性。当阳性点的数量比相应的阴性对照高出1.5倍以上时,我们定义为“IFNγ ELISPOT检测阳性”。虽然该患者LN#21的淋巴细胞在与自体肿瘤细胞共培养后显示出较高的IFNγ含量,但其余3个淋巴结(LN#11、12和20)的淋巴细胞未表现出任何阳性迹象(图2)。1a).有趣的是,在同一实验中,这三个淋巴结在没有肿瘤细胞刺激的情况下(作为阴性对照)均表现出较高的IFNγ分泌(图。2a和附加文件2:图S2a)。我们在抗pd1抗体的存在下培养淋巴细胞,使肿瘤反应性T细胞与肿瘤细胞以20:1的比例(淋巴细胞:癌细胞)扩增。在不含肿瘤细胞或抗pd1抗体的淋巴细胞培养2天后,我们以1:1的比例刺激含有肿瘤细胞的淋巴细胞,发现肿瘤细胞的加入减少了IFNγ的分泌,这说明LN#11、12和20淋巴细胞的IFNγ分泌可能受到肿瘤细胞某些因素的抑制。虽然这4个淋巴结经病理诊断为无转移,但我们检测到喀斯特在原发肿瘤中发现的突变,在ddPCR从所有四个淋巴结分离的DNA中发现,这表明存在少量的肿瘤细胞或被吞噬的肿瘤细胞,这些细胞可能已经启动了抗肿瘤反应(图。2b)。
然后,我们研究了四种免疫抑制受体(PD-1、TIM3、CTLA-4和LAG3)在LN#12、20和21淋巴细胞中的表达水平(由于获得的淋巴细胞数量非常少,我们无法检测LN#11)。CD8中TIM3-和pd -1阳性细胞+C207中LN#12和LN# 20的T群体高于LN#21和LN#23, LN#26和LN#28的T群体,显示出肿瘤反应性(图2)。2c和附加文件2:图S2b)。TIM3表达CD8的比例+与自体肿瘤细胞共培养后淋巴细胞中的T细胞数量少于TILs(附加文件)2:图S2b和S2c)。这些结果表明,共培养后的肿瘤反应性淋巴细胞比TILs更少耗尽表型[31,32].CTLA-4在CD8中的表达水平较低+LN#21的居群比LN#12和LN#20的居群多。LAG3在CD4和CD4细胞中的表达均较低+和CD8+LN#21的种群与LN#12和LN#20的种群比较(图2)。2c).这些结果表明CD4+和CD8+在LN#12和LN#20中表达抑制性受体分子的T细胞主要增加,而在LN#21中表达抑制性受体分子的T细胞数量较少。然后,我们进一步研究了淋巴细胞与肿瘤细胞共培养前后的转录谱。LN#21的淋巴细胞与其他3个淋巴结共培养后RNA表达模式明显不同(附加文件)3.:图S3a)。基因集富集分析显示,kegg_systemic_lupus_erytheosus通路相关基因(CD80、CD86和HLA II类分子)表达升高,但差异无统计学意义。
由于HLA II类- cd4途径可能影响T细胞反应的差异,我们检测了HLA II类在肿瘤细胞上的表达(附加文件)3.:图S3b)。C215乙状结肠不表达HLA II类,肿瘤细胞不能诱导肿瘤反应性CD8+有效的T细胞。因此,我们研究了与肿瘤细胞共培养前后的CD4表型。因为TBX21被认为是Th1和GATA3与Th2 [33],我们检查了相对TBX21 / GATA3实时PCR检测RNA表达率。所有样品(除C215外),均表现出了升高的趋势TBX21 / GATA3与肿瘤细胞共培养后,发现其抗肿瘤反应性增加(附加文件)4:图S4a)。此外,在该培养体系中添加IL-12和抗il -4抗体(Th1诱导)增加了Tbx21的表达(附加文件)4:图S4b)和增强的C215淋巴细胞的细胞毒活性(通过穿孔素ELISPOT法测定)(附加文件4:图S4c)。这些结果表明,在我们的培养系统中,通过HLA II类分子和CD4表型的抗原呈递可能会影响抗肿瘤CTL诱导。
淋巴结中的T细胞克隆型与TILs中的T细胞克隆型相同,与肿瘤细胞共培养增殖
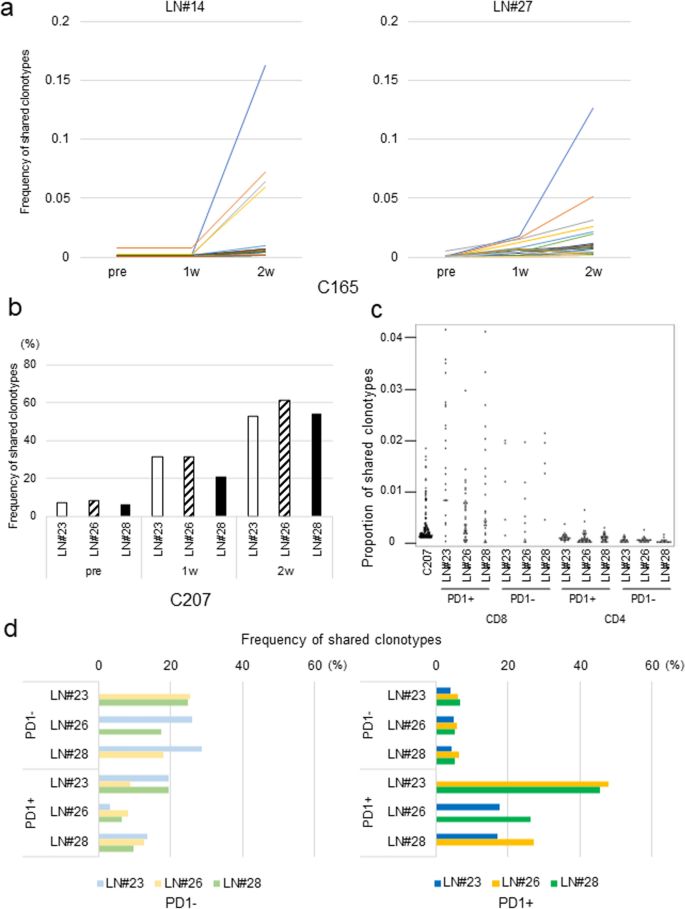
TILs在临床上被认为是肿瘤反应性T细胞的良好来源,尽管现在众所周知,TILs在许多情况下功能受损[34].我们比较了从原发肿瘤组织的4个不同部位分离的TILs的TCRβ克隆型与病例C165中与自体肿瘤细胞培养的两个淋巴结(#14和#27)的淋巴细胞的TCRβ克隆型。#14和#27的T细胞与四部分培养的TILs共享TCRβ克隆型,显著扩增(图2)。3.a).此外,我们比较了病例C207中淋巴结淋巴细胞与肿瘤组织单细胞悬浮后肿瘤浸润淋巴细胞的TCRβ克隆型。类似地,来自C165的两个淋巴结的T细胞,在原发肿瘤中与TILs共享克隆型,通过与肿瘤细胞共培养而扩增(图2)。3.b).然后,为了检查与肿瘤细胞共培养扩增的T细胞克隆的类型,我们对表达(或不表达)CD4的pd -1进行了分类+或CD8+来自非转移性淋巴结的T细胞,并将其克隆型与病例C207中的TILs进行比较。表达pd -1的CD8的T细胞受体克隆型+与pd -1阴性细胞相比,淋巴结中的T细胞与TIL的T细胞更常见(图2)。3.c).此外,我们比较了CD8的克隆型共享+T细胞根据3个淋巴结的PD-1表达水平,发现TILs克隆型的共同性与各淋巴结的PD-1表达模式相关(图2)。3.d).这些数据表明一些CD8 .+具有TCRs的T细胞克隆通常与TILs一起在这三个淋巴结中被激活,如PD-1表达所示。此外,我们比较了病例C177中4个淋巴结的TCR克隆型。在从4个淋巴结分离的淋巴细胞中,LN#21的一个样本在与肿瘤细胞共培养后,通过IFNγ ELISPOT检测显示出肿瘤反应性。LN#21的TCRβ克隆型与LN#11、#12和#20这三个淋巴结的克隆型没有相似之处。4a) LN#11、#12、#20的淋巴细胞与肿瘤细胞共培养后TCR克隆型相似。
与TILs共享的克隆型通过与肿瘤细胞共培养而扩大。一个将与肿瘤细胞共培养前、1周和2周的淋巴细胞TCRβ克隆型与C165至少1个TIL片段中超过0.1%的4个TIL片段进行比较。数字表示在每个淋巴结中检测到共享克隆型的频率百分比。b将C207淋巴细胞与肿瘤细胞共培养前后的TCR克隆型与占T细胞总数0.01%以上的TILs进行比较。数字表示在每个淋巴结中检测到共享克隆型的频率百分比。cC207非转移性淋巴结淋巴细胞用抗tcr αβ、CD4、CD8α和PD-1抗体染色。按PD1表达谱对CD4和CD8 T细胞进行分类。将TILs的TCRβ克隆型与每个人群的每个淋巴结进行比较。数字表示共享克隆的频率。d对每个淋巴结中CD8 T细胞占比超过0.1%的淋巴细胞进行TCRβ克隆型比较,通过PD1表达谱进行比较。数字表示每个样本之间共享克隆型频率的百分比
病例C215的4个淋巴结也得到了类似的结果,该病例同时在乙状结肠和直肠发生了癌症。与直肠肿瘤细胞共培养的4个淋巴结中的3个(#8,#9和#14)的淋巴细胞在ifn - γ ELISPOT检测中显示阳性。另一方面,LN#9中的淋巴细胞与乙状结肠肿瘤细胞共培养时ifn γ阳性,其余淋巴结中的淋巴细胞对乙状结肠肿瘤细胞无免疫反应性。我们发现与直肠肿瘤共培养的淋巴细胞中常见TCR克隆型的数量高于与乙状结肠肿瘤共培养的淋巴细胞(图2)。4b).这些结果表明,与肿瘤细胞共培养后的淋巴结淋巴细胞与肿瘤组织淋巴细胞的TCR共性可能会影响淋巴结的肿瘤反应性。有趣的是,LN#8和LN#9属于乙状结肠肿瘤的D2区,而不是直肠肿瘤的局部淋巴结。虽然该患者的淋巴流动不完全清楚,但我们的结果表明,当taa反应性T细胞克隆可以通过这种方法扩增时,离原发肿瘤相对较远的淋巴结(LN#8和LN#9)也可能适用于ACT。
讨论
TDLNs主要诱导抗肿瘤免疫活性,在有效产生抗肿瘤T细胞反应中发挥关键作用[18,19,35].tdln通常在手术中与原发肿瘤一起切除,以去除可能的残余肿瘤细胞,并检查这些淋巴结是否有转移性肿瘤细胞[36].目前众所周知,广泛切除LNs对于MSI-H/dMMR CRC患者的长期生存几乎没有临床益处[37].也有人怀疑保存淋巴结可能有利于宿主对癌细胞的免疫反应[38].在本研究中,我们探索了tdln用于ACT的可能性,并在非转移性淋巴结中发现了肿瘤反应性T细胞的存在,以及通过与自体肿瘤细胞共培养在体外扩增肿瘤反应性细胞毒性T细胞的可能性。正如预期的那样,Lynch综合征(C207)淋巴结中的肿瘤反应性T细胞在体内已经被激活和增殖,其他样本中的淋巴细胞需要与自体肿瘤细胞共培养。使用TILs的ACT的优势是获得大量可能具有抗肿瘤活性的T细胞。建立ACT的TILs通常需要两个阶段[39].第一阶段,从肿瘤组织中分离淋巴细胞体外培养,然后在含有高浓度IL-2的培养基中活化,进一步增加肿瘤反应性T细胞克隆。在第二阶段,淋巴细胞进一步扩大到1000倍(通常高达10倍)11细胞)在快速扩张程序条件下[7,40].然而,这种方法对晚期结直肠癌患者效果不佳[5,41],但已经通过与免疫检查点抑制剂结合进行了研究[42].CD8耗尽表型+T细胞被认为与细胞毒性损伤有关[34].事实上,TILs与自体肿瘤细胞共培养后显示出比淋巴细胞更衰竭的表型。另一方面,淋巴细胞数量较少(中位数为153 × 106细胞)可能对IV期结直肠癌患者有效,当淋巴细胞从前哨淋巴结分离时[21].无论如何,肿瘤反应性T细胞的数量肯定是过继细胞治疗成功的关键因素之一。根据我们的经验,要得到1 × 10并不难7或一个非转移性淋巴结的多个淋巴细胞,经自体肿瘤细胞培养2周后可扩增数倍。此外,如果我们在我们的培养条件下结合快速扩增程序,将有可能获得更多数量的肿瘤反应性T细胞。
在许多情况下,细胞疗法已被提供给转移性、难治性或复发肿瘤的晚期患者。在本研究中,我们从新鲜肿瘤组织中建立了自体肿瘤细胞系。在临床研究中,为所有患者提前制备自体肿瘤细胞系是很困难的。如果我们使用类器官培养系统,我们将更可靠地从冷冻保存的肿瘤组织中获得肿瘤细胞系[43].此外,tdln的淋巴细胞经单细胞悬浮后可保存较长时间,当患者复发时,这些细胞可被激活、扩增,成为细胞治疗的良好细胞来源。
我们的数据表明,与肿瘤细胞共培养后淋巴细胞的抗肿瘤反应水平可能由原发部位与TILs共享克隆型的扩增淋巴细胞的数量和频率来预测。在本研究中,我们无法检测与自体肿瘤细胞系共培养的淋巴细胞所识别的抗原类型。我们也不能确定其对肿瘤细胞的特异性,但由于淋巴细胞识别自身抗原(除一些癌睾丸抗原外)通常被排除,我们假设大多数或至少部分扩增淋巴细胞识别肿瘤特异性抗原。尽管从淋巴结培养的淋巴细胞作为TILs是安全的[24],在临床应用我们的方法时,有必要检查与正常细胞的交叉反应性,以确保患者的安全。此外,尽管在与自体肿瘤细胞共培养之前,我们无法确定可能具有更高潜力作为ACT良好细胞来源的淋巴结类型,因为我们发现在细胞群水平、细胞表型或RNA表达谱上没有显著差异。然而,我们可能能够通过与肿瘤细胞共培养后对T细胞群和表型的表征来做到这一点[42].此外,细胞输注后T细胞在体内的持久性和增殖能力似乎对ACT的临床疗效至关重要;T细胞干细胞样表型可能与体内持久性有关[44,45].
值得注意的是,我们可以从多个患者的非最近淋巴结中富集肿瘤反应性T细胞;这些淋巴结不属于离肿瘤最近的区域淋巴结群。结直肠癌区域淋巴结按解剖位置分为D1、D2、D3。D1离原发部位最近,D3离原发部位相对较远。C215的LN#8和LN#9(该患者乙状结肠肿瘤的局部淋巴结)在解剖位置上远离原发直肠肿瘤,不是该直肠癌的局部淋巴结,但这些淋巴结的淋巴细胞对直肠肿瘤细胞有免疫反应。由于淋巴管的流动是复杂的,在体内TAAs是否激活了距离原发部位相对较远的非转移性淋巴结尚不确定。当淋巴细胞与自体肿瘤细胞一起培养时,我们假设所有的淋巴结都可以作为ACT治疗的细胞源,即使淋巴结中含有很低水平的肿瘤反应性T细胞。
总之,我们的研究结果表明,非转移性淋巴结可能适用于作为过继细胞治疗的细胞来源。这些数据强调了非转移性淋巴结是预后不良的CRC患者的一种新的治疗选择。
数据和材料的可用性
在本研究过程中产生和分析的数据可根据合理要求从通讯作者处获得。
缩写
- 行为:
-
过继细胞疗法
- 儿童权利公约:
-
结肠直肠癌
- 细胞毒性t淋巴细胞:
-
细胞毒性T淋巴细胞
- TAA:
-
肿瘤相关抗原
- 识别:
-
T细胞受体
- TDLNs:
-
肿瘤引流淋巴结
- 尖:
-
肿瘤浸润淋巴细胞
- MMR:
-
错配修复
- MSI:
-
微卫星不稳定
参考文献
Watanabe T,等。日本结肠癌和直肠癌症协会(JSCCR) 2016年大肠癌治疗指南。中华临床医学杂志。2018;23:1-34。https://doi.org/10.1007/s10147-017-1101-6.
Hashiguchi Y,等。日本结肠直肠癌症协会(JSCCR) 2019年大肠癌治疗指南。中华临床肿瘤学杂志2020;25:1-42。https://doi.org/10.1007/s10147-019-01485-z.
李志强,李志强,李志强,李志强。免疫治疗结直肠癌与炎症的关系。细胞。2020。https://doi.org/10.3390/cells9030618.
Le DT,等等。PD-1阻断在错配修复缺陷肿瘤中的应用中华外科杂志2015;https://doi.org/10.1056/NEJMoa1500596.
向B,史诺克AE,马吉MS,华德曼SA。结直肠癌免疫治疗。《医学发现》2013;15:301-8。
Rosenberg SA, Restifo NP。过继细胞转移作为人类癌症的个性化免疫疗法。科学。2015;348:62-8。https://doi.org/10.1126/science.aaa4967.
Ben-Avi R,等。非小细胞肺癌肿瘤浸润淋巴细胞过继细胞治疗的建立。中国生物医学工程杂志,2018;https://doi.org/10.1007/s00262-018-2174-4.
忘掉MA,等等。转移性黑色素瘤患者的过继TIL治疗的前瞻性分析:反应、抗ctla4的影响和预测临床结果的生物标志物。临床癌症决议2018;24:4416-28。https://doi.org/10.1158/1078-0432.Ccr-17-3649.
阮lt,等。自体肿瘤浸润淋巴细胞和低剂量白介素-2过继细胞治疗转移性黑色素瘤的二期临床研究癌症免疫,2019;68:773-85。https://doi.org/10.1007/s00262-019-02307-x.
Inozume T,等。新鲜人黑素瘤中CD8+PD-1+淋巴细胞的选择丰富了肿瘤反应性T细胞。中华免疫杂志,2010;33:956-64。https://doi.org/10.1097/CJI.0b013e3181fad2b0.
Figlin RA,等。肾切除术、白细胞介素-2和细胞因子启动或CD8(+)选择肿瘤浸润淋巴细胞治疗转移性肾细胞癌张志刚,2004;https://doi.org/10.1097/00005392-199709000-00012.
Turcotte S,等。T细胞浸润胃肠道癌和黑素瘤内脏转移的表型和功能:过继细胞转移治疗的意义。中华免疫杂志,2013;https://doi.org/10.4049/jimmunol.1300538.
Sur D,等。嵌合抗原受体t细胞治疗结直肠癌。临床医学。2020。https://doi.org/10.3390/jcm9010182.
Morgan RA等。一例严重不良事件的报告后,管理转导与嵌合抗原受体识别ERBB2的T细胞。Mol Ther, 2010; 18:843-51。https://doi.org/10.1038/mt.2010.24.
帕克赫斯特先生等。靶向癌胚抗原的T细胞可介导转移性结直肠癌的消退,但可诱导严重的短暂性结肠炎。化学学报。2011;19:620-6。https://doi.org/10.1038/mt.2010.272.
陈ds, Mellman I.肿瘤学与免疫学的相遇:癌症-免疫循环。免疫力。2013;39:1-10。https://doi.org/10.1016/j.immuni.2013.07.012.
Förster R, Braun A, Worbs T淋巴结归巢的T细胞和树突状细胞通过传入淋巴。免疫杂志2012;33:271-80。https://doi.org/10.1016/j.it.2012.02.007.
Dammeijer F,等。PD-1/ pd - l1检查点抑制肿瘤引流淋巴结中的T细胞免疫。癌症细胞。2020;38:685-700.e688。https://doi.org/10.1016/j.ccell.2020.09.001.
康诺利KA,等。肿瘤引流淋巴结中的干样CD8(+) T细胞库保持了持续的抗肿瘤免疫反应。中国免疫杂志2021;6:eabg7836。https://doi.org/10.1126/sciimmunol.abg7836.
松田T,等。卵巢癌新抗原特异性细胞毒性T细胞的诱导及T细胞受体工程T细胞的构建临床癌症决议2018;24:5357-67。https://doi.org/10.1158/1078-0432.Ccr-18-0142.
甄玉华,等。大肠癌前哨淋巴结T淋巴细胞辅助免疫治疗的I/II期研究中国生物医学工程杂志,2015;https://doi.org/10.1007/s00262-015-1715-3.
田中N,等。APC突变作为结直肠癌对坦基酸酶抑制剂敏感性的潜在生物标志物。中华肿瘤杂志。2017;16:52 - 62。https://doi.org/10.1158/1535-7163.MCT-16-0578.
Mehta GU,等。肿瘤浸润淋巴细胞过继细胞转移对脑转移和无脑转移的转移性黑色素瘤患者的结果。中华免疫杂志。2018;41:41 - 7。https://doi.org/10.1097/cji.0000000000000223.
Dijkstra KK,等。通过共培养外周血淋巴细胞和肿瘤类器官产生肿瘤反应性T细胞。细胞。2018;174:1586 - 98。https://doi.org/10.1016/j.cell.2018.07.009.
赵旭,等。综合生物信息学分析识别系统性红斑狼疮关键生物标志物和免疫浸润。《翻译医学》2021;19:35。https://doi.org/10.1186/s12967-020-02698-x.
法CW,等。使用limma, Glimma和edgeR, RNA-seq分析像1-2-3一样简单。F1000Res。2016.https://doi.org/10.12688/f1000research.9005.3.
方H,等。利用下一代测序(NGS)对T细胞受体α和β链进行深度cDNA测序,定量分析T细胞库。中国肿瘤免疫学杂志。2014;3:e968467。https://doi.org/10.4161/21624011.2014.968467.
张敏,等。利用下一代测序技术鉴定卵巢癌患者血液、肿瘤和腹水中的T细胞库。肿瘤免疫学。2015;4:e1030561。https://doi.org/10.1080/2162402x.2015.1030561.
Lee CH,等。乳腺癌患者循环肿瘤细胞的肿瘤组分析。《科学》2018;16:612-8。https://doi.org/10.3892/ol.2018.8646.
Vanova B,等。在结直肠癌KRAS基因突变的多重筛查中,液滴数字PCR显示原发肿瘤与淋巴结转移高度一致。临床实验医学2019;19:219-24。https://doi.org/10.1007/s10238-019-00545-y.
空白CU,等。定义“T细胞衰竭”。免疫杂志2019;19:665-74。https://doi.org/10.1038/s41577-019-0221-9.
安藤,伊藤,史瑞特,近藤,吉村,记忆T细胞,衰竭和肿瘤免疫。免疫医学2020;43:1-9。https://doi.org/10.1080/25785826.2019.1698261.
Kanhere A,等。T-bet和GATA3通过远端调控元件的谱系特异性靶向调控Th1和Th2分化。Nat Commun. 2012;3:1268。https://doi.org/10.1038/ncomms2260.
Ahmadzadeh M,等。浸润肿瘤的肿瘤抗原特异性CD8 T细胞表达高水平的PD-1,功能受损。血。2009;114:1537-44。https://doi.org/10.1182/blood-2008-12-195792.
杜波依斯H,海姆TA,伦德AW。肿瘤引流淋巴结:处于转移和免疫的十字路口。免疫科学,2021。https://doi.org/10.1126/sciimmunol.abg3551.
金敏,弗兰克尔。结直肠癌淋巴结转移。临床外科杂志,2018;27:41 - 12。https://doi.org/10.1016/j.soc.2017.11.011.
Inamori K,等。淋巴结免疫应答在MSI-H/dMMR结直肠癌中的重要性JCI Insight, 2021。https://doi.org/10.1172/jci.insight.137365.
Koukourakis MI, Giatromanolaki a .肿瘤引流淋巴结,免疫反应和放射治疗:对治疗原则的修正。生物化学学报。2022;1877:188704。https://doi.org/10.1016/j.bbcan.2022.188704.
Lo W,等。转移性结直肠癌患者中共享p53突变新抗原的免疫学识别。癌症免疫杂志2019;7:534-43。https://doi.org/10.1158/2326-6066.Cir-18-0686.
陆玉春,等。单细胞转录组分析揭示了过继细胞治疗后与t细胞持久性相关的基因特征。癌症免疫res 2019; 7:1824-36。https://doi.org/10.1158/2326-6066.Cir-19-0299.
柯蒂斯NJ, Primrose JN, Thomas GJ, Mirnezami AH, Ottensmeier CH.结直肠癌的适应性免疫反应:从实验室到临床实践。中华外科杂志,2012;38:889-96。https://doi.org/10.1016/j.ejso.2012.05.011.
Kverneland AH,等。通过检查点抑制支持的肿瘤浸润淋巴细胞过继细胞治疗多种实体癌症类型。免疫癌症杂志,2021。https://doi.org/10.1136/jitc-2021-003499.
Perrone F, Zilbauer M.人体肠道类器官的生物银行转化研究。Exp Mol医学。2021;53:1451-8。https://doi.org/10.1038/s12276-021-00606-x.
姚X,等。外周CD4(+)FoxP3(+)调节性T细胞水平与人类癌症过继免疫治疗的临床反应呈负相关。血。2012;119:5688 - 96。https://doi.org/10.1182/blood-2011-10-386482.
Krishna S,等。干细胞样CD8 T细胞介导过继细胞免疫治疗对人类癌症的反应。科学。2020;370:1328-34。https://doi.org/10.1126/science.abb9847.
确认
我们感谢博士。日本癌症研究基金会肿瘤化疗中心实验化疗部Katayama Rhohei和Bo Gong为建立自体肿瘤细胞培养体系提供了帮助。我们也感谢Cancer Neoantigen Vaccine Development Group的Siew-Kee Low博士通过Ion AmpliSeq™综合癌症小组分析了C215的基因组谱。我们也感谢松本佐木,杉原纯子,根本健作的技术支持。这项工作得到了日本科学促进会的支持。
资金
本研究由日本科学促进会(JSPS)资助,资助号为20K16458。
作者信息
作者及隶属关系
贡献
YN负责整个项目的策划和监督,并负责编辑文章。SN提供了临床样本和建议。KK进行T细胞受体库分析。TT和HTC采集标本,建立自体肿瘤细胞系和淋巴细胞培养体系。KO设计了研究,进行了实验,进行了数据分析,并起草了这篇文章。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
该研究方案由日本癌症研究基金会癌症研究所医院机构审查委员会(2018-1021)批准。我们的研究涉及人类受试者,这符合赫尔辛基宣言。
发表同意书
所有患者均签署了关于公布其数据的知情同意书。
相互竞争的利益
Kazuma Kiyotani在日本Cancer Precision Medicine Inc担任顾问职务。Yusuke Nakamura,日本OncoTherapy Science公司的股东和顾问。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:
图S1。淋巴结肿瘤反应性T细胞的筛选和扩增。一个用自体肿瘤细胞系(1×105/well)刺激非转移性和转移性淋巴结培养的淋巴细胞(1×105/well) 24小时,elisa法检测IFNγ分泌物。仅淋巴细胞为阴性对照,淋巴细胞+抗cd3抗体(1μg/孔)为阳性对照。当斑点数比阴性对照多1.5倍时,样本被认为是阳性。实验是重复进行的。b肿瘤反应性T细胞体外富集方案。
附加文件2:图S2。
肿瘤反应性T细胞的筛选及TIM-3和PD-1在CD8+ T细胞上的表达。一个肿瘤反应性T细胞筛选的第二结果(图s1a)。b用抗tcr αβ、CD4、CD8α、TIM-3和PD-1抗体染色淋巴细胞。采用流式细胞术检测TIM-3和PD-1在CD8 T细胞中的表达。c肿瘤组织培养的表达TIM-3 CD8+ T细胞的比例(n=3 C149, n=3 C152)。
附加文件3:图S3。
HLA II类的表达与肿瘤反应性T细胞的诱导有关。一个热图显示共培养后ln# 21的前100个表达基因,表达量比ln# 11、12和20高4倍以上。b用IFNγ(200IU/ml)刺激肿瘤细胞24小时,流式细胞仪检测HLA II类的表达。
附加文件4:图S4。
Th1表型增强细胞毒活性。一个Tbx21和GATA3 mRNA在T细胞中的表达采用实时聚合酶链反应,采用TaqMan基因表达测定。将表达水平归一化至肌动蛋白表达水平。Tbx21与GATA3的相对表达被认为是Th1/Th2表型的平衡。B将C215中LN#9和LN#14的淋巴细胞与直肠肿瘤或乙状结肠肿瘤细胞株一起培养2周,诱导Th1 (IL-12 10ng/ml,抗il4抗体10μg/ml)或不诱导Th1(对照组)。这两种条件含有il - 2 (200 IU/ml)、抗pd1抗体(10μg/ml)和抗cd28抗体(5μg/ml),与前一实验相同。收集淋巴细胞,采用TaqMan基因表达法实时聚合酶链反应定量T细胞中Tbx21和GATA3 mRNA的表达。c淋巴细胞与自体肿瘤细胞一起培养2周,有无Th1诱导。随后,将淋巴细胞仅在淋巴细胞培养基中培养2天,再用肿瘤细胞株(1×105/well)刺激淋巴细胞24小时,用ELISPOT法检测穿孔素分泌物。实验是重复进行的。
附加文件5:表S1。
C215肿瘤细胞的基因组特征
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
冈村,K,永山,S,泰特,T。et al。肿瘤引流淋巴结淋巴细胞与自体肿瘤细胞共培养用于过继细胞治疗。翻译医学杂志20., 241(2022)。https://doi.org/10.1186/s12967-022-03444-1
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-022-03444-1
关键字
- 结肠直肠癌
- 过继T细胞疗法
- 肿瘤引流淋巴结
- 肿瘤浸润淋巴细胞