摘要
嵌合抗原受体(CAR) T细胞疗法因其对恶性血液病的治疗效果而备受关注。但在长期随访中存在复发、对实体瘤疗效有限等问题。疲劳会损害CAR - T细胞在体内的持久性和杀伤活性,是这些问题的原因之一。根据它们细胞外部分的结构,一些CARs在缺少配体刺激的情况下诱导强直信号,并在CAR - T细胞中诱导衰竭表型。分析这些自我激活的CAR有望为理解和解决CAR - T细胞衰竭提供关键信息。在这篇综述中,我们介绍了自激活CARs的例子,并总结了它们的表型,以找出CAR - T细胞衰竭是如何发生的。此外,我们旨在回顾阻碍CAR - T细胞治疗广泛应用的CAR - T细胞衰竭的有希望的解决方案。
简介
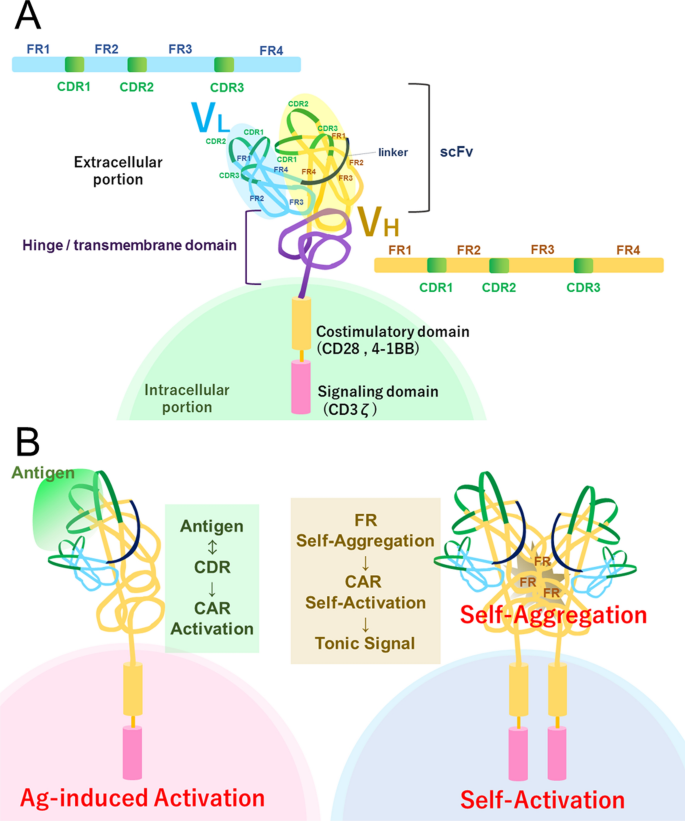
将抗体功能与T细胞受体(TCR)结合的想法源于TCR对肽-主要组织相容性复合体(MHC)的亲和力低于抗体-抗原复合体。因此,用单克隆抗体的可变片段(Fv)替换TCR可变区域有望在T细胞中诱导更强的信号。事实上,这种嵌合T细胞受体(cTCRs)成功地形成TCR复合物,识别其配体,并在T细胞杂交瘤中诱导IL-2的产生和细胞裂解[1].此外,为了避免cTCR和内源性TCR配对,采用单克隆抗体的单链可变区片段(scFv)和CD3ζ链作为信号域[2],被认为是第一代嵌合抗原受体(CAR)。由于这种类型的嵌合受体不需要信号复合物中的内源性CD3分子(γ, δ, ε和ζ), CAR可以应用于T细胞和NK细胞。然而,第一代CAR不能诱导naïve T细胞的激活[3.因为它们需要来自共刺激分子的第二个信号来激活。因此,CD28细胞内结构域被引入CAR构建中,以提供来自单链(28z-CAR)的第一和第二信号[4].这被指定为第二代CAR,并已广泛应用于临床试验和治疗(图。1A).然而,即使是具有CD28共刺激结构域的第二代CAR,也不能在效应/记忆T细胞中模拟TCR信号,这些T细胞利用TNF受体超家族成员如OX40和4-1BB作为共刺激分子[5].这导致了具有4-1BB共刺激结构域(BBz-CAR)的第二代CAR和具有多个共刺激结构域的第三代CAR的发展。此外,第四代CAR通过分泌IL-12等细胞因子来修饰肿瘤微环境(TME) [6]和IL-15 [7,8].
尽管CAR被设计用来模拟TCR信号,但CAR和TCR之间的激活机制存在许多差异。首先,28z-CAR不会诱导除ζ链以外的CD3成分的显著磷酸化,因为CAR的设计独立于内源性TCR成分。此外,28z-CAR对LAT的磷酸化程度低于TCR [9].尽管CD3ζ是CD3复合体的主要组成部分,但其单独磷酸化不足以完全激活ZAP-70-LAT通路。此外,在另一种含有4-BB共刺激结构域(BBz-CAR)的第二代CAR中,也未检测到LAT磷酸化[9].Dong等人解释了为什么CAR可以在不磷酸化LAT的情况下发挥作用,而LAT是TCR信号传导的必要支架分子。[10].他们使用表达TCR或CAR的la缺陷细胞系,发现只有CAR,而不是TCR,可以形成配体诱导的微簇。因此,CAR可能具有激活下游信号的旁路通路,这一点尚未被揭示。
抗CD19的CAR - T细胞是最成功的过继转移疗法之一,在急性淋巴细胞白血病(ALL) 10.6个月时完全缓解率为55% [11]以及40个月时29%的慢性淋巴细胞白血病(CLL) [12].然而,CAR - T细胞在其他癌症类型,特别是实体瘤中的有效性仍有待提高。与不成功的CAR - T细胞治疗相关的主要问题之一包括CAR - T细胞的衰竭,导致CAR - T细胞在体内的扩张和持久性受损[13,14].在这篇综述中,我们关注CAR - T细胞衰竭,损害其功能,并讨论预防策略。
CAR - T细胞衰竭
T细胞衰竭的特征是检查点分子和激活标记物的表达以及效应因子功能的缺陷,并首次在慢性淋巴细胞性脉络丛脑膜炎病毒感染中被描述[15].它是由过度的抗原信号传导诱导的,被认为是T细胞活化的负反馈机制之一[16].虽然在某些阶段停止免疫反应以防止自身免疫性疾病等不利影响是必不可少的[17],它还可以防止癌症免疫治疗的效果;肿瘤浸润T细胞经常因过度的抗原刺激和/或抑制性TME而耗尽[18].同样,疲劳是CAR - T细胞的一个常见问题,会破坏它们的功能。例如,有报道称,抗间皮CAR - T细胞在胸膜间皮瘤原位小鼠模型中表现出以PD-1上调和IL-2、IFN-γ、TNF-α和GRZB等效应分子表达缺陷为代表的耗尽表型,导致功能受损[19].此外,CD19 CAR - T细胞注入CLL患者[20.]或b细胞淋巴瘤[21]倾向于在无反应的患者中表现出衰竭表型。此外,CD19 CAR - T输注产物的单细胞RNA测序也显示,与完全缓解患者相比,部分缓解或进展性疾病患者的衰竭特征更丰富[22].这些观察表明,CAR - T细胞衰竭是成功治疗的主要障碍之一。
强直性信号通路诱导CAR - T细胞衰竭
人们已经认识到,在缺乏配体的情况下,未激活的T和B细胞在基础状态下传递低水平的本构信号,称为强直性TCR或B细胞受体(BCR)信号。淋巴细胞中TCR或BCR(包括pre-BCR)发出的紧张性信号参与细胞分化和维持细胞对抗原刺激的反应[23,24].同样,在CAR的情况下,已经观察到由CAR的自聚集引起的不同水平的配体无关受体信号,也被称为强直信号[25].有趣的是,据报道,高水平的强直性信号会导致CAR - T细胞的衰竭和功能障碍(图2)。1B). CAR细胞外结构域的结构被认为与紧张性信号传导有关。例如,与仅使用CH3的CAR相比,使用IgG1 CH2-CH3区域作为跨膜结构域和scFv之间的间隔,CAR产生了更强的张力信号[26].
一些CAR - T细胞,如c-Met IgG4 28z CAR - T细胞,在没有外源性抗原刺激或生长因子的情况下,在体外表现出长期增殖,被称为“连续CAR”。在表达这种“连续CAR”的T细胞中,增殖被认为是由CAR发出的自我激活的紧张性信号介导的;例如,NFAT报告Jurkat细胞系中的c-Met IgG4 28z CAR显示了NFAT信号的配体独立激活[27].此外,细胞表面c-Met IgG4 28z CAR表达的减少改善了CAR信号的持续增殖,这表明CAR信号的非配体激活是由自聚集介导的。值得注意的是,这些CAR - T细胞在体外可能处于衰竭状态,因为它们显示T-bet和EOMES上调,这与T细胞衰竭有关[28,29].事实上,尽管c-Met IgG4 28z CAR - T细胞在体外表现出良好的细胞毒性,但在体内抗肿瘤活性降低[27].
另一种自我激活的CAR - T细胞(GD2.28z)在体外显示增殖受损和耗尽表型[30.].这种表型归因于CAR单链抗体非配体聚集激活的紧张性CAR信号,它依赖于框架区(FR)而不是互补决定区(CDR)(图。1A).虽然GD2.28z CAR - T细胞在体外对靶细胞表现出较强的细胞毒性,但在体内活性很差。此外,GD2.28z CAR - T细胞上调了PD-1、TIM-3、LAG-3等检查点分子的表达,提示衰竭[31].
有趣的是,这两种自激活CARs在体外T细胞增殖中诱导了不同的表型。如前所述,c-Met IgG4 28z CAR - T细胞在体外表现出持续增殖,但在体内无法持续,而GD2.28z CAR - T细胞在体外和体内均表现出较差的增殖能力。两种功能缺陷CARs体外增殖能力的差异可能是由细胞因子表达的差异所解释的,因为c-Met IgG4 28z CAR诱导了持续的IL-2水平,而GD2.28z CAR则下调了IL-2的表达。CAR信号可以上调IL2通过激活NFAT和NF-κB转录,但这一过程被TIM-3抑制[32].CAR信号强度的差异可能导致衰竭表型的强度和/或持续时间的差异,包括TIM-3的表达,tim3的表达影响心肌梗死的表达IL2基因(表1).
当自我激活的CAR - T细胞自发地衰竭时,它们可能是一个方便和理想的模型,用于研究CAR - T衰竭的分子机制。例如,RNA测序(RNAseq)分析了表达GD2.28z (HA.28z)高亲和力版本的高度耗尽的CAR - T细胞,与CD19.28z CAR - T细胞相比,显示出明显不同的基因表达模式。HA.28z CAR - T细胞中上调的基因包括激活相关基因(IFNG GZMB,而且IL2RA)、抑制受体(滞后而且CTLA4),以及炎症因子(使用IL13 CXCL8,而且IL1A),而下调的基因包括与记忆相关的基因(Lef1, tcf7, il7r,而且KLF2) [34].该基因表达谱与慢性病毒感染后在精疲力尽的T细胞中观察到的基因表达谱重叠[35],表明该模型对T细胞衰竭的可行性。
据推测,耗尽和未耗尽的CAR - T细胞之间基因表达的差异可能反映了染色质可及性的差异。例如,一项使用HA.28z CAR - T细胞测序(ATAC-seq)分析转座酶可达染色质的实验显示,AP-1- bzip和bZIP-IRF结合基序富集,与JunB、IRF4和BATF3的上调表达一致,它们拮抗经典AP-1的功能[34].此外,当使用相同的模型检测耗尽和未耗尽的CAR - T细胞在离体扩张过程中染色质可及性状态的时间过程时,差异染色质可及性比观察到耗竭标记物的差异表达更早被检测到,这表明染色质重塑对CAR - T细胞耗竭表型的因果作用[36].据报道,肿瘤特异性耗尽的T细胞显示出两种不同的染色质状态:T细胞可以从一种可塑性功能失调状态中获救,以及细胞抵抗重编程的固定功能失调状态[37].类似地,具有强直性信号的CAR - t细胞表现出两阶段衰竭相关的染色质重塑[38],并且CAR - T细胞中耗尽印迹的表观基因组可以通过终止强直信号而逆转[38],如下所述。
避免强直性信号诱导的CAR - T细胞衰竭的策略
CAR细胞外结构域的结构修饰
CAR的自聚集诱导强直性信号是由CAR的单链fv部分介导的。因此,修饰scFv是一种可能的策略,以改善自聚集的强直性信号。由于自聚合依赖于FR而不是CDR [30.], CDR嫁接到非聚集scFv的FR上可能是改善CAR的一种很好的策略。例如,通过构建由GD2 CAR cdr和CD19 CAR FRs组成的混合scFv,实验利用该方法排气GD2.28z CAR [30.].虽然这种方法涉及创建两个scFv区域的混合结构,但选择合适的FR是重要而困难的。由于CDR移植需要选择最像原始单克隆抗体的FR [39],来自非穷举式单链抗体(如CD19单链抗体)的FR可能并不总是适用于每种类型的自聚集单链抗体。因此,为每个详尽的CAR确定或微调合适的FR可能是必不可少的。
此外,CAR的其他部分可以被修改以减少强音信号。例如,通过缩短VH序列和改变人CD8α的铰链和跨膜结构域(而不是igg衍生的铰链和CD28跨膜结构域)来修饰抗gd2 CAR,导致自二聚化减少以及衰竭标记PD-1的表达降低[40].此外,修饰单链fv和跨膜结构域之间的间隔已被证明可以改变张力信号。CAR单独携带一种含有CH3的免疫球蛋白间隔体,而不是同时携带CH3和CH2的免疫球蛋白间隔体,减轻了ag不依赖的紧张性信号传导,并恢复了细胞溶解能力而不出现衰竭[26].
共刺激域的选择
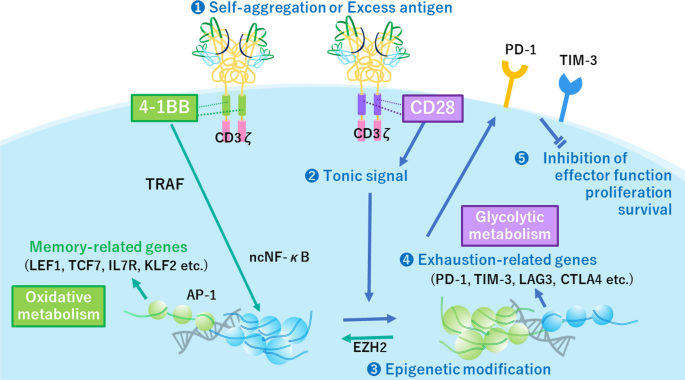
已有研究表明,CAR的共刺激结构域对CAR - T细胞的表型至关重要[41,42].例如,4-1BB细胞内结构域被证明可以修饰耗尽的GD2.28z CAR - T细胞的表型。4-1BB胞内结构域(命名为GD2)的合并。BBz CAR), instead of CD28 intracellular domain of GD2.28z CAR, reduced the exhaustion phenotype and enhanced cytokine production in vitro, as well as prolonged T cell persistence in vivo. Persistent activating signaling from the CD28 intracellular domain is suggested to induce exhaustion of GD2.28z CAR T cells, whereas the 4-1BB intracellular domain produces a weaker costimulatory signal [43],在配体存在的情况下,这可能足以激活T细胞,但不足以作为耗尽信号。的确,与GD2相比。BBz CAR T cells, GD2.28z CAR T cells showed increased expression of genes encoding inhibitory receptors and exhaustion-related molecules, whereas GD2.BBz CAR T cells exhibited higher expression of memory-related transcription factors [30.].同样,通过引入4-1BB胞内结构域(称为c-Met IgG4 BBz CAR)修饰c-Met IgG4 28z“连续”CAR也被证明可以取消本构信号和配体无关的连续生长[27].此外,基于cd28和基于4- 1bb的抗bcma CAR - T细胞之间的比较表明,基于4- 1bb的CAR - T细胞表现出较少的耗尽表型[44].总的来说,这些结果表明,使用4-1BB共刺激结构域可能是预防衰竭的可行方法之一,因为它已在多个自激活car中得到验证。
BBz-CAR(而不是28z-CAR)的一个显著特性是激活traf依赖的非典型NF-κB信号通路。据报道,naïve和活化T细胞通过CD28共同刺激激活典型NF-κB通路,而效应T细胞和记忆T细胞通过CD27、CD30 OX40或4-1BB共同刺激激活非典型NF-κB通路[5].因此,28z-CAR和BBz-CAR的信号通路可能与T细胞中TCR和共刺激分子的信号通路相似。例如,BBz-CAR复制了记忆T细胞分化的信号[45]可以防止CAR - T细胞衰竭[46].此外,在CD19-CAR - T细胞模型中,28z-和BBz-CAR - T细胞的代谢状态也有所不同。在该模型中,BBz-CAR诱导氧化代谢并导致中枢记忆T细胞表型,而28z-CAR诱导糖酵解代谢并产生效应记忆表型[47].细胞代谢状态的这种差异可能与CAR - T细胞的衰竭有关。
在一些临床研究中,有人认为CD19-BBz在CAR - T细胞体内持久性方面优于CD19-28z,支持CAR - T细胞表型中共刺激结构域的重要性[42,48,49].然而,在解释这些结果时需要谨慎,因为在这些研究中,CD19-BBz CAR (CTL019)使用cd8衍生的铰链/跨膜结构域,而CD19-28z CAR使用cd28衍生的铰链/跨膜结构域[41].如上所述,由于cd8衍生的铰链/跨膜结构域比cd28衍生的结构域具有更低的自二聚性[40],在这些研究中,铰链/跨膜结构域的差异可能会影响CAR - T细胞的表型。在一项临床前研究中,直接比较CAR中具有相同铰链结构域的CD28和4-1BB共刺激结构域,证明CD19-BBz CAR在细胞存活和持久性方面优于CD19-28z CAR [50].相比之下,除了体内持久性外,在小鼠模型中,低剂量CD19-28z CAR比CD19-BBz CAR表现出更快的肿瘤消除速度,这表明4-1BB共刺激结构域并不总是在所有方面都更好[51].在肿瘤抗原丰度有限且自我激活风险较小的情况下,CD28共刺激结构域可能是更好的选择。由于没有足够的研究表明cd28共刺激或4- 1bb共刺激的CARs在控制肿瘤方面具有明显优势[52],仍需进一步研究。
由于来自CAR的过度信号会导致CAR - T细胞的衰竭,因此修改CAR的细胞内结构域将是避免衰竭的另一种方法。例如,通过删除或Y到F突变使三个CD3ζ免疫受体酪氨酸激活基基(ITAM)中的两个远端失效,导致效应细胞和记忆CAR - T细胞的命运平衡[53].此外,CD28 YMNM基序中的单氨基酸替换为YMFM显示了T细胞分化和衰竭的减少,以及向Th17细胞倾斜的增加[54].此外,CD19-28z CAR中的CD28突变,仅留下CD28三个功能域(YMNM, PRRP和PYAP)中的PYAP结构域,显示出衰竭相关转录因子和基因的减少,从而导致显著的生存优势[55].
紧张信号的瞬态终止
一个潜在的策略,停止强直性CAR信号是暂停CAR表达时,它是不必要的。例如,报道了一个有趣的系统,其中一个不稳定域(DD)被引入到CAR构造中[56].在这个系统中,CAR的表达通过降解而停止,而DD的稳定试剂可以防止CAR的降解并恢复CAR的表达。通过该系统,耗尽的CAR- t细胞可以通过CAR降解恢复记忆样表型,这表明CAR诱导的耗尽是一种可逆现象[38].该系统也可作为一种安全装置,用于控制CAR - T细胞介导的不良事件,其中CAR的表达可通过停药终止[56].有趣的是,抑制表观遗传修饰子EZH2减弱了耗尽表型的逆转,这表明在强直性CAR信号终止期间,耗尽相关的表观基因组通过EZH2被重塑[38].
将DD引入CAR结构以改善疲劳显然是劳动密集型的,并且仅在单一的临床前研究中报道[38].有趣的是,同一作者报告说,类似于这种CAR结构的修饰,CAR - T细胞也可以使用临床可用的激酶抑制剂达沙替尼休止,该抑制剂可有效且可逆地抑制近端CAR信号激酶,从而逆转耗尽的CAR - T细胞表型[38].因此,达沙替尼在CAR - T细胞体外扩增期间的治疗可能是另一种有前途的策略,可以在不修改CAR结构的情况下恢复耗尽的CAR - T细胞,尽管需要进一步的例子来证明其普遍适用性。
下游信令修改
如上所述,带有紧张性信号的耗尽的CAR - T细胞中的基因表达差异可以通过某些转录因子的染色质通路缺陷来解释[34].例如,HA-28z CAR - T细胞表型衰竭,典型AP-1转录因子表达异常。这些细胞的典型c-Fos/c-Jun异源二聚体比例降低IL2转录对抗非典型的JUNB, IRF4和BATF3,拮抗典型AP-1的表达和功能。值得注意的是,经改造过表达c-Jun以恢复典型AP-1功能的CAR - T细胞被证明具有增强的扩张潜力,增强的功能容量,减少耗尽的表型,并提高体内抗肿瘤效力[34].请注意,仅在HA-28z CAR - T细胞中报道了典型AP-1转录因子的表达失调,在其他自激活CAR - T细胞中尚未得到证实。
一些转录因子也被证明与CAR - T细胞的衰竭表型直接相关。如NR4A家族转录因子的表达与PD-1、TIM-3的表达呈正相关[57],除了在调节性T细胞发育中的作用外[58].此外,其结合基基在耗尽T细胞的差异可达区域富集[59].有趣的是,与野生型CAR - T细胞相比,细胞的转移NR4A1, NR4A2,NR4A3对荷瘤小鼠进行三次敲除CAR - T细胞,降低了肿瘤浸润淋巴细胞中高度耗尽的CAR - T细胞的比例,并导致更好的预后[57].值得注意的是,由于NR4A家族成员在诱导衰竭方面具有冗余功能,三次敲除NR4A基因对于改善CAR - T细胞功能是必要的。对于临床应用,NR4A基因在(自体)CAR - T细胞中的破坏将是障碍。虽然crispr工程T细胞在临床试验中进行了测试[60,我们可能需要等到“现成的”CAR - T细胞可用,以充分利用这种方法。
避免其他细胞或环境因素引起的CAR - T细胞衰竭的策略
除了紧张性信号的自我激活外,其他细胞或环境因素也被报道可诱导CAR - T细胞衰竭。下面将介绍和讨论一些预防疲劳的策略。
阻断抑制性受体和细胞因子
在耗尽的CAR - T细胞中观察到抑制性分子PD-1的持续过表达[30.],类似于在慢性病毒感染后耗尽的CD8 T细胞中观察到的[61].来自PD-1的抑制信号被认为有助于衰竭,因为在慢性病毒感染模型中,单克隆抗体阻断PD-1/PD-L1可导致更好的病毒控制和T细胞反应[61]尽管有争议的观点认为PD-1/PD-L1阻断的作用可能是短暂的,不能逆转与衰竭相关的表观遗传印记[59].类似地,在CAR - T细胞衰竭模型中,用PD-1阻断抗体或显性阴性的PD-1构建在CAR - T细胞中处理可以在一定程度上恢复其功能[19].在一项临床试验中,给药PD-1抑制剂派姆单抗并没有改变成神经细胞瘤中GD2 CAR - T细胞的扩张、持久性和细胞因子的产生[62],而最近的另一项试验显示,抗间皮瘤CAR - T细胞和派姆单抗联合给药在间皮瘤患者中延长了生存期[63].这些不一致的结果可能是由于PD-1信号对CAR - T细胞衰竭的影响不同,这取决于CAR产品。然而,目前还没有明确的证据来解释这种差异,需要进一步的调查。
除了抑制性受体配体外,TME内分泌的细胞因子可能抑制免疫细胞功能。例如,前列腺癌细胞分泌TGF-β [64]据报道可诱导效应记忆T细胞衰竭[65].为了避免TGF-β的免疫抑制作用,在侵袭性人前列腺癌诱导的小鼠模型中,显性阴性TGF-β rii被引入到CAR - T细胞中对抗前列腺特异性膜抗原(PSMA)。使细胞增殖增加,细胞因子分泌增强,抗衰竭,长期存在,体内肿瘤消失[66].
优化T细胞亚群和分化阶段
一般来说,CAR - T细胞是通过将CAR基因引入被抗cd3和IL-2治疗激活的外周血单个核细胞(pmcs)中产生的。因为在这个过程中,CD4的混合物+和CD8+使用不同分化阶段的T细胞,预计T细胞亚群的差异可能导致CAR - T细胞的不同表型。对CAR - T细胞生产的T细胞亚群的比较表明,低分化的T细胞群表现更好[67].例如,将CD19 CAR引入干细胞记忆T细胞(T供应链管理),是最原始的具有自我更新能力的记忆T细胞子集[68],与传统CAR - T细胞相比,其体外增殖活性增强,体内持久性延长,肿瘤控制效果更好[69].由于CAR - T细胞衰竭发生在最终分化的效应T细胞中,在早期阶段使用T细胞可能有利于防止CAR - T细胞衰竭。
另一种控制T细胞稳态和存活的方法包括用细胞因子如IL-15和IL-7治疗[70].因此,采用这些细胞因子与CAR异位表达来抑制CAR的衰竭[7,8].例如,据报道,IL-15与GD2 CAR共表达可在CAR - T细胞中保留中央记忆/干细胞样表型,并显示PD-1表达降低[40],表明该方法可以用于改善CAR - T细胞衰竭。值得注意的是,介绍IL-15Rα在CAR结构中显示出比引入其他信号域的优势[71],提示IL-15R信号通路在预防衰竭中的重要性。
总结
尽管CD19 CAR - T细胞治疗白血病取得了发展和成功,但这种方法在其他类型的肿瘤,特别是实体肿瘤中尚未取得类似的成功。这至少可以部分解释为CD19 CARs,特别是由来源于FMC63克隆的scFv组成,是一个罕见的自身不产生强音信号的例外。CD19 CAR的这种特征可能是其他CAR的一大优势,这些CAR不仅在离体扩张过程中,而且在体内肿瘤组织中,都表现出不同水平的紧张性信号并导致衰竭[30.].然而,即使使用CD19 CAR,肿瘤细胞上持续遇到CD19分子后的疲劳是实现长期缓解的障碍[20.].因此,需要付出巨大的努力来了解CAR - T细胞衰竭的机制,并通过技术创新来克服它。
最近,RNA测序和ATAC-seq全球染色质图谱等新技术极大地促进了对t细胞衰竭的理解。在CAR紧张性信号停止后,可以通过几种方法诱导衰竭相关表观基因组的重编程[38(图。2).当CAR具有自激活效力时,选择4-1BB共刺激结构域可能是预防CAR - T细胞衰竭的更好方法[27,30.,44].此外,通过修改scFv结构或短暂终止CAR表达来减少紧张信号可以被认为是一种有前途的微调CAR信号的方法。因此,在修饰scFv时,在选择合适的人体框架区域时,应将补强信号的缺失作为关键参数之一。此外,识别对紧张性信号传导至关重要的氨基酸残基可能有助于微调框架结构。此外,揭示与衰竭相关的表观遗传重塑的分子机制和识别抑制它们的分子或药物方法将是对抗CAR - T细胞衰竭的有力措施。
目前,CAR - T细胞衰竭的各种机制已经通过不同的方法被独立地识别出来。虽然每项研究都发现了相关分子,但一般机制尚未确定。因此,不能保证对某种耗尽CAR有效的一种策略对不同的耗尽CAR也有效。在我们回顾的各种减轻自激活CAR - T细胞衰竭的策略中,当CAR - T细胞被发现自激活时,哪一种是首选?首先,使用4-1BB共刺激结构域可能是一种有前途的方法,因为这种方法已经在多个自激活car中得到验证[27,30.,44],尽管4- 1bb衍生结构域是否优于其他结构域尚未达成共识。或者,其他方法,如使用达沙替尼进行体外扩增[38]和抑制受体的阻断[63],可以尝试,因为这些方法更容易执行,不需要修改CAR结构,特别是当修改CAR结构改变了CAR蛋白的稳定性,导致其细胞表面表达的丧失。然而,目前这些方法,包括其他方法,还不能被积极推荐,因为它们大多在单一的研究中得到了证明,而没有在其他研究中得到反复验证。因此,在统一的分析方案中对各种耗尽的汽车进行分析,明确它们之间的异同点,将是今后的研究课题。这一尝试将进一步提高CAR治疗的有效性。
数据和材料的可用性
不适用。
缩写
- 汽车:
-
嵌合抗原受体
- 识别:
-
T细胞受体
- MHC:
-
主要组织相容性复合体
- 阵线:
-
变量的片段
- cTCRs:
-
嵌合T细胞受体
- scFv:
-
单链可变区域片段
- 时差:
-
肿瘤微环境
- 全部:
-
急性淋巴细胞白血病
- 慢性淋巴细胞白血病:
-
慢性淋巴细胞白血病
- BCR:
-
B细胞受体
- FR:
-
框架区
- CDR:
-
Complementarity-determining地区
- RNAseq:
-
RNA序列
- ATAC-seq:
-
利用测序分析转座酶可达染色质
- ITAM:
-
基于酪氨酸的免疫受体激活基序
- 弟弟:
-
不稳定域
- 《港口:
-
前列腺特异性膜抗原
- PBMC:
-
外周血单个核细胞
- T供应链管理:
-
干细胞记忆T细胞
- ncNF -κB:
-
非规范NF -κB
参考文献
Gross G, Waks T, Eshhar Z.免疫球蛋白-T细胞受体嵌合分子作为具有抗体特异性的功能受体的表达。美国国家科学研究院。1989; 86:10024-8。
Eshhar Z, Waks T, Gross G, Schindler DG。通过由抗体结合域和免疫球蛋白和t细胞受体的γ或ζ亚基组成的嵌合单链特异性激活和靶向细胞毒性淋巴细胞。美国国家科学研究院。1993; 90:720-4。
仅通过T细胞受体-zeta链的信号不足以启动静息T淋巴细胞。中华检验医学杂志,1995;
芬尼HM,劳森AD,比宾顿CR,威尔AN。嵌合受体在T细胞中提供单基因产物的初级和共刺激信号。中华免疫杂志,1998;21(2):344 - 344。
非典型NF-kappaB通路在免疫和炎症中的作用。中华免疫杂志,2017;17:545-58。
Pegram HJ, Lee JC, Hayman EG, Imperato GH, Tedder TF, Sadelain M, Brentjens RJ。修改肿瘤靶向T细胞分泌IL-12根除系统性肿瘤,而不需要事先调理。血。2012;119:4133-41。
Hoyos V, Savoldo B, Quintarelli C, Mahendravada A, Zhang M, Vera J, Heslop HE, Rooney CM, Brenner MK, Dotti G.用白细胞介素-15和自杀基因工程cd19特异性T淋巴细胞以增强其抗淋巴瘤/白血病的作用和安全性。白血病。2010;24:1160 - 70。
何超,周勇,李震,Farooq MA, Ajmal I,张宏,张磊,陶玲,姚洁,杜波,等。il-7的共表达通过增强nkg2d为基础的car - t细胞的增殖、抑制凋亡和衰竭来改善前列腺癌的治疗。癌症。2020;12:1-17。
Salter AI, Rajan A, Kennedy JJ, Ivey RG, Shelby SA, Leung I, Templeton ML, Muhunthan V, Voillet V, Sommermeyer D,等。比较分析TCR和CAR信号,CAR设计具有优越的抗原敏感性和体内功能。科学信号。2021;14:eabe2606。
董锐,Libby KA, Blaeschke F, Fuchs W, Marson A, Vale RD, Su X.表达嵌合抗原受体(CAR)的T细胞信号网络的重组。Embo j. 2020;39: e104730。
Grupp SA, Maude SL, Shaw PA, Aplenc R, Barrett DM, Callahan C, Lacey SF, Levine BL, Melenhorst JJ, Motley L,等。用cd19靶向嵌合抗原受体(CTL019)改造的T细胞治疗复发/难治性ALL儿童的持久缓解。血。2015;126:681 - 681。
Porter DL, Frey NV, Melenhorst JJ, Hwang W-T, Lacey SF, Shaw PA, Chew A, Marcucci K, Gill S, Loren AW,等。针对复发难治性CLL (R/R)患者的嵌合抗原受体(CAR)修饰T细胞的随机II期剂量优化研究中华临床肿瘤学杂志。2016;34:3009-3009。
Shah NN, Fry TJ。CAR - T细胞治疗耐药机制。中国医学杂志,2019;16:372-85。
马丁内斯M,穆恩EK。实体肿瘤的CAR - T细胞:在肿瘤微环境中发现、浸润和存活的新策略前沿免疫杂志2019;10:1-21。
Zajac AJ, Blattman JN, Murali-Krishna K, Sourdive DJ, Suresh M, Altman JD, Ahmed R.由于激活T细胞持久性而导致的病毒免疫逃避。中华检验医学杂志1998;188:2205-13。
Vigano S, Bobisse S, Coukos G, Perreau M, Harari A.癌症与HIV-1感染:慢性抗原暴露模式。前沿免疫。2020;11:1350。
McKinney EF, Lee JC, Jayne DR, Lyons PA, Smith KG。自身免疫和感染中的t细胞衰竭、共刺激和临床结果大自然。2015;523:612-6。
艾哈默扎德M,约翰逊LA,海姆斯克B,温德利希JR,达德利我,怀特德,罗森博格SA。浸润肿瘤的肿瘤抗原特异性CD8 T细胞表达高水平的PD-1,功能受损。血。2009;114:1537-44。
张志刚,刘志刚,张志刚,冯勇。CAR - T细胞抗肿瘤抑制作用的研究进展。J clinin Invest, 2016; 126:3130-44。
Fraietta JA, Lacey SF, Orlando EJ, Pruteanu-Malinici I, Gohil M, Lundh S, Boesteanu AC, Wang Y, O 'Connor RS, Hwang WT,等。慢性淋巴细胞白血病对CD19嵌合抗原受体(CAR) T细胞治疗反应和耐药性的决定因素中华医学杂志2018;24:563-71。
Schuster SJ, Bishop MR, Tam CS, Waller EK, Borchmann P, McGuirk JP, Jäger U, Jaglowski S, Andreadis C, Westin JR,等。Tisagenlecleucel治疗成人复发或难治性弥漫性大b细胞淋巴瘤。中华医学杂志。2019;38:45 - 56。
邓琪,韩刚,Puebla-Osorio N,马mcj, Strati P, Chasen B,戴娥,党敏,Jain N,杨华,等。抗cd19 CAR - T细胞输注产品与大B细胞淋巴瘤患者疗效和毒性相关的特征医学杂志2020;26:1878-87。
Hochweller K, Wabnitz GH, Samstag Y, Suffner J, Hämmerling GJ, Garbi N.树突状细胞控制T细胞对外来抗原反应所需的强直性信号。美国国家科学研究院。2010; 107:5931-6。
高尔德SB,达尔波尔图JM, Cambier JC。B细胞抗原受体信号:在细胞发育和疾病中的作用。科学。2002;296:1641-2。
李志强,李志强,李志强,等。car介导的强直信号通路分析。方法Mol生物学2020;2086:223-36。
Watanabe N, Bajgain P, Sukumaran S, Ansari S, Heslop HE, Rooney CM, Brenner MK, Leen AM, Vera JF。微调CAR间隔可以提高t细胞的效力。肿瘤免疫学。2016;5:e1253656。
Frigault MJ, Lee J, Basil MC, Carpenito C, Motohashi S, Scholler J, Kawalekar OU, Guedan S, McGettigan SE, Posey AD,等。鉴定嵌合抗原受体介导T细胞的组成或诱导增殖。癌症免疫杂志2015;3:356-67。
李娟,何颖,郝娟,倪玲,董超。高eomes水平促进抗肿瘤CD8(+) T细胞衰竭。前沿免疫,2018;9:2981。
Beltra JC, Manne S, Abdel-Hakeem MS, Kurachi M, Giles JR, Chen Z, Casella V, Ngiow SF, Khan O,黄玉军,等。四个耗尽的CD8+ T细胞亚群的发育关系揭示了潜在的转录和表观遗传景观控制机制。免疫力。2020;52:825 e828——841.。
Long AH, Haso WM, Shern JF, Wanhainen KM, Murgai M, Ingaramo M, Smith JP, Walker AJ, Kohler ME, Venkateshwara VR,等。4-1BB共刺激改善嵌合抗原受体强压信号诱导的T细胞衰竭。医学杂志2015;21:581-90。
小舟EJ。T细胞衰竭。中华免疫杂志2011;12:492-9。
Tomkowicz B, Walsh E, Cotty A, Verona R, Sabins N, Kaplan F, Santulli-Marotto S, Chin CN, Mooney J, Lingham RB,等。TIM-3通过NFAT信号通路抑制抗cd3 / cd28诱导的TCR激活和IL-2表达。PLoS ONE。2015; 10: e0140694。
徐Kochenderfer约,费尔德曼SA,赵Y, H,黑色的马,摩根RA,威尔逊WH,罗森博格SA。抗cd19嵌合抗原受体的构建和临床前评估。中华免疫杂志,2009;32:689-702。
Lynn RC, Weber EW, Sotillo E, Gennert D, Xu P, Good Z, Anbunathan H, Lattin J, Jones R, Tieu V,等。大自然。2019;576:293 - 300。
王晓明,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明。慢性病毒感染过程中CD8+ T细胞衰竭的分子特征研究。免疫力。2007;27:670 - 84。
Gennert DG, Lynn RC, Granja JM, Weber EW, Mumbach MR, Zhao Y, Duren Z, Sotillo E, Greenleaf WJ, Wong WH,等。人CAR - T细胞衰竭的动态染色质调节景观。美国国家科学研究院。2021; 118: e2104758118。
Philip M, Fairchild L, Sun L, Horste EL, Camara S, Shakiba M, Scott AC, Viale A, Lauer P, Merghoub T,等。染色质状态定义肿瘤特异性T细胞功能障碍和重编程。大自然。2017;545:452-6。
Weber EW, Parker KR, Sotillo E, Lynn RC, Anbunathan H, Lattin J, Good Z, Belk JA, Daniel B, Klysz D,等。短暂休息通过表观遗传重塑恢复耗尽的CAR-T细胞的功能。科学。2021;372:eaba1786。
Almagro JC, Fransson J.抗体人格化。《生物科学》2008;13:1619-33。
陈艳,孙晨,陈艳,孙晨,陈艳,陈艳,陈艳,陈艳,陈艳,陈艳,陈艳,陈艳,陈艳,陈艳,陈艳。临床癌症杂志2019;25:2915-24。
Lee DW, Kochenderfer JN, stedler - stevenson M, Cui YK, Delbrook C, Feldman SA, Fry TJ, Orentas R, Sabatino M, Shah NN,等。表达CD19嵌合抗原受体的T细胞用于儿童和年轻人急性淋巴细胞白血病:1期剂量递增试验《柳叶刀》杂志。2015;385:517-28。
Maude SL, Frey N, Shaw PA, Aplenc R, Barrett DM, Bunin NJ, Chew A, Gonzalez VE, Zheng Z, Lacey SF,等。嵌合抗原受体T细胞用于白血病的持续缓解。中华外科杂志,2014;
Salter AI, Ivey RG, Kennedy JJ, Voillet V, Rajan A, Alderman EJ, Voytovich UJ, Lin C, Sommermeyer D, Liu L,等。嵌合抗原受体信号的磷酸化蛋白质组学分析揭示了影响细胞功能的动力学和定量差异。科学通报。2018;11:1-18。
Harush O, Asherie N, kfirl - erenfeld S, Adler G, Barliya T, Assayag M, Gatt ME, Stepensky P, Cohen CJ。抗bcma CAR靶向多发性骨髓瘤的临床前评估和结构优化。Haematologica》2022。https://doi.org/10.3324/haematol.2021.280169.
林志刚,刘鹏,王永华。4-1BB与cd28介导的共刺激的时间分离:4-1BB配体在主要反应后期影响T细胞数量,并调节流感感染后T细胞记忆反应的大小。中华免疫杂志2002;168:3777-85。
McLellan AD, Ali Hosseini Rad SM。嵌合抗原受体T细胞持久性和记忆细胞的形成。免疫细胞生物学,2019;97:664-74。
Kawalekar OU, O 'Connor RS, Fraietta JA, Guo L, McGettigan SE, Posey AD, Patel PR, Guedan S, Scholler J, Keith B,等。不同的信号共受体调节特定的代谢途径,并影响CAR - T细胞的记忆发育。免疫力。2016;44:380 - 90。
Grupp SA, Kalos M, Barrett D, Aplenc R, Porter DL, Rheingold SR, Teachey DT, Chew A, Hauck B, Wright JF,等。嵌合抗原受体修饰的T细胞治疗急性淋巴白血病。中华外科杂志,2013;368:1509-18。
波特DL, Levine BL, Kalos M, Bagg A, June CH.嵌合抗原受体修饰的T细胞在慢性淋巴细胞白血病中的作用。中华外科杂志,2011;
Brentjens RJ, Santos E, Nikhamin Y, Yeh R, Matsushita M, La Perle K, Quintas-Cardama A, Larson SM, Sadelain M.基因靶向T细胞根除系统性急性淋巴细胞白血病异种移植。临床癌症杂志2007;13:5426-35。
赵Z, Condomines M, van der Stegen SJC, Perna F, Kloss CC, Gunset G, Plotkin J, Sadelain M.工程共刺激的结构设计决定了CAR - T细胞的肿瘤排斥动力学和持久性。《癌症杂志》2015;28:415-28。
Cappell KM, Kochenderfer JN。含有CD28和4-1BB共刺激结构域的嵌合抗原受体的比较。中华临床医学杂志,2021;18(11):715-27。
Feucht J, Sun J, Eyquem J, Ho YJ, Zhao Z, Leibold J, Dobrin A, Cabriolu A, Hamieh M, Sadelain M. CAR激活电位的校准指导替代T细胞命运和治疗效力。中国医学杂志2019;25:82-8。
Guedan S, Madar A, Casado-Medrano V, Shaw C, Wing A, Liu F, Young RM, June CH, Posey AD Jr. cd28共刺激CAR-T细胞中的单个残留限制了长期持久性和抗肿瘤持久性。J clinin Invest, 2020; 130:3087-97。
Boucher JC, Li G, Kotani H, Cabral ML, Morrissey D, Lee SB, Spitler K, Beatty NJ, Cervantes EV, Shrestha B,等。CD28共刺激域靶向突变增强嵌合抗原受体t细胞功能。癌症免疫杂志2021;9:62-74。
Richman SA, Wang LC, Moon EK, Khire UR, Albelda SM, Milone MC.配体诱导的CAR - T细胞降解允许在体外和体内可逆的远程控制CAR - T细胞活性。Mol Ther 2020; 28:1600-13。
陈j, López-Moyado IF, Seo H, Lio CWJ, Hempleman LJ, Sekiya T, Yoshimura A, Scott-Browne JP, Rao A. NR4A转录因子限制CAR - T细胞在实体瘤中的功能。大自然。2019;567:530-4。
Sekiya T, Kashiwagi I, Yoshida R, Fukaya T, Morita R, Kimura A, Ichinose H, Metzger D, Chambon P, Yoshimura A. Nr4a受体对胸腺调节性T细胞发育和免疫稳态至关重要。中华免疫杂志,2013;14:230-7。
Pauken KE, Sammons MA, Odorizzi PM, Manne S, Godec J, Khan O, Drake AM, Chen Z, Sen DR, Kurachi M,等。耗尽的T细胞的表观遗传稳定性限制了PD-1阻断再活力的持久性。科学。2016;354:1160-5。
Stadtmauer EA, Fraietta JA, Davis MM, Cohen AD, Weber KL, Lancaster E, Mangan PA, Kulikovskaya I, Gupta M, Chen F,等。crispr工程T细胞在难治性癌症患者中的应用科学。2020;367:eaba7365。
陈晓明,陈晓明,陈晓明,朱斌,陈晓明。慢性病毒感染后CD8 T细胞功能恢复的研究进展。大自然。2006;439:682-7。
刘红,吴明明,梅泽,吉,等。CAR - T细胞联合淋巴衰竭和PD-1抑制治疗成神经细胞瘤患者。Mol Ther, 2017; 25:2214-24。
Adusumilli PS, Zauderer MG, Rivière I, Solomon SB, Rusch VW, O ' ceearbhaill RE, Zhu A, Cheema W, Chintala NK, Halton E,等。区域间皮靶向CAR -t细胞治疗恶性胸膜疾病患者联合抗pd -1药物派姆单抗的I期试验癌症发现。2021;11:2748-63。
tgf - β在稳态和癌症中的细胞抑制和凋亡作用。癌症杂志2003;3:807-21。
杨ZZ,格罗特DM,修B,齐斯默SC,普莱斯-特罗斯卡TL,霍奇LS,耶茨DM,诺瓦克AJ,安塞尔SM。TGF-β在b细胞非霍奇金淋巴瘤中上调CD70表达并诱导效应记忆T细胞衰竭。白血病。2014;28:1872 - 84。
Kloss CC, Lee J, Zhang A, Chen F, Melenhorst JJ, Lacey SF, Maus MV, Fraietta JA, Zhao Y, June CH.显性阴性TGF-β受体增强psma靶向的人CAR - T细胞增殖并促进前列腺癌的根除。Mol Ther, 2018; 26:1855-66。
Sommermeyer D, Hudecek M, Kosasih PL, Gogishvili T, Maloney DG, Turtle CJ, Riddell SR.嵌合抗原受体修饰的T细胞来源于定义的CD8+和CD4+亚群,在体内具有优异的抗肿瘤反应性。白血病。2016;30:492 - 500。
张勇,乔国强,贺克纳,朱军,艾默生。移植物抗宿主病中的宿主反应性CD8+记忆干细胞医学杂志,2005;11:1299-305。
Sabatino M, Hu J, Sommariva M, Gautam S, Fellowes V, Hocker JD, Dougherty S, Qin H, Klebanoff CA, Fry TJ,等。临床级cd19特异性car修饰CD81记忆干细胞的产生用于治疗人类b细胞恶性肿瘤。血。2016;128:519-28。
Ma A, Koka R, Burkett P. IL-2, IL-15和IL-7在淋巴稳态中的不同功能。中华免疫杂志2006;24:657-79。
Nair S,王俊杰,曹st,刘勇,朱伟,Slayton WB, Moreb JS,董林,常丽娟。通过内在白介素- 15r α信号通路改善嵌合抗原受体功能。Curr Gene Ther. 2019; 19:40-53。
确认
不适用。
资金
这项工作得到了以下资助者的部分支持;日本医学研究开发机构(AMED)的资助号为JP21cm0106406(给TS)和内藤基金(给TS)。资助者没有参与这篇文章的写作或提交发表的决定。
作者信息
作者及隶属关系
贡献
TK起草了主要文本、图表和表格。HH起草了主要文本和图表。TS负责监督工作,并对文本进行审核和修改。所有作者都对这篇文章做出了贡献,并批准了提交的版本。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
本文不涉及任何作者对人类或动物进行的任何新研究。
发表同意书
本文不包含任何个人的任何形式的资料。
相互竞争的利益
作者声明,这项研究是在没有任何商业或财务关系的情况下进行的,这些关系可能被解释为潜在的利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
Kouro, T, Himuro, H. & Sasada, T. CAR - T细胞衰竭:潜在原因和解决方案。翻译医学杂志20., 239(2022)。https://doi.org/10.1186/s12967-022-03442-3
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-022-03442-3
关键字
- 嵌合抗原受体
- 疲惫
- 主音信号
- 细胞工程
- 表观遗传学