摘要
自然杀伤细胞(NK)作为一种重要的先天性免疫调节细胞类型,作为一种有前景的细胞免疫治疗替代平台,近年来受到广泛关注。NK细胞可以通过非mhc限制作用快速杀死多个相邻癌细胞。虽然肿瘤可能对内源性NK细胞的攻击产生多种耐药机制,但体外活化、扩增和基因修饰NK细胞可大大增强其抗肿瘤活性,使其具有克服耐药的能力。其中一些方法已经转化为临床应用,在恶性血液病和实体瘤患者中进行NK细胞输注的临床试验迄今为止取得了许多令人鼓舞的临床结果。CAR-T细胞在治疗恶性血液病方面取得了巨大成功,但其缺点包括制造成本高和潜在的致命毒性,如细胞因子释放综合征。为了克服这些问题,通过基因工程产生了CAR-NK细胞,与CAR-T细胞治疗相比,CAR-NK细胞表现出显著的临床反应和较低的不良反应。本文综述了NK细胞免疫治疗的最新进展,重点介绍了NK细胞的生物学和功能、NK细胞治疗的类型、NK细胞治疗的临床试验和未来展望。
简介
在全球范围内,癌症是对人类健康的一大威胁,也是导致死亡的主要原因之一[1].几十年来,手术、化疗和放疗一直是治疗患者肿瘤的主要方法。2].然而,对化疗和/或放疗产生耐药性与癌症复发率高有关[3.,4,5].这些癌症的治疗可以降低体力和损害免疫反应,这可能导致复发以及治疗后体内剩余肿瘤细胞的转移。因此,学者们应该尽快发现消除这些耐药癌细胞的新策略。多年来,免疫细胞已被证明是癌症的重要靶标。到1984年,免疫治疗被认为是手术、化疗和放疗之后的第四种治疗方法[6].
免疫细胞大致赋予先天免疫和适应性免疫,通过免疫监测积极避免癌症的发展[7,8,9,10].先天免疫细胞包括自然杀伤细胞(NK)、树突状细胞(dc)、单核细胞和巨噬细胞[11,12].这些细胞通过即时和短暂的免疫反应介导细胞因子的释放。细胞因子然后驱动以下过程:(i)直接溶解癌细胞或捕获死亡的癌细胞;(ii)吞噬癌细胞进行抗原处理;(iii)活化T细胞介导的适应性抗肿瘤免疫反应;(iv)释放含有穿孔素和颗粒酶的细胞质颗粒,直接杀死癌细胞等[13,14,15,16,17].T细胞和B细胞构成适应性免疫细胞,负责长时间的抗原特异性反应和有效的免疫记忆[13].
尽管我们体内存在先天和适应性免疫反应,但癌细胞可以通过几种机制逃避免疫监测[18,19,20.,21,22,23,24(图。1).例如,它们分泌免疫抑制细胞因子TGF-β和IL-10,抑制适应性抗肿瘤免疫反应[25,26]或将肿瘤相关巨噬细胞(tam)极化到M2表型,M2表型具有明显较低的抗肿瘤潜力,但高度促进肿瘤生长和转移能力[27].有些癌症会影响IL-6的释放[28], il-10 [29], vegf [30.],或GM-CSF [31]并通过灭活或抑制成熟而损害DC的功能。一些肿瘤诱导T调节细胞抑制肿瘤特异性T细胞反应[18].一些癌症还诱导PD-L1的表达,从而通过与PD-1相互作用耗尽T细胞[32].在正常情况下,避免被巨噬细胞吞噬的红血细胞会表达“不要吃我”的信号,而衰老的红细胞则不再具有表达CD47的能力,被巨噬细胞吞噬[33,34,35].其他癌症也表达CD47以避免肿瘤微环境(TME)中巨噬细胞的吞噬[27,36,37].此外,恶性细胞表达最低水平的肿瘤相关抗原,清除NK细胞激活受体配体,或改变MHC-I的表达以及共刺激生物分子以逃避免疫反应[13,38].
免疫疗法通过激活免疫反应来触发前瞻性的主动或被动抗肿瘤反应来对抗癌症[39,40].迄今为止,几种癌症免疫疗法已应用于临床实践,如细胞因子[10,41,42],单克隆抗体[43]、疫苗[44,45,46],过继细胞转移(T [47,48,49,50,51,52], dc [53,54,55], nk [56,57]和NK-T [58,59]),以及toll样受体(TLR)激动剂[60,61,62].特别是,NK细胞免疫疗法在30多年来一直保持着很高的前景。近年来,在NK细胞生物学领域,NK细胞作为一种有效的癌症免疫治疗工具的功能的理解取得了显著的进展。值得注意的是,NK细胞疗法已经过临床I/II期试验。在本文中,我们综述了NK细胞免疫治疗的最新进展,重点介绍了NK细胞的生物学、NK细胞治疗的功能和类型、临床试验以及NK细胞治疗的未来展望。
NK细胞的发育、分类和分布
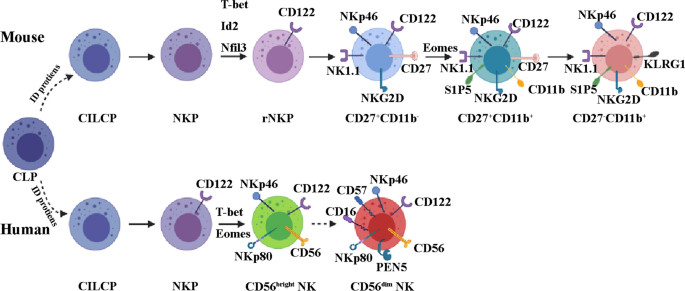
NK细胞是一种独特的淋巴细胞亚群,其体积大于T淋巴细胞和B淋巴细胞,并含有独特的细胞质颗粒[63].1975年,赫伯曼等人首次发现了它们。[64]和Kiessling等人。[65].NK细胞起源于CD34+在此过程中,普通淋巴细胞祖细胞(CLPs)稳定下调CD34,上调CD56。这些事件促使NK细胞在成熟过程中分化[66,67,68,69].在人类中,接近CLPs的多能祖细胞有可能产生ILCs的所有亚群。ILC限制的普通ILC前体(CILCP)源于CLP,随后生成nk限制的NKP。NKs与CD122表达及CD34和CD127的缺失有关。值得注意的是,T-bet和Eomes的表达是功能性NK细胞进一步分化所必需的[70,71,72].在小鼠体内,CLP细胞产生CILCP, CILCP依次生成NK细胞和helper-like ilc。从CILCPs开始,NK细胞的发育至少包括五个阶段:NKP→rNKP→CD27+CD11b−nk→cd27+CD11b+nk→cd27−CD11b+NK (73,74(图。2).
NK细胞发育。在小鼠中,共同淋巴样祖细胞(CLP)产生共同的ILC前体CILCP。CILCP可以产生NK细胞和辅助ilc。在从CILCP发育NK细胞的过程中,至少还有五个其他阶段:NK祖细胞(NKP)、精制NKP (rNKP)、CD27+CD11b−NK, CD27+CD11b+NK和CD27−CD11b+NK。在人类中,从CLP发展出CILCP后,将从后者发展出nk -限制性的NKP。NKs的特点是表达CD122,缺失CD34和CD127。T-bet和Eomes的表达是进一步分化为功能性NK细胞所必需的。CD56的表达可将NK细胞分为两个亚群:CD56昏暗的和CD56明亮的.这两个亚群表达活化的表面受体NKp46和NKp80。CD56+NK细胞可分化为CD56−NK细胞表达CD16, PEN5和CD57
由于NK细胞表达许多表面标记物,因此存在对NK细胞的不同亚群进行分类的独特方法[70,75,76].根据CD56的表达,它们被分为两个细胞亚群,即CD56低/暗和CD56明亮的.特别是CD56低/暗NK细胞具有抗肿瘤细胞毒性,但两个亚群都能分泌细胞因子[57,77,78].NKp46-和nkp80激活表面受体在两种NK细胞亚群中均有表达[79,80,81].CD56明亮的NK细胞特化成CD56昏暗的NK细胞通过表达CD16和PEN5 [82,83].同样,在小鼠中研究了基于CD11b、CD226 (DNAM-1)、CD27和KLRG1表达的不同亚群[84,85].然而,迄今为止还没有在人类NK细胞亚群和小鼠NK细胞亚群之间建立等价性[86].
NK细胞广泛分布于淋巴组织和非淋巴组织,包括骨髓、肝脏、肺、淋巴结(LNs)、脾脏、肝脏和外周血[87,88].研究还发现NK细胞存在于其他几个器官,包括小鼠的子宫、肠道、皮肤、脂肪组织、膀胱、胸腺、扁桃体、肾脏、胰腺和大脑[88].一般来说,CD56低/暗在人类血液中占主导地位的是CD56亚群明亮的亚群在淋巴结中更占优势[13,89].
NK细胞的激活和抑制
抑制和激活信号
NK细胞分泌几种抑制性和激活性信号分子。在稳定状态下,抑制受体阻止NK细胞的激活及其随后的杀伤作用。NK细胞以非mhc限制性的方式识别靶细胞,然后识别靶细胞上表达的MHC-I分子。这种识别抑制了NK细胞的刺激,并防止它们攻击身体[13,89,90,91,92].在压力下,靶细胞减少MHC-I的表达。因此,NK细胞失去了抑制信号,并通过“缺失自我识别”过程被激活[13,89,90,91,92,93,94,95].一些非mhc生物分子,如Clr-b、CD48和LLT-1,由抑制性受体NKR-P1B识别[96], 2b4 [97],及NKR-P1A [98],分别也起激活作用。其他抑制性受体是杀伤细胞免疫球蛋白样受体(KIRs;例如,KIR2DL和KIR3DL) [99]和c型凝集素受体(CD94/NKG2A/B) [One hundred.].表格1表示与NK细胞相关的抑制受体处于稳定状态。越来越多的证据表明,NK细胞表达的激活受体具有潜在的病原体编码分子或自表达蛋白的识别能力[13].在正常情况下,宿主不分泌病原体编码的生物分子,这种识别被称为“非自我识别”[13].此外,疾病感染或转化的细胞已被发现上调自我产生的蛋白质。这种现象被称为“压力引发的自我认知”。[13].刺激受体包括细胞毒性受体NKp44 [101], NKp46 [79],及NKp30 [102];c型凝集素受体NKG2E/H [103], cd94 / nkg2c [104,105], nkg2f [103],及NKG2D [106];以及基尔- 3ds和基尔- 2ds [99],而抑制性受体包括CD94/NKG2A/B和基尔- 2dl和基尔- 3dl [99,One hundred.].表格2显示与NK细胞相关的激活受体处于稳定状态。总的来说,NK细胞通过识别刺激和抑制信号的数量来识别它们的目标,其结果取决于目标细胞的性质。
TME中增加NK细胞的调节细胞因子
正在进行的对NK细胞的研究提供了越来越多的证据,表明它们在病毒感染的早期调控中发挥着关键作用,在造血干细胞移植(HSCT;改善移植、移植物抗肿瘤效应和移植物抗宿主病),以及在癌症免疫监测等方面[107].几种调节细胞因子诱导NK细胞作为肿瘤靶点的功能[108].多种细胞因子(IL-2、IL-21、IL-12、IL-18和IL-15)和I型干扰素可用于体外增殖,并在过继转移前诱导NK细胞。值得注意的是,单个激活受体在naïve NK细胞中触发细胞因子分泌或细胞毒性不足。暴露于细胞因子在NK细胞的预激活中起着显著作用。IL-12增强NK细胞激活受体的信号通路[109].IL-12与IL-15和IL-18结合尤其有吸引力,因为它诱导了记忆样NK细胞群,这些细胞群在外源性IL-2接种的免疫功能不全小鼠中生长[110].注射NK细胞的患者经常给予IL-2以促进体内扩张[111].一项研究发现,以低剂量重复施用IL-2具有良好的耐受性;然而,在相应的配对评估中,没有报道IL-2治疗的临床获益[112].IL-12和IL-18作为单剂的抗恶性作用非常小[108].相比之下,IL-21是有效的,特别是与癌症靶向单克隆抗体(mAbs)结合时[113].IL-15细胞因子是最有希望的一种,在NK细胞中建立IL-15信号机制方面取得了进展[108].一项涉及转移性癌症患者的I期临床试验发现,每天给药IL-15可诱导NK细胞增殖,并显著提高NK细胞数量[114].即使在试验中没有客观的反应报告,一些个体表现出很少的标记性病变。在另一项研究中,发现il -15触发的NK细胞在六分之四的儿童实体性难治性癌症患者中诱导临床反应[115].目前,IL-15正在进行一项通过注入NK细胞治疗实体癌和恶性血液病的试验(NCT01385423和NCT01875601临床试验)。超级激动剂ALT-803 (IL15N72D:IL15RαSu/IgG1 Fc复合物)显示出相对于天然IL-15的显著生物学影响。这种有希望的NK细胞抗转移诱导剂正在进行临床试验(NCT02099539)。此外,IL-15异位表达的基因工程是促进NK细胞作用的另一种潜在方法。I型IFN是一种促炎细胞因子,可通过激活受体预激活NK细胞,为其激活做好准备[110].为此,调节细胞因子在刺激NK细胞杀伤肿瘤中起着不可或缺的作用。许多激活NK细胞的细胞因子目前正处于临床或临床前开发阶段。
NK细胞介导的抗肿瘤机制
直接抗癌
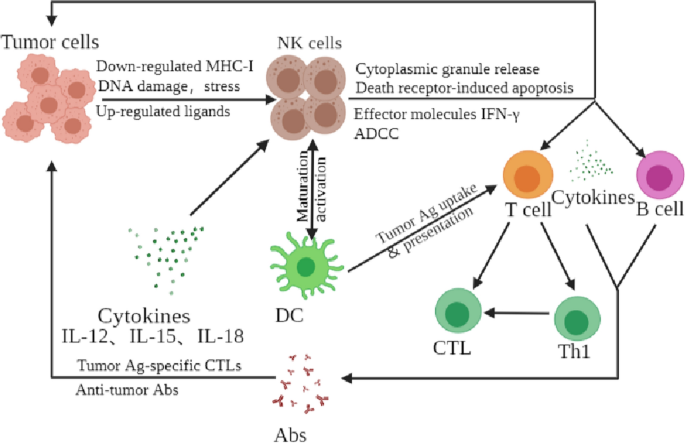
根据之前的研究,NK细胞已经进化出多种从肿瘤细胞中识别健康细胞的机制。值得注意的是,NK细胞对肿瘤细胞的杀伤是非mhc - i和非抗体依赖的[13].为了逃避肿瘤侵袭细胞毒性T细胞的识别,MHC-I在肿瘤细胞表面的表达经常减少或丢失[13].然而,放弃MHC-I自我表达的肿瘤或含有“改变自我”应激诱导蛋白的肿瘤会导致NK细胞刺激受体的配体表达不受调节[13].因此,由于NK细胞通过最初识别某些“应激”或“危险”信号而受到刺激,毫无疑问,肿瘤细胞是理想的NK细胞靶点[13].利用NK细胞对mhc - i缺陷的同源癌细胞的选择性排斥反应分析,首次证实了NK细胞识别肿瘤细胞的“自我缺失”模型[116].此外,NK细胞抑制受体可以检测MHC-I表达的这种缺陷。通过它们的激活受体,NK细胞可以通过检测应激触发的自我配体来杀死特定的MHC-I充足的癌细胞[90].综上所述,NK细胞介导的直接细胞毒性具有显著的抗癌作用。NK细胞通过多种机制直接杀伤癌细胞,具体机制如下:(1)NK细胞释放杀伤介质穿孔素和颗粒酶引起恶性细胞凋亡,这一过程需要NK细胞识别受体与肿瘤细胞直接接触;CD56的低/暗NK细胞亚群主要通过这一机制杀伤靶细胞[117].(2) NK细胞通过膜TNF家族分子(FasL、TRIAL、mTNF)与肿瘤细胞膜配体结合,触发细胞凋亡。该过程不需要NK细胞识别受体与肿瘤细胞和CD56直接接触明亮的NK细胞亚群杀死恶性细胞[57].(3) NK细胞作为抗肿瘤抗体IgG1和IgG3之间的桥梁,Fab特异性识别肿瘤,Fc段与NK细胞FcRγ IIIa结合,触发抗体依赖的细胞介导细胞毒性(ADCC) [118].(4) NK细胞产生大量构成IFN-γ的细胞因子,这些细胞因子通过抑制肿瘤血管生成和激活适应性免疫反应等不同机制发挥抗肿瘤作用[119(图。3.).
NK细胞在肿瘤免疫监测中的应用。该图显示了NK细胞在肿瘤免疫监测中的潜在作用。NK细胞最初通过压力或危险信号识别肿瘤细胞。活化的NK细胞通过至少四种机制直接杀伤靶细胞:细胞质颗粒释放、死亡受体诱导的凋亡、效应分子产生或ADCC。此外,NK细胞作为调节细胞与树突状细胞相互作用,提高树突状细胞的抗原摄取和递呈,促进抗原特异性CTL反应的产生。此外,活化的NK细胞诱导CD8+T细胞通过产生细胞因子如IFN-γ成为ctl。活化的NK细胞也促进CD4+T细胞向Th1反应分化并促进CTL分化。NK细胞产生的细胞因子也可能调节B细胞产生抗肿瘤抗体。Abs,抗体;ADCC,抗体依赖性细胞毒性;CTL,细胞毒性T淋巴细胞;DC,树突细胞;干扰素干扰素;朝鲜,自然杀手
间接抗癌
NK细胞具有免疫调节作用,其对包括dc、巨噬细胞、T细胞和B细胞在内的众多免疫细胞的功能具有前瞻性影响[107,120].此外,各种细胞因子、生长因子和趋化因子通过这些免疫细胞的相互作用而产生[107,120].受刺激的NK细胞分泌IFN-γ触发CD8的转化+T细胞转化为细胞毒性T淋巴细胞(ctl)和CD4的特化+T细胞转化为Th1细胞。这就促进了CTL分化[121].NK细胞源性细胞因子也可调节B细胞产生的抗肿瘤抗体[122].此外,被NK细胞杀死的癌细胞可以将癌症抗原传递给dc,促使dc成熟并呈递抗原[123].活化的NK细胞可以通过裂解被吞噬后再处理外源抗原的外周dc,向其他dc提供更多的抗原细胞碎片[123].因此,为了促进抗肿瘤免疫,激活的NK细胞调节DC刺激和成熟。这些DCs可能促进抗原特异性CTL反应的产生,因为它们可以交叉呈现癌症特异性抗原(源于NK细胞触发的肿瘤裂解)和CD8 T细胞[124].
基于NK细胞的治疗策略
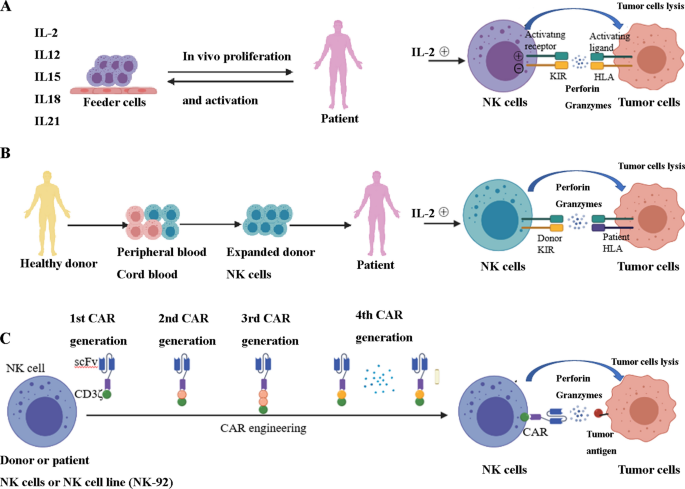
许多临床方法都是通过刺激NK细胞来杀伤癌细胞。细胞因子,自体和异基因NK细胞,以及基因编辑的CAR-NK细胞免疫治疗目前在NK细胞治疗领域处于领先位置(图2)。4).
基于NK细胞的治疗策略。一个自体NK细胞转移:细胞因子IL-2、IL-12、IL-15、IL-18、IL-21体外可刺激患者血液中的NK细胞,并在肿瘤患者体内注入NK细胞后促进NK细胞增殖和活化。NK细胞接触并识别肿瘤细胞上的受体后,释放穿孔素和颗粒酶,引起肿瘤细胞凋亡。B异基因NK细胞移植:来自健康捐赠者外周血的NK细胞在体外扩增并注入癌症患者。NK细胞与供体KIR释放穿孔素以及颗粒酶接触并识别肿瘤细胞上的HLA受体后,引起肿瘤细胞凋亡。如果ir配体失配,则不存在负信号。Ccar工程NK细胞:有四代不同的CARs,它们向NK细胞传递刺激信号。通过基因工程修饰,CAR可以与NK细胞表面表达的肿瘤特异性抗原结合。输血后,可以特异性识别具有特异性抗原的肿瘤细胞,并触发免疫反应,达到清除肿瘤细胞的目的
细胞因子
细胞因子IL-18、IL-2、IL-15、IL-21、IL-12可以通过刺激NK细胞来减弱肿瘤内的免疫抑制微环境。抑制或激活NK细胞活性的细胞因子相互冲突的特性破坏了这一现象[125].例如,NK细胞对恶性细胞的抑制作用随着IL‐2的注射而增强。然而,IL‐2的使用很少,因为它的不良毒性是由调节性T细胞群的扩张引起的[126].最近的一份报告记录了IL‐2白喉毒性融合促进体内NK细胞生长。同时清除Treg细胞。此外,在体外实验中,使用IL-2、IL-21和IL-15单独或联合使用时,抑制性检查点受体TIM-3在人NK细胞中升高。一种由白喉毒素和截短的IL-2 (IL-2DT)组成的重组融合蛋白被设计用于消耗Tregs [127].结果显示单倍体NK细胞在体内增殖增强,导致急性髓系白血病(AML)缓解[127].
IL-15在NK细胞治疗中引起了广泛关注,因为它具有有益的特性,其中调节性T细胞不放大但显著激活NK细胞[128].IL-15与其受体的相互作用产生一种独特的复合物,降低IL-2Rβ对NK细胞的亲和力,并抑制IL-2对Treg细胞扩张的激活影响[129].一种IL-15超级激动剂复合物,即ALT-803,最近被发现可能会升高NK细胞并增强其细胞毒性。然而,体内和体外实验证明,与间歇暴露相比,不断接种IL-15的NK细胞会消耗更多的NK细胞。然而,ALT-803在实体瘤和血液系统恶性肿瘤中仍有临床反应[130,131].给予患者联合PD-1单抗的ALT-803方案逆转,难治性疾病支持一组新型NSCLC药物的抗肿瘤作用[130].在ALT-803的I期首次人体多中心试验中,在异基因hct后60天复发>的研究对象中,发现它是一种安全且耐受性良好的药物。它还显著升高NK和CD8+T细胞的功能。这种免疫激活IL-15超级激动剂应进一步研究,以单独促进抗癌免疫,以及与其他免疫疗法联合使用[131].
此外,IL-12可与IL-15、IL-2和/或IL-18协同激活NK细胞[132].用IL-12预刺激NK细胞,用IL-15和IL-18激活它们,会导致记忆样NK细胞延长生存期和增强功能。IL-12的激活需要STAT4的刺激,而IL-15、IL-18和IL-12的协同作用则不需要[15].NK细胞的细胞毒性降低已在地震-有缺陷的老鼠;然而,单独的IL-18不能充分诱导IFN-γ的产生。IL-12单独或联合IL-15可用于鉴别CD34+用于治疗目的的体外NK细胞造血干细胞[15].
IL-21和IL-2协同作用,导致NKG2A、穿孔素、CD25、颗粒酶B、CD69和CD86的升高,与人NK细胞的高细胞毒性有关[85].IL-21还可逆转NK细胞衰竭,促进小鼠癌症消退[133].il -21激活的NK细胞调节细胞内病原体的扩增,如丙型肝炎病毒结核分枝杆菌[15].在最近的一项研究中,人类NK细胞通过IL-21与自体供体细胞一起升高以产生CAR-NK细胞[134].尽管利用NK-92细胞系的研究已经证明了强有力的结果,但优化供体或患者体内功能NK细胞的体外提升对于生成安全有效的CAR-NK细胞至关重要。
尽管进行了大量的临床和转化实验,以揭示更有效的细胞因子来触发NK细胞,但与NK细胞和细胞因子相关的研究仍然不成熟。了解各种趋化因子对NK细胞设计过程的影响的根本必要性值得进一步探索。
异基因和自体NK细胞治疗
异基因或自体NK细胞来源于外周血[57].它们也可以来源于脐带血或骨髓,以及受刺激的多能干细胞或人类胚胎干细胞,目前正被探索作为具有临床意义的NK细胞的潜在来源[57].NK细胞祖细胞或成熟NK细胞可作为造血干细胞移植的一部分与其他细胞灌注,或在预富集过程后单独灌注[57].
供体异基因NK细胞(如KIR)上的抑制性受体在类不匹配的情况下不识别受体细胞上的人类白细胞抗原(HLA) I类。因此,供体NK细胞被解除其抑制受体触发的抑制。在这种情况下,癌细胞缺乏合适的I类MHC配体来参与抑制性KIR,因此,它们被异基因反应性NK细胞去除[13].大量报告显示,异基因NK细胞有可能引发包括AML和多发性骨髓瘤(MM)在内的血液系统恶性肿瘤个体的缓解或抑制复发[57,125].这是由于体外扩展和激活HSCT或游走NK细胞治疗[57,125].在一项单倍体NK细胞治疗AML的临床试验中,作者报告了在一项儿科队列研究中,预后不佳或老年个体的完全缓解和18个月的100%无事件生存率[135].异基因反应性NK细胞有能力通过消除宿主抗原提呈细胞来避免移植物抗宿主病(GVHD) [136].然而,这一保护性影响受到了一项研究的挑战,该研究表明,在同种异体造血干细胞移植后,输注IL-15和CD137L(共刺激受体CD137配体)刺激的供体NK细胞,通过促进基础的T细胞异体反应,加剧了急性GVHD [137].注入的NK细胞的起源和发展的差异可以解释这些矛盾的发现。的确,在ir不匹配的移植物中,T细胞耗竭不足可能导致严重的GVHD,并抵消了异基因NK细胞的临床益处[138].总的来说,进一步的研究有必要探索将受益于异基因NK细胞输注的离散条件和癌症类型。
在接受自体造血干细胞移植的血液病癌症患者中,血液NK细胞的数量在移植后早期恢复。在这些患者中,几种NK细胞与阳性结果相关,这说明了NK细胞的抗癌能力[139,140].其他报道表明,在转移性黑色素瘤、晚期胃肠道癌或肾细胞癌患者中,自体NK细胞扩增和输注并不能转化为临床反应[141,142].值得注意的是,通过二次输注在循环中持续存在的NK细胞不能杀死肿瘤细胞,除非它们在体外被重新刺激。这一发现强调了需要组合方法来充分利用自体NK细胞的能力[108].
综上所述,同种异体和自体NK细胞治疗单独或联合常规治疗均显示出临床疗效。表格3.总结了将NK细胞注入癌症患者体内的临床试验结果。自体NK细胞的研究正在进行中,目前正在进行约50项临床试验。此外,关于异基因NK细胞转移疗效的研究目前正在进行中,并显示出良好的临床潜力(例如,NCT00720785、NCT03068819、NCT02782546、NCT01898793、NCT03081780、NCT03319459、NCT03213964、NCT03019640、NCT01729091、NCT01787474、NCT02809092、NCT02271711和NCT03579927)。使用异基因NK细胞的过继细胞治疗与自体NK细胞有相似的缺点,如及时的体外扩增以及临床级NK细胞的激活以及输注后的体内持久性。在未来,科学家们应该在这一领域投入更多的精力来改进NK细胞的治疗方法。
CAR-NK细胞疗法
背景
最近,美国食品和药物管理局(FDA)批准了靶向CD19的CAR-T细胞疗法,这是癌症转基因细胞疗法设计的一个关键突破。这也引起了人们对CAR-NK细胞制备用于肿瘤免疫治疗的关注[143].在临床研究中,输注未修饰的异基因NK细胞已显示出轻微的疗效,特别是在AML中。然而,它们短暂的寿命(输血后2-3周)在一定程度上限制了它们的成功。异基因NK细胞尽管能够发挥异基因反应性,但不会引起急性GVHD。因此,相对于CAR-T细胞,异基因NK细胞是不需要其他基因修饰的潜在治疗药物。因此,NK细胞的新颖生物学特性使其成为基于转基因免疫细胞的免疫治疗的更有吸引力的来源。
研究概述
研究的进步使汽车的设计逐步改进。目前存在几代CARs:第一代CARs由一个信号区域的基本结构组成[144];第二代CARs有一个额外的共刺激结构域,如CD28或4-1BB [145,146];第三代car具有多个共刺激域[147,148];第四代car具有多个共刺激结构域和细胞因子信号(图。4C).已经探索了许多共刺激结构域,包括免疫球蛋白超家族成员(CD28和ICOS)、TNF受体超家族成员(4-1BB、CD27、OX40和CD40)和其他成员(例如CD40L和TLR) [149].一开始,用于CAR- nk细胞的CAR结构针对t细胞信号和功能进行了优化。尽管CAR设计中使用的某些信号/共刺激结构域(如CD3ζ和4-1BB)在T细胞和NK细胞之间共享,但NK细胞中其他共刺激分子(如CD28)的作用是难以捉摸的[150].迄今为止,已经发表了大量关于nk细胞信号通路DAP10、DAP12和2B4具有更高特异性的报道[151,152].DAP10和DAP12是含有免疫受体酪氨酸激活的激活基序,并向NK细胞传递刺激信号。DAP10向激活受体NKG2D发出信号,而DAP12通过NKG2C、NKp44和激活杀手免疫球蛋白受体(KIR)介导信号传递。另一种激活受体是2B4,属于信号淋巴细胞激活分子(SLAM)家族;当2B4与天然配体CD48结合时,2B4通过其基于酪氨酸的免疫受体开关基序,募集slam相关蛋白(SAP) (ITSM)等关节分子来介导信号转导[153].最近,4th对第一代car进行了调查[154].这些载体结合转基因“有效载荷”,旨在促进car工程NK细胞的生长、持久性和抗肿瘤活性。迄今为止,已经发表的结果证明了这些最新的CAR设计修订版具有优越的活性,并且CAR修饰的NK细胞在现有癌症免疫治疗方法中的功能扩展是有希望的[155,156].
NK细胞来源
此外,科学家们还探索了产生表达car的NK细胞的不同细胞来源。这些细胞来源包括外周血[157,158,159]、脐带血[134,156,160,161,162,163]、干细胞(包括造血干细胞及受刺激多能干细胞)[66,164,165],以及NK细胞株[162,166,167].值得注意的是,每种来源都有其独特的优点和缺点(表4).
CAR-NK在癌症中的临床疗效
目前,CAR-NK细胞疗法已经在血液癌和实体肿瘤(包括白血病、淋巴瘤、骨髓瘤、卵巢癌和胶质母细胞瘤)中产生了临床前的抗恶性活性[168].在一些临床试验中,该疗法已显示出疗效。
AML
在2018年,建华的研究组报告了一项涉及CD33-CAR NK细胞的I期首次人体临床试验,用于复发和难治性AML患者[169].在他们对CD33-CAR-NK细胞的研究中,他们招募了三名患者并测试了他们的安全性,但没有报告不良事件。值得注意的是,作者透露,CAR NK-92细胞的生成成本比CAR- t细胞低得多,并且相信即使经过优化,它们也可以广泛用于癌症管理[169].
淋巴瘤
2020年,Rezvani等人证明源自脐带血的同种异体CAR-NK细胞对高风险B细胞淋巴瘤和CD19有益+慢性淋巴细胞白血病(156].CAR-NK细胞的使用与细胞因子释放综合征、神经毒性或GVHD的发生无关联。此外,包括IL-6在内的炎症细胞因子的数量没有超过基线水平,也没有达到最大耐受剂量。11例患者中有8例(73%)缓解,其中7例患者(4例淋巴瘤,3例CLL)完全缓解,而1例患者里克特转化部分缓解但持续CLL。他们的反应是迅速的,并报告了输注后30天的所有剂量水平。注入的CAR-NK细胞被扩增,然后以低量持续至少一年[156].Fate Therapeutics公司最近公布了一种异基因ipsc衍生CAR-NK细胞FT596的临床数据。FT596单药治疗显示出持久的肿瘤清除和延长的体内生存,证明了ipsc衍生的NK细胞疗法作为一种新型癌症免疫疗法的发展前景[170].此外,FT596对CD20的杀伤能力增强+与单独使用利妥昔单抗相比,联合利妥昔单抗对体内淋巴瘤细胞的影响。这初步表明抗体药物与NK细胞治疗联合使用可产生协同效应,是CAR-NK细胞发展的另一个新方向[170].
毫米
MM是一种由B淋巴细胞向浆细胞分化过程中发生的基因突变引起的恶性肿瘤。MM细胞系中常见的肿瘤抗原包括细胞表面糖蛋白CD2亚群1 (CS1) [171], cd138 [172], BCMA [173].CAR-NK细胞产品用于治疗MM的研究相对较少,目前用于治疗MM的大多数CAR-NK细胞产品使用NK92细胞系,使用的肿瘤抗原多为CS1 [174]及CD138 [175].CS1是MM细胞表面的高表达蛋白,主要参与MM细胞的粘附和生长[174].CD138参与MM细胞的粘附、生长和成熟,是MM的主要诊断标志物。体外研究表明,分别以CS1和CD138为靶点设计的CS1- car - nk92细胞和CD138- ifn α- car - nk92细胞成功抑制MM细胞生长,延长骨髓瘤小鼠的生存时间[174].
实体肿瘤
CAR-T细胞在对抗实体瘤时受到PD-1/ pd - l1介导的免疫抑制。具有非常低的表面PD-1表达和相对较少的肿瘤微环境免疫抑制的NK细胞可能是对抗实体肿瘤的良好候选细胞。在实体肿瘤研究中,CAR-NK细胞主要靶向表达肿瘤相关抗原的转移性实体恶性肿瘤,如HER2、PSMA、间皮素、ROBO1或MUC1,包括前列腺癌、卵巢癌、乳腺癌、胰腺癌和非小细胞肺癌。此外,PD-L1在几种癌症类型的TME和免疫抑制细胞中上调。一种新的NK-92细胞系被设计用于靶向PD-L1、er保留的IL-2和一种称为PD-L1靶向haNK (t-haNK)的高亲和力CD16 CAR。令人振奋的临床前数据表明,这些细胞在体外对15种肿瘤细胞系具有特异性抗肿瘤作用,在体内对三阴性乳腺癌、膀胱癌和肺癌具有强抗肿瘤作用。QUITL3.064 I期临床试验(NCT04050709)目前正在与PD-L1 t-haNK联合其他药物评估局部晚期或转移性胰腺癌患者(NCT0439099)的安全性和有效性。
鉴于CAR-NK细胞治疗的安全性和有效性,目前正在进行大量血液肿瘤和实体肿瘤的临床试验。表格5介绍了CAR-NK细胞治疗恶性血液病和实体瘤的临床试验。
CAR-NK细胞的优势和挑战
NK细胞有一些强大的治疗优势。(1)它们的获取范围更广,可以从异基因细胞中提取,不需要依赖患者自身的特异性免疫细胞。(2) NK细胞不需要MHC分子来进行抗原提呈或抗原激活,可以靶向广泛的致病抗原,具有更大的细胞毒性。(3) NK细胞不分泌触发CRS的主要细胞因子,可大大降低不良反应的风险。(4)同种异基因NK细胞也不引起移植物抗宿主反应。然而,CAR-NK细胞治疗仍然存在一些困难和困境。(1)体外扩增NK细胞是CAR-NK细胞免疫治疗的首要障碍。单个供体的NK细胞数量不足以进行治疗,因此NK细胞的扩增和激活至关重要。这种生产过程通常需要两到三周的时间培养NK细胞。因此,获取足够的NK细胞仍然是一个挑战。 (2) Selecting the appropriate method for transducing CARs into NK cells is the key to CAR-NK cell immunotherapy [57].到目前为止,病毒和非病毒载体都被用于转化car。虽然逆转录病毒载体具有很高的转染效率,但它们可能引起插入突变、致癌和其他不良反应。相比之下,尽管慢病毒载体表现出较低的插入突变发生率,但对外周血NK细胞的转染效率低至20% [57].用mRNA转染CAR-NK细胞也被认为是一种安全实用的转染方法。一项研究表明,在异种移植瘤模型中,转染mrna的NK细胞在电穿孔24小时后表现出显著的细胞毒性,受体表达水平超过80% [57].此外,最近有研究证明转染mRNA可以有效避免“靶向非肿瘤”毒性,这是限制car修饰免疫治疗临床应用的关键因素。而电穿孔转染mRNA的CAR-NK细胞的抗肿瘤作用是短暂的,CARs的表达量不超过3天。(3) CAR-NK治疗的另一个挑战是TME的影响。(4)实体癌CAR-NK治疗临床前可靠评估的主要障碍是缺乏临床相关的动物模型,这些模型包含了TME中相互作用的复杂性[168].大多数研究依赖于来自免疫受损NOD scid γ null (NSG)小鼠的人类肿瘤细胞系,这些小鼠缺乏有效的免疫系统[168].虽然现有的NSG模型可以用于快速评估CAR效应子的功能和持久性,但它们不能建立临床相关的TME或准确估计CAR- nk细胞的功能和持久性。此外,该模型还可以探索不同免疫细胞与肿瘤之间的相互作用。
基于NK细胞的免疫检查点
吉珥
KIR家族(也称为CD158)是一组多样且多态的NK细胞受体亚型,包含抑制性和激活性KIR,每种亚型都识别特定的HLA I类同源物(HLA- a, -B或-C)作为配体[176].IPH2101和lirilumab (IPH2102/BMS-986015)是一种抗kir3dl2 /2/3 NK细胞抑制受体的IgG4单抗,而IPH4102是一种人源化的抗kir3dl2 IgG1单抗。IPH2101阻断KIR可提高体内存活,临床前证据也表明其对AML细胞有效[177].一项针对首次完全缓解的老年AML患者的IPH2101的I期研究表明,总体和无复发生存期与可比患者人群的报告相比良好[177].lirilumab的II期临床试验结果表明单药治疗MM疗效较差[178].然而,lirilumab联合全剂量azacitidine在重度预处理/复发AML患者中具有良好的耐受性[179].最近的一项研究报告了lirilumab作为单一药物或与azacitidine联合用于骨髓增生异常综合征(MDS)患者的疗效和耐受性[180].IPH4102也被称为lacutamab,在复发/难治性皮肤t细胞淋巴瘤的I期临床评估中具有良好的耐受性,最常见的不良反应包括水肿、疲劳和淋巴细胞减少[181].临床活动也令人鼓舞,44例患者中有16例(36%)达到ORR [181].复发/难治性皮肤t细胞淋巴瘤Sézary综合征患者表现出更好的临床反应(43%)[181].
一些临床试验仍在顺铂不适用的肌肉侵袭性膀胱癌(NCT03532451),复发或难治性肿瘤(NCT02813135),局部复发的头颈部鳞状细胞癌(NCT03341936)和晚期T细胞淋巴瘤(NCT03902184)中进行。
NGK2A和CD94
NKG2A(也称为CD159)和CD94是c型凝集素家族的异二聚体抑制受体,它们识别非经典MHC-I分子HLA-E作为配体[182].体外和体内研究结果表明,人源化抗nkg2a /CD94 (IPH2201, monalizumab)抗体用于血液系统恶性肿瘤和实体肿瘤是安全有效的[183].在体外试验中,单抗改善了慢性淋巴细胞白血病的NK细胞功能障碍[184].单单抗作为治疗妇科恶性肿瘤的单药耐受性良好(静脉注射或SC给药高达10 mg/kg) [185].对单抗联合西妥昔单抗治疗既往治疗、复发和/或转移性头颈部鳞状细胞癌(SCC)的安全性和有效性的初步评估显示,该组合的ORR为27.5%,中位PFS为5个月,中位总生存期(OS)为10个月[186].与以往研究中单独使用西妥昔单抗疗效的历史记录(ORR 12.6%, PFS 2.3 m, OS 5.6 m)相比,这是一个令人鼓舞的结果。联合治疗与单独使用西妥昔单抗有相似的不良反应。总的来说,阻断NKG2A/CD94是一种令人兴奋的治疗方法;特别是,它与其他免疫肿瘤疗法的结合是前进的方向,值得进一步探索。此外,临床试验目前正在评估monalizumab联合多种其他靶向药物治疗多种肿瘤(NCT02643550、NCT02671435、NCT03822351、NCT03833440和NCT03088059)的疗效。
TIGIT和CD96
TIGIT是一种在NK细胞和T细胞上表达的免疫抑制受体[187].CD96与TIGIT属于同一免疫球蛋白超家族,具有相似的抑制作用,但与配体CD155的结合亲和力较低。CD155(主要)和CD112作为TIGIT和CD96结合的配体抑制t细胞和nk细胞介导的免疫[188].它在正常人体组织中几乎不表达,但许多肿瘤细胞系和原发性恶性肿瘤高表达CD155 [189,190,191].在CD155的功能中,通过其与抑制性受体TIGIT和CD96以及激活受体CD226相互作用的免疫调节是特别令人感兴趣的。各种癌症通过诱导T细胞或NK细胞抑制,CD155表达上调,相应的NK和T细胞表达上调TIGIT和CD96,逃避抗肿瘤免疫[189,190,191].
动物实验表明,TIGIT的内在表达可抑制NK和CD8+T细胞功能,从而帮助结直肠癌细胞在体内生长[192].TIGIT与荷瘤小鼠和结肠癌患者的NK细胞衰竭有关,这种衰竭通过其阻断而恢复,从而激发强大的抗肿瘤免疫[187].NK细胞的存在对于TIGIT和/或PD-L1阻断或双重阻断检查点的治疗效果至关重要,因为NK细胞缺乏与IFN-γ或tnf分泌TIL (CD8)频率较低有关+)和更高频率的表达pd -1的TIL (CD8+) [187].NK细胞占肝淋巴细胞的25-50%,这表明它们对肝脏免疫的重要性。此外,肝细胞癌(HCC)患者的生存和预后与血液和肿瘤组织中NK细胞的数量呈正相关[193,194].HCC患者的癌症进展与NK细胞浸润功能障碍有关,主要是CD11b−CD27−分组人口(193,194].Sun等人鉴定出肿瘤浸润性CD96缺失+并发现其表达与HCC患者较差的临床结果相关[195].当CD96-CD155相互作用或TGF-β1被阻断时,NK细胞衰竭逆转[195].
近年来,检查点抑制剂联合应用因其具有协同效应而受到越来越多的关注。加强CD8+据报道,t细胞活化可提高PD-1和TIGIT双靶向激素小鼠的存活率。Dixon等报道,在MC38结肠癌模型中,双重阻断TIGIT和PD-1产生协同抗肿瘤作用,导致肿瘤完全消退[196].在黑色素瘤患者中,双重阻断TIGIT和PD-1可协同增加肿瘤浸润和肿瘤抗原特异性CD8+T细胞增殖、脱颗粒和细胞因子分泌,提示可能存在双重阻断[197].Hong等人.提示PD-1和TIGIT也可能是治疗RCC的潜在靶点[198].在GBM患者中,这种双受体阻滞剂还可提高抗肿瘤免疫和生存率[199].虽然这些研究通过探索T细胞的作用,反映了双检查点封锁在各种癌症中的有效性,但也有一些研究表明,双检查点封锁的有效性也依赖于NK细胞。抗tigit +抗pd - l1阻滞剂可防止激素小鼠和结肠癌患者的NK细胞衰竭[187].另一方面,抗cd96联合阿霉素化疗、抗ctla -4或抗pd -1在三种不同的肿瘤模型中表现出更有效的肿瘤转移抑制作用[200].NK细胞衰竭的膀胱癌患者在外周和肿瘤中均表现出TIM-3和TIGIT上调[201].事实上,TIGIT和CD96在各种癌症中NK细胞衰竭中的作用仍在研究中,需要进一步的揭示来确定它们作为单一疗法或与其他检查点联合使用的潜力。目前正在进行临床试验,将TIGIT阻断剂作为单一疗法或与其他疗法联合治疗各种血液系统恶性肿瘤和实体肿瘤(例如,NCT04818619、NCT04150965、NCT04656535、NCT04500678、NCT04732494、NCT0435383、NCT04693234、NCT04570839、NCT04354246、NCT04047862、NCT04952597、NCT04457778、NCT04543617、NCT03563716和NCT04746924)。总体而言,TIGIT单克隆抗体处于早期临床试验阶段,结果有待进一步观察。
未来的视角
许多策略已经开发利用NK细胞的抗肿瘤特性。研究人员正在测试IL-2和IL-15,这是两种促进NK细胞活性的细胞因子,但加剧免疫反应会带来安全问题。来自健康供体的NK细胞在体外被IL-2和IL-15刺激,然后被输回癌症患者的血液中。该策略可以利用供体KIR和患者HLA之间的不匹配来减少NK细胞功能的抑制,并促进其抗肿瘤活性。自从CAR工程技术的引入,引导细胞治疗领域的范式已经发生了转变。CAR- t细胞作为第一个由CAR工程的免疫效应细胞,在临床中具有良好的效果,为未来基于CAR的免疫治疗的设计奠定了基础。NK细胞是一种特殊的免疫效应细胞,具有快速反应和强大的抗肿瘤能力。尽管CAR- t细胞取得了成功,但它们仍然存在重大缺陷,这推动了对其他免疫效应细胞的研究,作为CAR工程的替代方法。在过去的十年中,血液肿瘤的临床研究率先提出了游走性NK细胞免疫治疗的概念。有证据表明NK细胞具有很高的安全性和有效性。 Some clinical efficacy has also been demonstrated for allogeneic as well as autologous NK cell therapy, either alone or in combination with conventional therapies. Crucially, tumor antigen-expressing CAR-NK cell therapy increases anti-tumor activities. Thus, NK cell transfer presents an effective method of fighting cancer. In addition, antibodies that directly target NK cell inhibitory receptors, such as those targeting KIRs, NKG2A, and TIGIT, can enhance NK cell responses and thus kill tumor cells, and some are currently being validated in clinical trials. Therefore, based on the pan-specific recognition property of NK cells, NK cell-based multiple immune combination therapy is a strategy for further improving anti-tumor efficacy and deserves further exploration.
数据和材料的可用性
不适用。
缩写
- NK细胞:
-
自然杀伤细胞
- 鳞状细胞癌:
-
鳞状细胞癌
- 操作系统:
-
总生存时间
- 肝细胞癌:
-
肝细胞癌
- MDS:
-
骨髓增生异常综合征
- 猛击:
-
信号淋巴细胞激活分子
- DCs:
-
树突细胞
- 时差:
-
肿瘤微环境
- TLR:
-
toll样受体
- 马伯:
-
单克隆抗体
- CLPs后续:
-
常见淋巴细胞祖细胞
- LNs:
-
淋巴结
- 铅:
-
外周血
参考文献
Siegel RL, Miller KD, Fuchs HE, Jemal A.癌症统计,2021。中华癌症杂志,2021;21(1):7-33。
杨建平,李建平,张建平,等。实现世卫组织消除宫颈癌目标对死亡率的影响:78个低收入和中低收入国家的比较建模分析。柳叶刀》。2020;395(10224):591 - 603。
Hutchinson MKND, Mierzwa M, D 'Silva NJ。头颈部鳞状细胞癌的放射抵抗:迫切需要一种合适的敏化剂。致癌基因。2020;39(18):3638 - 49。
Garcia-Mayea Y, Mir C, Masson F, Paciucci R, Leonart ME。深入了解癌症干细胞多药耐药的新机制和模型。中国癌症杂志。2020;60:166-80
闵海燕,李海燕。非小细胞肺癌化疗耐药机制的研究。Arch Pharm Res. 2021;44(2): 146-64。
藤谷T,高原T,服部H, Imajo Y,小笠原H.腭扁桃体非霍奇金淋巴瘤的放射化疗。癌症。1984;54(7):1288 - 92。
胡杰,李国强,等。肺癌转移中的再生谱系和免疫介导的修剪。中华医学杂志2020;26(2):259-69。
Póvoa V, Rebelo de Almeida C, Maia-Gil M,等。在结直肠斑马鱼异种移植模型中发现先天免疫逃避。网络通信。2021;12(1):1 - 15。
Möckl L.哺乳动物糖萼在功能性膜组织和免疫系统调节中的新兴作用。前端细胞发育生物学。2020;8:253。
Chulpanova DS, Kitaeva KV, Green AR, Rizvanov AA, Solovyeva VV。基于细胞因子的抗癌免疫治疗的分子方面及未来展望。前端细胞发育生物学2020;8:402。
潘达A,阿约娜A,萨皮E,等。人类先天免疫衰老:老年免疫的原因和后果。免疫学杂志2009;30(7):325-33。
李国强,李国强,李国强。通过自噬调节先天免疫系统:单核细胞,巨噬细胞,树突状细胞和抗原提呈。细胞死亡差异。2019;26(4):715-27。
程敏,陈勇,肖伟,孙锐,田志。NK细胞为基础的恶性疾病免疫治疗。细胞分子免疫杂志,2013;10(3):230-52。
张建平,张建平,张建平。癌症免疫治疗。中国药物学杂志,2009;29(1):1 - 4。
金宁,李洪杰,李洪杰,等。自然杀伤细胞是一种很有前途的肿瘤免疫治疗靶点。Arch Pharm res 2019;42(7): 591-606。
Rothlin CV, Ghosh S.解除抗肿瘤免疫的先天免疫障碍。中华免疫杂志,2020;8(1):e000695。
梁伟,费丽娜。铁代谢在肿瘤微环境中的作用:先天免疫细胞的贡献。前沿免疫。2021;11:626812。
易敏,徐林,焦毅,等。癌症来源的microRNAs在癌症免疫逃逸中的作用。中华血液病杂志,2020;13(1):25。
李志强,李志强,李志强,等。膀胱癌免疫逃避机制的研究进展。中华癌症杂志2020;69(1):3-14。
李志刚,李志刚。急性髓系白血病的免疫逃逸与免疫治疗。中国临床医学杂志,2018;30(4):344 - 344。
李志强,李志强,李志强,等。肿瘤细胞可塑性和细胞周期静止在免疫逃逸中的作用。细胞死亡杂志2020;11(6):1-3。
葛震,吴松,张震,丁松。肿瘤细胞逃脱NK细胞免疫监视的机制。免疫毒理学杂志,2020;42(3):187-98。
吴艳,Biswas D, Swanton C.癌症进化对免疫监测和检查点抑制剂反应的影响。Semin癌症生物学,2021。https://doi.org/10.1016/j.semcancer.2021.02.013.
德什,Hollý J,叶伟德。一些好的多肽:基于MHC i类的癌症免疫监测和免疫逃避。中华免疫杂志2021;21(2):116-28。
Sapski S, Beha N, Kontermann RE, Müller D.抗原密度和免疫抑制因子对肿瘤靶向共刺激抗体融合蛋白和双特异性抗体介导T细胞反应的影响。中国癌症杂志。2020;69:2291-303。
Close HJ, Stead LF, Nsengimana J,等。单细胞和患者群体的表达谱鉴定出胶质母细胞瘤中的多种免疫抑制途径和改变的NK细胞表型。中国临床免疫学杂志,2020;200(1):33-44。
李志强,李志强,等。CD47在恶性血液病中的作用。中华血液病杂志,2020;13(1):96。
李志强,李志强,李志强,等。树突状细胞在多发性骨髓瘤中有功能缺陷:白细胞介素-6的作用。血。2002;100(1):230 - 7。
李志强,李志强。自分泌IL-10通过抑制DC向引流淋巴结的运输和局部IL-12的产生来削弱分枝杆菌感染的树突状细胞(DC)衍生的免疫反应。中华免疫杂志2002;32(4):994-1002。
Mimura K, Kono K, Takahashi A, Kawaguchi Y, Fujii H.血管内皮生长因子抑制VEGF受体-2介导的人成熟树突状细胞功能。中华癌症杂志2007;56(6):761-70。
王志强,王志强,Mariamé B,等。人巨细胞病毒对向树突状细胞分化的单核细胞中GM-CSF信号的旁分泌抑制血。2011;118(26):6783 - 92。
彭德华,罗德里格斯,刁磊,等。胶原蛋白通过lair1依赖的CD8+ T细胞衰竭促进癌症中的抗pd -1/PD-L1耐药。网络学报。2020;11(1):1 - 18。
李伟,王勇,赵华,等。红细胞岛巨噬细胞的鉴定和转录组分析。血。2019;134(5):480 - 91。
李伟,王勇,陈玲,安欣。红细胞岛巨噬细胞的最新发现及展望。血液科学2019;1(1):61-4。
李伟,郭睿,宋勇,姜哲。红系造血疾病中红细胞岛巨噬细胞对正常红细胞生成的影响及相关疾病的驱动。前沿细胞发育生物学。2021;8:1858。
杨红,闫敏,李伟,徐磊。肿瘤相关巨噬细胞SIRPα和PD1表达预测肝内胆管癌预后中华医学杂志,2002,20(1):40。
Logtenberg MEW, Scheeren FA, Schumacher TN. CD47-SIRPα免疫检查点。免疫力。2020;52(5):742 - 52。
萨伊托格鲁,乔戈达基,乔波克,等。通过DNAM-1和NKG2D促进自然杀伤细胞介导的肉瘤靶向。前免疫,2020;11:40。
埃格蒙特,李宝丽,特尔J,费格多CG。迈向有效的癌症免疫治疗:开发人工抗原提呈细胞的进展。生物技术,2014;32(9):456-65。
Martin JD, Cabral H, Stylianopoulos T, Jain RK。利用纳米药物改善癌症免疫治疗:进展、机遇和挑战。中华儿科杂志,2020;17(4):251-66。
石原J,石原A,佐佐木K,等。通过胶原亲和靶向抗体和细胞因子癌症免疫治疗。Sci TranslMed。2019; 11 (487): eaau3259。
王志强,王志强,王志强,等。细胞因子在临床癌症免疫治疗中的应用。中华肿瘤学杂志,2019;20(1):6-15。
张文杰,张文杰,张文杰,等。单克隆抗体在肿瘤治疗中的应用。抗体。2020;9(3):34。
沙欣,Türeci Ö。癌症免疫治疗的个体化疫苗。科学。2018;359(6382):1355 - 60。
张志强,张志强,张志强,等。DNA和mRNA疫苗防治癌症的比较。今日药物发现,2020;25(3):552-60。
刘松,蒋强,赵旭,等。一种基于DNA纳米设备的癌症免疫治疗疫苗。学报学报。2021;20(3):421-30。
赵娟,宋勇,刘东。双靶点CAR - T细胞、供体来源CAR - T细胞和通用CAR - T细胞治疗急性淋巴细胞白血病的临床试验中华血液病杂志2019;12(1):1 - 11。
王志强,李志强,等。在CAR - t细胞时代,复发DLBCL患者的自体移植是否只实现PET+ PR合适?血。2021;137(10):1416 - 23所示。
黄蓉,李霞,何勇,等。CAR-T细胞工程的最新进展。中华血液病杂志,2020;13(1):86。
拉森RC,老鼠MV。CAR - T细胞的机制和功能的最新进展和发现。中华癌症杂志,2021;21(3):145-61。
张志刚,张志刚,张志刚,等。Senolytic CAR - T细胞逆转衰老相关病理。大自然。2020;583(7814):127 - 32。
Rafiq S, Hackett CS, Brentjens RJ。克服目前CAR - T细胞治疗障碍的工程策略。中华儿科杂志,2020;17(3):147-67。
casenmiller C, Keumatio-Doungtsop BC, van Ree R, de Jong EC, van Kooyk Y.耐受原免疫治疗:靶向DC表面受体诱导抗原特异性耐受。Front Immunol. 2021;12:422。
王志强,王志强,王志强,等。树突状细胞在癌症免疫和免疫治疗中的应用。中华免疫杂志2020;20(1):7-24。
王勇,项勇,辛大众,等。树突状细胞生物学及其在肿瘤免疫治疗中的作用。中华血液病杂志,2020;13(1):107。
张超,刘宇。针对NK细胞检查点受体或分子进行癌症免疫治疗。前沿免疫。2020;11:1295。
迈尔斯JA,米勒JS。探索NK细胞平台用于癌症免疫治疗。中华临床医学杂志,2021;18(2):85-100。
王志强,王志强,王志强。在癌症免疫治疗中利用不变NKT细胞的新方法。前沿免疫,2018;9:384。
裴艺,徐浩,金益,全一,姜春春。NKT细胞在肿瘤免疫治疗中的作用。Arch Pharm res 2019;42(7): 543-8。
李森,陈森,申夏,林宜东。以toll样受体激动剂为基础的癌症免疫治疗增强疗效的化学策略。化学学报。2020;53(10):2081-93。
庄玉春,曾景昌,黄瑞麟,等。toll样受体9激活对检查点阻断癌症免疫治疗的辅助作用前沿免疫。2020;11:1075。
黄霞,张霞,陆敏。toll样受体7/8靶向治疗的研究进展。中国药物学杂志,2021;16(8):869-80。
李志强,李志强,李志强,等。肿瘤自然杀伤细胞免疫周期研究进展。中华癌症杂志,2020;20(8):437-54。
Herberman RB, Nunn ME, Lavrin DH。小鼠淋巴细胞对同基因和异基因肿瘤的天然细胞毒性反应。一、反应性和特异性分布。中华癌症杂志,1975;16(2):216-29。
Kiessling R, Klein E, Wigzell H.小鼠体内的“天然”杀伤细胞。一、对小鼠Moloney白血病细胞具有特异性的细胞毒性细胞。根据基因型的特异性和分布。中华免疫杂志,2005;5(2):112-7。
朱海红,黄晓明,王晓明,等。在人ipsc来源的NK细胞中,通过删除CISH的代谢重编程促进体内持久性和增强抗肿瘤活性。细胞干细胞。2020;27(2):224-237.e6。
王志强,王志强,王志强,等。超重和肥胖人群中人NK细胞和NK细胞亚群表面受体表达和细胞毒性的特征。前沿免疫。2020;11:573200。
郭志强,李志强,李志强,等。抗疟疾免疫的自然杀伤细胞的分化和适应。免疫杂志2020;293(1):25-37。
于俊,毛海昌,魏敏,等。CD94表面密度确定了CD56bright和CD56dim人类nk细胞亚群之间的功能中介。血。2010;115(2):274 - 81。
杨春华,杨春华,马兰楠,等。mTOR复合物对NK细胞发育的转录调控。前端细胞发育生物学。2020;8:1280。
王志强,王志强,等。成熟NK细胞稳态和细胞毒性中eomes的阶段特异性需求。Cell rep 2020;31(9): 107720。
杨C, sibert JR, Burns R,等。单细胞转录组揭示了t-bet在抑制未成熟NK基因签名中的新作用。Elife。2020;9:1-23。
彭世敏,李丽娟,李丽娟。小鼠骨髓中最早的nk细胞前体的鉴定。血。2011;117(20):5449 - 52。
毕杰,王霞。NK细胞成熟的分子调控。Front Immunol, 2020; 11:45。
马强,董旭,刘松,等。慢性乙型肝炎病毒感染时,乙型肝炎e抗原通过调节性T细胞衍生的白介素10诱导NKG2A+自然杀伤细胞功能障碍。前端细胞发育生物学。2020;8:421。
El-Deeb NM, El-Adawi HI, El-wahab AEA,等。调节NKG2D, KIR2DL和细胞因子的产生平菇葡聚糖增强自然杀伤细胞对癌细胞的毒性。前沿细胞开发生物学。2019;7:165。
吴淑云,付涛,蒋永智,邵志明。癌症生物学和治疗中的自然杀伤细胞。中华肿瘤杂志2020;19(1):120。
Björkström NK,永仁HG, Michaëlsson J.人类外周组织中自然杀伤细胞的新认识。免疫免疫学杂志,2016;16(5):310-20。
李国强,李国强,等。通过NKp46识别病毒感染细胞上的血凝素,激活人类NK细胞的裂解。大自然。2001;409(6823):1055 - 60。
Welte S, Kuttruff S, Waldhauer I, Steinle A. NKp80-AICL相互作用介导的自然杀伤细胞和单核细胞的相互激活。中华免疫杂志2006;7(12):1334-42。
Klimosch SN, Bartel Y, Wiemann S, Steinle A.基因耦合受体配体对NKp80-AICL使人NK细胞反应的自主控制。血。2013;122(14):2380 - 9。
Cooper MA, Fehniger TA, Caligiuri MA。人类自然杀手细胞亚群的生物学。免疫学杂志2001;22(11):633-40。
马志刚,马志刚,马志刚。人类自然杀伤细胞的多样性。免疫力。2017;47(5):820 - 33所示。
孙志强,孙志强。自然杀伤细胞的发育和成熟。中国医学免疫学杂志,2016;39:82-9。
Abel AM, Yang C, Thakar MS, Malarkannan S.自然杀伤细胞:发育、成熟与临床应用。前沿免疫。2018;9:1869。
吴春华,李志强,李志强,等。恒河猴NK细胞亚群的克隆扩增和区室化维持。免疫科学,2018;3(29):eaat9781。
Grégoire C, Chasson L, Luci C,等。贩卖自然杀手细胞。中国生物医学工程杂志,2007;29(1):529 - 529。
孙华,孙超,田震,肖伟。免疫耐受器官中的NK细胞。细胞分子免疫杂志,2013;10(3):202-12。
李志强,李志强,李志强,等。缺乏自我mhc抑制受体的人类外周血NK细胞亚群发育不成熟。血。2007;110(2):578 - 86。
杨晓燕,André P,张晓燕,等。MHC i类抑制受体对人NK细胞的教育。2006;25(2):331-42。
孟思哲,王淑娟,等。PBRM1和糖基磷脂酰肌醇生物合成途径促进mhc不受限制的细胞毒性淋巴细胞介导的肿瘤杀伤。科学通报2020;6(48):eabc3243。
倪娟,王旭,Stojanovic A,等。肿瘤浸润NK细胞的单细胞RNA测序显示,抑制转录因子HIF-1α可释放NK细胞活性。免疫力。2020;52 (6):1075 - 1087. e8。
Beĺanger S, Tu MM, Rahim MMA,等。ly49缺陷小鼠的自然杀伤细胞自我教育受损和“自我缺失”反应。血。2012;120(3):592 - 602。
Kärre K.自然杀伤细胞对缺失自我的识别。中华免疫杂志2008;9(5):477-80。
许福林,罗丽华,李志强,等。NK细胞的自我耐受、反应性和自我识别缺失。中华免疫杂志2014;26(2):138-44。
陈平,李志强,等。小鼠NKR-P1B:Clr-b识别系统是先天性免疫反应的负调节因子。血。2015;125(14):2217 - 27所示。
阿萨松E, Kambayashi T, Schatzle JD,等。NK细胞通过2B4/CD48相互作用刺激T细胞和NK细胞增殖。中华免疫杂志,2004;29(1):344 - 344。
杨晓东,杨晓东,杨晓东,等。NK细胞中的CD161(人npr - p1a)信号通路涉及酸性鞘磷脂酶的激活。中华免疫杂志,2006;26(4):457 - 457。
Fauriat C, Ivarsson MA, Ljunggren HG, Malmberg KJ, Michaëlsson J.通过激活杀伤细胞免疫球蛋白样受体教育人类自然杀伤细胞。血。2010;115(6):1166 - 74。
王志强,王志强,等。CD94的结构揭示了新的c型凝集素折叠:NK细胞相关CD94/NKG2受体的意义免疫力。1999;10(1):75 - 82。
杨晓东,张晓明,张晓明,等。天然细胞毒性受体NKp44的细胞配体鉴定。血。2013;122(17):2935 - 42。
王志强,王志强,王志强,等。人树突状细胞激活静止的自然杀伤细胞(NK),并通过NKp30受体被激活的NK细胞识别。中华检验医学杂志,2002;19(3):343-51。
López-Botet M, Llano M, Navarro F, Bellon T.非经典HLA I类分子的NK细胞识别。中华免疫杂志2000;12(2):109-19。
兰尼尔LL, Corliss B,吴军,Phillips JH。DAP12与激活CD94/NKG2C NK细胞受体的关联。免疫力。1998;8(6):693 - 701。
Pupuleku A, Costa-García M, Farré D,等。CD94/NKG2C NK细胞受体在对巨细胞病毒反应中的难以捉摸的作用:报告细胞系统中的新实验观察前沿免疫,2017;8:1317。
Eagle RA, Trowsdale J.性混杂与单受体NKG2D。中华免疫杂志2007;7(9):737-44。
维维耶E, Tomasello E, Baratin M, Walzer T, Ugolini S.自然杀伤细胞的功能。中华免疫杂志2008;9(5):503-10。
Guillerey C, Huntington ND, Smyth MJ。针对自然杀伤细胞的癌症免疫治疗。中华免疫杂志,2016;17(9):1025-36。
王志刚,王志刚,等。IL-12调节IL-15和IL-18激活的小鼠NK细胞的扩增、表型和功能。中华癌症杂志,2020;69(9):1699-712。
罗丽梅,李志强,李志强,等。细胞因子激活诱导人类记忆类NK细胞。血。2012;120(24):4751 - 60。
胡德SP, Foulds GA, Imrie H,等。来自前列腺癌患者的激活自然杀伤细胞的表型和功能:患者对启动和IL-2激活的依赖反应。前沿免疫。2019;9:3169。
Burns LJ, Weisdorf DJ, DeFor TE,等。淋巴瘤和乳腺癌自体移植后基于il -2的免疫治疗诱导免疫激活和细胞因子释放:I/II期试验中国骨髓移植杂志,2003;32(2):177-86。
李国强,李国强,等。重组人IL-21联合西妥昔单抗治疗转移性结直肠癌患者的一期试验中华肿瘤学杂志,2012;26(5):529 - 529。
李志强,李志强,等。重组人白细胞介素-15在癌症患者中的首次临床试验中的再分配、过度增殖、自然杀伤细胞和CD8 T细胞的激活以及细胞因子的产生。中华临床肿瘤学杂志,2015;33(1):74-82。
Pérez-Martínez A, Fernández L, Valentín J,等。单倍体干细胞移植后输注白介素15刺激的自然杀伤细胞治疗小儿难治性实体瘤的I/II期试验17岁Cytotherapy。2015;(11):1594 - 603。
永仁HG, Kärre K.寻找“缺失的自我”:MHC分子与NK细胞识别。免疫今日。1990;11:237-44。
张志刚,张志刚。NK细胞在感染和肿瘤过程中的调节作用。中国生物医学工程杂志,2011;29(1):349 - 349。
许丽丽,王志强,王志强,等。在表达FcγRIIIa-158 V/V和V/F多态性的个体中,CD16的自然杀伤细胞表达增加,与利妥昔单抗的结合和ADCC活性增强。血。2007;110(7):2561 - 4。
Smyth MJ, Crowe NY, Pellicci DG,等。NK1.1+ T细胞和自然杀伤细胞连续产生干扰素-γ对于α-半乳糖神经酰胺的抗转移作用至关重要。血。2002;99(4):1259 - 66。
Bryceson YT, March ME,永仁H-G, Long EO。休眠的人类自然杀伤细胞的激活、共激活和共刺激。中华免疫杂志,2006;21(1):73-91。
Martín-Fontecha,李志强,李志强,等。诱导NK细胞招募到淋巴结为TH1启动提供IFN-γ。中华免疫杂志2004;5(12):1260-5。
Smyth MJ,早川Y,武田K, Yagita H.自然杀伤细胞监测和癌症治疗的新方面。中华癌症杂志2002;2(11):850-61。
阮范东,杨德华,阮达,等。生成用于癌症免疫治疗的自然杀伤细胞诱导树突状细胞的最佳培养条件。细胞分子免疫,2012;9(1):45-53。
Kelly JM, Darcy PK, Markby JL,等。NK细胞介导的肿瘤排斥反应诱导肿瘤特异性T细胞记忆。中华免疫杂志2002;3(1):83-90。
李志刚,张志刚,张志刚。NK细胞在肿瘤免疫治疗中的应用。新药品发现2020;19(3):200-18。
王志刚,王志刚,王志刚,等。CD4细胞耗竭+CD25+调节性T细胞增强了白介素-2诱导的结肠腺癌小鼠模型的抗肿瘤免疫。中华癌症杂志,2007;32(3):416-23。
张志强,李志强,等。使用IL-2白喉毒素融合蛋白可改善单倍同源自然杀伤细胞对急性髓系白血病的清除。血。2014;123(25):3855 - 63。
Marçais A, Cherfils-Vicini J, Viant C,等。代谢检查点激酶mTOR在NK细胞发育和激活过程中对IL-15信号通路至关重要。中华免疫杂志,2014;15(8):749-57。
王志强,王志强,王志强,等。IL-15是外周nk细胞稳态的重要调节因子。血。2003;101(12):4887 - 93。
葛兰杰,韦彻提,帕特尔,等。IL-15超级激动剂ALT-803联合尼volumab用于转移性非小细胞肺癌患者:一项非随机、开放标签的1b期试验。中华肿瘤学杂志,2018;19(5):694-704。
罗梅梅,郭丽娟,等。IL-15超级激动剂复合物ALT-803治疗移植后复发的首次人类一期临床研究。血。2018;131(23):2515 - 27所示。
梁继伟,蔡建明,罗梅,等。IL-12、IL-15和IL-18预激活诱导cd25和人细胞因子诱导的记忆样自然杀伤细胞上的功能性高亲和力il-2受体。中国生物医学杂志,2014;20(4):463-73。
徐浩,全一,金斌,等。il -21介导的NK细胞衰竭逆转促进MHC i类缺陷肿瘤的抗肿瘤免疫。地理学报。2017;8(1):1 - 14。
刘娥,昂索特,Kerbauy L,等。gmp兼容通用抗原呈递细胞(uAPC)促进装甲脐带血CAR-NK细胞的代谢适应性和抗肿瘤活性。Front Immunol. 2021; 12:30 30。
Hodgins JJ, Khan ST, Park MM, Auer RC, Ardolino M.杀手2.0:NK细胞疗法在癌症控制的前沿。中国临床医学杂志,2019;29(9):369 - 369。
李志强,李志强,等。NK细胞通过抑制激活的、异源性T细胞介导GVHD的降低,同时保留GVT效应。血。2010;115(21):4293 - 301。
王海燕,王志强,王志强,等。在t细胞衰竭干细胞移植后接受IL-15/4-1BBL活化NK细胞的患者的急性GVHD。血。2015;125(5):784 - 92。
毕夏拉,德桑蒂斯,维特,等。HLA I类NK表位的抑制性KIR基因在单倍体不匹配的同种异体干细胞移植物中的有益作用可能被导致GVHD的供体异源反应性T细胞所掩盖。组织抗原。2004;63(3):204-11。
波拉塔LF,内向DJ,安塞尔SM,等。早期淋巴细胞恢复预测非霍奇金淋巴瘤自体干细胞移植后较高的生存率:一项前瞻性研究。中国生物医学杂志,2008;14(7):807-16。
Rueff J, Medinger M, Heim D, Passweg J, Stern M.自体造血干细胞移植治疗浆细胞骨髓瘤后淋巴细胞亚群恢复及预后。中国生物医学杂志,2014;20(6):896-9。
Parkhurst MR, Riley JP, Dudley ME, Rosenberg SA。自体自然杀伤细胞过继转移导致高水平的循环自然杀伤细胞,但不介导肿瘤消退。临床癌症杂志,2011;17(19):6287-97。
李志强,李志强,李志强,等。采用新型扩增方法治疗晚期消化系统癌患者自体NK细胞的I期临床试验中华医学杂志2015;13(1):277。
谢刚,董辉,梁勇,等。CAR-NK细胞:一种很有前途的癌症细胞免疫疗法。EBioMedicine。2020; 59: 102975。
李志强,李志强,等。抗转基因排斥反应有助于减弱过继转移CD20/ cd19特异性嵌合抗原受体重定向T细胞在人体内的持久性。中国生物医学杂志,2010;16(9):1245-56。
Maher J, Brentjens RJ, Gunset G, Rivière I, Sadelain M.单嵌合TCRζ/CD28受体诱导的人t淋巴细胞的细胞毒性和增殖。生物技术学报。2002;20(1):70-5。
黄志刚,王志刚,王志刚,等。具有4-1BB信号传导能力的嵌合受体对急性淋巴细胞白血病具有强烈的细胞毒性。白血病。2004;18(4):676 - 84。
卡宾托C,米隆MC,哈桑R,等。用含有CD28和CD137结构域的基因重定向人T细胞控制大型已建立的肿瘤异种移植。美国国家科学研究院。2009年,106(9):3360 - 5。
嵌合抗原受体的共刺激重新审视了联合CD28-OX40信号通路对T细胞抗肿瘤反应的益处。中华肿瘤学杂志,2011;29(12):2935-44。
魏可夫R,乔治P,达沙姆N,麦克莱伦AD。为嵌合抗原受体选择共刺激结构域:功能和临床考虑。临床传播免疫杂志2019;8(5):e1049。
王丽娟,王丽娟,王丽娟,等。B7.1-CD28/ ctla -4介导的人NK细胞共刺激的缺失。中华免疫杂志1998;28(3):780-6。
李志刚,刘志刚,李志刚,李志刚。免疫受体DAP12带有酪氨酸激活基序,参与激活NK细胞。大自然。1998;391(6668):703 - 7。
比拉多DD,厄普肖JL,舍恩RA,迪克CJ,莱布森PJ。NKG2D-DAP10通过syk不依赖的调控途径触发人类NK细胞介导的杀伤。中华免疫杂志2003;4(6):557-64。
Nakajima H, Colonna M. 2B4:具有独特特异性和信号转导机制的NK细胞激活受体。中华免疫杂志2000;61(1):39-43。
Chmielewski M, Abken H. TRUCKs:第四代CARs。中国生物医学杂志,2015;15(8):1145-54。
刘娥,童杨,多提G,等。经工程改造表达IL-15和cd19靶向CAR的脐带血NK细胞显示出长期持久性和强大的抗肿瘤活性。白血病。2018;32(2):520 - 31所示。
刘娥,马琳,班杰,等。car转导的自然杀伤细胞在cd19阳性淋巴肿瘤中的应用中华实用医学杂志,2020;26(6):545 - 553。
脐带血CAR-NK细胞:良好的初始疗效和毒性,但临床反应的持久性尚不清楚。癌症杂志,2020;37(4):426-7。
王旭,王晓明,王晓明,等。诱导型MyD88/CD40与IL-15协同增强CAR-NK细胞的抗肿瘤疗效。Blood ad . 2020;4(9): 1950-64。
刘东,孙鑫,杜勇,孔明。异丙酚促进结肠癌患者外周血自然杀伤细胞活性及杀伤能力的研究医学科学,2018;24:6 19 - 28。
李志强,李志强,李志强。成人和脐带血NK细胞的纯化、培养和CD19-CAR慢病毒转导。中华免疫杂志2020;31(1):e108。
王志强,王志强,王志强,等。靶向细胞因子检查点增强装甲脐带血CAR-NK细胞的适应性。血。2021;137(5):624 - 36。
王志强,王志强,王志强,等。利用人类NK细胞治疗肿瘤。前沿免疫。2020;10:3013。
马刚,ND Marin, Wong P,等。car修饰的记忆样NK细胞对NK耐药淋巴瘤表现出强烈的反应。血。2020;136(20):2308 - 18。
李杨,Hermanson DL, Moriarity BS, Kaufman DS。人类ipsc衍生的自然杀伤细胞与嵌合抗原受体工程增强抗肿瘤活性。细胞干细胞,2018;23(2):181-192.e5。
朱海红,黄志强,王志强,等。具有高亲和力不可切割CD16a的多能干细胞来源的NK细胞介导改善的抗肿瘤活性。血。2020;135(6):399 - 410。
罗梅,罗萨里奥,贝莲-艾略特,等。细胞因子诱导的记忆样自然杀伤细胞对髓系白血病表现出增强的反应。中国生物医学工程学报,2016;26(3):374 - 374。
Klingemann H, Boissel L, Toneguzzo F.免疫治疗的自然杀伤细胞- NK-92细胞系相对于血液NK细胞的优势。Front Immunol. 2016;7:91。
Daher M, Rezvani K.以汽车nk细胞为重点的新型汽车治疗展望:在对抗癌症的竞赛中,汽车工程t细胞之外还有什么。癌症杂志,2021;11(1):45-58。
唐旭,杨林,李忠,等。CAR - NK-92细胞的首次人体临床试验:CD33-CAR - NK-92细胞在复发难治性急性髓系白血病患者中的安全性试验中国癌症杂志,2018;8(6):1083-9。
郭伟杰,朱华,等。FT596:翻译第一个多抗原靶向现成的CAR-NK细胞,具有工程持久性,用于B细胞恶性肿瘤的治疗。血。2019;134 (Supplement_1): 301 - 301。
张勇,陈琳,王勇,等。daratumumab联合CAR-NK靶向CS1治疗多发性骨髓瘤血。2016;128(22):1342 - 1342。
姜华,张伟,尚鹏,等。嵌合抗cd138基因转染增强自然杀伤细胞的活化和杀伤多发性骨髓瘤细胞。中国生物医学杂志,2014;8(2):297-310。
Martín EM, Encinas J, García-Ortiz A,等。探讨NKG2D和BCMA-CAR NK-92在多发性骨髓瘤过继细胞治疗中的应用。临床淋巴瘤骨髓瘤杂志,2019;19(10):e24-5。
褚健,邓勇,Benson DM,等。cs1特异性嵌合抗原受体(CAR)工程自然杀伤细胞增强体外和体内抗人类多发性骨髓瘤的抗肿瘤活性。白血病。2014;28(4):917 - 27所示。
栾皮蓬,普哈苏安,克莱蒙,艾萨拉格瑞西,单抗和双抗cd19和cd138嵌合抗原受体-自然杀伤细胞对血液恶性肿瘤的选择性细胞毒性研究。中华免疫杂志2021;2021:1 - 16。
Parham P, Norman PJ, Abi-Rached L, Guethlein LA。杀手细胞免疫球蛋白样受体识别主要组织相容性复合体I类分子的人类特异性进化。Philos Trans R Soc B生物科学。2012, 367(1590): 800 - 11所示。
韦文杰,张志强,张志强,等。抗抑制性KIR单抗IPH2101治疗AML的一期试验完全缓解。血。2012;120(22):4317 - 23所示。
Nijhof IS, Van Bueren JJL, Van Kessel B,等。daratumumab介导的原发性多发性骨髓瘤细胞裂解与人抗kir抗体IPH2102和来那度胺联合使用增强。Haematologica。2015;100(2):263 - 8。
王晓明,王晓明,王晓明,等。lirilumab联合氮胞苷(AZA)治疗复发性急性髓系白血病(AML)患者的IB/II期研究血。2016;128(22):1641 - 1641。
王志强,王志强,等。lirilumab联合或不联合阿扎胞苷治疗骨髓增生异常综合征患者的初步试验。临床淋巴瘤骨髓瘤杂志,2018;18(10):658-63。
王晓燕,王晓燕,王晓燕,等。IPH4102,一类首创抗kir3dl2单克隆抗体,用于复发性或难治性皮肤t细胞淋巴瘤患者:一项国际首例人体开放标签一期试验。中华肿瘤学杂志2019;20(8):1160-70。
Braud VM, Allan DSJ, O 'Callaghan CA,等。HLA-E与自然杀伤细胞受体CD94/NKG2A结合。B和C自然科学,1998;391(6669):795-9。
Seymour L, Tinker A, Hirte H, Wagtmann N, Dodion P.使用IPH2201(一种靶向HLA-E受体CD94/NKG2A的人源单克隆抗体)进行I期和剂量范围II期研究。安杂志.2015; 26: ii3。
McWilliams EM, Mele JM, Cheney C,等。治疗性CD94/NKG2A阻断改善慢性淋巴细胞白血病自然杀伤细胞功能障碍中国肿瘤免疫学杂志,2016;5(10):e1226720。
Tinker AV, Hirte HW, Provencher D,等。单抗(IPH2201)在晚期妇科恶性肿瘤患者中的剂量范围和队列扩大研究:加拿大癌症试验小组(CCTG)的一项试验:IND221临床癌症杂志2019;25(20):6052-60。
Cohen RB, Lefebvre G, Posner MR,等。Monalizumab联合西妥昔单抗治疗复发性或转移性(R/M)头颈癌(SCCHN)患者(患者):1年生存数据。Ann Oncol. 2019;30: v460。
张强,毕杰,郑霞,等。阻断检查点受体TIGIT可以防止NK细胞衰竭,并引发有效的抗肿瘤免疫。中华免疫杂志,2018;19(7):723-32。
陈志强,陈志强,陈志强,等。受体CD96和CD226在调节自然杀伤细胞功能方面相互对立。中华免疫杂志,2014;15(5):431-8。
李晓霞,李晓霞,王志强,王志强。CD155的肿瘤内、外免疫功能。中国癌症杂志。2020;65:189-96。
马森D,贾瑞A,贝里B,等。CD155基因在人大肠癌中的过表达。肠道。2001;49(2):236 - 40。
Lupo KB, Matosevic S, Matosevic S. CD155免疫调节作为胶质母细胞瘤自然杀伤细胞免疫治疗的靶点。中华血液病杂志,2020;13(1):1 - 10。
梁荣,朱霞,蓝涛,等。TIGIT促进CD8+T细胞衰竭,预测结直肠癌不良预后中国生物医学工程杂志,2015;29(4):457 - 457。
周伟,崔志强,等。炎性肿瘤微环境与肝细胞癌患者较高的生存率相关。中华肝病杂志,2010;52(3):370-9。
周伟,陈杰,李东,等。趋化因子驱动的淋巴细胞浸润:决定可切除肝细胞癌长期生存的早期瘤内事件。肠道。2012;61(3):427 - 38。
孙C,孙海勇,肖文辉,张超,田志刚。肝细胞癌的自然杀伤细胞功能障碍及NK细胞免疫治疗。药物学报。2015;36(10):1191-9。
高志强,李志强,等。功能性抗tigit抗体调控自身免疫和抗肿瘤免疫的发展。中华免疫杂志,2018;20(8):3000-7。
肖文杰,彭丽娟,李文杰,等。TIGIT和PD-1在黑色素瘤患者中损害肿瘤抗原特异性CD8+ T细胞。中国临床医学杂志,2015;29(5):344 - 344。
洪霞,王霞,王涛,张霞。T细胞免疫球蛋白、ITIM结构域(TIGIT)和程序性死亡1 (PD-1)与肾癌临床病理特征的相关性可能为治疗提供潜在靶点。医学科学,2018;24:6861-72。
王文杰,王志强,等。TIGIT和PD-1双检查点阻断可增强GBM的抗肿瘤免疫和生存率。Oncoimmunology。2018;7 (8):e1466769。
刘娟,刘建军,等。使用一种新的淋巴细胞检查点靶点进行癌症免疫治疗抑制转移。癌症杂志,2016;6(4):446-59。
刘国强,刘国强,等。TIM-3和TIGIT是膀胱癌患者可能的免疫检查点靶点。urrol Oncol Semin Orig调查,2020。https://doi.org/10.1016/j.urolonc.2020.06.007.
确认
我们感谢本手稿中列出的所有作者。
资金
中国自然科学基金(81970183)资助。
作者信息
作者及隶属关系
贡献
JC, FG, MY撰写了手稿,收集了相关文献,完成了图表。BS和YL对稿件进行了修改和编辑。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
不适用。
发表同意书
不适用。
相互竞争的利益
作者声明,他们与此手稿的出版没有任何利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
褚杰,高峰,闫敏,李志强。et al。自然杀伤细胞:一种很有前途的癌症免疫疗法。翻译医学杂志20.240(2022)。https://doi.org/10.1186/s12967-022-03437-0
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-022-03437-0
关键字
- NK细胞
- 免疫疗法
- CAR-NK细胞
- 癌症