摘要
背景
微量白蛋白尿是糖尿病肾病(DKD)最早的临床证据,有助于DKD的诱导和/或进展。先前的研究表明,ANGPT2表达的增加与蛋白尿的增加有关。然而,ANGPT2在蛋白尿发展中的关键作用尚不清楚。有研究表明转胞作用在蛋白尿的发生中具有重要意义,但尚不清楚转胞作用是否发生在DKD患者肾小管细胞的白蛋白循环中。此外,这种关联的潜在机制也尚不清楚。
方法
本研究采用Transwell平板高糖培养人肾小管上皮细胞(HK-2)建立转胞作用模型,C57BL/6小鼠腹腔注射链脲佐菌素建立DKD模型。免疫组化和western blot检测ANGPT2和caveolin1 (CAV1)磷酸化表达。
结果
高糖暴露后,肾小管上皮细胞白蛋白转运下调,体内外ANGPT2和CAV1磷酸化表达增加。抑制ANGPT2和CAV1独立促进转胞作用。此外,ANGPT2的下调抑制了CAV1的磷酸化,而CAV1的磷酸化对ANGPT2的表达没有影响。
结论
在高糖条件下,ANGPT2通过激活CAV1磷酸化减少肾小管上皮细胞的白蛋白转运,从而增加DKD中的白蛋白尿。这些发现表明ANGPT2和CAV1可能是治疗DKD蛋白尿的有希望的靶点。
背景
蛋白尿是糖尿病肾病(DKD)最显著的特征。越来越多的证据表明,肾小管细胞重吸收能力的降低显著促进了白蛋白尿的发生[1];但其作用机制尚未完全阐明。
近端小管通过受体介导的内吞作用重吸收,是唯一有文献记载的小管蛋白清除过程[2].内吞作用是转胞作用的初步步骤,它涉及通过囊泡或管状膜载体从极化细胞的一个表面选择性地跨细胞传递到另一个表面[3.].根据内吞途径的不同,转胞作用可分为两种主要类型:由网格蛋白介导的受体介导的选择性转胞作用和小泡介导的非选择性吸附转胞作用,后者依赖于分子和质膜的电荷导致它们之间的相互作用[4].转胞作用已被证明与多种癌症有关[3.],笔画[4]、肝脏损伤[5],以及肾脏疾病[6,7,8].在肾脏疾病中,受体介导的内吞作用负责蛋白质重吸收和近端小管中过滤白蛋白的降解[1].内吞功能障碍有效地消除了肾病小鼠近端小管白蛋白摄取,导致尿白蛋白排泄增加[7].然而,DKD中管状转胞作用的作用和机制尚不清楚。
血管生成素-2(ANGPT2)血清水平升高,是一种内皮功能障碍和损伤生物标志物,已被证明不仅与内皮功能障碍有关,而且与DKD有关。1型糖尿病患者血清ANGPT2浓度升高与DKD相关[9].DKD大鼠血管生成素样2 (ANGPTL-2)表达升高,下调ANGPTL-2可降低DKD [10].在人微血管内皮细胞中,晚期糖基化产物和高血糖会增加ANGPT2的产生[11].诱导ANGPT2表达并发内皮细胞炎症[12].更重要的是,足细胞特异性的ANGPT2过表达加重了小鼠的蛋白尿[13].这些研究强调ANGPT2参与了DKD和蛋白尿的进展;然而,ANGPT2在管状白蛋白重吸收中的作用尚不清楚。
小泡(CAVs)是一种特殊的梭状结构,出现在细胞表面,形成小的、烧瓶状的质膜内陷,引起胞吞作用。小穴的生物发生和功能依赖于包膜蛋白、小穴蛋白和支持蛋白。caveolin -1(CAV1)是小穴蛋白家族的一员,是一种球茎状、50-100 nm的小穴蛋白组分,在各种组织中表达,与多种疾病有关。小梁网细胞中小泡蛋白的表达及其在青光眼发病机制中的意义已有报道[14].越来越多的证据表明,CAV1是促进细胞脂质运输、稳态、内吞和胞吐的重要伴侣。它有助于传递趋化因子、白蛋白、低脂蛋白和高密度脂蛋白[15].CAV1已被证明参与足细胞白蛋白转运[16]和肾小球内皮细胞[17,18].CAV1也被证明参与了DKD的进展[19].CAV1在DKD肾小管转胞作用中的作用及其与蛋白尿的关系仍需进一步研究。
在本研究中,我们试图阐明ANGPT2介导的CAV1磷酸化在高糖(HG)浓度下肾小管细胞转胞作用的调节作用。我们推测,上调ANGPT2可能促进CAV1磷酸化,进一步抑制肾小管细胞的转胞作用,从而减少肾小管白蛋白的再吸收,导致HG暴露时蛋白尿。本研究将提供更多的证据来证明调节CAV1和ANGPT2可能改善DKD患者蛋白尿的结局。
材料与方法
动物的使用和程序
8周龄、成年、雄性C57BL/6小鼠20只,体重20-25 g,由HFK(生物科学有限公司,北京,中国)提供。所有的老鼠都有免费的水和标准的食物。小鼠被随机分为两组:糖尿病小鼠和正常对照组小鼠。两组均禁食一晚,糖尿病组随后腹腔注射链脲佐菌素(STZ, 150 mg/kg, Boster生物科技,武汉)1次,如上所述[12].对照组给予相同体积的柠檬酸盐。注射STZ后3天和7天,只有血糖水平稳定的> 16.7 mmol/L的小鼠被归为糖尿病小鼠进行实验。12周后对小鼠实施安乐死。本研究获得华中科技大学同济医学院机构动物护理使用专业委员会批准(2019S2645)。
代谢和生理参数评估
每两周测量一次体重和血糖水平,安乐死前采集血液和尿液。血糖水平及血液样本评估如上文所述[12].如前所述,使用自动生化分析仪(ADVIA 2400, Siemens, Erlangen, Germany)鉴定尿蛋白、血清肌酐和尿肌酐[12].计算肌酐清除率,以µL/min/g表示。
肾脏组织病理学分析
切除、切割肾脏组织,用多聚甲醛固定,石蜡包埋。然后,将肾脏组织块切成4微米厚的部分。用苏木精-伊红(HE)和周期酸-希夫(PAS)染色评价肾组织损伤。
免疫组化染色
用福尔马林固定的石蜡包埋切片用滑片加热器和酒精脱蜡和水化。为了提取抗原,切片在EDTA中120°C孵育5分钟,然后加入3% H2O2在室温下放置15分钟。用5%正常山羊血清阻断非特异性结合30分钟。载玻片用抗磷- caveolin -1 (CST3251;CST, Danvers, MA, USA)和抗血管生成素2 (ab153934;Abcam, Cambridge, MA, USA)抗体在4°C下过夜。切片在磷酸盐缓冲盐水中清洗,用生物素化山羊抗兔抗体(Beyotime,江苏,中国)孵育20分钟。经3,3 ' -二氨基联苯胺(DAB, EnVision检测试剂盒)反应染色后,切片用酒精梯度脱水,用中性胶密封,在光学显微镜下观察。
细胞培养、处理和转染
人肾小管上皮细胞(HK-2)细胞系来自美国类型培养收藏(Manassas, VA, USA)。细胞在37°C和5% CO下培养2最小必要介质(MEM, Hyclone, Logan, UT, USA)添加10%的牛血清白蛋白(BSA, Bioscience, Shanghai, China)和1%的青霉素-链霉素。高糖处理时,细胞在30 mmol/L的浓度下培养d-葡萄糖含培养基。
RNA转染(siRNA和shRNA)
HK-2细胞在6孔板中播种,培养至30-40%合流,并用OPTI-MEM替代培养基(Gibco, Thermo Fisher Scientific, MA, USA)。随后,使用OPTI-MEM稀释的Lipofectamine 2000 (Invitrogen, Carlsbad, CA, USA)转染Caveolin-1 siRNA (Ribobio, Guangzhou, China),并将细胞轻轻搅拌4小时。随后,将OPTI-MEM替换为正常培养基,在无或存在5 mmol/L或30 mmol/L葡萄糖的情况下再孵育48小时。此后,收集细胞进行进一步实验。对于shRNA靶向的ANGPT2转染,表达靶向ANGPT2 shRNA的慢病毒(Genechem, Shanghai, China)和相应的控制载体按照制造商的指定进行转染。48小时后,用荧光显微镜观察转染细胞的转导效率(Nikon, Tokyo, Japan)。
白蛋白吸收
细胞被镀入6孔载玻片(Corning, Palo Alto, CA, USA),在5.6 mM中孵育d-葡萄糖和30毫米d-葡萄糖培养基,生长至90-100%合流。如前所述,白蛋白用异硫氰酸荧光素标记(FITC, Bioscience, Shanghai, China) (FITC- bsa) [20.].血清饥饿4 h后,用100 μg/ml的FITC-BSA孵育细胞3 h, 4%多聚甲醛固定HK-2, 0.5% Triton X-100/PBS渗透20 min, DAPI染色露出细胞核,揭去载片盖密封。图像用荧光显微镜(Olympus BX51,东京,日本)拍摄。100 μg/ml FITC-BSA孵育3 h, 2% Triton/PBS裂解2 h后,在Olympus荧光显微镜下检测裂解时的荧光强度。
单分子层完整性,用于胞吞测定
HK-2被播种到Transwell 24孔板(Corning, USA)中,在正常生长条件下孵育。当达到100%合流时,测量跨上皮电阻(TEER),以确定HK-2细胞单层的完整性。上皮伏压计EVOM2™(WPI, New Haven, CT, USA)使用灭菌电极测量Ω。每口井测量9次以上,计算平均值。TEER计算公式如下:
如果TEER > 40Ω*cm .2,这些细胞可用于胞吞分析。
白蛋白胞吞试验
测定的HK-2以5.5 mmol/L或30 mmol/L重悬d-葡萄糖,移到另一个Transwell 24孔板上,再孵育12小时。然后,HK-2在Transwell上腔中与100µg/ml FITC-BSA孵育,Transwell下腔中的培养基与100µg/ml BSA混合。移除了腔体,将Transwell下部腔体中的介质均匀混合。荧光分光光度计(Infinite F200PRO;Tecan, Männedorf,瑞士)用于测定Transwell上下腔室的荧光信号。FITC-BSA的激发波长为490 nm,发射波长为520 nm。
Western blot分析
收集肾组织和HK-2细胞,使用无线电免疫沉淀试验(RIPA)裂解缓冲液(Beyotime,江苏,中国)提取总蛋白。将总共50µg的蛋白质加载到8-12%的聚丙烯酰胺凝胶上,并通过十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)进行分离。之后,将蛋白质转移到聚偏二氟乙烯膜(Millipore, Bedford, MA, USA)。将膜在5%脱脂干牛奶(Beyotime)中在室温下封闭1小时,并在4℃下与一抗孵育过夜。最后,将膜孵育在含有二抗(1:2500;Eric Biotechnology,武汉,中国)2小时后检测。甘油醛-3-磷酸脱氢酶(GAPDH)作为内对照。所使用的一抗为:Angiopoietin2 (ab153934, Abcam)、Caveolin-1 (D46G3) XP®Rabbit mAb (CST3267, CST)、Phospho- Caveolin-1 (Tyr14) (CST3251, CST)、GAPDH(ab8245, Abcam)、DNM2多克隆抗体(14605-1-AP, Proteintech, Chicago, IL, USA)、Syntaxin4多克隆抗体(14988-1-AP, Proteintech)、Tie2多克隆抗体(19157-1-AP, Proteintech)、SRC多克隆抗体(11097-1-AP, Proteintech)。采用ImageJv1.8.0软件(NIH, Bethesda, MD, USA)对各条带进行密度分析。
统计分析
采用GraphPad Prism 8.0软件进行统计分析。所有数据均以均数±标准差表示。两组比较采用Student 's t检验,两组以上采用单因素方差分析(ANOVA)。P < 0.05为差异有统计学意义。
结果
高糖抑制HK-2白蛋白转运
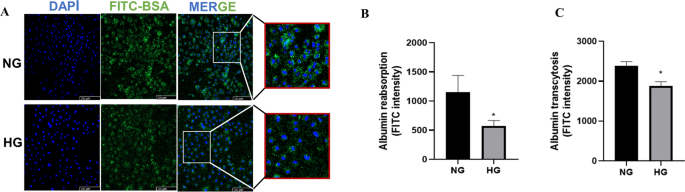
虽然DKD中蛋白尿的发生机制尚不明确,但已有报道称白蛋白转胞作用参与了白蛋白在肾脏中的再吸收和循环[1,8].为了探索DKD中肾小管上皮细胞是否发生胞吞,我们检测了HK-2细胞的白蛋白内吞和胞吞。具有代表性的免疫荧光图像显示细胞间FITC-BSA的内吞作用(图。1A).在正常葡萄糖(NG)培养基中白蛋白的内吞作用较高,而在HG培养基中培养的细胞内吞作用明显受到抑制。在hg培养的裂解液中,FITC强度远弱于NG裂解液(图2)。1同时,HG给药后Transwell下腔的FITC强度也有所降低(图2)。1C).这些结果表明HG处理抑制了HK-2细胞的胞吞和转胞吞。
HG暴露过程中ANGPT2上调
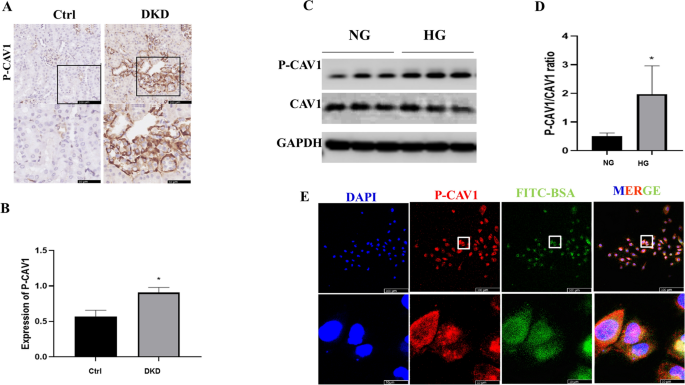
ANGPT2已被报道参与糖尿病肾病[12].为了探讨ANGPT2在DKD中的潜在相关性,采用western blotting检测HG孵卵后HK-2细胞中ANGPT2的表达。数字2A为western blotting检测到的ANGPT2表达,提示在HG组HK-2细胞中ANGPT2表达上调,而在NG组中则没有。2B).我们还检测了Syntaxin4 (STX4)的表达[21]和动力素-2 (DNM2)。而STX4的表达(图;2C)和DNM2(图。2D)两组之间没有显著差异。我们进一步检测了DKD小鼠肾组织中ANGPT2的表达。与对照组相比,小鼠的血糖水平(附加文件1:图S1A),肾重/体重比值(附加文件1:图S1B),血清肌酐(附加文件1:图S1C),以及尿白蛋白/肌酐比值(附加文件1:图S1D)均在糖尿病小鼠中升高。he染色显示肾病小鼠肾小球和系膜体积较大(附加文件)1:图S1E)。PAS染色显示肾小球和管状基底膜增厚、系膜基质堆积和系膜扩张(附加文件)1:图S1F)。这些结果与我们以前的报告一致[12],表现出DKD最具代表性的特征。糖尿病小鼠的ANGPT2水平高于对照组小鼠(图。2E, F)。综上所述,这些发现表明ANGPT2可能参与hg相关肾损伤。
HG引起的CAV1磷酸化
CAV1已被证明参与细胞转运[22];然而,在糖尿病小管上皮细胞中尚未观察到。我们检测了HG给药后肾小管细胞中CAV1的表达。在研究小鼠中,与对照组相比,糖尿病肾脏中的CAV1磷酸化上调(图2)。3.在hg培养的HK-2细胞中,P-CAV1 (P-CAV1)的表达一致增加(图2)。3.通过免疫荧光,我们发现P-CAV1和内吞白蛋白在HK-2细胞的细胞质中共定位(图2)。3.E),提示CAV1参与白蛋白转运。
抑制ANGPT2促进转胞作用
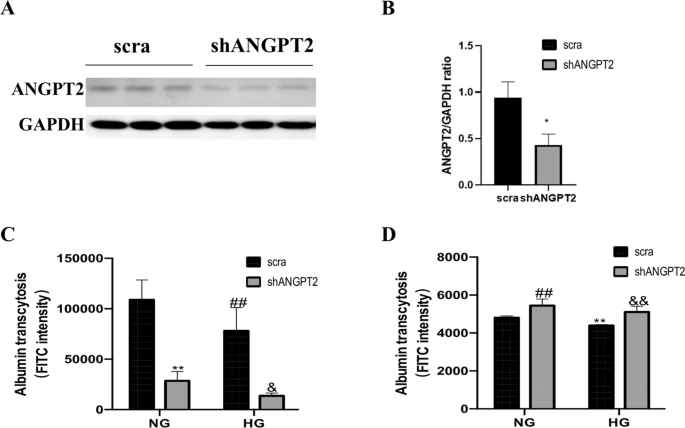
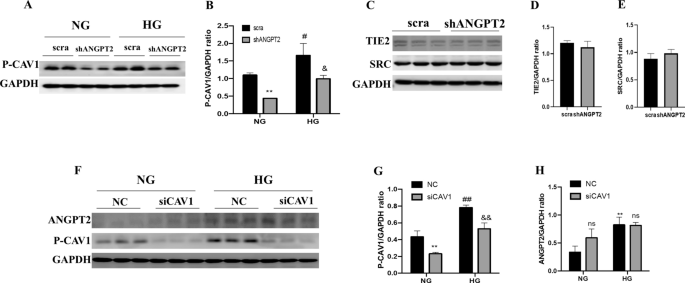
为了研究ANGPT2在转胞作用中的作用,我们使用了一个靶向ANGPT2的shRNA。Western blot和定量分析显示,转染shANGPT2后ANGPT2表达降低(图。4我们使用Transwell系统进一步检测了shANGPT2对白蛋白转胞作用的影响。即使在NG条件下,Transwell上部腔室的FITC强度也会降低ANGPT2。4C;shANGPT2 vs. scramble转染)。在HG培养基中培养的细胞,shANGPT2进一步降低了FITC强度(图。4C;shANGPT2 vs. scramble转染)。同时,NG条件下,shANGPT2增加了Ttranswell下部腔室的FITC强度(图5)。4D;shANGPT2 vs. scramble转染)。一旦在HG培养基中培养,通过FITC强度检测,shANGPT2转染增加了白蛋白的转胞率(图。4D;shANGPT2 vs. scramble转染)。这些结果表明,HG诱导ANGPT2表达,可能阻碍白蛋白转运,导致蛋白尿。
ANGPT2下调促进白蛋白转运。用shANGPT2转染HK-2,检测其对白蛋白转胞率的影响。一个ANGPT2与shANGPT2的代表性免疫印迹72 h。BANGPT2免疫印迹信号的密度分析(n≥3)。*与scra (scramble shRNA)比较P < 0.05。CTranswell上腔室统计中频信号(n≥3)。**P < 0.01 vs NG + scra,# #P < 0.01 vs NG + scra,&与HG + scra相比P < 0.05。D统计免疫荧光(IF)信号在Transwell下腔(n≥3)。**P < 0.01 vs NG + scra,# #P < 0.01 vs NG + scra,& &与HG + scra相比P < 0.01
抑制CAV1磷酸化可促进胞吞作用
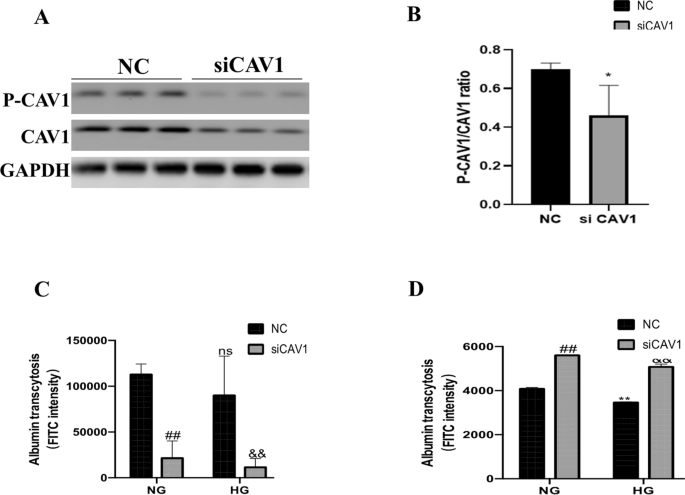
用siRNA抑制CAV1的表达。siCAV1转染后,CAV1和P-CAV1下调(图;5A, B)。接下来,我们使用Transwell室验证siCAV1对转胞作用的影响。在NG中,siCAV1降低了Transwell上部腔室的FITC强度(图2)。5C;siCAV1 vs. NC)。在HG培养基中培养后,转染siCAV1可进一步降低FITC强度(图2)。5C;siCAV1 vs. NC)。Transwell上腔室的阴性对照(NC)在NG和HG下均无明显差异(图2)。5C).在NG中转染siCAV1后,Transwell下部腔室的FITC强度增加(图。5D;siCAV1 vs. NC)。在HG培养基中培养后,与NC相比,siCAV1转染后的FITC强度在下腔增强(图2)。5D;HG siCAV1 vs. NC),提示siCAV1上调白蛋白转运。综上所述,这些数据表明CAV1磷酸化可以阻断白蛋白的转运。
抑制CAV1可促进HK-2细胞白蛋白的转运。一个用siCAV1转染HK-2 72 h后,对CAV1和P-CAV1进行免疫印迹。BP-CAV1/CAV1免疫印迹信号(n≥3)的密度分析。*P < 0.05。CTranswell上腔的统计FITC强度(n≥3)。# #P < 0.01 vs NG + NC, ns vs NG + NC,& &与HG + NC相比P < 0.01。DTranswell下腔的FITC强度(n≥3)。# #P < 0.01 vs NG + NC,**P < 0.01 vs NG + NC,& &与HG + NC相比P < 0.01。HG:高糖;NC:正常控制;NG:正常葡萄糖
ANGPT2下调抑制CAV1磷酸化
考虑到ANGPT2和CAV1都参与白蛋白转运,我们分析了它们在肾小管细胞中的关系。我们用shANGPT2检测了其在CAV1中的作用及其磷酸化。转染shANGPT2后,P-CAV1在NG或HG中的表达被抑制(图。6A). P-CAV1/GAPDH比值的统计分析证实了这一结果。在HG和NG培养基中,shANGPT2转染导致P-CAV1/GAPDH的减少(图5)。6B).此外,我们检测了TIE2和SRC的表达;然而,结果显示两者水平无显著差异(图;6一部)。我们还测定了siCAV1转染对ANGPT2的影响。在NG和HG培养基中,转染siRNA均能抑制P-CAV1的表达(图2)。6F), P-CAV1/GAPDH比值降低(图。6然而,siCAV1转染不影响NG或HG培养基中HK-2细胞中ANGPT2的表达(图2)。6H).综上所述,shANGPT2影响CAV1磷酸化的表达,而siCAV1对ANGPT2没有影响,说明ANGPT2可能通过CAV1磷酸化调节白蛋白的转胞作用。
ANGPT2下调抑制CAV1磷酸化。一个用shANGPT2转染P-CAV1和CAV后的免疫印迹如图所示。BP-CAV1/GAPDH的密度分析比值(n≥3)。**P < 0.01 vs NG + scra,#与NG + scra相比P < 0.05,&与HG + scra相比P < 0.05。CHK-2转染shANGPT2、TIE2和Src免疫印迹。DTIE2和Src的密度分析(n≥3)。差异无统计学意义。ESrc的密度分析(n≥3)。差异无统计学意义。FsiCAV1转染后P-CAV1和ANGPT2的免疫印迹。G。P-CAV1/GAPDH的密度分析比值(n≥3)。**P < 0.01 vs NG + NC,# #P < 0.01 vs NG + NC,& &与HG + NC相比P < 0.01。HANGPT2/GAPDH (n≥3)的密度分析。**与NG + NC、ns与NG + NC、HG + NC相比P < 0.01。HG:高糖;NC:正常控制;NG:正常葡萄糖
讨论
蛋白尿是DKD的独立危险因素。诱发肾小球损伤[20.,23]和由于小管受损导致的白蛋白再吸收减少可能导致白蛋白尿的产生。在本研究中,我们发现ANGPT2在HG条件下通过激活CAV1磷酸化减少了肾小管上皮细胞的白蛋白转运,从而增加了白蛋白尿。
转胞作用是一种重要的细胞内转运机制,是运送白蛋白所必需的[22].在本研究中,我们验证了白蛋白在管状细胞中的转胞作用的激活,发现HG下调了白蛋白的转胞作用。白蛋白转胞作用已被报道参与白蛋白在肾脏的再吸收和循环[1,8,24].我们的研究结果表明,白蛋白转运减少导致蛋白尿增加,这与小管细胞白蛋白转运异常先于蛋白尿肾病发生的结果一致[1].
先前的研究已经阐明了蛋白尿时白蛋白重吸收降低的重要性[7,13].Megalin-Cubilin复合物介导小鼠DKD近端小管的白蛋白内吞和重吸收[6],而megalin/cubilin敲除可有效地消除白蛋白摄取,导致尿白蛋白排泄增加[7].新生儿Fc受体(FcRn)介导的白蛋白转胞作用已被描述为在管状细胞中的白蛋白提取/再吸收中以特定的方式发挥作用[13].然而,在本研究中,我们并没有发现参与白蛋白跨肾小管上皮细胞转运的特异性白蛋白结合蛋白。
小穴形成中必不可少的包膜蛋白CAV1 [25],已被证明可促进DKD对高血糖的纤维化前反应[19]并参与肾小球内皮细胞的胞吞作用[17,18].最近的研究结果表明CAV-1在糖尿病和痴呆之间的关系中起着重要作用[26].也有文献证明它参与内皮细胞的胞吞作用[22],但在糖尿病小管上皮细胞中没有。到目前为止,关于小管细胞中白蛋白转运与CAV1表达之间的相关性仍缺乏证据。
基于转胞作用参与白蛋白重吸收,我们研究了CAV1在DKD中调节管状细胞转胞作用的作用。我们的研究结果证实,在DKD小鼠和hg培养的HK-2细胞的小管中,CAV1磷酸化上调,抑制CAV1导致白蛋白转运的诱导。这些结果表明,CAV1磷酸化抑制白蛋白转运加重蛋白尿。因此,CAV1可能是治疗糖尿病蛋白尿的潜在治疗靶点。
与我们的结果相反,在DKD的内皮细胞中,上调的CAV1磷酸化增强了白蛋白的转胞作用[20.].这种差异可能是由于不同的细胞类型和CAV1磷酸化的灵活功能。CAV1磷酸化影响小泡的功能和结构,并调节白蛋白的转运。据报道,在给予上皮生长因子(EGF)后,大鼠小管细胞中CAV1磷酸化的增加显著增加了小泡的数量[27].相反,另一项研究表明,CAV1磷酸化容易被泛素-蛋白酶体途径降解,从而导致CAV1的不稳定[28],这进一步影响了小泡的活动和胞吞作用。一直以来,CAV1磷酸化导致70S-CAV完整性的丧失,这使得它更容易被泛素化酶、酰基蛋白硫酯酶和其他降解方式降解[29].然而,CAV1磷酸化在DKD中的作用和机制尚需进一步研究。
此外,我们在之前的研究中发现ANGPT2在CAV1介导的转胞作用中的调节作用,而转胞作用已被证实参与蛋白尿[12].我们发现,shANGPT2下调了CAV1的磷酸化,并增强了白蛋白的胞吞作用。由于ANGPT2不是激酶,它不能直接调节CAV1的磷酸化。ANGPT2可以通过依赖Src来刺激CAV1的磷酸化,Src是唯一被证明直接诱导CAV1 Tyr 14磷酸化的激酶[30.].然而,在本研究中,Src水平在对照和HG条件下没有表现出差异。ANGPT2受体和酪氨酸激酶受体2(TIE2)已被证明参与不同疾病中ANGPT2的调节[30.,31,32].ANGPT2抑制ANGPT-1激活,阻断内皮细胞TIE2磷酸化,进而抑制血管生成[33].另一项研究表明,ANGPT2可促进TIE2磷酸化[31].然而,我们的数据显示,对照组和DKD组之间TIE2没有明显差异。因此,ANGPT2/CAV1磷酸化的调控机制有待进一步探索。
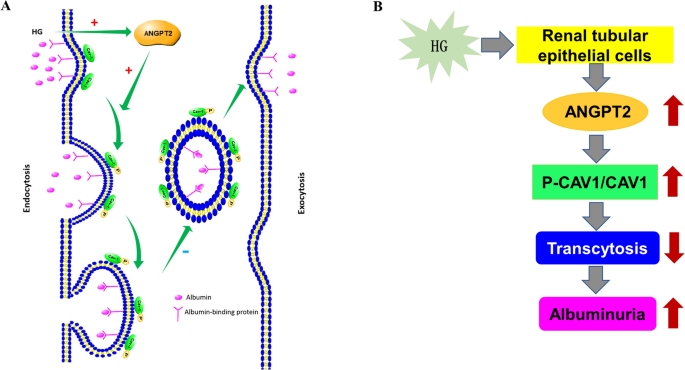
在目前的研究中,我们发现HG暴露后,白蛋白的转胞作用被抑制,而ANGPT2、CAV1磷酸化和白蛋白的尿排泄在体外和体内均被上调。ANGPT2下调抑制CAV1磷酸化,增加白蛋白转运(图。7).我们的研究结果表明,ANGPT2激活CAV1磷酸化,进一步阻断小管细胞中的白蛋白转运,导致白蛋白再吸收减少和尿中白蛋白排泄增加。针对ANGPT2和CAV1的策略可能有助于通过阻断初始蛋白尿来治疗DKD。
需要指出的是,这项研究有一定的局限性。我们在体外检测到了这种调控,但在体内的作用尚未得到充分的研究。未来的研究将致力于充分阐明其调控机制,包括ANGPT2与CAV1的相互关系以及CAV1磷酸化对转胞作用的调控。同时,需要进行更多的体内分析,以检测在全球和组织特异性水平上的生理作用和机制。这些探索将有助于进一步分析DKD进展中的蛋白尿。有趣的是,转胞作用已被探索为特定成像和治疗提供药物和基因[3.].考虑到细胞转运在肾脏疾病中的重要作用,它可能是一种有前途的治疗肾脏疾病的治疗策略。
结论
总之,我们发现ANGPT2通过激活CAV1磷酸化来减少高糖条件下肾小管上皮细胞的白蛋白转运,从而增加DKD中的白蛋白尿。我们的研究首次报道了ANGPT2-P-CAV1/CAV1的作用与DKD肾小管细胞白蛋白转胞抑制相关。这些发现表明ANGPT2和CAV1可能是治疗DKD患者蛋白尿的可能靶点。
数据和材料的可用性
本研究中使用和/或分析的数据集可根据合理要求从通讯作者处获得。
缩写
- ANGPT2:
-
Angiopoietin2
- BSA:
-
牛血清白蛋白
- CAV1:
-
Caveolin1
- DKD:
-
糖尿病肾病
- 轻拍:
-
Diaminobenzidine
- DNM2:
-
Dynamin-2
- FITC:
-
异硫氰酸荧光素
- GAPDH:
-
Glyceraldehyde-3-phosphate脱氢酶
- 他:
-
Haematoxylin-eosin
- HG:
-
高葡萄糖
- 吴:
-
正常的葡萄糖
- HK-2:
-
人肾小管上皮细胞
- 包含IHC:
-
免疫组织化学
- MEM:
-
最低必需介质
- 不是:
-
周期性acid-Schiff
- P-CAV1:
-
Phosphor-CAV1
- STX4:
-
突触融合蛋白4
- te:
-
跨上皮电阻
- TIE2:
-
酪氨酸激酶受体2
参考文献
狄克森LE,瓦格纳MC,桑多瓦尔RM,等。近端小管和蛋白尿:真的!中国生物医学工程学报。2014;25:43 - 53。
张志刚,张志刚,等。Cubilin对肾近端小管的白蛋白再吸收至关重要。中国科学,2010;21:1859-67。
刘霞,蒋娟,孟H.转胞质-一种补充“EPR效应”的胰腺癌纳米药物的有效靶向策略。开展。2019;9:8018-25。
顾志刚,顾志刚。血脑屏障的胞吞作用。《神经生物学杂志》2019;57:32-8。
李国强,李国强,等。肝脏FcRn调节白蛋白稳态和肝损伤易感性。美国国家科学研究院。2017; 114: E2862-e2871。
周玲,刘峰,黄晓荣,等。链脲霉素诱导的糖尿病肾病ROCK1基因敲除小鼠蛋白尿的改善Am J Nephrol. 2011; 34:468-75。
韦耶K,安徒生PK,施密特K,等。在肾病综合征小鼠中,取消近端小管白蛋白内吞作用不影响血浆白蛋白。肾内科杂志2018;93:335-42。
张志刚,张志刚,张志刚,等。白蛋白通过小管转胞作用从原尿中回收。中国农业大学学报。2013;24:196 - 19。
王晓明,王晓明,王晓明,等。1型糖尿病患者血管生成素2和神经肽Y与糖尿病肾病相关临床内分泌糖尿病杂志2020;128:654-62。
杨松,张娟,王松,等。下调血管生成素样蛋白2可通过抑制TLR4改善糖尿病肾病。中国生物医学工程学报。2017;43:685-96。
Puddu A, Sanguineti R, Maggi D,等糖基化终末产物和高血糖通过损害血管生成素-1- tie -2系统增加血管生成素-2的产生。J Diabetes res 2019;2019:6198495。
罗超,李涛,张超,等。前列地尔治疗糖尿病肾病的作用:血管生成素-2和IL-18的可能作用。细胞物理与生物化学。2014;34:916-28。
戴维斯B, Dei Cas A, Long DA,等。足细胞特异性表达血管生成素-2引起蛋白尿和肾小球内皮细胞凋亡。中国农业科学。2007;18:2320-9。
小梁网细胞中小泡蛋白的表达及其在原发性开角型青光眼发病中的意义。生物学报,2011;17:2878-88。
维库卡尔J,法尔曼JF,格雷格JR,等。穴蛋白1介导的鞘脂肿瘤代谢是前列腺癌代谢易损的基础。Nat Commun. 2020;11:4279。
杜布林斯基赫,冈村K,科普JB,等。人足细胞进行极化、小泡依赖性白蛋白内吞。中国医学杂志,2014;36(2):344 - 344。
森山文,武井文,板桥文,等。小泡可使白蛋白进入人肾小球内皮细胞。中国生物医学工程学报,2015;
森山T,佐佐木K,卡拉泽K,等。肾小球内皮细胞经小泡内吞后白蛋白的胞内转胞。中国生物医学工程学报,2017;
Van Krieken R, Krepinsky JC。小穴蛋白-1在糖尿病肾病发病机制中的作用:潜在的治疗靶点?咕咕叫DiabRep。2017;十七19。
吴东,杨霞,郑涛,等。红景天苷缓解糖尿病蛋白尿的新机制:对肾小球内皮细胞白蛋白转运的影响。中国医学杂志。2016;31:E225-37。
李志强,李志强,等。dysferlin突变体质膜表达的减少归因于syntaxin-4相关途径的加速内吞作用。中国生物医学工程学报,2010;
小穴,小穴,洞穴,和内皮细胞功能:新的见解。《前沿物理》2012;2:120。
王志强,王志强,王志强,等。前列腺素I2受体激动通过肾素依赖机制保持β细胞功能并减弱蛋白尿。糖尿病。2016;65:1398 - 409。
Molitoris英航。用双光子显微镜了解蛋白尿。中国临床医学杂志(英文版)。2014;讨论356 - 347).
小穴蛋白:糖尿病和AD之间的新联系。细胞分子神经生物学。2020;40:1059-66。
Chidlow JH Jr, Sessa WC。小穴、小穴和洞穴:细胞信号和炎症的复杂控制。心血管杂志2010;86:219-25。
黄斌,李志强,李志强,等。上皮生长因子诱导的小穴蛋白1酪氨酸14磷酸化刺激上皮细胞小穴形成。生物化学学报。2006;
尹海杰,金德华,金世杰,等。src介导的小穴蛋白1磷酸化、泛素化和降解促进乳腺癌细胞干性。癌症杂志2019;49:8 - 19。
Busija AR, Patel HH, Insel PA。小泡的运输、成熟和降解中的小泡蛋白和小泡蛋白:对细胞生理学的影响。中国生物医学工程学报。2017;31(2):344 - 344。
孙勇,胡刚,张旭,等。磷酸化的小穴蛋白-1通过细胞旁和跨细胞途径调节氧化诱导的肺血管通透性。Circ res 2009; 105:676-85。
陈志强,李志强,李志强,等。iv型胶原衍生肽破坏α5β1整合素并增强Ang2/Tie2信号通路。JCI洞察力。2019; 4: e122043。
李志强,李志强,李志强,等。血管生成素-2对Tie2信号通路和FOXO1激活的相反作用。中华临床杂志。2016;126:3511-25。
何文明,刘林,葛伟,等。抗血管生成活性雷公藤还有它的萜。中华药理学杂志。2009;121:61-8。
确认
不适用。
资金
基金资助:国家自然科学基金(No. 81570657、81900629)、湖北省卫生和计划生育委员会(No. 81570657、81900629);WJ2015MB013)和湖北省自然科学基金项目(2018CFB485)。
作者信息
作者及隶属关系
贡献
WY设计了这项研究。LJ, ZY, SJ和YJ进行实验。WY, YJ和LJ对数据进行了分析。LJ撰写并起草了手稿。所有作者阅读、编辑并批准最终手稿。
相应的作者
道德声明
伦理批准并同意参与
所有动物实验均由华中科技大学同济医学院机构动物关爱使用专业委员会(No. 2019S2645)批准。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1。
STZ注射液诱导c57bl7小鼠糖尿病肾病1血糖水平(BG)。1 b肾重/体重之比(KBWR)。1 c血清肌酐(Scr)。1 d尿白蛋白/肌酐比值(UACR)。1 e肾HE(苏木精-伊红)染色代表图像。1 f肾脏代表性PAS (periodic acid-Schiff)染色图像。数据以均值±标准差(n≥5)表示,*P<0.05, ** P<0.01, ** P<0.001,对照组(Ctrl)。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
刘,J。姚明,J。,赵,Y。et al。血管生成素2介导的小泡蛋白1磷酸化调节肾小管上皮细胞的转胞作用有助于高糖暴露下蛋白尿的发生。翻译医学杂志20., 185(2022)。https://doi.org/10.1186/s12967-022-03388-6
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-022-03388-6
关键字
- 糖尿病肾病
- 肾小管上皮细胞
- Transcytosis
- Angiopoietin2
- Caveolin1