- 研究gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
SORBS2作为家族性高胆固醇血症患者动脉粥样硬化的分子靶点gydF4y2Ba
转化医学杂志gydF4y2Ba体积gydF4y2Ba20.gydF4y2Ba、物品编号:gydF4y2Ba233gydF4y2Ba(gydF4y2Ba2022gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
家族性高胆固醇血症(FH)是一种代谢性疾病,患者易发生早发性动脉粥样硬化(AS)。Sorbin and SH3 Domain Containing 2 (SORBS2)在冠心病(CHD)中起重要作用。然而,SORBS2参与高胆固醇血症发生的机制尚不清楚。在这里,我们研究了SORBS2对炎症和泡沫细胞形成的影响及其潜在机制。gydF4y2Ba
方法gydF4y2Ba
通过生物信息学分析,我们发现FH患者中SORBS2表达上调。采用ELISA试剂盒检测SORBS2循环浓度(n = 30)。采用Spearman相关分析循环SORBS2水平与炎症因子或脂质指标的相关性。我们进一步在gydF4y2Ba体外gydF4y2Ba实验分析SORBS2的表达,并将SORBS2 siRNA转染氧化LDL (OxLDL)诱导的巨噬细胞,进行western blot和免疫荧光检测。gydF4y2Ba
结果gydF4y2Ba
循环SORBS2水平与炎症因子和脂质指数呈正相关。我们还观察到oxldl诱导的巨噬细胞中SORBS2的体外高表达。SORBS2沉默后,Nod样受体家族pyrin结构域3蛋白(NLRP3)-Caspase1激活和NF-κB激活减弱,促炎细胞因子(IL-1β和IL-18)分泌减少。此外,SORBS2沉默阻断活性氧(ROS)的产生和脂质积累,促进胆固醇通过ABCG1-PPARγ途径外排。gydF4y2Ba
结论gydF4y2Ba
SORBS2调节脂质诱导的炎症和泡沫细胞的形成,是高胆固醇血症的潜在治疗靶点。gydF4y2Ba
介绍gydF4y2Ba
动脉粥样硬化(AS)是一种脂质诱导的慢性炎症性疾病,其特征是动脉病变、斑块积聚并最终斑块破裂。家族性高胆固醇血症(FH)是一种以过早动脉粥样硬化为特征的疾病,其患者尤其容易出现动脉粥样硬化相关的不良临床事件。在动脉粥样硬化病变中,单核细胞来源的巨噬细胞是先天免疫细胞中最丰富的亚群,这些巨噬细胞在脂质积累和炎症反应中起着关键作用[gydF4y2Ba1gydF4y2Ba]。为了有效预防动脉粥样硬化相关的不良临床事件,动脉粥样硬化的干预措施(特别是FH患者)应该针对这些初始炎症过程。gydF4y2Ba
Sorbin and SH3 Domain Containing 2 (SORBS2)是Sorbin同源蛋白适配蛋白和支架蛋白家族的关键成员。最近的研究表明,SORBS2是一种潜在的心脏疾病生物标志物。Li等人gydF4y2Ba.gydF4y2Ba报道了SORBS2在左室非压实性心肌病心衰发展中的潜在作用[gydF4y2Ba2gydF4y2Ba]。此外,Kakimoto等人gydF4y2Ba.gydF4y2Ba报道SORBS2在致死性急性心肌梗死时从受损的心脏组织释放到血液中[gydF4y2Ba3.gydF4y2Ba]。生物信息学分析表明,FH患者血清SORBS2表达升高。然而,SORBS2在高胆固醇血症中的作用及其潜在的分子机制仍然知之甚少。gydF4y2Ba
如上所述,炎症在动脉粥样硬化中起着关键作用。Nod样受体(NLR)家族含pyrin结构域3蛋白(NLRP3)炎性小体在巨噬细胞(和其他细胞)对炎症刺激的反应中诱导表达。已知NLRP3可被一系列损伤相关信号激活,包括活性氧(ROS)、氧化LDL (OxLDL)和胆固醇晶体[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba]。在饮食诱导的动脉粥样硬化小鼠模型中,NLRP3炎性体激活通过基因沉默与动脉粥样硬化进展有关gydF4y2BaNlrp3gydF4y2Ba在gydF4y2BaApoegydF4y2Ba−−/gydF4y2Ba老鼠(gydF4y2Ba7gydF4y2Ba]。与非AS髂动脉相比,人类颈动脉AS斑块组织中NLRP3的表达也有所增加[gydF4y2Ba8gydF4y2Ba]。因此,干扰NLRP3炎性体通路可能是减少局部炎症和抑制斑块进展的有效策略。虽然NLRP3沉默可能减轻局部炎症,但SORBS2通过NLRP3炎性体途径调节oxldl诱导的泡沫细胞炎症仍有待证实。gydF4y2Ba
巨噬细胞泡沫形成是早期动脉粥样硬化的典型病理改变。ppar通过影响脂质摄取和外排在巨噬细胞泡沫细胞形成中发挥重要作用。PPARγ是配体诱导的转录因子,在巨噬细胞中高表达,控制动脉粥样硬化斑块中巨噬细胞的炎症、极化和脂质代谢。然而,SORBS2在脂质代谢中的潜在作用尚未得到充分的探索。gydF4y2Ba
为了解决这些问题,我们研究了SORBS2与炎症因子之间的相关性,通过沉默SORBS2研究了SORBS2对炎症和脂质代谢的影响,并阐明了SORBS2调节oxldl诱导的巨噬细胞的分子机制。gydF4y2Ba
材料与方法gydF4y2Ba
人口研究与实验设计gydF4y2Ba
本研究包括30名遗传诊断为杂合性FH的患者,因此终生暴露于高LDL胆固醇水平,以及30名非FH对照参与者(FH患者的所有亲属)。根据指南,所有FH患者的分子和/或临床DLCN评分≥6。获得所有参与者的人口统计、生活方式、一般医疗、降脂治疗和治疗数据。虽然所有FH患者都按照临床指南接受了降脂治疗,但没有人达到LDL目标水平。因此,FH组LDL胆固醇平均水平为7.76 mmol/L,对照组LDL胆固醇平均水平为3.40 mmol/L(表2)gydF4y2Ba1gydF4y2Ba).FH组和对照组均未纳入失代偿性心力衰竭、严重肝肾功能不全、甲状腺功能障碍、全身性炎症或恶性肿瘤患者。收集患者和健康对照者的血液样本进行ELISA分析,如下所述。gydF4y2Ba
本研究符合《赫尔辛基宣言》,并经医院伦理审查委员会(中国北京阜外医院和国家心血管疾病中心)批准。每位参与者在入组前都提供了书面的知情同意书。gydF4y2Ba
生物信息学分析gydF4y2Ba
我们对GEO数据库中的GSE6054(10个FH单核细胞和13个对照组)和GSE6088(10个FH T细胞和13个对照组)微阵列数据集进行了差异基因表达分析(gydF4y2Bahttp://www.ncbi.mlm.nih.gov/geo/gydF4y2Ba).微阵列(LIMMA)的线性模型使用R包中的Version: 3.30.3)筛选这些表达谱数据集中FH患者和匹配对照的差异表达基因(DEGs)。这是使用调整后的gydF4y2BaPgydF4y2Bavalue < 0.05和(|log2FC|> 1)作为阈值。我们比较分析的结果是显著上调(log2FC > 1)和下调(log2FC < -1)的基因列表。gydF4y2Ba
细胞培养和处理gydF4y2Ba
人单核细胞白血病细胞系(THP-1)来源于中国科学院类型培养收藏细胞库。细胞以5 × 10的密度培养gydF4y2Ba5gydF4y2Ba细胞/mL,罗斯威尔公园纪念研究所(RPMI) 1640培养基(Gibco, Carlsbad, CA),添加10%胎牛血清(FBS, Gibco, GrandIsland, NY), 37℃,5% COgydF4y2Ba2gydF4y2Ba孵化器。在所有实验中,THP-1单核细胞在6孔板中培养,100 nM phorbol 12-肉豆酸酯13-乙酸酯(PMA)处理48 h,使其转化为贴壁巨噬细胞。将分化后的巨噬细胞用50 μg/mL Ox-LDL处理24 h诱导形成细胞。收集培养上清于1.5 mL管中进行ELISA。为了提取蛋白质,先用PBS洗涤三次。gydF4y2Ba
ELISA检测细胞因子gydF4y2Ba
为了评估分泌的SORBS2和细胞因子(包括NLRP3、caspase-1、IL-1β和IL-18)的浓度,从人血清和细胞培养上清中分离样品,并使用R&D Systems (Minneapolis, USA)、Abcam (Cambridge, UK)和Sorlarbio (Beijing, China)的ELISA试剂盒进行分析。所有程序都按照制造商的说明进行。每个样品一式两份分析。gydF4y2Ba
油红O染色gydF4y2Ba
THP-1衍生的巨噬细胞或泡沫细胞用4%多聚甲醛溶液固定30分钟,然后用PBS洗涤。所有细胞用油红O在异丙醇中染色3 min,再用苏木精反染色20 s。使用Leica显微镜系统(Leica, Wetzlar, Germany)观察细胞形态。利用Image J软件(gydF4y2Bahttps://imagej.nih.gov/ij/gydF4y2Ba),表面积单位为平方微米(μm)gydF4y2Ba2gydF4y2Ba).然后将数据加载到GraphPad Prism 8中,计算Oil Red o染色面积的百分比。gydF4y2Ba
小干扰RNA转染gydF4y2Ba
基因敲低实验采用Lipotectamine RNAiMAX转染试剂(Invitrogen,美国)在无血清Opti-MEM(美国)中进行。用40 nM的人SORBS2小干扰RNA (si-SORBS2)转染巨噬细胞24小时,或用阴性对照(si-NC)转染模拟细胞24小时。人类si-SORBS2序列(义,5 ' - gcaucuuccuguuuccuat -3 ';反义,5 ' -UAGGAAACAGGGAAGAUGCTT-3 ')和si-NC序列(义,5 ' - uucuccgaacguguucacgutt -3 ';反义5′- acgugacacguucggagaat -3′)由Gene Pharma (Gene Pharma Co., Ltd, China)合成。对于转染方案,我们准备了两个独立的微离心管,一个在Opti-MEM中含有Si-SORBS2,另一个在Opti-MEM中含有Si-NC。另外,将2 μL Lipotectamine RNAiMAX试剂分别与100 μL Opti-MEM混合,孵育管5 min。将稀释后的RNAi双链与稀释后的Lipofectamine (51 μL)混合。两种混合物在室温下孵育20分钟。将两种混合物分别加入6孔板培养的巨噬细胞中,37℃孵育24 h。最后用50 μg/mL OxLDL处理巨噬细胞24 h,诱导泡沫细胞形成。 These cells were subsequently harvested for western blot analysis.
细胞活性氧的测定gydF4y2Ba
使用活性氧(ROS)检测试剂盒评估ROS的产生。种子2.5 × 10粒gydF4y2Ba4gydF4y2Ba96孔板中THP-1衍生巨噬细胞每孔获得70-80%的融合度。然后按照上述方法转染Si-SORBS2或Si-NC贴壁细胞。细胞经OxLDL或不经OxLDL处理过夜后,将荧光探针2’7’-二氯荧光素(DCFDA)直接加入无血清培养基(终浓度10 μM)中,37℃黑暗孵育30 min。孵育后,丢弃培养基,用PBS洗涤探针。进入细胞后,DCFDA被细胞酯酶修饰,形成非荧光DCF。细胞内活性氧氧化DCF产生高度荧光产物,可以检测到。使用荧光微孔板读卡器(激发,488nm;发射光谱,520 nm)。荧光显微镜分析时,使用适合荧光素的发射滤光片立即观察细胞。使用FACS Accuri C6机器(BD Biosciences)立即测量荧光强度,并使用FlowJo V10 (BD Biosciences)进行分析。gydF4y2Ba
胆固醇外排测定gydF4y2Ba
收集THP-1衍生的巨噬细胞(或泡沫细胞)和条件培养基,根据制造商的说明,使用Amplex红色胆固醇测定试剂盒(Invitrogen)测定细胞内和细胞外胆固醇水平。简单地说,将巨噬细胞或泡沫细胞溶解在细胞裂解缓冲液中-九份RIPA,一份PMSF。细胞提取液在12000℃离心澄清gydF4y2BaggydF4y2Ba在4℃下保温10 min,用BCA测定试剂盒(Beyotime, Nanjing, China)测定总蛋白含量。然后用1倍反应缓冲液稀释细胞提取物(蛋白质μg)和条件培养基(每毫升培养基中胆固醇μg)。将提取的胆固醇用反应缓冲液稀释后,以每孔50 μL的比例加入96孔板的单孔中。巢中,每孔加入含Amplex Red、胆固醇氧化酶、胆固醇酯酶、辣根过氧化物酶的工作试剂50 μL。37℃黑暗孵育30 min后,荧光读数(激发,550 nm;每个样品的发射光谱为590 nm。采用胆固醇标准参考曲线(0-8 μg/ml)估计样品胆固醇水平。总胆固醇(TC)减去游离胆固醇(FC)后测定胆固醇酯(CE)含量。结果分别以每毫升培养基中蛋白质的μg和胆固醇的μg表示。gydF4y2Ba
蛋白提取和western blottinggydF4y2Ba
采用标准方案进行Western blotting。简单地说,用裂解缓冲液(Beyotime, Beijing, China)、蛋白酶、磷酸酶抑制剂鸡尾酒(Beyotime, Beijing, China)和PMSF (Beyotime, Beijing, China)提取细胞总蛋白。按照生产商说明书(Solarbio,北京,中国)使用核蛋白提取试剂盒提取核组分。所有提取的蛋白在80℃保存。样品蛋白浓度采用比辛胆酸法测定。在SDS-PAGE分析之前,蛋白质样品在100°C下变性5分钟。然后通过电泳分离蛋白质样品并转移到NC膜(Invitrogen, USA)。转移后,用5%脱脂乳在室温下封闭2小时。然后用特异性一抗(见下文)在4℃下孵育过夜。抗NLRP3、Caspase 1、cleaved Caspase 1、ASC、IL-1β、cleaved IL-1β、NF-κB p65、磷酸化NF-κB p65 (Ser 536)、ABCA1、PPARγ和GAPDH的一抗购自Cell Signaling Technology (Boston, USA)。抗ABCG1抗体购自Abcam (Cambridge, UK),抗SORBS2抗体购自Proteintech (Chicago, USA)。洗净后,与合适的二抗室温孵育1.5 h。 Finally, bound antibody bands were visualized using a GE ImageQuantLAS4000 Chemiluminescent instrument (GE, USA). All the western blotting images presented in this study are representative of at least three independent biological experiments. The band densities were quantified by TotalLab image analysis software after normalizing to GAPDH.
免疫荧光染色gydF4y2Ba
THP-1来源的巨噬细胞或泡沫细胞用4%多聚甲醛固定20分钟,然后用0.3% TritonX-100渗透2分钟。抗原回收和阻断后,用一抗在4℃孵育过夜。丢弃一抗后,与Alexa Fluor®488山羊抗兔IgG (H + L)抗体在37℃下孵育1小时。细胞核用4′,6-二胺-2-苯基吲哚(DAPI)反染;(Beyotime,中国)在观测前。使用Olympus FV1000共聚焦显微镜(Olympus, Japan)以100倍倍率捕获图像。gydF4y2Ba
统计分析gydF4y2Ba
所有实验至少独立进行三次。连续变量以均数±标准差(SD)或中位数[四分位间距(IQR)]报告。分类变量以数量(百分比)报告。用Student分析被试的组间特征gydF4y2BatgydF4y2Ba检验和方差分析检验。对于SORBS2与炎症因子之间的相关性分析,我们计算Spearman相关系数(r)。分析使用IBM SPSS Statistics version 25.0 (IBM SPSS Statistics, IBM Corp., Armonk, NY, USA), GraphPad Prism 8.0软件和r (gydF4y2Bahttp://www.r-project.org/gydF4y2Ba)统计软件包。与a的差异gydF4y2BaPgydF4y2Ba值< 0.05认为有统计学意义。gydF4y2Ba
结果gydF4y2Ba
SORBS2在家族性高胆固醇血症患者和oxldl诱导的THP-1巨噬细胞中表达上调gydF4y2Ba
我们首先对GEO数据集进行了生物信息学分析,以确定FH患者与对照组相比差异表达的基因。利用GEO2R在线工具,我们在GSE6054中发现了1722个基因片段(959个上调,763个下调),在GSE6088中发现了1426个基因片段(447个上调,979个下调),这些基因片段在FH患者和对照组参与者之间存在差异表达(见图中的火山图)。gydF4y2Ba1gydF4y2BaA, B)图中显示了两个数据集中差异上调基因之间的重叠。gydF4y2Ba1gydF4y2BaC,维恩图显示了两个数据集中差异下调基因之间的重叠,如图所示。gydF4y2Ba1gydF4y2BaD.结果显示,两个数据集中有149个重叠的deg(67个上调,82个下调)。在前20个上调基因中,SORBS2被发现与冠状动脉疾病相关,并被选为进一步研究的感兴趣基因(附加文件)gydF4y2Ba1gydF4y2Ba表2)。为了验证DEG分析的结果,我们对FH患者对照参与者的血清样本进行了ELISA检测。ELISA结果显示,与对照组相比,FH患者的SORBS2浓度显著升高(1.20 ng/mL vs. 0.39 ng/mL);gydF4y2BaPgydF4y2Ba< 0.0001;无花果。gydF4y2Ba1gydF4y2BaE).因此,ELISA结果证实了我们的DEG分析结果。我们进一步使用OxLDL (50 μg/mL)处理THP-1来源的巨噬细胞来模拟体外高胆固醇血症。western blot结果显示,oxldl诱导的巨噬细胞中SORBS2表达上调,这与FH患者中SORBS2表达上调的结果相似(图2)。gydF4y2Ba1gydF4y2BaF)。gydF4y2Ba
SORBS2在家族性高胆固醇血症患者中上调。采用生物信息学分析方法鉴定FH患者和正常对照组的差异表达基因(DEGs)。gydF4y2Ba一个gydF4y2BaGSE6054中FH和对照样品中DEGs的火山图。gydF4y2BaBgydF4y2BaGSE6088中FH和对照样品中DEGs的火山图。gydF4y2BaCgydF4y2Ba维恩图表示两个数据集中共67个上调基因。gydF4y2BaDgydF4y2Ba维恩图表示两个数据集中共包含82个下调基因。gydF4y2BaEgydF4y2BaELISA结果显示FH患者和正常对照组(n = 30)血清中SORBS2的浓度。gydF4y2BaFgydF4y2BaOx-LDL (50 μg/mL)处理或不处理THP-1源性巨噬细胞24 h。western分析测定蛋白水平。****gydF4y2BaPgydF4y2Ba< 0.0001,与对照组(无Ox-LDL治疗)比较。DEGs,差异表达基因;家族性高胆固醇血症gydF4y2Ba
循环SORBS2与炎症因子和脂质指标相关gydF4y2Ba
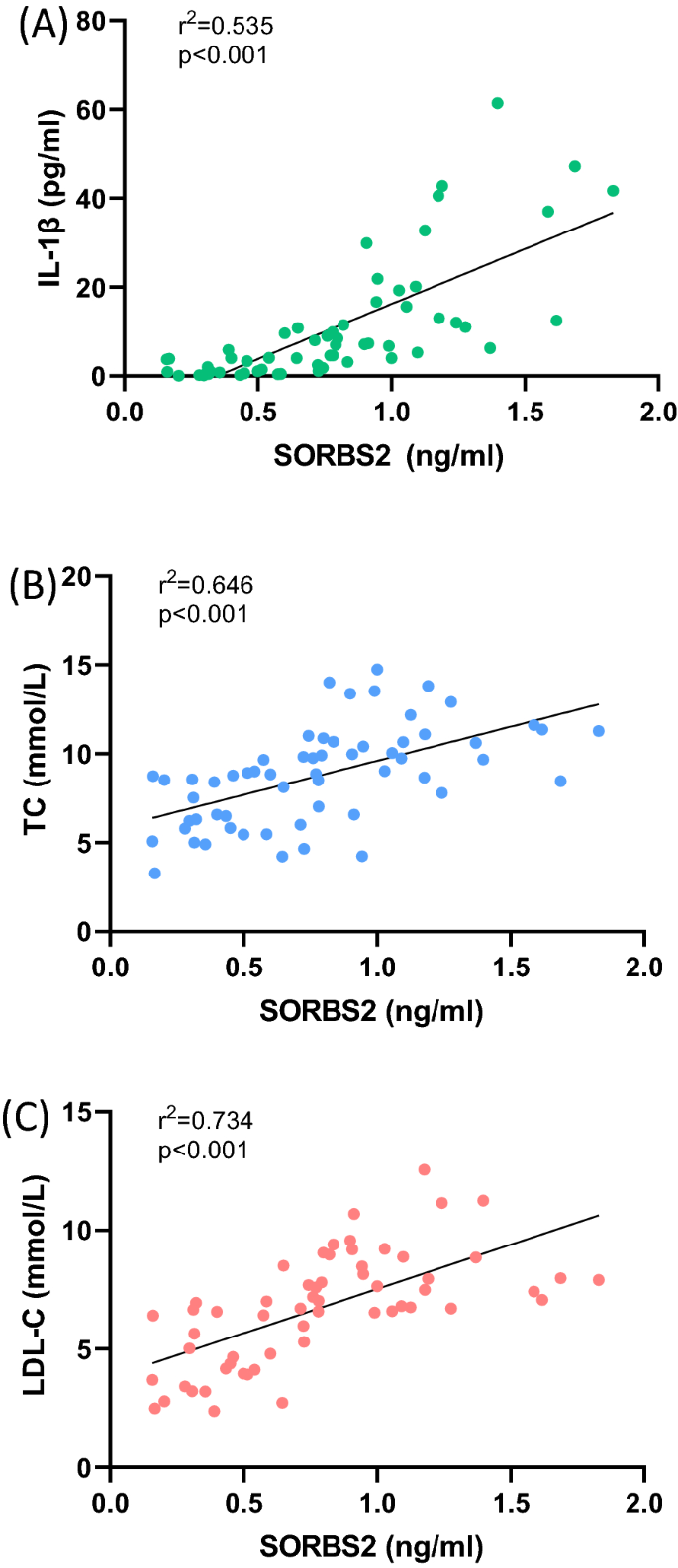
FH患者和对照组的基线特征见表gydF4y2Ba1gydF4y2Ba.除了循环SORBS2水平外,我们还比较了FH组患者和对照组患者的炎症因子和脂质指数水平(附加文件)gydF4y2Ba1gydF4y2Ba:图S1)。有趣的是,我们发现循环SORBS2水平与IL-1β分泌之间存在适度但显著的相关性(Spearman r = 0.731,gydF4y2BaPgydF4y2Ba< 0.001)。此外,SORBS2水平也与TC水平呈正相关(Spearman r = 0.804;gydF4y2BaPgydF4y2Ba< 0.001), LDL-C (Spearman r = 0.857;gydF4y2BaPgydF4y2Ba< 0.001),表明循环SORBS2水平与脂质指数呈正相关(图2)。gydF4y2Ba2gydF4y2Ba).然而,没有观察到SORBS2水平与TG水平或SORBS2水平与HDL-C水平之间的关联gydF4y2Ba1gydF4y2Ba:图S1)。gydF4y2Ba
SORBS2沉默通过NLRP3炎性体和NF-κB信号通路减弱oxldl诱导的炎症gydF4y2Ba
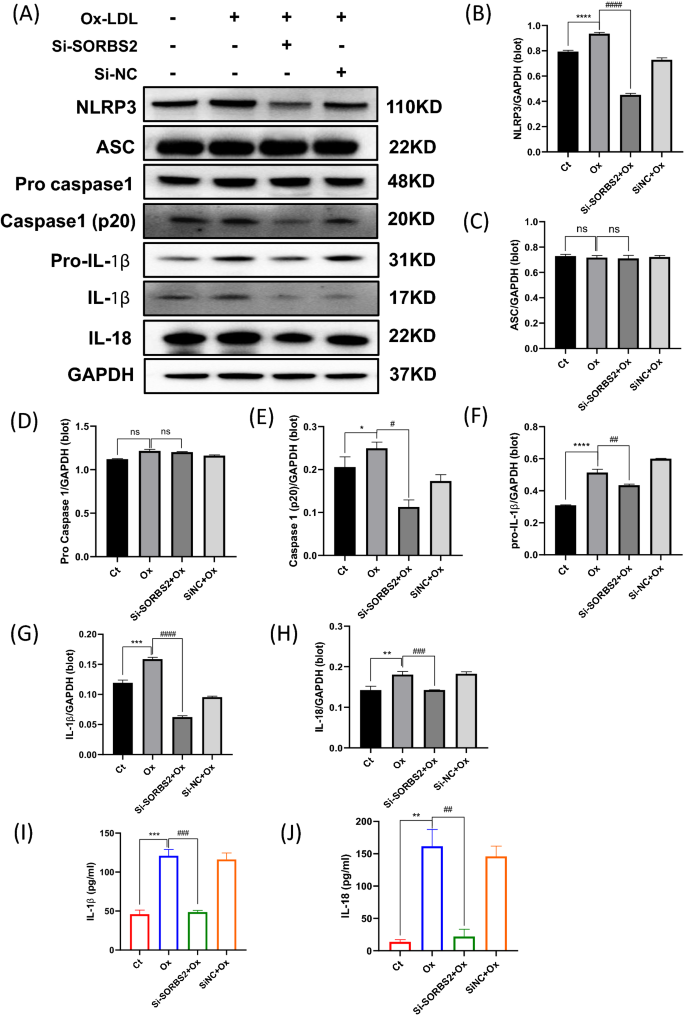
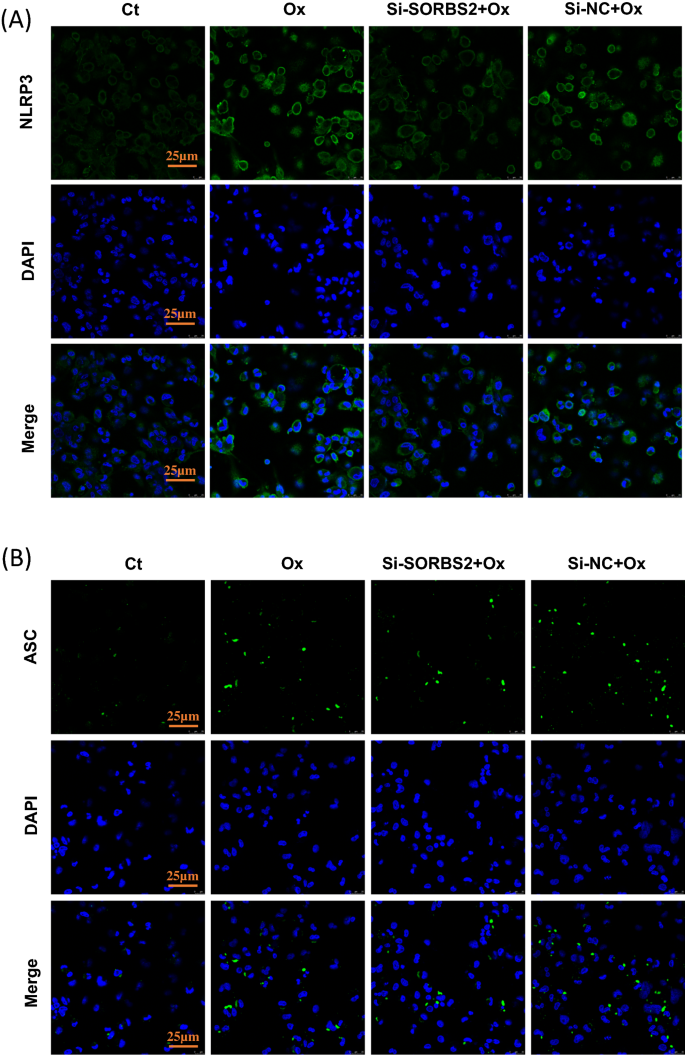
NLRP3炎性小体的激活先前已被证明在动脉粥样硬化的严重炎症中起重要作用[gydF4y2Ba6gydF4y2Ba]。在本研究中,使用OxLDL触发巨噬细胞NLRP3炎性体的激活[gydF4y2Ba9gydF4y2Ba]。这些活化的巨噬细胞也转染了SORBS2 siRNA(或阴性对照),并研究si-SORBS2沉默对NLRP3炎性体激活的影响。虽然OxLDL激活增加了NLRP3蛋白的表达,但si-SORBS2处理可以逆转这种作用(图2)。gydF4y2Ba3.gydF4y2BaA, B)。因此,si-SORBS2沉默通过降低NLRP3炎性体激活诱导抗炎作用。免疫荧光染色也证实了si-SORBS2对NLRP3炎性体活化的影响(图2)。gydF4y2Ba4gydF4y2Ba此外,western分析显示si-SORBS2阻断了相关的裂解caspase-1的增加(p20)。gydF4y2Ba3.gydF4y2BaA, D, E),但没有改变ASC蛋白的表达(图2)。gydF4y2Ba3.gydF4y2BaA, C)有趣的是,si-SORBS2也减少了OxLDL刺激的ASC斑点的数量(图2)。gydF4y2Ba4gydF4y2BaB).总之,这些观察结果提供了SORBS2沉默可以抑制NLRP3炎症小体途径激活的证据。此外,SORBS2沉默被观察到可以抑制oxldl诱导的细胞裂解液中IL-1β和IL-18炎症因子水平的升高(图2)。gydF4y2Ba3.gydF4y2BaF-H)和上清(图。gydF4y2Ba3.gydF4y2BaI, J)。gydF4y2Ba
SORBS2 siRNA减弱NLRP3炎性体的激活。gydF4y2Baa -gydF4y2Ba用OxLDL (50 μg/L)刺激THP-1细胞,并加或不加Si-SORBS2处理24h,然后用western blotting分析检测蛋白表达水平。gydF4y2BaBgydF4y2BaNLRP3;gydF4y2BaCgydF4y2BaASC;gydF4y2BaDgydF4y2Bapro-caspase-1;gydF4y2BaEgydF4y2Bacaspase-1 p20;gydF4y2BaFgydF4y2Bapro-IL-1β;gydF4y2BaGgydF4y2Bail - 1β;gydF4y2BaHgydF4y2Ba的地震。GAPDH水平作为内控指标。直方图报告了三个实验中蛋白质带密度的平均值±SEM(与GAPDH比较归一化)。gydF4y2Bai jgydF4y2BaELISA结果显示培养基中炎症细胞因子浓度。gydF4y2Ba我gydF4y2Bail - 1β;gydF4y2BaJgydF4y2Ba的地震。*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba与对照组(未给予OxLDL治疗)比较< 0.001;gydF4y2Ba#gydF4y2BaPgydF4y2Ba< 0.05,gydF4y2Ba# #gydF4y2BaPgydF4y2Ba< 0.01,gydF4y2Ba# # #gydF4y2BaPgydF4y2Ba与相应对照(OxLDL浓度为50 μg/mL)相比< 0.001gydF4y2Ba
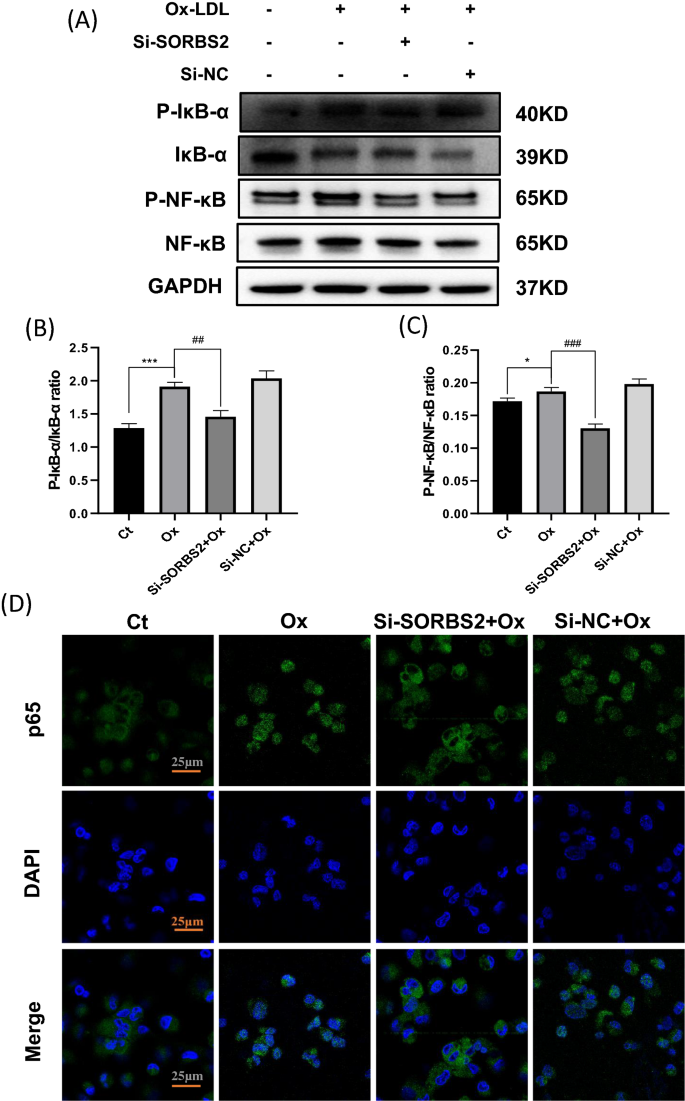
核因子κB (Nuclear factor κB, NF-κB)是一种关键的转录因子,通过诱导多种炎症基因的上调,在炎症中发挥重要作用,因此参与炎症[gydF4y2Ba10gydF4y2Ba]。将50 μg/mL的OxLDL作用于巨噬细胞15 min、30 min、1 h、2 h、3 h、6 h、12 h、24 h,收集不同时间点的蛋白,对磷酸化的NF-κB进行western blot分析。最后,我们发现OxLDL以时间依赖性的方式增加NF-κB的磷酸化,在3 h达到峰值(附加文件)gydF4y2Ba1gydF4y2Ba然而,SORBS2沉默在处理后3小时抑制了p-p65和p- i - κB的表达(图2)。gydF4y2Ba5gydF4y2Ba此外,在表达si-SORBS2的oxldl诱导细胞中,p-p65/p65和p- i- κ b / i- κ b比值降低(图2)。gydF4y2Ba5gydF4y2BaB, C)。此外,免疫荧光染色显示,转染si-SORBS2可显著抑制p65的核定位,这与抑制NF-κB活性一致(图2)。gydF4y2Ba5gydF4y2BaD)。gydF4y2Ba
SORBS2沉默抑制NF-κB的活化。gydF4y2Ba得了gydF4y2BaSi-SORBS2处理抑制thp1源性巨噬细胞中NF-κB信号传导。Western blotting检测Si-SORBS2处理或不处理巨噬细胞中p- κ b -α、i- κ b -α、p-p65、p65和GAPDH蛋白的表达水平。gydF4y2BaDgydF4y2Ba用共聚焦显微镜检测细胞质和细胞核中的P65亚基蛋白水平。在用Si-SORBS2和OxLDL预处理24小时的THP-1来源的巨噬细胞中,用抗p65(绿色)抗体观察p65的核定位。DAPI(蓝色)作为核标记物。直方图报告了三个实验中蛋白带密度扫描的平均值±SEM(与GAPDH比较归一化)。*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba与对照组(无Ox-LDL治疗)比较< 0.001;gydF4y2Ba#gydF4y2BaPgydF4y2Ba< 0.05,gydF4y2Ba# #gydF4y2BaPgydF4y2Ba< 0.01,gydF4y2Ba# # #gydF4y2BaPgydF4y2Ba与相应的对照(OxLDL为50µg/mL)相比< 0.001。比例尺,25 μm (400 ×)gydF4y2Ba
通过SORBS2沉默,oxldl诱导的ROS生成减少gydF4y2Ba
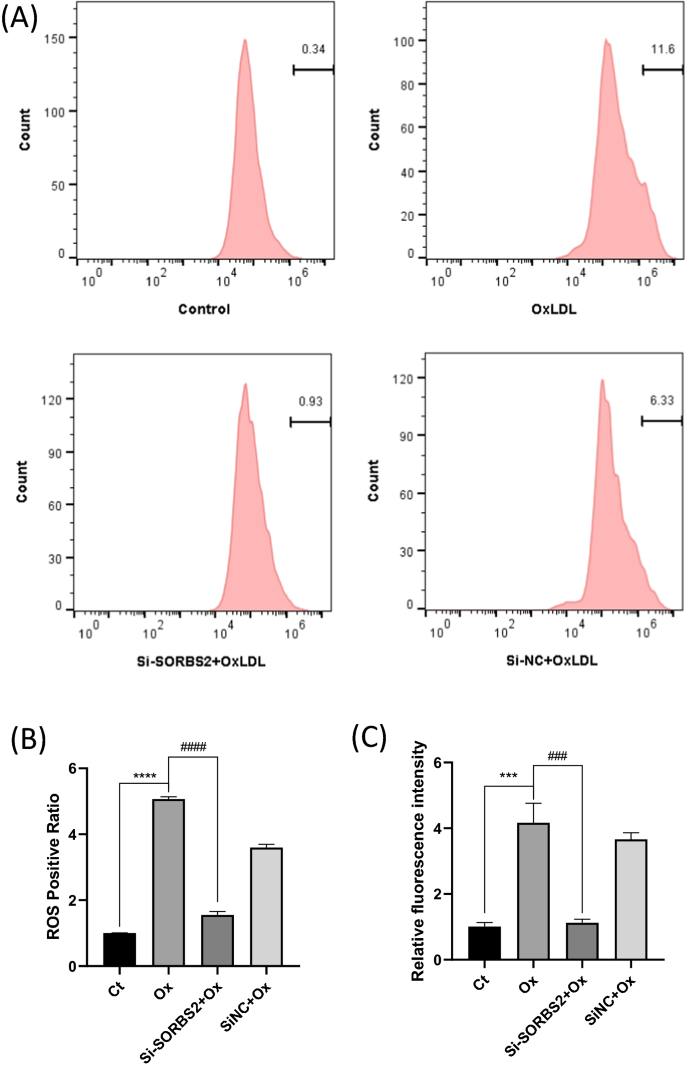
NLRP3炎性体的激活需要来自ROS产生的第二个激活信号[gydF4y2Ba11gydF4y2Ba]。在oxldl诱导的巨噬细胞中,si-SORBS2转染被观察到下调细胞内ROS的产生(图2)。gydF4y2Ba6gydF4y2Ba).因此,SORBS2沉默会损害NLRP3激活所需的第二个信号。gydF4y2Ba
SORBS2 siRNA抑制ROS的产生。THP-1来源的巨噬细胞用Si-SORBS2或Si-NC预处理24 h,然后用OxLDL(50µg/mL)刺激24 h。gydF4y2Ba一个gydF4y2Ba流式细胞术检测ROS的产生。gydF4y2BaBgydF4y2Ba采用密度分析量化ROS生成水平(n = 3)。gydF4y2BaCgydF4y2Ba用荧光微孔板读卡器测定相对荧光强度(n = 5)。***gydF4y2BaPgydF4y2Ba< 0.001和****gydF4y2BaPgydF4y2Ba与对照组(未给予OxLDL治疗)比较< 0.0001;gydF4y2Ba# # #gydF4y2BaPgydF4y2Ba< 0.001和gydF4y2Ba# # # #gydF4y2BaPgydF4y2Ba< 0.0001与相应的对照组相比(OxLDL在50µg/mL)gydF4y2Ba
SORBS2沉默对氧化ldl诱导的THP-1巨噬细胞脂质积累的影响gydF4y2Ba
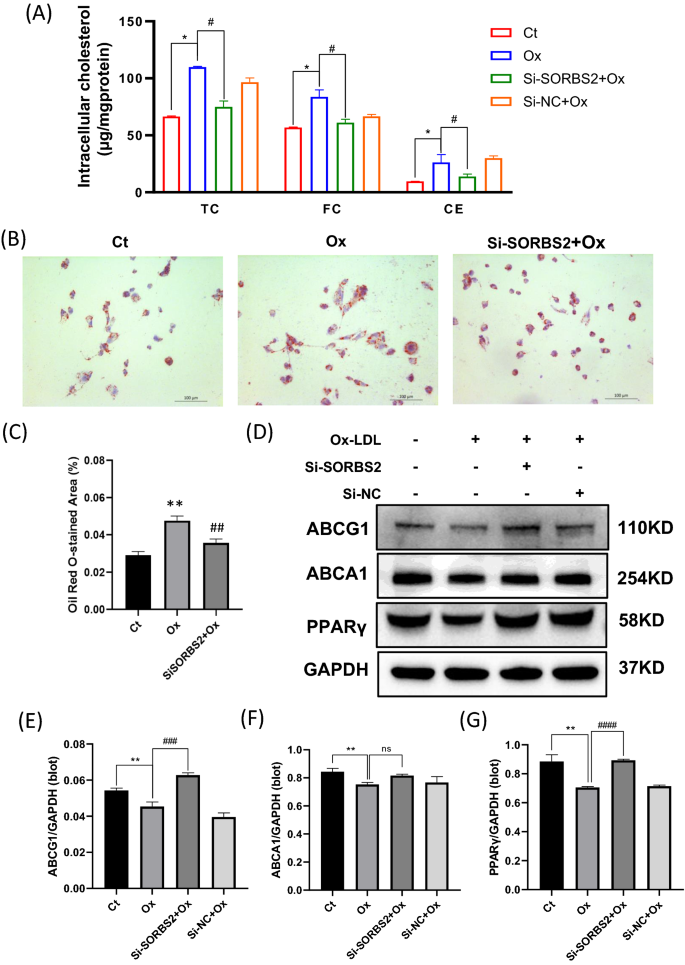
异常脂质代谢和炎症之间的联系是众所周知的。我们对脂质指标的分析显示,SORBS2沉默可显著降低氧化低密度脂蛋白诱导的巨噬细胞条件上清中的TC、FC和CE水平(图2)。gydF4y2Ba7gydF4y2Ba此外,oxldl诱导的巨噬细胞油红O染色证实,转染si-SORBS2后,脂滴表面积也随之减少(图2)。gydF4y2Ba6gydF4y2BaB, C)。根据西方的分析,SORBS2沉默显著增加了负责胆固醇外排的转运蛋白ABCG1的表达。相比之下,SORBS2沉默不调节ABCA1的表达。在si-SORBS2转染后,胆固醇逆向转运的关键调节因子PPARγ的表达也上调(图2)。gydF4y2Ba6gydF4y2Bad)。总之,我们的研究结果提供了SORBS2沉默可以抑制脂质积累并通过ABCG1-PPARγ途径促进胆固醇外排的证据。gydF4y2Ba
SORBS2沉默对氧化低密度脂蛋白诱导THP-1巨噬细胞脂质积累和胆固醇外排的影响gydF4y2Ba一个gydF4y2Ba总胆固醇(TC)、游离胆固醇(FC)和胆固醇酯(CE)水平在氧化低密度脂蛋白活化的巨噬细胞(n = 5)经Si-NC或Si-SORBS2处理后的培养上清中测定。gydF4y2BaBgydF4y2Ba油红o染色各细胞组THP1细胞的代表性图像。gydF4y2BaCgydF4y2Ba油红o染色结果定量分析。gydF4y2BadgydF4y2BaWestern blotting测定THP-1源性巨噬细胞中ABCA1、ABCG1和PPARγ蛋白的表达水平。直方图报告了三个实验中蛋白质带的密度扫描的平均值±SEM(通过与GAPDH比较归一化)。*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba与对照组(无Ox-LDL治疗)比较< 0.001;#gydF4y2BaPgydF4y2Ba< 0.05,gydF4y2Ba# #gydF4y2BaPgydF4y2Ba< 0.01,gydF4y2Ba# # #gydF4y2BaPgydF4y2Ba与相应的对照(OxLDL为50µg/mL)相比< 0.001gydF4y2Ba
讨论gydF4y2Ba
FH患者在年轻时表现出动脉粥样硬化和心肌梗死的高风险。这些结果主要与终生暴露于高血浆胆固醇水平有关。通常需要多种药物治疗才能达到适当的LDL-C水平。高强度他汀类药物、依折麦布和胆汁酸隔离剂都是有用的治疗方法。针对PCSK9的单克隆抗体可增加有效LDL-R并显著降低血浆LDL-C水平。除了LDL-C水平外,炎症在维持动脉粥样硬化过程中也起着关键作用。最近的研究支持这样一种观点,即FH患者尽管接受了长期的降胆固醇治疗,但仍表现出炎症加剧[gydF4y2Ba12gydF4y2Ba]。事实上,高胆固醇血症和炎症可视为“一枚硬币的两面”[gydF4y2Ba13gydF4y2Ba]。尽管PCSK9抑制剂与显著降低CV风险相关,但最近对随机对照试验的荟萃分析发现,短期PCSK9抑制治疗并未降低hs-CRP浓度[gydF4y2Ba14gydF4y2Ba]。我们的研究可能是对FH患者处方的有益补充,因为抑制SORBS2可以阻断炎症过程,从而减少动脉粥样硬化。gydF4y2Ba
在本研究中,观察到FH患者的循环SORBS2水平高于对照组。特别是,我们观察到循环SORBS2水平与炎症因子(IL-1β)以及循环SORBS2水平与脂质指数(TC和LDL-C)呈正相关,表明SORBS2可能在家族性高胆固醇血症患者的炎症中发挥重要作用。基于这些观察结果,我们用OxLDL处理thp1来源的巨噬细胞来模拟高胆固醇血症,然后研究SORBS2是否可以调节炎症过程和巨噬细胞来源的泡沫细胞的形成,从而促进高胆固醇血症人群动脉粥样硬化(AS)的进展。gydF4y2Ba
SORBS2是桥接炎症功能障碍和冠状动脉粥样硬化性疾病的关键因子。SORBS2是包括CAP (SORBS1)和vinexin (SORBS3)在内的三蛋白家族的原型成员[gydF4y2Ba15gydF4y2Ba]。SORBS2在多种疾病中发挥的重要作用已被报道[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba15gydF4y2Ba]。SORBS2变异也与冠心病有关[gydF4y2Ba16gydF4y2Ba]。此外,据报道,人类心脏组织中的SORBS2定位于成熟肌原纤维的z带,可以调节心肌细胞的重要过程[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba17gydF4y2Ba]。在本研究中,我们报道SORBS2表达是AS进展的一个标志。因此,FH患者的循环SORBS2水平明显较高,FH患者具有较高水平的炎性小体相关细胞因子Wang等先前报道SORBS2可以调节败血症相关心功能障碍中IL-6、TNF-α和IL-1β的水平[gydF4y2Ba18gydF4y2Ba]。本研究发现,在OxLDL诱导巨噬细胞活化后,SORBS2沉默抑制IL-1β和IL-18分泌到培养上清中。此外,SORBS2沉默可抑制细胞裂解液中IL-1β和IL-18的水平。因此,SORBS2沉默可以抑制oxldl诱导的泡沫细胞中的炎症。gydF4y2Ba
NLRP3炎症小体是先天免疫反应中最具特征的模式识别受体,由传感器(NLRP3蛋白)、适配器(ASC蛋白)和效应体(前caspase-1)组成。流行病学研究间接证明AS患者主动脉NLRP3高表达,且NLRP3表达水平与疾病严重程度及临床危险因素相关[gydF4y2Ba19gydF4y2Ba]。激活刺激后,NLRP3蛋白与凋亡相关的含有CARD (ASC)和前caspase-1的斑点样蛋白相互作用,形成NLRP3炎性体。这最终导致成熟的caspase-1切割和成熟强效的促炎细胞因子IL-1β和白细胞介素18 (IL-18) [gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba]。在机制上,NLRP3炎性小体的激活是通过NF-κB途径进行的。gydF4y2Ba
oxldl诱导的巨噬细胞显著促进NF-κB的活化。NF-κB活化后,NF-κB易位进入细胞核,促进NLRP3炎性小体复合物的形成和活化。SORBS2沉默可有效抑制巨噬细胞NF-κB活化和NLRP3炎性体活化。当NLRP3炎性小体被激活时,接头蛋白ASC组装成一个名为ASC斑点的大蛋白复合物,这被认为是炎性小体激活的典型标志。在显微镜下,炎性小体激活后聚集的ASC斑点可见为微米大小的病灶。本研究采用免疫荧光法对体外ASC斑点的组装进行了研究。我们发现SORBS2沉默阻断了Ox-LDL刺激的巨噬细胞中ASC斑点的组装。gydF4y2Ba
ASC微粒组装后,ASC前体caspase-1成核,NLRP3炎症小体随后将前体caspase-1切割成活性caspase-1。随后,激活的caspase-1将IL-1β和IL-18前体加工成成熟的IL-1β和IL-18,增强炎症反应和相关损伤。我们的研究表明,SORBS2沉默抑制NLRP3/ caspase-1/ IL-1β通路的激活,最终阻断AS的炎症过程,从而可能对高胆固醇血症和动脉粥样硬化提供保护。gydF4y2Ba22gydF4y2Ba]。gydF4y2Ba
据报道,NLRP3炎性小体的激活需要额外的触发因素,如活性氧(ROS)。ROS是一种不稳定的高活性分子,主要是在线粒体氧化磷酸化过程中由氧还原产生的[gydF4y2Ba23gydF4y2Ba]。在内皮细胞中,高糖条件下Ox-LDL处理会增加细胞内ROS的产生,并随后激活NLRP3炎性体[gydF4y2Ba24gydF4y2Ba]。抗氧化剂的应用是一种合理的治疗策略,可以预防涉及氧化应激的疾病。天然抗氧化剂通常具有很强的抗氧化和自由基清除能力以及抗炎作用,这也是其他生物活性和健康益处的基础。在我们的研究中,我们发现SORBS2可以通过ROS激活调节NLRP3炎性体。因此,SORBS2沉默可以作为家族性高胆固醇血症患者的天然抗氧化剂。我们的研究结果表明SORBS2沉默抑制oxldl诱导的ROS产生。通过减少氧化应激标志物的产生,SORBS2沉默进一步抑制NLRP3炎性体的激活。gydF4y2Ba
在动脉粥样硬化中,巨噬细胞泡沫细胞的形成被认为是病理过程的第一步[gydF4y2Ba25gydF4y2Ba]。已知这些细胞调节OxLDL摄取和细胞内胆固醇运输。据报道,OxLDL通过与清除率受体结合并在细胞质中积累,在AS的发生和发展中起致病作用。我们的数据显示,在OxLDL条件下,THP-1细胞的泡沫细胞形成增强,如油红O染色所示。先前已经确定,受体介导的胆固醇外排和逆向胆固醇移植是去除细胞胆固醇的主要机制,而CE水解是这些过程中的限速步骤。在OxLDL处理的THP-1细胞中,观察到胆固醇外排(TC、FC和CE)增加,从而下调ABCG1和PPARγ。这些结果与Bekkering等人的研究结果一致gydF4y2Ba.gydF4y2Ba研究。[gydF4y2Ba26gydF4y2Ba由于SORBS2沉默显著增加TC、FC和CE外排,因此可以推断SORBS2在ox - ldl诱导的巨噬细胞泡沫细胞形成中发挥作用。gydF4y2Ba
配体诱导的转录因子PPARγ在巨噬细胞中高表达,并且已知在动脉粥样硬化斑块中控制巨噬细胞炎症、极化和脂质代谢[gydF4y2Ba27gydF4y2Ba]。先前的研究表明,PPARγ在诱导ABCA1/ ABCG1表达、预防泡沫细胞形成和动脉粥样硬化进展中起着至关重要的作用[gydF4y2Ba28gydF4y2Ba]。Jiang等报道PPARγ配体可显著降低ABCG1表达诱导和hdl介导的胆固醇外排[gydF4y2Ba29gydF4y2Ba]。在本研究中,我们发现SORBS2沉默增强了ABCG1蛋白的表达和胆固醇向HDL的外排。相反,SORBS2沉默不影响ABCA1蛋白表达,因此不影响胆固醇向ApoA1的外排。因此,可以推测SORBS2沉默通过促进胆固醇的逆向转运来调控巨噬细胞泡沫细胞的形成。综上所述,我们的研究结果进一步证明SORBS2可以通过转录激活脂质基因来调节脂质生物合成。gydF4y2Ba
结论gydF4y2Ba
总之,我们的研究提供了SORBS2沉默通过阻断NLRP3炎性小体和NF-κB的激活来调节泡沫细胞形成和减轻炎症的证据。此外,SORBS2沉默可以减少ROS的产生。通过这些机制,SORBS2沉默可阻止细胞脂质积累,并通过PPARγ/ABCG1途径促进胆固醇外排。我们的发现为高胆固醇血症和动脉粥样硬化的治疗机制提供了新的思路。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
所有数据将在合理要求的情况下共享给通讯作者。本研究中使用和/或分析的数据集可应通讯作者的合理要求向其提供。gydF4y2Ba
缩写gydF4y2Ba
- FH:gydF4y2Ba
-
家族性高胆固醇血症gydF4y2Ba
- 为:gydF4y2Ba
-
动脉粥样硬化gydF4y2Ba
- SORBS2:gydF4y2Ba
-
Sorbin和SH3 Domain ContaininggydF4y2Ba
- 冠心病:gydF4y2Ba
-
冠心病gydF4y2Ba
- OxLDL:gydF4y2Ba
-
氧化低密度脂蛋白gydF4y2Ba
- ROS:gydF4y2Ba
-
活性氧gydF4y2Ba
- NLRP3:gydF4y2Ba
-
Nod样受体家族pyrin结构域3蛋白gydF4y2Ba
- PPAR -γ:gydF4y2Ba
-
过氧化物酶体增殖物激活受体gydF4y2Ba
- DLCN:gydF4y2Ba
-
荷兰脂质诊所网络gydF4y2Ba
- 度:gydF4y2Ba
-
差异表达基因gydF4y2Ba
- THP-1:gydF4y2Ba
-
人类单核细胞白血病细胞系gydF4y2Ba
- DCFH-DA:gydF4y2Ba
-
2 ' 7 ' -Dichlorofluorescin二醋酸盐gydF4y2Ba
- PMA:gydF4y2Ba
-
佛波12-肉豆蔻酸13-醋酸酯gydF4y2Ba
- si-SORBS2:gydF4y2Ba
-
SORBS2小干扰RNAgydF4y2Ba
- CE:gydF4y2Ba
-
胆甾醇酯gydF4y2Ba
- 舰队指挥官:gydF4y2Ba
-
免费的胆固醇gydF4y2Ba
- TC:gydF4y2Ba
-
总胆固醇gydF4y2Ba
- GAPDH:gydF4y2Ba
-
Glyceraldehyde-3-phosphate脱氢酶gydF4y2Ba
- 密度:gydF4y2Ba
-
低密度脂蛋白胆固醇gydF4y2Ba
- ABCA1 / G1:gydF4y2Ba
-
atp结合盒转运体A1/G1gydF4y2Ba
参考文献gydF4y2Ba
李建军,李建军。动脉粥样硬化免疫与炎症的关系。Circ Res. 2019; 124:315-27。gydF4y2Ba
李超,刘峰,刘松,潘慧,杜华,黄娟,谢勇,李勇,赵睿,魏勇。左室非压实性心肌病患者心肌SORBS2升高及其意义。EBioMedicine。2020; 53:102695。gydF4y2Ba
Kakimoto Y, Ito S, Abiru H, Kotani H, Ozeki M, Tamaki K, Tsuruyama T. Sorbin和SH3结构域蛋白2在心肌梗死早期释放的蛋白质组学分析。中华医学会心脏科杂志,2013;22(2):563 - 564。gydF4y2Ba
Duewell P, Kono H, Rayner KJ, Sirois CM, Vladimer G, Bauernfeind FG, Abela GS, Franchi L, Nuñez G, Schnurr M, Espevik T, Lien E, Fitzgerald KA, Rock KL, Moore KJ, Wright SD, Hornung V, Latz E。大自然。2010;464:1357 - 61。gydF4y2Ba
李建平,李建平。动脉粥样硬化危险信号研究进展。Circ Res. 2015; 116:323-40。gydF4y2Ba
葛丽娟,王晓明,王晓明,等。NLRP3炎性体与动脉粥样硬化中IL-1通路的关系。Circ Res. 2018; 122:1722-40。gydF4y2Ba
郑峰,邢生,龚忠,穆伟,邢强。NLRP3沉默抑制载脂蛋白e缺乏小鼠动脉粥样硬化及斑块稳定。中西医联合杂志。2014;39(4):571 - 578。gydF4y2Ba
parel Varghese G, Folkersen L, Strawbridge RJ, Halvorsen B, Yndestad A, Ranheim T, Krohg-Sørensen K, Skjelland M, Espevik T, Aukrust P, Lengquist M, Hedin U, Jansson j h, fransn K, Hansson GK, Eriksson P, Sirsjö A.动脉粥样硬化NLRP3炎症小体的表达和激活。美国心脏协会,2016。gydF4y2Ba
李建军,李建军,李建军,等。靶向性免疫系统在动脉粥样硬化治疗中的应用。中华医学杂志,2015;8:297-313。gydF4y2Ba
乔颖,王鹏,齐军,张丽,高昌。tlr诱导的NF-κB活化对小鼠巨噬细胞NLRP3表达的调控。生物工程学报。2012;586:1022-6。gydF4y2Ba
赵义奎,金建军,申德明,Sasakawa C. NLRP3炎性小体激活的分子机制。中国生物医学工程学报,2016;13(1):444 - 444。gydF4y2Ba
王晓明,王晓明,王晓明,等。家族性高胆固醇血症的研究进展。中国生物医学工程学报,2018;33(3):564 - 564。gydF4y2Ba
李建军,李建军,李建军,等。高胆固醇血症对动脉粥样硬化性炎症的影响。[J] .中华心血管病杂志。2020;27(2):391 - 391。gydF4y2Ba
王晓明,王晓明,王晓明,等。PCSK9基因在慢性炎症中的应用研究进展。动脉粥样硬化。2019;288:146-55。gydF4y2Ba
韩丽,黄超,张生。rna结合蛋白SORBS2通过稳定RORA mRNA抑制肝癌肿瘤发生转移。中华肝病杂志,2019;39:2190-203。gydF4y2Ba
梁峰,王斌,耿军,有刚,法杰,张敏,孙华,陈华,傅强,张翔,张忠。SORBS2是4q缺失综合征患者心脏畸形的遗传因子。Elife》2021。gydF4y2Ba
王晓明,王晓明,王晓明,等。一种新的细胞骨架组织和信号转导调控蛋白家族。细胞结构函数。2002;27:1-7。gydF4y2Ba
王辉,贝燕,沈生,黄鹏,石健,张健,孙青,陈燕,杨燕,徐涛,孔翔,肖军。miR-21-3p通过调节SORBS2调控败血症相关心功能障碍。中华生物医学杂志,2016;44(4):444 - 444。gydF4y2Ba
郑峰,邢生,龚忠,邢强。NLRP3炎性小体在动脉粥样硬化患者主动脉中的高表达。心肺杂志,2013;22:746-50。gydF4y2Ba
杨建军,杨建军,李建军,等。NLRP3炎性小体的研究进展[j]。中华医学杂志,2019。gydF4y2Ba
Sharma D, Kanneganti T-D。炎性小体的细胞生物学:炎性小体的激活和调节机制。中国生物医学工程学报,2016;21(3):617 - 629。gydF4y2Ba
连丹,袁宏,尹鑫,吴艳,何锐,黄燕,陈艳。葛根素通过ros依赖氧化途径抑制内皮Nlrp3炎性体激活,抑制高血糖诱导的内皮间连接。植物学期刊。2019;55:310-9。gydF4y2Ba
林强,李生,姜宁,邵晓,张敏,金华,张忠,沈杰,周勇,周伟,顾玲,卢荣,倪铮。PINK1-parkin途径通过降低线粒体ROS和NLRP3炎性体激活对造影剂诱导的急性肾损伤的保护作用。中国生物医学工程学报,2019;26(1):1049 - 1054。gydF4y2Ba
Nyandwi JB, Ko YS, Jin H, Yun SP, Park SW, Kim HJ。迷迭香酸通过下调p38- fox01 - txnip途径抑制高糖条件下氧化低密度脂蛋白诱导的炎性体激活。中国生物医学工程学报,2014;32(2):444 - 446。gydF4y2Ba
李赵X,赵L,杨H, J,最小值X,杨F,刘J,黄g .丙酮酸激酶M2与核固醇调节元件结合蛋白1,从而激活脂肪生成,在肝癌细胞增殖。生物化学学报,2018;29(3):623 - 634。gydF4y2Ba
Bekkering S, Quintin J, Joosten LAB, van der Meer JWM, Netea MG, Riksen NP。氧化低密度脂蛋白通过单核细胞的表观遗传重编程诱导长期促炎细胞因子的产生和泡沫细胞的形成。中华动脉粥样硬化杂志,2014;33(4):391 - 391。gydF4y2Ba
冯鑫,于伟,李鑫,周峰,张伟,沈强,李军,张超,沈鹏。PPARγ的调节因子芹菜素通过Nrf2激活调节肝细胞脂质代谢和氧化应激,减轻hfd诱导的NAFLD。中国生物医学工程学报,2017;36(1):1 - 4。gydF4y2Ba
任凯,李辉,周鸿飞,梁毅,童明,陈磊,郑小林,赵国军。芒果苷通过增加ABCA1和ABCG1的表达,促进巨噬细胞胆固醇外流,防止动脉粥样硬化。衰老(纽约州奥尔巴尼)。2019; 11:10992 - 1009。gydF4y2Ba
蒋明,李霞。活化PPARγ不参与巨噬细胞ABCA1表达和ABCA1介导的胆固醇外排至apoAI。生物化学学报,2017;42(2):849 - 856。gydF4y2Ba
致谢gydF4y2Ba
作者感谢本研究的所有工作人员和参与者的重要贡献。gydF4y2Ba
资金gydF4y2Ba
本研究得到首都健康发展基金(201614035)和中国医学科学院医学科学创新基金(2016-I2M-1-011)的部分资助,资助人为李建军博士,MD, PhD。gydF4y2Ba
作者信息gydF4y2Ba
作者及单位gydF4y2Ba
贡献gydF4y2Ba
JJL和CJC设计了研究,解释了数据,并对文章进行了批判性修改。MML完成项目,进行实验,分析数据,制作图表和表格,撰写稿件。JP收集并解释数据,并参与撰写初稿。YLG、CGZ、NQW、RXX和QD参与了患者招募和临床数据收集。所有作者都认可了最终稿。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准并同意参与gydF4y2Ba
我们的研究符合《赫尔辛基宣言》,并获得医院伦理审查委员会(中国北京阜外医院和国家心血管疾病中心)的批准。获得了所有患者的知情书面同意。gydF4y2Ba
发表同意书gydF4y2Ba
所有作者和参与者均已同意稿件发表。gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们没有相互竞争的利益。gydF4y2Ba
额外的信息gydF4y2Ba
出版商的注意gydF4y2Ba
伟德体育在线施普林格·自然对已出版的地图和机构关系中的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1:gydF4y2Ba
图S1。gydF4y2Ba酶联免疫吸附试验结果显示gydF4y2Ba一个gydF4y2Ba) il-1β, (gydF4y2BaBgydF4y2Ba) il-18, (gydF4y2BaCgydF4y2Ba) IL-8,及(gydF4y2BaDgydF4y2Ba) FH患者和正常对照组(n=30)血清中TNF-α的含量。Spearman相关分析显示,SORBS2水平与(gydF4y2BaEgydF4y2Ba高密度脂蛋白胆固醇;和(gydF4y2BaFgydF4y2BaTG)。gydF4y2Ba图S2。gydF4y2Bawestern blotting分析不同时间ox-LDL刺激后NF-κB磷酸化表达(n=3) (gydF4y2Baa - bgydF4y2Ba50 μg/mL Ox-LDL分别作用巨噬细胞15min、30min、1h、2h、3h、6h、12h、24h。然后收集不同时间点的蛋白,对磷酸化的NF-κB进行western blot分析。gydF4y2Ba图S3。gydF4y2Ba使用活性氧(ROS)检测试剂盒检测ROS的产生。(gydF4y2Ba一个gydF4y2Ba)用荧光显微镜观察细胞。(gydF4y2BaBgydF4y2Ba)使用荧光酶标仪测量不同时间点的相对荧光强度(n=3)。gydF4y2Ba
附加文件2:gydF4y2Ba
表S1gydF4y2Ba.gydF4y2BaGSE6054和GSE6088的前20个重叠基因上调。gydF4y2Ba
附加文件3:gydF4y2Ba
中央插图。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。如欲查阅本许可证副本,请浏览gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.创作共用公共领域免责声明(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文中提供的数据,除非在数据的信用额度中另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
刘,MM.,彭,J.,郭,YL.。gydF4y2Baet al。gydF4y2BaSORBS2作为家族性高胆固醇血症患者动脉粥样硬化的分子靶点gydF4y2BaJ翻译医学gydF4y2Ba20.gydF4y2Ba, 233(2022)。https://doi.org/10.1186/s12967-022-03381-zgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12967-022-03381-zgydF4y2Ba
关键字gydF4y2Ba
- SORBS2gydF4y2Ba
- 氧化低密度脂蛋白gydF4y2Ba
- NLRP3 inflammasomegydF4y2Ba
- ROSgydF4y2Ba
- 胆固醇流出gydF4y2Ba