摘要
目标
铂基化疗是目前非小细胞肺癌的一线治疗方法。本研究将提高我们对顺铂耐药原因的认识,特别是在肺腺癌(LUAD)中,并为临床实践中的治疗决策提供参考。
方法
采用Cancer Cell Line Encyclopedia (CCLE)、The Cancer Genome Atlas (TCGA)和复旦大学附属中山医院(zs-cohort)对铂类化疗相关的多组学差异进行鉴别。采用Logistic回归、分类回归树和C4.5决策树分类算法构建顺铂耐药mRNA和miRNA模型,前期特征选择采用最小绝对收缩和选择算子(LASSO)进行。利用A549和H358细胞的qRT-PCR和western-blotting,以及肿瘤样本的单细胞Seq数据,验证某些基因的倾向。
结果
将661株细胞株根据顺铂的IC50值分为三组,IC50值较小的前1/3(220)为敏感组,后1/3(220)为不敏感组。TP53是不敏感组中最常见的突变,而TTN则是敏感组。两组间差异表达1348个mRNA, 80个miRNA, 15个代谢物(P < 0.05)。根据LASSO惩罚逻辑建模,1348个mRNA中有6个,FOXA2, BATF3, SIX1, HOXA1, ZBTB38, IRF5,被选为与顺铂耐药相关的特征,并用于预测mRNA模型的贡献(所有调整后的p值< 0.001)。6个基因中的3个(BATF3, IRF5, ZBTB38)最终在细胞水平和zs队列患者中得到验证。
结论
体细胞突变、mRNA表达、miRNA表达、代谢产物和甲基化与顺铂耐药有关。我们创建的模型可以帮助预测接受铂类化疗的患者的反应和预后。
中心思想
通过对顺铂敏感组和耐药组的多组学比较,建立并验证了预测含顺铂化疗效果的机器学习模型。
观点陈述
本研究旨在从基因、药理学、细胞水平以及铂类化疗患者的预后等方面了解顺铂耐药的原因,为临床治疗提供治疗决策参考。
中央图片图例
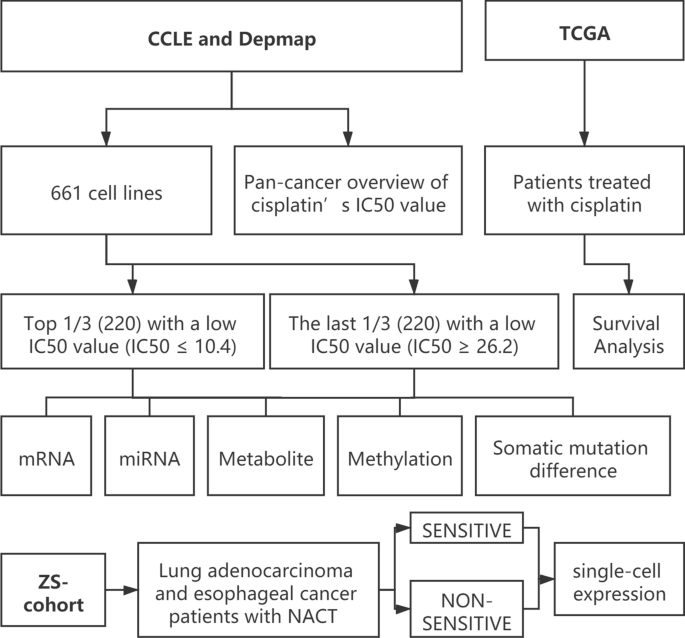
整体设计流程图。
简介
顺铂由M. Peyrone于1844年首次合成,其化学结构由Alfred Werner于1893年首次阐明。然而,这种化合物直到20世纪60年代才得到充分的科学研究,当时罗森博格发现它能够抑制大肠杆菌的细胞分裂,这增加了它在癌症化疗中使用的可能性[1,2].
1978年,顺铂成为fda批准的第一个用于癌症治疗的铂化合物[3.,后来它成为最重要的抗癌药物之一。目前,铂基化疗仍是晚期NSCLC患者的重要治疗方式,因为EGFR、ALK或ROS突变肿瘤的靶向治疗出现耐药性[4].
就其药理学机制而言,一般是破坏DNA,导致细胞周期阻滞和细胞死亡,通常是通过细胞凋亡[5,6].然而,副作用和耐药性是限制顺铂应用和疗效的两个固有挑战[7].在许多常见的肿瘤类型中,如NSCLC,铂基DNA损伤剂的治疗效果有限,导致只有约三分之一的患者受益[8,9].到目前为止,至少有四种不同的机制使癌细胞对顺铂类化疗产生耐药性,针对至少两种不同的机制可能是规避耐药性的最成功的策略[10].
本研究旨在从基因、药理学、细胞水平以及铂类化疗患者的预后等方面了解顺铂耐药的原因,为临床治疗提供治疗决策参考。
方法
数据处理
细胞系信息的详细信息可从癌症依赖地图(Depmap, depmap.org)和癌细胞系百科全书(CCLE,https://portals.broadinstitute.org/ccle/data),包括IC50值、细胞系来源、体细胞突变、mRNA表达、miRNA表达、代谢物等。使用顺铂治疗的肺腺癌患者的信息从The Cancer Genome Atlas (TCGA)中下载,https://gdc.cancer.gov/) (TCGA-LUAD)及其基因表达数据。由于CCLE、Depmap、TCGA数据库是在特定的指导方针下向公众开放的,因此它确认所有的书面知情同意都是在数据收集之前获得的。
差分析
用R(3.6.1版)对低IC50组和高IC50组之间的体细胞突变、RNA、miRNA和代谢产物数据进行了差异分析。利用R包Maftools对体细胞突变数据进行汇总、分析和可视化。去除样本中没有足够序列片段的RNA、miRNA和代谢物数据后,首先使用edgfR构建相关表达矩阵,进行归一化和标准化。根据logFoldChange值(|logFC|> 1)对差异基因、躯体突变、miRNAs (P < 0.05,假发现率(FDR) < 0.05)进行排序,以识别显著差异表达。所有的差异分析都以热图和火山图的形式呈现。
GO, KEGG和GSVA分析
进行GO分析和GSVA分析,以研究与铂反应显著相关的蛋白质的生物学意义。使用R(3.6.1版)进行GSVA、GO和KEGG通路富集分析。校正后的显著性水平设置为0.05P值。用条形图和点状图来可视化结果。
模型的贡献
LASSO回归的特点是在拟合广义线性模型时同时考虑变量选择(Variable Selection)和正则化(Regularization),在拟合广义线性模型时,采用惩罚最大似然拟合的“Glmnet”(LASSO and Elastic-Net Regularization generalized linear Models) R包,得到的mRNAs和miRNAs主要与顺铂耐药性相关。
在LASSO结果的基础上,采用Logistic回归、分类回归树(CART)和C4.5决策树分类算法,利用出现率来确定因变量的类别。最后,采用逐步回归的方法选择变量,建立可预测的模型。
细胞培养和细胞毒性试验
NSCLC A549和H358细胞来自American Type Culture Collection (Manassas, VA, USA)。细胞在含有10%胎牛血清(FBS)和100 μg/mL青霉素-链霉素的rmi -1640培养基中培养,并加入或不加入DDP (Sigma-Aldrich, Merck KGaA, Darmstadt, Germany),在含5% CO的潮湿环境中培养237°C。
细胞计数试剂盒-8(CCK-8;Dojindo,熊本,日本)。简单来说就是2 × 103.A549和H358细胞分别镀于96个孔板上。用含10%胎牛血清(FBS)的100 μL rmi -1640和100 μg/mL青霉素-链霉素孵育24 h,然后加或不加DDP (Sigma-Aldrich, Merck KGaA, Darmstadt, Germany)在37℃下孵育24 h。处理后,细胞用10% CCK-8试剂孵育。使用Bio-Rad的microplate reader (microplate reader 3550-UV)在450 nm处测量2 h后的OD值。
RNA干扰
靶向BATF3、IRF5、ZBTB38和消音阴性对照的siRNAs从Ribobio购买(序列在附加文件中提供)6:表S1)。我们为每个基因购买了两个不同的sirna,以避免脱靶效应。A549和H358细胞在6孔板中培养24小时,然后转染靶向BATF3、IRF5、ZBTB38的siRNA和相应的非靶向对照。在每个由靶siRNA组成的实验中加入总共150 nM的siRNA,并在适当的地方补充适当浓度的非靶向对照。在OptiMem培养基(Gibco)中使用Lipofectamine 8000转染试剂(Beyotime)进行转染。转染48小时后,收集细胞并检测目标RNA和蛋白质的表达水平。同时,对相应的样品进行了文中所述的处理。
RNA制备及qRT-PCR分析
为了检测BATF38、IRF5、ZBTB38在A549和H358细胞系中的表达,在QuantStudio上进行RT-qPCR®5实时PCR系统(应用生物系统公司),具有适当的PCR参数。
总rna由TRIzol (TIANGEN, Beijing, China)提取。根据制造商说明,使用Hifair®III 1st Strand cDNA Synthesis SuperMix for qPCR (gDNA消化器+)(YEASEN, Tokyo, Japan)合成第一链cDNA。然后Hieff®qPCR采用SYBR Green Master Mix (Low Rox Plus) (YEASEN), PCR参数为:95℃30 s 1个循环,95℃5 s 40个循环,60℃34 s。β-肌动蛋白作为参比。本研究中使用的引物列在附加文件中7:表S2。
所有样本重复三次。
Western blot分析
RNA干扰后的A549细胞和H358细胞蛋白采用RIPA (Beyotime, Shanghai, China)和蛋白酶磷酸酶抑制剂鸡尾酒(Topscience)提取。然后用Enhanced BCA Protein Assay Kit (Beyotime)对这些蛋白进行定量。然后,蛋白质被分解、分离,最后在电流的作用下转移到PVDF膜中(默克- millipore, Burlington, MA, USA)。阻断细胞膜,然后用特定的一抗孵育[11].
最后,利用Moon化学发光试剂盒(Beyotime)对蛋白带进行了观察。使用以下抗体:兔抗batf3 (NBP2-41296,稀释1:15 00,Novus Biologicals);兔抗irf5 (CY5822,稀释1:15 00,Abways);兔抗zbtb38 (21906-1-AP,稀释1:15 00,Proteintech),小鼠β-ACTIN (1:3 00, AA128, Beyotime),辣根过氧化物酶(HRP)标记山羊抗兔IgG (H + L) (1:3 00, A0208, Beyotime),和HRP标记山羊抗小鼠IgG (H + L) (1:3 00, A0208, Beyotime)。
单个肿瘤和免疫细胞
我们使用了之前研究中描述的相同方法来检测顺铂敏感性相关基因[12].
本研究获复旦大学中山医院伦理委员会批准(B2019-137R)。患者在住院时已签署知情同意书。
结果
顺铂组划分及细胞IC50值概述
最终纳入661个细胞系,包括mRNA、microRNA表达和代谢物的完整数据。根据CCLE数据库给出的IC50值,即一半抑制浓度,将患者分为3组,IC50值反映了患者对化疗药物的敏感性。数值越低,灵敏度越强。本研究将IC50值低(IC50≤10.4)的前1/3(220)组定义为敏感组,将IC50值低(IC50≥26.2)的后1/3(220)组定义为不敏感组(图2)。1).
显然,对顺铂的耐药性在不同的癌症中是不同的。在Depmap数据库中,我们成功地根据不同肿瘤细胞系的癌源对其进行分类,从而得到相关癌症顺铂的平均IC50值。如附加文件所示1:图S1, 6种癌症的平均IC50值大于100,包括肺腺癌(LUAD)、间皮瘤(MESO)、甲状腺癌(THCA)等,这意味着这些类型的癌症患者对最常见的化疗药物之一顺铂耐药的可能性更高。
体细胞突变差异
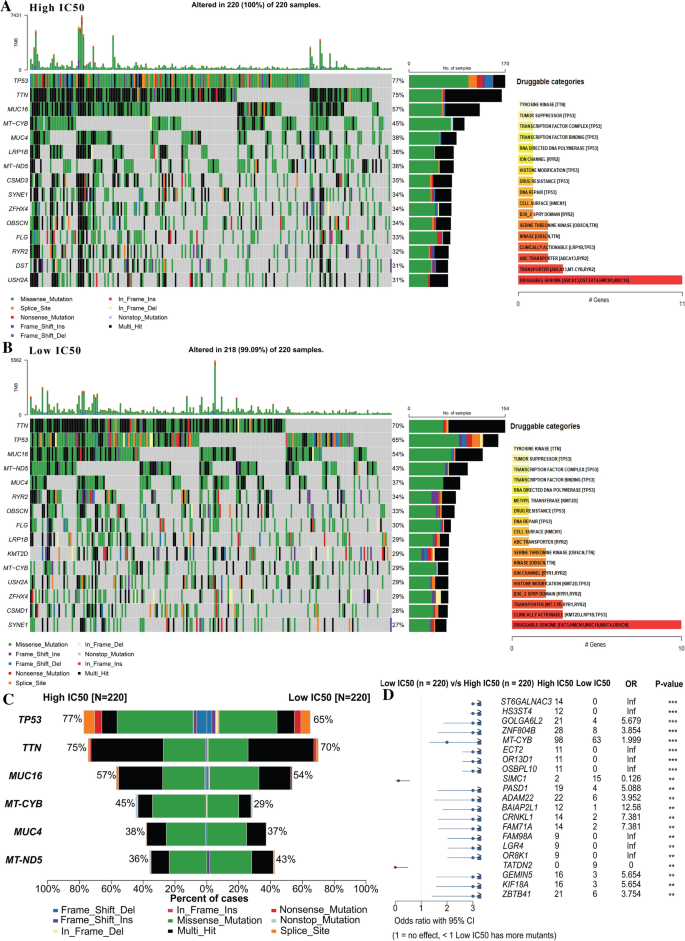
在附加文件中详细描述了细胞系体细胞突变的总体模式2:图S2。将体细胞突变数据与药敏数据进行比对后,研究IC50低组(220中218)与IC50高组(220中220)间体细胞突变特征的差异。如图所示。2A和B,虽然这两种基因的两个体细胞突变致癌位点和共现集在一定程度上相似,但不难发现,在顺铂耐药组(高IC50组)中,TP53突变排在第一位(10%),高于顺铂敏感组(低IC50组)的突变率。Aditya Bagrodia此前报道[13], TP53突变仅在顺铂耐药肿瘤中发现,尤其是原发性纵隔非精原细胞瘤。因此,我们可以认为TP53突变与顺铂耐药密切相关。相比之下,低IC50组MUT5的突变率更高。我们还检查了从具有“药物相互作用”功能的药物基因相互作用数据库编译的药物-基因相互作用。大多数药物与TTN和TP53有关,这两组细胞之间的差异较小。
不同层次的差异分析基因功能分析
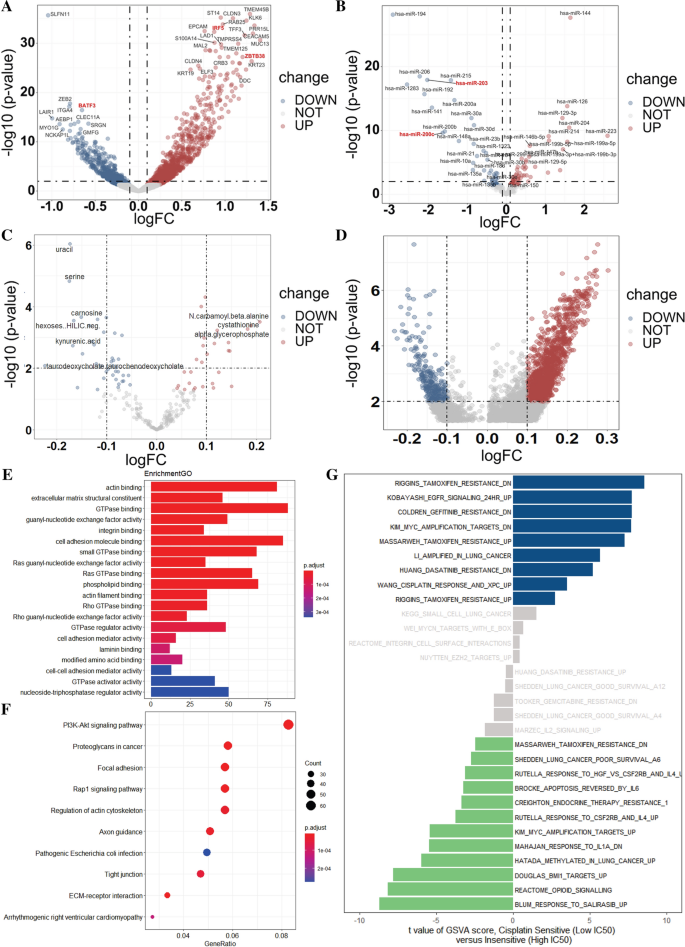
为了进一步发现两组之间的差异,我们从不同水平对两种细胞系进行了差异分析。首先,在mRNA水平上,通过edgfR,我们发现两组间有1348个mRNA差异表达(P < 0.01),其中顺铂耐药组有1个mRNA下调(SLFN1), 35个mRNA上调(TMEM4SB、CLDN3、KLK6、IRF5、ZBTB38等),并有明显的折叠变化(|logFC| > 1)(图1)。3.A)。同样,在miRNA水平,如图3B所示,发现80个差异表达的miRNA (P < 0.01), 11个下调(miR-194, miR-206, miR-215等,),12个上调(miR-144, miR-16, miR-129-3p等,),并出现明显的倍数变化(|logFC| > 1)。而在代谢物方面,两组间仅尿嘧啶、丝氨酸、肌肽、n -氨甲酰-β-丙氨酸、胱胱硫氨酸等15种代谢物的表达有显著差异,且无明显的折叠变化(|logFC| < 1)(图。3.C).甲基化方面,折叠变化明显的差异甲基化位点(|logFC| > 1)均与差异表达基因关系不密切(图。3.D)。
我们首先基于CCLE数据对之前发现的差异表达的1348个mrna进行了基因本体(GO)分析。基因功能富集分析显示,20个GO功能基团在低IC50组与高IC50组之间表现出显著差异,包括肌动蛋白结合、细胞外基质结构成分、GTPase结合、鸟苷-核苷酸交换因子活性等。5A).对于基于这些mrna的京都基因和基因组百科全书(KEGG)(图。5B),两组间有10条通路差异:PI3K-Akt信号通路差异最大,基因比最高,其次为癌蛋白多糖、局灶性粘连等。
接下来,为了进一步总结途径和功能的差异,我们应用了基因集变异分析(Gene set variation analysis, GSVA),将特定的基因集作为特征表达矩阵,对基因富集的结果进行量化(图。5C).我们总共总结了643条基因通路,其中大部分与耐药有关,包括Riggins他莫西芬耐药、EGFR信号24HR、吉非替尼耐药、KIM-MIC扩增靶点等。
模型构建与评价
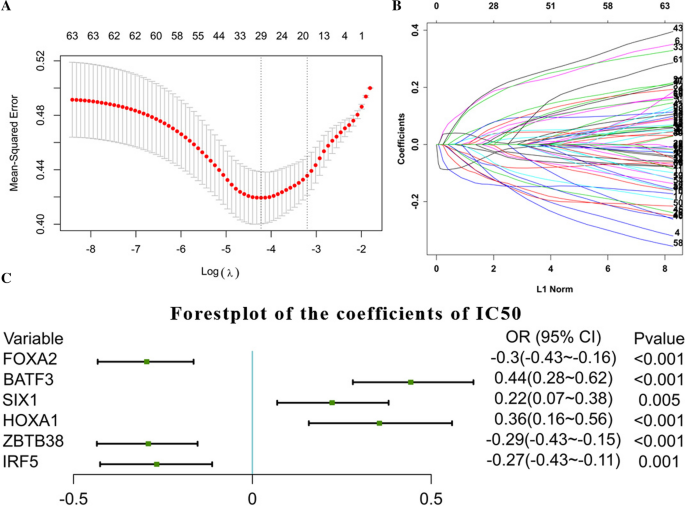
首先,应用glmnet R包,“family = binomial”,适用于二元离散因变量,以确定deg与IC 50的高低相关。1348个mrna中的6个,FOXA2, BATF3, SIX1, HOXA1, ZBTB38, IRF5,被选为与顺铂耐药相关的特征(图。4A, B),然后通过glm建立相关的logistic模型[14函数(图;4C)。
接下来,我们应用J48和rpart R包,“”公式= ic50 ~ FOXA2 + BATF3 + SIX1 + HOXA1 + ZBTB38 + IRF5“”和“family =高斯”,这适用于连续单变量,因为我们旨在通过该模型得到ic50值的预测值(附加文件3.:图S3)。采用阶跃函数实现逐步回归。从结果来看,6个变量中有3个通过了显著性检验(p < 0.05),成为构建模型的相对重要变量。虽然模型中的每个变量都通过了显著性检验,但有必要确保整个模型是显著的。因此,对模型进行卡方检验。随着变量从第一个到最后一个依次加入到模型中,模型最终通过显著性检验,说明模型组成(表1)是有意义和正确的。
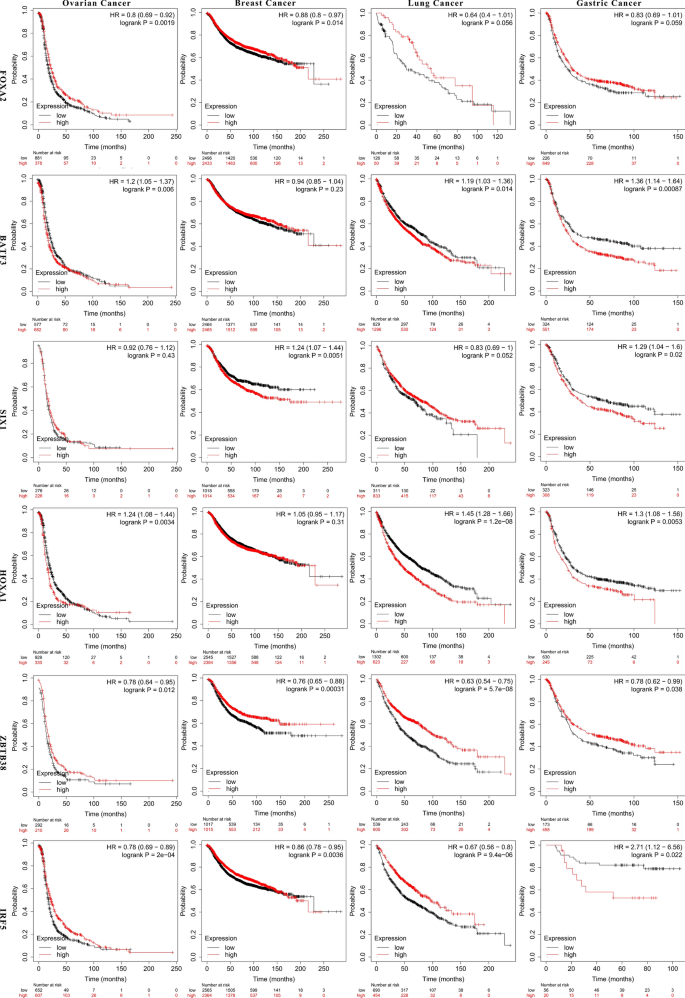
最后,我们验证了这些基因是否不仅与顺铂耐药有关,而且与患者生存有关。此外,根据TCGA数据库的数据,它们的表达水平与不同肿瘤患者的预后有一定的关系,包括乳腺癌、卵巢癌、肺癌和胃癌(图2)。5).事实上,BATF3, IRF5和ZBTB38也有助于评估乳腺癌和卵巢癌患者对化疗的反应(附加文件)4:图S4)。
同样,我们构建了miRNA预测模型。从LASSO回归中,总结出4个显著的mirna, miR-203, miR-200c, miR-148a, miR-142-5p(附加文件)5:图S5)。阶梯函数后,miR-203和miR-200c离开,均通过了卡方检验的显著性检验,说明模型组成(表21)是有意义和正确的。
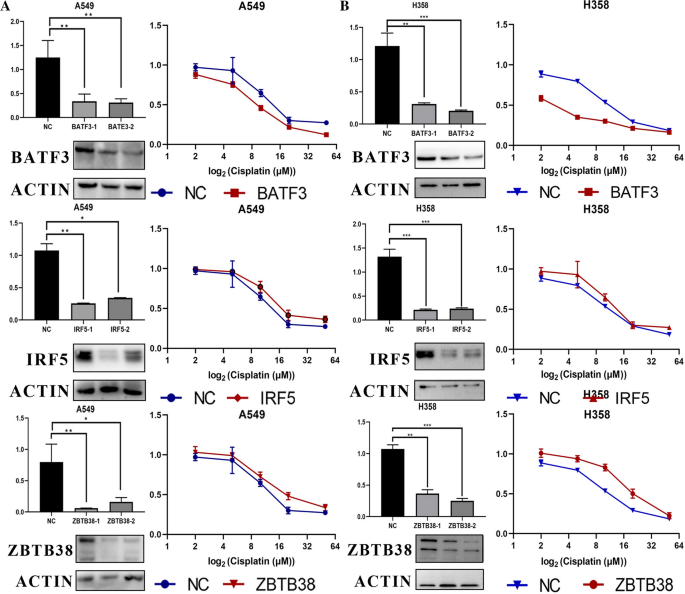
BATF3、IRF5、ZBTB38的表达与A549、H358细胞及肿瘤样品中顺铂敏感性相关
为了在细胞水平上检验BATF3、IRF5、ZBTB38表达与顺铂敏感性之间的因果关系,我们分别在人类癌细胞系A549和H358(非小细胞肺癌)中转染BATF3靶向、IRF5靶向和ZBTB38靶向的sirna,这些sinas一方面表达高BATF3、IRF5、ZBTB38水平。这两种细胞系在之前测序分析的结果中,在另一方面,在我们的实验室中经常被使用。所有sirna介导的沉默都被证明是高效的,并且持续了3d或更长时间。与模拟沉默的细胞相比,IRF5和zbtb38沉默的细胞对顺铂的敏感性至少降低,而batf3沉默的细胞对顺铂的敏感性增加(P≤0.01,图。6A、B)。
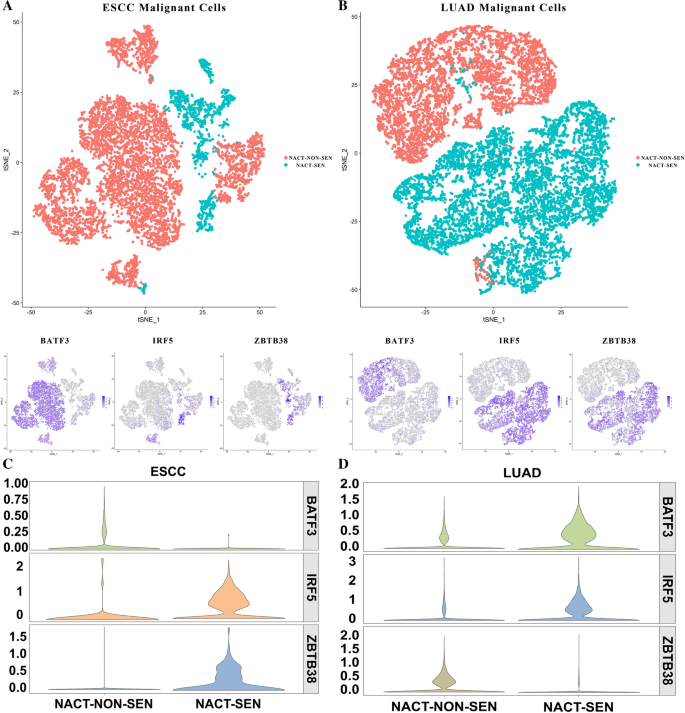
共选取6例ESCC(食管鳞状细胞癌)患者,接受完全含顺铂新辅助化疗治疗,包括4例新辅助化疗不敏感(nect - non - sen)肿瘤样本和2例新辅助化疗敏感(nect - sen,完全缓解[CRs])肿瘤样本(图。7A).采用RECIST标准评价NACT效应的有效性。
同样,我们选取了5例LUAD患者,其中3例为NACT-SEN(3例CRs, 1例PRs), 2例为NACT-NON-SEN(图。7B)。
在LUAD中,NACT-SEN组BATF3明显下调,而恶性上皮细胞群中,NACT-SEN组IRF5、ZBTB38的表达明显高于NACT-NON-SEN组(用EPCAM和SOX4标记,图。7D)。在ESCC中,BATF3、IRF5、ZBTB38在以LYZ和C1QB标记的9801个恶性细胞中表现出相同的趋势。7C)。
讨论
顺铂是治疗各种实体癌症(如睾丸癌、肺癌、子宫颈癌等)最有效和最广泛使用的药物之一,[7],而肿瘤对顺铂或卡铂的反应取决于铂- DNA加合物的水平和细胞的DNA修复能力[3.,15].顺铂耐药在人类癌细胞中的发展,包括细胞生长促进、细胞凋亡、DNA损伤修复和内吞作用,这些都是支持细胞生存的机制[16].
在本研究中,我们首先探索了不同癌细胞系中与顺铂IC50值相关的重要基因和miRNA,在此基础上,我们利用6个mrna的表达值构建了顺铂耐药的预测模型,其中BATF3、IRF5、ZBTB38 3个mrna在我们自己的样本中也得到了验证。所有这些都与免疫系统密切相关。
一方面,多项研究报道化疗能够调节TAM的功能[17,18,19].另一方面,TAM的不同变化反映了患者对化疗的反应[20.,21,22,23].巧合的是,我们选择的三个基因都与免疫相关,这可能提示它们通过调节TAM来影响肿瘤细胞对顺铂的敏感性。免疫细胞系中batf和irf之间的相互作用发生在几个关键过程的基因表达网络中。例如,BATF和IRF4在CSR中合作,以及通过影响T进行抗体类切换跳频细胞和生发中心B细胞[24].此外,ZBTB46、BATF3和IRF8的合作激活CD8α+常规树突状细胞(cDCs)的发育[25].在本研究中,我们发现ZBTB38、BATF3和IRF5可能存在相互作用,影响细胞对顺铂的敏感性,但趋势不同。
碱性亮氨酸拉链转录因子atf样(BATF)、BATF2和BATF3属于活化蛋白1 (AP-1)转录因子家族,调节多种细胞过程[26].BATF3首先在人T细胞中被发现,后来被发现在传统dc的cDC1亚群的发展中发挥关键作用[25,27].虽然我们发现敲除BATF3的表达会增加癌症对顺铂的敏感性,但该转录因子的主要功能是激活CD8alpha+树突状细胞。换句话说,它在肿瘤排斥反应和转录因子Batf3缺失消融CD8alpha +树突状细胞发育的交叉呈递中发挥重要作用[28].此外,在OpACIN试验中,在伊匹单抗+尼鲁单抗辅助或新辅助治疗后肿瘤复发的严重黑色素瘤患者显示出低水平的Batf3+dc相关基因[29],这可能揭示BATF3在化疗和免疫治疗中的双重调节作用。
干扰素调节因子-5 (IRF5)是一种转录因子,作为肿瘤抑制基因具有重要的细胞机制[30.].NACRT对TAMs浸润的有益作用可能与性别依赖的IRF-5表达有关,如CD163 + TAMs与不良预后有关[31],与IRF-5 +细胞数量呈负相关[20.].也有报道称,m2样TAM中IRF-5的表达增加促进了对NACT的抗肿瘤免疫应答[31].在我们的研究中,IRF-5表现出同样的趋势,敲除它可以增加肿瘤细胞对顺铂的耐药性,且IC50更高,其潜在机制可能与其分泌素IFN-α的功能有关,因为将IRF5蛋白递送到人原发性pDCs中会增加IFN-α的分泌[32],具有抗增殖、诱导分化、凋亡和抗血管生成的特性,其临床活性已在几种癌症中得到证实,包括作为化疗后维持[33,34].
锌指和含BTB结构域38 (ZBTB38)是甲基- cpg结合蛋白(MBPs)锌指(ZF)家族的一个成员[35].与IRF5相似,在我们的实验中,它的表达与顺铂敏感性有关。前期研究表明,ZBTB38作为DNA甲基转移酶抑制剂的靶点,可以增强对DNMT抑制剂治疗的应答[36],并通过参与影响DNA甲基化的各种表观遗传过程,影响癌细胞系对化疗的反应[37].然而,ZBTB38的生物学功能仍然是未知的[38].ZBTB38在膀胱癌中促进迁移和侵袭性生长[39],而在前列腺癌中,在阿霉素治疗后,ZBTB38的缺失导致ROS的更高表达和细胞死亡的升高[40].
然而,这3个基因之间改变癌细胞对顺铂敏感性的具体机制还有待探索。
miRNAs可通过影响mRNA翻译调节约30%的基因表达[41],在许多生物学过程中起着关键作用,包括肿瘤化疗耐药[42].有证据表明,几种miRNAs的表达可能与恶性细胞中的顺铂耐药有关[43,44].在我们的研究中,miR-200c和miR-203最终促成了顺铂耐药模型。前者属于miR-200家族,据报道,它可以增加多种癌症中细胞对抗肿瘤药物的敏感性,包括胃癌[45,46],乳房[47]及非小细胞肺癌[48].同样,miR-203在ddp敏感和-不敏感肿瘤细胞中也有差异表达。前期研究表明miR-203可与DKK1的3'UTR结合,进而调控肺癌细胞的特性[49].此外,它还影响胰腺癌细胞对顺铂的耐药[50]、舌鳞癌[51].总之,大量的研究表明,miRNAs积极地影响顺铂耐药的机制。
结论
体细胞突变、mRNA表达、miRNA表达及代谢产物差异与顺铂耐药有关。我们基于BATF3、IRF5、ZBTB38 3个基因的表达建立的模型,可以帮助预测癌症患者接受铂类尤其是顺铂类化疗后的反应和预后。
数据和材料的可用性
用于支持本研究结果的数据可以在网上获得,也可以根据要求从通讯作者那里获得。
参考文献
达萨里S,春武PB。顺铂在癌症治疗中的分子作用机制。欧洲药物学杂志,2014;740:364-78。
杨晓明,李志强,李志强,等。细胞分裂抑制作用研究进展大肠杆菌通过电解铂电极的产物。大自然。1965;205:698-9。
Kelland L.基于铂的癌症化疗的复兴。中华癌症杂志,2007;7(8):573-84。
Rossi A, Di Maio M.晚期非小细胞肺癌的铂基化疗:最佳治疗周期数。专家评论抗癌杂志2016;16(6):653-60。
奥默罗德MG, Orr RM,孔雀JH。凋亡在顺铂杀伤细胞中的作用:流式细胞术研究。中华肿瘤学杂志,1994;19(1):93-100。
Siddik ZH型。顺铂:细胞毒作用模式及耐药分子基础。致癌基因。2003;22(47):7265 - 79。
高希顺铂:第一种金属基抗癌药物。生物组织化学2019;88:102925。
孔耀文,戴瑞恩,莫兰德尔,周伟,达拉斯,斯瑞拉姆,等。通过联合靶向核苷酸切除修复和细胞周期检查点增强合成致死率来增强化疗反应。网络学报。2020;11(1):4124。
Sirohi B, Ashley S, Norton A, Popat S, Hughes S, Papadopoulos P,等。非小细胞肺癌患者对铂类一线化疗的早期反应可预测生存期。中华胸肺科杂志,2007;2(8):735-40。
Galluzzi L, Senovilla L, Vitale I, Michels J, Martins I, Kepp O,等。顺铂耐药的分子机制。致癌基因。2012;31(15):1869 - 83。
牛华,黄燕,闫玲,张玲,赵敏,陆涛,等。在体内和体外实验中,SMAD3的下调通过p21抑制肺腺癌的生长并增强其放射敏感性。中国生物医学工程学报,2020;16(6):1010-22。
陈震,黄勇,胡震,赵敏,李敏,毕刚,等。早期和晚期肺腺癌中单个肿瘤和免疫细胞的格局和动态中华医学杂志2021;11(3):e350。
李文杰,李文杰,李文杰,李文杰,等。晚期生殖细胞肿瘤患者顺铂耐药的遗传决定因素中华临床肿瘤学杂志,2016;34(33):4000-7。
傅建平,李志强,李志强,等。广义线性模型的正则化路径。统计软件,2010;33(1):1 - 22。
鲍登NA。核苷酸切除修复:为什么不用于预测铂基化疗的反应?中华癌症杂志,2014;36(2):339 - 344。
沈d - w, Pouliot LM, Hall MD, Gottesman MM.顺铂耐药:一种由多种表观遗传和遗传变化引起的细胞自我防御机制。中国药理学杂志,2012;29(3):344 - 344。
Di Caro G, Cortese N, Castino GF, Grizzi F, Gavazzi F, Ridolfi C,等。肿瘤相关巨噬细胞在化疗治疗或未治疗的人胰腺腺癌中的双重预后意义。肠道。2016;65(10):1710 - 20。
松木H,广岛Y,三宅K,村上T,本马Y,松山R,等。胰腺癌患者新辅助放化疗后肿瘤微环境中性别相关的m2样肿瘤相关巨噬细胞的减少中华肝胆胰腺杂志2021;28(2):174-82。
特蕾莎·平托A,拉兰杰罗·平托M, Patrícia卡多索A,蒙泰罗C,特谢拉·平托M,菲利佩·玛雅A,等。电离辐射将人巨噬细胞调节为促炎症表型,保持其促侵入性和促血管生成能力。科学代表2016;6:18765。
达拉瓦asa S, Beeraka NM, Basavaraju CG, Tulimilli SRV, Sadhu SP, Rajesh K,等。肿瘤相关巨噬细胞(TAMs)在癌症进展、耐药、血管生成和转移的作用。高级医学化学,2021年。https://doi.org/10.2174/0929867328666210720143721.
王松,李勇,邢超,丁超,张宏,陈林,等。肿瘤微环境在胰腺癌耐药、转移和免疫治疗中的作用。中华癌症杂志,2020;10(7):1937-53。
中岛S,米村K,齐藤K,塔尔敏AK,远藤E,山田L,等。新辅助化疗通过食管鳞状细胞癌肿瘤相关巨噬细胞极化诱导IL34信号通路并促进化疗耐药。中国生物医学工程学报,2017;19(6):1085-95。
米塔尔V, El Rayes T, Narula N, McGraw TE, Altorki NK, Barcellos-Hoff MH.肺癌微环境及其治疗意义。Adv Exp医学生物学,2016;890:75-110。
邓文杰,李文杰,李文杰。合作特异性:BATF-IRF相互作用控制免疫调节网络。中华免疫杂志,2013;13(7):499-509。
郭晓东,王晓东,王晓明,等。Batf3维持Irf8的自动激活,以承诺CD8α(+)常规DC克隆原体。中华免疫杂志,2015;16(7):708-17。
张志刚,张志刚,张志刚,张志刚,等。Pfam蛋白家族数据库。Nucleic Acids Res. 2010;38(数据库issue):D211-22。
杜斯旺德,李伟林,马沙耶克希,郭志强,等。BATF-IRF相互作用介导的树突状细胞代偿发育。大自然。2012;490(7421):502 - 7。
Hildner K, Edelson BT, Purtha WE, Diamond M, Matsushita H, Kohyama M,等。Batf3缺失揭示了cd8 α +树突状细胞在细胞毒性T细胞免疫中的关键作用。科学。2008;322(5904):1097 - 100。
刘j, Rozeman EA, O 'Donnell JS, Allen S, Fanchi L, Smyth MJ,等。Batf3(+) DCs和I型IFN对新辅助癌症免疫治疗的疗效至关重要。Oncoimmunology。2019;8 (2):e1546068。
Acidereli H, Turut FA, Cevik O.干扰素调节因子-5乙酰化抑制雄激素受体,下调Sox2表达。中国生物医学工程学报,2017;39(5):667-78。
仓原H,新志H,马木Y,前村K,野马H,久保F,等。m2极化肿瘤相关巨噬细胞在胰腺癌中的意义。中华外科杂志,2011;29(2):344 - 344。
Griesbeck M, Ziegler S, Laffont S, Smith N, Chauveau L, Tomezsko P,等。IRF5浆细胞样树突状细胞水平的性别差异导致女性IFN-α的产生更高。中华免疫杂志,2015;195(11):5327-36。
Bukowski RM, Tendler C, Cutler D, Rose E, Laughlin MM, Statkevich P.用PEG内含子治疗癌症:一种改进的干扰素- α -2b配方的药代动力学分析和给药指南。癌症。2002;95(2):389 - 96。
Tarhini AA, Kirkwood JM。好到什么程度?干扰素α -2b辅助治疗需要多长时间?中华临床肿瘤学杂志,2012;30(31):3773-6。
Hudson NO, Whitby FG, Buck-Koehntop BA。DNA阅读蛋白ZBTB38的c端锌指对甲基化DNA识别的结构洞察。中国生物医学工程学报,2018;29(5):457 - 457。
Marchal C, de Dieuleveult M, Saint-Ruf C, Guinot N, Ferry L, Olalla Saad ST,等。ZBTB38的缺失通过CDKN1C mRNA的上调增强了DNA去甲基化剂在癌细胞中的作用。肿瘤形成。2018;7(10):82。
Vural S, Palmisano A, Reinhold WC, Pommier Y, Teicher BA, Krushkal J.肿瘤细胞表观遗传分子因子表达与DNA甲基化和化疗药物敏感性的关系。临床表观遗传学。2021;13(1):49。
陈晓明,陈晓明,陈晓明,等。甲基化cpg结合蛋白ZBTB38在DNA甲基化中的作用。Epigenet Insights。2018;11:2516865718811117。
景娟,刘娟,王勇,张敏,杨玲,石峰,等。ZBTB38促进膀胱癌细胞迁移和侵袭性生长的作用中国农业科学,2019;41(3):1980-90。
de Dieuleveult M, Marchal C, Jouinot A, Letessier A, Miotto B. ZBTB38在前列腺癌中的表达水平及其临床意义。癌症。2020;12(5):1106。
郭华,Ingolia NT, Weissman JS, Bartel DP。哺乳动物microRNAs主要作用是降低靶mRNA水平。大自然。2010;466(7308):835 - 40。
黄燕,沈晓军,邹强,王素萍,唐明生,张广志。microRNAs的生物学功能综述。中国生物医学工程学报。2011;29(1):329 - 329。
董春春,林培林,程耀文,吴德伟,叶世德,陈春春,等。E6癌蛋白减少microRNA-184可通过增加Bcl-2导致肺癌对顺铂耐药。Oncotarget。2016;7(22):32362 - 74。
李伟,王伟,丁敏,郑霞,马松,王霞。MiR-1244对非小细胞肺癌A549细胞顺铂耐药的增敏作用Cancer Cell Int. 2016;16:30。
姜涛,董鹏,李林,马霞,徐鹏,朱辉,等。MicroRNA-200c通过靶向ZEB2调节人胃癌细胞顺铂耐药。中国农业科学,2017;38(1):151-8。
常林,郭飞,王勇,吕勇,霍波,王林,等。MicroRNA-200c通过直接靶向roe调控胃癌SGC7901/DDP细胞化疗的敏感性。中国病原学杂志,2014;20(1):93-8。
白卫东,叶晓明,张美明,朱海燕,奚文杰,黄霞,等。MiR-200c在乳腺癌中通过靶向ZNF217和ZEB1抑制TGF-β信号通路,对抗曲妥珠单抗耐药和转移。中华肿瘤学杂志,2014;35(6):366 - 366。
Berghmans T, Ameye L, Willems L, Paesmans M, Mascaux C, Lafitte JJ,等。基于microrna的特征在顺铂-长春瑞滨治疗非小细胞肺癌的反应和生存中的鉴定中华癌症杂志。2013;32(2):344 - 344。
程锐,陆超,张刚,张刚,赵刚。过表达miR-203通过靶向Dickkopf-1提高NSCLC A549/H460细胞系对顺铂的敏感性中国农业科学,2017;37(4):2129-36。
杜世林,徐丽丽,高鹏,刘启勤,卢福夫,莫志华,等。MiR-203调控DJ-1表达,影响胰腺癌细胞增殖、凋亡和DDP耐药。欧洲医学与药物科学2019;23(20):8833-40。
林娟,林勇,范琳,匡伟,郑玲,吴娟,等。miR-203抑制顺铂诱导的舌鳞癌细胞增殖并促进细胞死亡。生物化学学报。2016;473(2):382-7。
确认
不适用。
资金
本文由复旦大学中山医院人才培养计划项目(批准号:2021ZSYQ24)、复旦大学上海医学院福清学者基金项目(FQXZ202114B)资助。
作者信息
作者及隶属关系
贡献
构思设计:QS、CZ;行政支持:CZ, QW;ZL, LT;提供研究资料或患者:JL, YB;数据采集与组装:ZH, YH;数据分析与解读:ZC、GB;编制数字:MZ;佐;稿件撰写:均为作者。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
作者对工作的各个方面负责,确保与工作的任何部分的准确性或完整性相关的问题得到适当的调查和解决。本研究中实施的所有程序均符合《赫尔辛基宣言》(2013年修订),并由复旦大学附属中山医院(中国上海)伦理委员会批准(批准文号:;: b2019 - 137 r)。知情同意书除外。
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:图S1。
顺铂对泛癌细胞IC50值的研究。
附加文件2:图S2。
突变状态的整体格局。
附加文件3:图S3。
(一)通过分类回归树(CART)建立模型。(二)采用C4.5决策树分类算法建立模型。

附加文件4:图S4。
ROC绘图仪将BATF3、IRF5和ZBTB38的表达与乳腺癌和卵巢癌的治疗反应联系起来。
附加文件5:图S5。
miRNA LASSO模型的建立。
附加文件6:表S1。
靶向BATF3, IRF5, ZBTB38的siRNAs序列。
附加文件7:表S2。
我们研究中使用的引物的序列和熔化温度(Tm),是否跨越外显子连接,PCR效率和与稀释序列的相关性(R2).
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
隋,Q,陈,Z,胡,Z。et al。顺铂耐药相关多组学差异及机器学习模型的建立。翻译医学杂志20., 171(2022)。https://doi.org/10.1186/s12967-022-03372-0
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-022-03372-0
关键字
- 顺铂
- 耐药性
- 机器学习
- IC50