摘要
背景
NK细胞系NK-92及其转基因变体作为治疗一系列恶性肿瘤的免疫疗法正受到关注。然而,由于NK-92细胞本身就是肿瘤,它们在转移前需要照射,并且可能容易受到患者免疫系统的攻击。在这里,我们研究了NK-92细胞介导的系列杀伤对γ照射和死亡受体Fas (CD95)结扎的影响,以及NK-92细胞对激活的原发性NK细胞攻击的易感性。
方法
为了评估连环杀人案,我们用了51用低NK-92效应细胞进行cr释放试验,以靶向Raji, Daudi或K562肿瘤细胞(E:T)比率,以确定2-,4-,6-和8小时的杀伤频率。
结果
NK-92细胞在8小时内最多可杀死14个Raji细胞。照射10 Gy后,NK-92细胞立即保持高细胞毒活性,但照射后存活的细胞在照射1天后活性下降50%。尽管CD95高表达,NK-92细胞在Fas/CD95连接过夜后仍保持活力,但失去了一些细胞毒活性。然而,照射后1天,NK-92细胞更容易发生Fas结扎,导致照射后存活细胞的细胞毒活性降低。照射的NK-92细胞也容易被未刺激和IL-2激活的原代NK细胞(LAK)杀死。相比之下,未辐照的NK-92细胞对NK和LAK细胞的攻击更有抵抗力。
结论
照射对NK-92细胞的存活和细胞毒性均有害,使NK-92细胞易受fas引发的死亡和原代NK细胞引发的死亡。因此,替代辐照作为抗增殖前处理和从过继转移细胞系中去除Fas和/或NK激活配体是提高治疗效果的新途径。
背景
自然杀伤细胞(NK)是免疫治疗中很有吸引力的细胞,因为它们是先天免疫系统中非常有效的效应淋巴细胞,可以在没有预先致敏的情况下攻击和杀死许多不同的肿瘤靶细胞[1,2,3.].研究表明,一些细胞毒性免疫细胞,包括T细胞和NK细胞,能够依次杀死多个靶细胞,这一过程被称为连环杀伤[4,5].此外,连环杀手细胞通常比非连环杀手NK细胞更快地进行裂解命中和诱导靶细胞死亡[6].不幸的是,对于过继免疫疗法来说,许多NK细胞只能杀死一次,只有不到30%的NK细胞能够连环杀伤[7,8,9].虽然每个效应剂杀死的靶细胞数量因研究而异,但始终注意到少数NK细胞负责大多数杀伤事件。此外,从患者血液中获得足够数量的功能活性NK细胞也存在挑战,因为尽管NK细胞遍布全身,但仅占人类外周血淋巴细胞的2-18%,获得足够数量的NK细胞以超过肿瘤细胞的数量是一项挑战[10,11].
为了方便地获得所需的大量NK细胞,已经从NK细胞癌症患者中建立了永生化细胞毒性细胞系;然而,人们对他们的连环杀人能力知之甚少。NK-92是超过八种可用的NK细胞系之一(附加文件1:表S1),并对多种肿瘤类型具有可复制的细胞毒性[10,12,13],即使在缺氧的情况下[14].截至2022年2月,NK-92细胞是FDA批准进行临床试验的唯一NK细胞系,并已成为PubMed USA引用的550多篇论文的主题。除了它们的先天活性,NK-92细胞还可以通过基因操纵来表达识别特定肿瘤抗原的受体,并通过抗体依赖的细胞细胞毒性(ADCC)增强治疗性单克隆抗体。这些NK-92细胞和CAR-NK-92变体可以立即获得,而且比目前的car - t细胞疗法更便宜[15].事实上,haNK (NK-92)细胞被改造成表达高亲和力CD16A等位基因(以识别肿瘤细胞结合的单克隆抗体),并与抗pd - l1抗体avelumab联合测试,现在已被进一步修饰,也表达pd - l1特异性嵌合抗原受体[16,17].NK-92细胞已被注入晚期癌症患者体内,临床获益,副作用有限。此外,NK-92细胞正在四个不同国家的几个临床试验中进行测试,并用于一系列恶性肿瘤患者,包括白血病、胶质母细胞瘤和黑色素瘤[18,19,20.,21].重要的是评估这些细胞在移植后在体内会发生什么,这是一个具有挑战性的问题,迄今为止只能通过监测患者血液中循环的细胞来解决[19].在本报告中,我们进行了体外评估,过继移植后在体内可能发生的NK-92细胞系列杀伤的潜在危险,包括照射后细胞毒性系列能力的丧失,肿瘤细胞对NK-92细胞Fas的结扎,以及NK-92细胞对血液原代NK细胞攻击的脆弱性。
据作者所知,我们是第一个观察到杀伤频率的人[5(KF) > 1由NK-92细胞使用标准释放试验(在美国免疫学家协会年会上提出,2021年)。我们监测了这种连环杀伤,以预测在过继移植后细胞仍能存活的时间内细胞活性的潜在损失。我们的数据表明,当NK-92细胞在照射后受损时,几种可能导致体内治疗效果损失的潜在并发症。先前有报道称,当NK-92细胞用10 Gy照射后,NK-92细胞的增殖被阻止,并且在照射后剩余1天的活细胞内,细胞溶解活性基本保持不变[22].但我们发现,NK-92细胞连环杀伤作用在照射后1天显著降低。照射还增加了NK-92细胞对fas -结扎的敏感性,以及淋巴因子激活的原发性NK细胞的攻击。
方法
细胞系和培养
使用MycoAlert™支原体检测试剂盒(Lonza, Walkersville MD)定期检测所有细胞系支原体阴性。nk - 92细胞(ATCC CRL-2407)在alpha Minimum Essential培养基中培养l-谷氨酰胺和丙酮酸钠,不含核糖核苷或脱氧核糖核苷(Gibco, Waltham MA), 0.2 mM肌醇,0.2 mM 2-巯基乙醇和0.02 mM叶酸,12.5%马血清(Gibco), 12.5%胎牛血清(FBS) (Atlanta Biologicals, Flowery Branch GA), 1000 U/ml Tecin, Teceleukin重组白介素2 (IL-2) (Roche,瑞士巴塞尔),5% CO237°C。K562细胞(ATCC cc -243)培养于Dulbecco 's改良Eagle培养基(DMEM)中,添加4.5 g/L葡萄糖,l-谷氨酰胺和丙酮酸钠(康宁生命科学),10%胎牛血清(FBS)和1%青霉素-链霉素(penp -strep)溶液(MilliporeSigma, Burlington MA), 5% CO237°C。Raji(写明ATCC ccl - 86),Daudi(ATCC cc -213),以及Jurkat(ATCC TIB-152)细胞在Roswell Park Memorial Institute (RPMI)培养基中培养l-谷氨酰胺(Corning Life Sciences, Tewksbury MA), 10% FBS和1%笔链球菌,5% CO237°C。PBMCs(STEMCELL Technologies, Vancouver, Canada)在含有4.5 g/L葡萄糖的DMEM中培养后,l-谷氨酰胺,丙酮酸钠和10% FBS和1% Pen-Strep在37°C和5% CO2过夜或LAK活化后,在含4.5 g/L葡萄糖的DMEM中培养,l-谷氨酰胺,丙酮酸钠和10% FBS和1% pen-strep在37°C和5% CO2并在检测前3天补充1000u /ml IL-2。
细胞照射
NK-92细胞在15毫升的培养基中使用铯进行γ辐照137来源(JL Shepherd I-30型)。测试的剂量范围为2.5-20戈瑞。照射后,细胞在1000u /ml IL-2中按规定时间(0-48 h)培养。对照细胞平行处理,不施加辐照。
Fas-receptor结扎
用于细胞毒性测定, NK-92细胞培养至2.5 × 105用1 ug/ml LEAF纯化的抗人CD95克隆EOS9.1或LEAF纯化的小鼠IgM克隆MM-30作为同型对照培养过夜。用于流式细胞术检测细胞Fas/CD95结扎后诱导的潜在细胞死亡、NK-92或Jurkat细胞在2.0 × 10下培养过夜6细胞/ml与1 ug/ml LEAF纯化抗人CD95或LEAF纯化小鼠IgM同型对照。结合照射时,首先对细胞进行照射,然后在照射后立即或照射后1天添加单克隆抗体,结果表明。对照细胞平行处理,不添加抗体。单克隆抗体来自BioLegend (San Diego, CA)。
细胞毒性检测
靶细胞用Na标记51阴极射线示波器4(珀金·埃尔默,马萨诸塞州沃尔瑟姆)[23].效应因子NK-92细胞计数使用血球计测定,常规样本为> 600细胞,排除台锥蓝(MilliporeSigma)。NK-92效应细胞在v型底板(Costar 3894, 96孔)的每一个E:T中被稀释2倍于0.1 ml,形成6至8个效应细胞与目标细胞(E:T)的比例。pbmc内的NK细胞效应物同样被稀释。放射标记的“靶”细胞(1 × 105/ml, 0.1 ml)添加到每孔诱导细胞毒性。将培养皿在1000rpm下离心(Sorvall RC 6 +) 3分钟,使效应细胞和靶细胞在5% CO下孵育237℃保温8小时(除非另有说明)。孵育后,将培养皿以1200转/分的速度离心10分钟,取0.1 ml无细胞上清,在珀金-埃尔默Wizard伽马计数器中分析。用不含效应剂的靶细胞的平均泄漏率计算自发释放,最大释放量为1% SDS裂解靶细胞释放的放射性。计算的%特异性释放是一个衡量目标细胞杀伤,因为目标释放内化51当它们死亡时,Cr进入采样的上清液。按以下公式计算比释百分数:
所示的数据至少代表了三个重复实验。
流式细胞术分析
用于测定细胞上fas受体CD95的存在, AF647抗cd95克隆体DX2与Zombie Aqua一起使用以消除死亡细胞。立即从培养物中取出细胞,用PBS清洗一次,并在室温(RT)下用1:100稀释的僵尸水染色30分钟,避光。然后用含1% FCS的FACS缓冲液淬灭细胞,加热至5 × 106细胞/ml,倒入流管,用10 ug/ml AF647抗cd95克隆体DX2在RT下染色30分钟,避光,洗涤两次。用于分析辐照和/或抗fas结扎后的细胞死亡,使用以下荧光探针:FITC annexin V (BioLegend, San Diego CA)和7-氨基放线菌素D (7-AAD) (MilliporeSigma)。辐照或抗fas处理后,对照细胞用annexin V结合缓冲液洗涤,用4 ug/ml 7-AAD和4.5 ug/ml FITC annexin V染色20分钟,室温避光,然后洗涤两次,用含有20 ug/ml放线菌素D (AD) (MilliporeSigma)的annexin V缓冲液培养,0.5%甲醛固定。用于测定外周血单核细胞内NK计数, TruCOUNT™Beads (BD Biosciences)和以下荧光抗体面板:PacBlue抗cd45克隆HI30, BV711抗cd56克隆HCD56, BV711抗cd16a克隆3G8, FITC抗cd3克隆OKT3, AF647抗cd244 [24]克隆C1.7,与7-AAD一起鉴定坏死细胞,不清洗细胞(以防止细胞流失)。门控序列可在附加文件2:图S1。静息或LAK激活的pbmc(如前面所述)从培养物中取出,旋转,并在FACS缓冲液中重悬,然后倒入流管。细胞在避光条件下RT染色30分钟。染色后加入20 ug/ml AD,加入甲醛(MilliporeSigma, Boston MA)固定细胞至终浓度0.5%。所有单克隆抗体均来自加州圣地亚哥的BioLegend公司,并经过滴定,使其浓度适合于免洗条件。在1天内,使用BD Biosciences Special Order Research Product LSR II分析流式细胞仪和高通量采样器(HTS)单元对样品进行分析。仪数据使用FlowJo软件(BD Biosciences)进行分析,以确定细胞计数、阳性细胞百分比、中位荧光强度(MFI)以及样本之间的统计学比较。所示数据至少代表两个重复实验。
统计分析
细胞毒性试验数据用Microsoft Excel计算并绘制图形,用SPSS统计软件(IBM,28日版本, Armonk, NY)使用线性回归分析或差中差比较。陆50s(引起50%裂解所需的效应细胞数量)通过细胞毒性线性回归方程(y = %特异51Cr释放量,x = log10E:T细胞比率),以确定杀死50%的“目标”细胞所需的细胞数量。酶解活性用LU表示50/1.0 × 106效应细胞[25,26].这种细胞毒性线性回归的斜率提供了有用的信息,用于检测细胞协同性的差异或杀死“目标”细胞所需的多次“攻击”。使用FlowJo“比较总体”工具计算欧弗顿减法[27]和卡方统计分析流式细胞术群体。
结果
NK-92细胞连续杀死多种癌细胞系
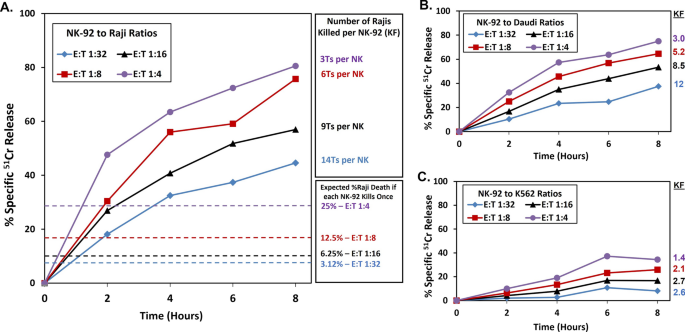
由于NK细胞能识别多种配体,许多肿瘤细胞都是合适的连环杀伤目标[1在不同的肿瘤上。我们将常用的NK靶细胞K562与两种b细胞肿瘤系Daudi和Raji进行了比较,因为之前有报道称NK-92细胞在体外能很好地杀死这些造血肿瘤细胞[28]以及在临床试验中杀死患者的造血肿瘤[21].我们使用杀伤频率(KFs)来测量随着时间的推移,每个NK-92细胞杀死的肿瘤“靶”细胞的平均数量。在2-、4-、6-和8-h时间点停止测定细胞毒活性。Raji细胞在各时间点的杀伤效果均优于K562和Daudi细胞。具体观察8小时的数据,在E:T为1:16时,Rajis有57%的特异性释放(KF =每个NK-92细胞9个死亡,计算为56%的目标被杀死除以6.25%,效应器的可用频率以1:16的比例),而Daudi和K562目标分别为53% (KF = 8.5)和17% (KF = 2.7)(图5)。1a - c)。此外,Raji和Daudi肿瘤细胞在6小时后继续被连续杀伤,而K562细胞在6小时后停止了连续杀伤(图。1在8小时实验中,当E:T为1:16时,NK-92细胞在11个实验中每个效应子的平均KF为6.7 Raji, KF范围为3.0 - 9.5。NK-92 KFs随着目标浓度的增加而增加,在E:T为1:32时达到每NK-92 14 Raji的记录。图中数据。1在一个实验中观察到的每一个目标代表连环杀人案。在多个实验中观察到类似的活动(Raji: n = 11个实验,Daudi: n = 3个,K562: n = 4个)。
杀伤频率(KF)描述每个效应细胞杀伤目标的平均数量,并假设每个效应细胞杀伤[5].图中对应的彩色虚线表示对每种效应细胞浓度的单轮杀灭。1.应该注意的是,在实践中NK-92细胞的杀伤存在异质性。我们观察到CD107A的可变外化与细胞毒性颗粒释放相关[29[Navarrete-Galvan等人,未发表的结果],以前也通过延时摄影观察到杀戮的可变性[30.,31].因此,单个NK-92细胞可以杀死比KF值所反映的更多的靶标。8 h时E:Ts为1:16时的KFs和本研究纳入的实验数,各靶点的均值±标准差分别为:Raji, n = 11, KF 6.6±2.2;道迪,n = 3, KF 6.8±1.6;K562, n = 5, KF 1.6±1.5。KF范围在附加文件中3.:表S2。
照射NK-92细胞影响其活力和细胞毒功能
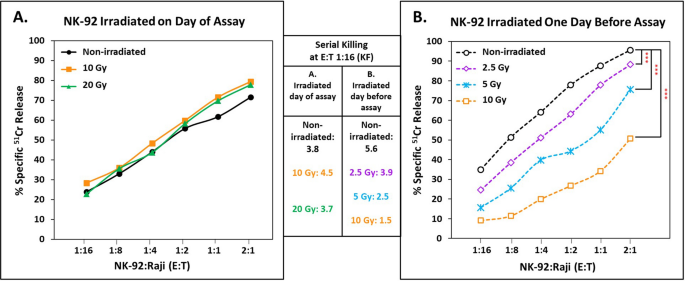
NK-92细胞的细胞毒能力在照射后立即或过夜培养后测量,以检测那些暂时抵抗致命照射影响的细胞的活性。我们使用了2.5到20戈瑞;10gy是FDA的收养转移标准。数字2A表明,在20 Gy辐照后,NK-92细胞立即保持完全杀伤能力。然而,在培养过夜后,仍然存活的NK-92效应物显示出随辐射剂量增加而降低细胞毒功能的剂量反应。8小时杀灭的线性回归斜率(每log杀灭的细胞百分比)10用于计算溶出单位的10个gy照射细胞与未照射对照细胞之间存在显著差异。在3个实验中,对照组的斜率为49.5±15.0,辐照细胞的斜率为38.8±15.8。各实验内斜率的配对比较均有统计学意义(P < 0.01)。斜率的变化与每个照射NK-92细胞的杀伤减少相一致。如果每个细胞具有对照活性的照射NK-92细胞更少,则斜率将类似。
对连环杀人案的影响是显而易见的。当E:T为1:16时,未辐照的NK-92细胞(KF 5.6)杀死了35.0%的靶标,而10 Gy辐照的NK-92效应物(KF 1.5)杀死了9.1%的靶标,每个细胞的细胞毒活性损失超过2/3(图2)。2B, p值< 0.001)。在K562靶标上也观察到这种剂量-反应辐射对连环杀人的影响(未说明)。因此,通过fda批准的照射,NK-92细胞的连环杀伤大大降低。值得注意的是,在低于目前临床实践中10戈瑞的照射剂量下,连环杀人案仍然受到显著影响;2.5 Gy辐照的NK-92细胞KF为3.9(图;2B),与未辐照的NK-92细胞相比,系列细胞毒性降低30% (p < 0.001)。
由于辐射引起的死亡而造成的细胞损失和细胞毒性功能的丧失共同作用,限制了辐射NK-92细胞的总体疗效。当考虑到连环杀伤的损失和较低的活细胞回收率时,在10 Gy照射后1天,NK-92的潜在连环杀伤功效仍保留了10%(表2)1).用裂解单位作比较,如LU50在8小时内,每100万个NK-92细胞在照射后出现剂量依赖性的整体活性损失,当考虑到细胞存活率下降和功能损失时,这种损失被放大1).由LU监测的活动50在重复实验中,10 Gy后1天的NK-92细胞持续低于未辐照NK-92细胞的30%(数据未显示)。
Fas (CD95)受体结扎可减弱NK-92系列杀伤作用,照射后1天效果更明显
fas -配体在许多肿瘤中表达,是这些肿瘤与NK-和/或T-细胞上的fas -受体结合的一种手段,从而启动效应淋巴细胞的“自杀”[32以及对肿瘤细胞的保护作用。为了评估Fas结扎是否也会影响NK-92细胞,首先,我们监测了NK-92细胞上Fas/CD95的表达,然后发现NK-92细胞对Fas结扎缺乏“自杀”反应,最后,观察到Fas结扎对连环杀人的有害影响。在膜结合的Fas结扎后容易死亡的Jurkat细胞被用作检测Fas表达和抗Fas抗体诱导细胞“自杀”的阳性对照[33].用AF647-anti-CD95/Fas染色Jurkat和NK-92细胞,流式细胞术分析。数字3.A显示> 95%的Jurkat和NK-92细胞CD95/Fas阳性。此外,NK-92细胞比Jurkat细胞表达更多的Fas,照射后的中位荧光指数(MFI)较高,为6339,而Jurkat细胞的MFI为2263。值得注意的是,在一天内,约20%的受照射NK-92细胞亚群的Fas水平降低(MFI 1851)。3.A,在重复实验中有43%的亚群体)。
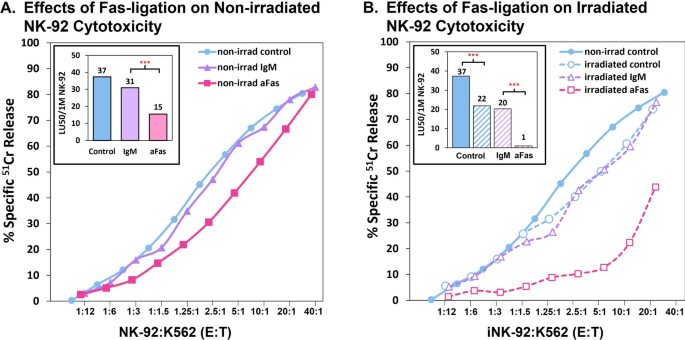
NK-92细胞CD95 (Fas)表达及Fas结扎对细胞活力的影响Fas敏感Jurkat细胞被用作Fas表达和Fas结扎一天后死亡的阳性对照。死亡细胞是由fitc标记的膜联蛋白V与磷脂酰丝氨酸结合而指示的,磷脂酰丝氨酸外化在死亡细胞的细胞膜上。一个Fas/CD95的表面表达。1Jurkat细胞Fas的表达。1标记细胞。1 b单克隆抗体标记的细胞抗cd95 Fas。2非辐照NK-92细胞Fas的表达。2a和2b如所示1&1 b.3.10 Gy 3a和3b辐照后NK-92细胞Fas的表达1&1 b.B在过夜培养中用IgM对照或IgM抗fas诱导死亡通过Overton减法,从膜联蛋白v低的细胞到膜联蛋白v高的细胞(凋亡和坏死)的转换在Jurkat细胞中为52%,在未照射的NK-92细胞中为5.8%,在照射的NK-92细胞中为9.2% (*p < 0.05)。C辐照和fas -结扎后细胞大小的变化(正向散射)。1用培养基、IgM同型或抗fas IgM培养的未辐照细胞。2细胞在10gy照射后1天,与培养基、IgM同型或抗fas IgM一起培养
在NK-92细胞上检测到CD95后,我们将未辐照和10 Gy辐照的NK-92细胞与抗fas IgM孵育过夜,随后检查这些细胞的凋亡或坏死死亡情况。用FITC-annexin V染色细胞,它与凋亡细胞外化的磷脂酰丝氨酸结合,也与通透性坏死细胞的内部磷脂酰丝氨酸结合。Jurkat细胞对抗fas连接反应强烈,99% annexin V阳性(图。3.相比之下,未辐照和辐照的NK-92细胞对Fas连接的反应都很弱,与对照细胞相比,膜联蛋白v阳性细胞增加< 10%(图2)。3.B)。至少三分之一的膜联蛋白v阳性细胞也被7-AAD染色为阳性,表明这些细胞的相当一部分已经进展为坏死(未说明)。尽管NK-92细胞在Fas结扎后具有抵抗死亡的能力,抗Fas治疗确实会以萎缩细胞的形式影响辐照后的非坏死NK-92细胞(如低正向散射(FSC)所示)(图。3.C)。
相比于对nk -活力的影响很小,fas -结扎后对NK-92细胞毒功能的影响是显著的。将未辐照或10 Gy辐照的NK-92细胞预培养1天,无抗体、IgM同型对照或抗fas IgM。这些细胞的细胞毒能力,然后测试针对K562靶标与持续存在的抗体51铬释放测定。由于K562细胞缺乏Fas,它们被用作肿瘤“靶”细胞,这阻止了NK-92细胞在靶细胞杀伤中加入抗Fas启动的“自杀”。数字4A表明,未辐照的细胞在Fas结扎过夜后能够保持较高的细胞毒活性,在E:T比相似的情况下,杀灭率分别达到80%,而对照组和IgM处理的细胞杀灭率分别为80-83%。由陆50与IgM同型对照相比,抗fas处理的NK-92细胞保留了约50%的活性(插入,图。4然而,在10 Gy辐照后,抗fas处理的NK-92细胞毒活性显著降低,杀灭率分别达到44%,而对照组和IgM处理的细胞杀灭率分别为74-77%(图2)。4B).插入图。4B表明,抗fas处理后,10 Gy辐照的NK-92细胞在LU下仅保留< 5%的活性50与对照细胞相比。
CD95 (Fas)结扎对非辐照和辐照NK-92细胞系列杀伤的影响。未辐照或10 Gy辐照的细胞在无任何物质、1 ug/ml对照IgM或IgM抗fas条件下培养1天。由于K562细胞缺乏Fas,它们被用作肿瘤“靶”细胞,以防止NK-92细胞在靶细胞杀伤过程中加入抗Fas启动的“自杀”。8小时后测定对K562细胞的细胞毒活性。E:T比值近似。一个抗fas结扎仅限于未辐照的NK-92细胞。插入:陆50/1 M未辐照的NK-92细胞。B10 Gy辐照NK-92细胞的抗fas结扎。插入:LU50/1 M辐照NK-92细胞,经过处理。[通过回归分析,***p-value < 0.001]。kf一个,B计算的KFs为1:1的E:T一个未辐照对照组、IgM组和抗fas组分别为0.36、0.34和0.22。为B,辐照细胞单独、IgM和抗fas的KFs分别为0.30、0.30和0.03。辐照和抗fas组合的KF损失超过了基于单一处理损失估计的加性效应和协同效应
照射后的NK-92细胞易被原发性血液NK细胞(bNK)和IL-2淋巴因子激活杀伤细胞(LAK)杀伤
虽然有人想知道过养转移NK-92肿瘤细胞的原生宿主NK细胞攻击是否对NK-92细胞的细胞毒性功能有影响(即使NK-92细胞能够抵抗攻击),但这项研究在技术上受到阻碍,因为原生NK和NK-92细胞都会同时介导“靶细胞”死亡。要理清每个细胞的作用是不可能的。相反,我们只是简单地确定了照射后的NK-92细胞是否会被患者自身的NK细胞攻击,这将是NK-92细胞过继治疗在体内疗效受损的另一种手段。未辐照的NK-92细胞对原发性NK和IL-2诱导的LAK细胞攻击的易感性已被充分证明[34,35].我们想要评估这种易感性是否对受辐照的NK-92细胞有所增加。照射后应激配体的诱导支持了这种可能性,这些配体可以作为NK细胞的识别分子[36].
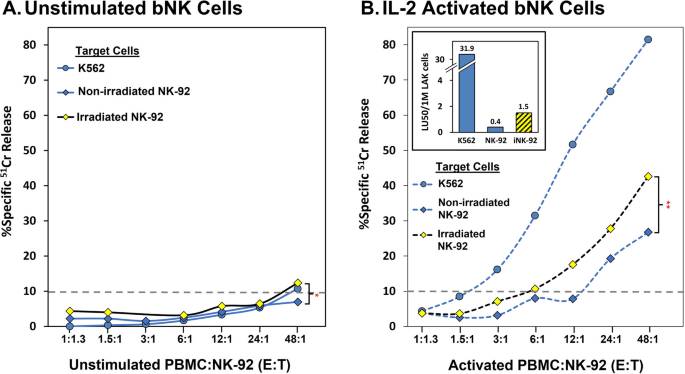
在初步实验中,我们测试了静息bNK或LAK细胞杀死NK-92细胞的能力。数据以PBMC:NK-92、效应器:目标(E:T)比值表示。E:T比值在不同的实验中有所不同,因为细胞产量随供体的不同而不同。我们从最高的E: t开始。我们还研究了IL-2是否诱导NK细胞显著分裂,并导致pbmc内LAK细胞多于bNK细胞。我们使用Trucounts®和流式细胞仪检测bNK和LAK频率(见图2)方法)并发现短期培养后的频率相似。我们使用K562细胞作为对照“靶标”,以确认健康供体的bNK和LAK细胞具有良好的细胞毒活性,无论它们的NK细胞是否杀死NK-92细胞。NK-92靶细胞经10 Gy辐照或未辐照后培养过夜。
数字5说明受辐照的NK-92细胞特别容易受到LAK细胞的攻击。培养后,无论靶标如何,供体的bNK细胞活性均较低。相比之下,LAK细胞非常活跃,与未照射的NK-92细胞相比,LAK细胞优先杀死照射的NK-92细胞。与Fig的供体缺乏bNK活性相一致。5,来自其他供体的未受刺激的bNK细胞也具有较低的细胞毒活性,如表所示2.供体SC-6617的LAK细胞既能杀死未辐照的NK-92细胞,也能明显增加LAKvs。bNK抗nk -92细胞杀伤(Table2).这些有限的实验表明,照射后,NK-92细胞保留和/或增加NK攻击的配体,因此在体内容易被先天免疫消除,这表明可以通过避免照射和/或基因工程来解决的第三个问题。
通过静息或激活的原发性NK细胞杀死NK-92细胞。研究了NK-92肿瘤细胞对健康供者的原代外周血NK细胞攻击的敏感性,NK-92细胞经10 Gy辐照或未辐照后培养1天。原代NK细胞经1000u /ml IL-2培养后静息或活化3 d。用4-h测定细胞毒性51Cr-release化验;灰色虚线反映了正面杀伤的10%阈值。所示的结果代表了用E:Ts对来自单个供体SC-0975的活的效应NK细胞进行的同时测定,并代表了4个不同供体的实验。一个静息原代NK细胞杀伤NK-92细胞。陆50未受刺激的NK细胞被排除在外,因为只有最高E:T的杀伤率超过10%。B活化的原代NK细胞杀伤NK-92细胞。bNKs和LAKs对未辐照和辐照NK-92细胞的细胞毒性在最高E:T时显著不同(学生T检验,*p < 0.03, **p < 0.005)。插入的BLU50/1 M LAK bNK计算使用TruCOUNT™珠(gate -附加文件2:图S1)
讨论
在这项研究中,我们展示了NK-92细胞对几种“目标”细胞类型的显著连环杀伤潜力,以及γ辐射对这种杀伤的影响。我们还测试了NK-92细胞在fas结扎后的功能,并记录了NK-92对循环bNK细胞攻击的敏感性,这是过继细胞治疗的两个潜在限制。这些发现表明NK-92细胞在过继癌症免疫治疗中具有巨大的潜力,但在输注给患者之前应仔细优化以确保最大的治疗效果。
NK-92细胞的连环杀人事件以前也有记录;然而,我们将注意力集中在对连环杀人的潜在体内抑制作用上,这在标准的体外NK检测中是不存在的(例如,骨髓细胞上的FasL)。先前的一项研究集中于开发一种基于液滴的细胞毒性测定方法,该方法利用最低E:T为1:3,并表明约50%的观察到的NK-92细胞能够在12小时内连续杀死两个或多个K562靶标[37].连续细胞毒性也已观察到使用延时摄影转基因,产生IL-2的NK92-MI细胞。这项研究表明,一个NK-92细胞在6小时内可以杀死多达14个靶HeLa细胞[30.].许多研究使用标准放射性释放试验来表征NK-92对各种细胞类型的杀伤作用,但是,如果没有过量的“靶标”,这些试验无法解决NK-92的系列细胞毒性。我们的研究结果证实NK-92细胞是连环杀手,并表明连环杀人是靶细胞类型依赖的,Raji和Daudi靶点的KFs达到> 10,而K562靶点的KFs < 3.0时,对连环杀人的易感程度要低得多(图5)。1).
由KFs确定的对不同“靶”细胞杀伤的差异可能是由于靶细胞上与NK-92细胞的不同激活受体接合的配体的差异。对K562细胞低杀伤的一种可能解释是NK-92细胞低表达受体NKG2D,相比之下,高表达NKG2D的KHYG-1细胞系更有效地杀死K562细胞[38].此外,k562产生颗粒酶B抑制剂PI-9,使它们不易被颗粒酶B杀死,颗粒酶B主要被NK-92细胞使用,但被KHGY-1使用的颗粒酶M所克服[39].NKG2D配体可能被ADAM10等金属蛋白酶切割[40]与细胞毒激活过程中NKG2D下调结合[41]影响NK-92杀死k562。NKG2D的损失也可以解释我们在K562 6小时后观察到的杀伤停滞,在其他地方也观察到长达12小时[37].KF方法的局限性[5它测量的是每个效应剂被杀死的目标的简单平均数量,而不是识别NK细胞群中参与杀伤的效应剂的比例。无论如何,KF方法仍然是筛选过继细胞转移之前使用的治疗方法对连环杀人的效果的最佳方法(就统计有效性、时间、人工和成本节省而言)。
在本报告中,我们揭示了NK-92细胞介导的连环杀伤和治疗效果的潜在局限性,特别是在辐照之后,目前的临床实践在过继转移之前。先前的研究研究了照射对NK-92细胞介导杀伤的影响;然而,这些研究对不同的靶细胞进行了较短的细胞毒性实验,并报道了NK-92的细胞毒性在照射后至少能保留24小时[22,42].另一项研究,在照射后24小时使用haNK细胞,与照射后立即杀死haNK细胞相比,对多种癌细胞系的细胞毒性增加[43].这些发现与我们对未经修饰的NK-92细胞的研究结果相反,NK-92细胞在照射后1天对Raji细胞的杀伤下降(图2)。2)及K562细胞(未发表的).这些发现之间的差异可能的解释包括haNK细胞内源性表达IL-2,而我们的细胞补充了1000u /ml IL-2,淋巴细胞与癌靶细胞,以及用于haNK细胞的18小时释放试验,这可能允许检测比我们的8小时释放试验更长的杀伤潜力。应认识到,要对连环杀人案及其损失进行明确评估,还有另外两种方法,即延时摄影和在单个井中使用单个效应细胞和多个靶细胞的微芯片分析[8,30.,44,45],比KF频率有优势。这些替代方法可以区分由所有效应细胞缓慢杀伤和由完全不活跃和完全活跃的细胞组合杀伤。
在本报告中,我们还将照射的影响扩展到fas -结扎后对细胞毒性的影响,以及NK-92细胞对患者NK细胞潜在攻击的敏感性。首先,我们观察到NK-92细胞活力和活细胞恢复下降(表1),并且在照射后1天连续细胞毒性一致降低,即使在较低剂量2.5-5 Gy(图5)。2).值得注意的是,当NK-92细胞在20 Gy照射后立即进行检测时,没有这种杀伤下降。这种最初的活性保留表明治疗细胞系应在照射后立即使用,以最大限度地提高体内的细胞毒性,如第一阶段试验的设计[21].理想情况下,一种用于过继治疗的细胞系的替代抗增殖方法将被使用。
辐射对NK-92细胞毒能力的深刻影响表明,辐射影响超出了DNA损伤,可能还包括对蛋白质的直接损伤[46,47].电离辐射产生放射性分解产物,如活性氧,使蛋白质组功能失活,包括参与杀伤和DNA修复的蛋白质组功能[42].低能电子照射作为γ照射的替代品,可抑制NK-92细胞增殖,同时保持较高的细胞毒能力和较长的时间,因此可考虑用于临床应用[42].该报告还表明,10 Gy γ照射后2小时,编码多种对细胞介导的细胞毒性至关重要的途径的基因表达降低[42].考虑到辐照对蛋白质组直接损伤的额外影响,可在过继转移之前使用仅对DNA造成损伤的替代治疗方法,如诱导遗传引入的II型限制性内切酶和使用某些拓扑异构酶抑制剂对细胞进行预处理(Hudig等,未发表的结果)[47].
我们发现了辐照NK-92细胞的致命弱点,即Fas/CD95,此前在大多数活化NK细胞上都有发现[48,49]和NK-92细胞[50].尽管CD95高表达,单独抗fas抗体不能影响未辐照NK-92细胞的增殖或在1天内引发死亡,即使非辐照细胞对fas结扎有反应,体积缩小。NK-92细胞抗fas结扎后死亡敏感性低的一个可能解释是fas介导的死亡有两种途径,其中一种依赖于线粒体信号放大。这种II型内在通路是缓慢的,容易被凋亡蛋白Bcl-2家族的表达所抑制[32,51].另一种可能的解释是NK-92细胞可能表达野生型PI-9,其抑制caspase依赖的Fas/ fasl介导的死亡途径[52].NK-92细胞组成性地产生可溶性Fas配体的证据也表明了对Fas连接的内在抗性[42].
尽管NK-92细胞抵抗了Fas的死亡,但它们确实以降低细胞毒活性作出反应。仅fas连接可降低NK-92对Raji细胞的毒性,但对未辐照的效应细胞的作用通常为两倍或更少。然而,对于受辐照的NK-92细胞,抗fas效应显著增强,仅剩下10%或更少的对照组杀伤。在协同作用下,fas -结扎和辐照极大地降低了细胞毒性(图。4).这种协同效应的一种可能解释是,与细胞毒性有关,但与活力无关,与Fas-ligated辐照的非坏死NK-92细胞发生的细胞收缩损害了它们的活性。这种收缩与脱水有关,并被报道为细胞死亡的早期指标[53].
这些发现表明,CD95作为阻碍NK-92细胞体内治疗效果的机制存在严重风险,特别是如果患者的肿瘤细胞表达反fas -配体(Fas-L/CD178)。照射后,面对fas介导的死亡受体结扎,NK-92细胞似乎具有正常的活力,但其杀伤效果明显较差。一个合乎逻辑的下一步可能是从NK-92细胞中去除CD95,以降低它们通过Fas途径快速死亡的易感性。CRISPR/Cas-9的最新进展使该方法成为一种更有效的基因工程NK-92细胞的方法,包括一次实现多个基因改变[54].
在发现照射影响NK-92细胞对fas -结扎的敏感性后,我们怀疑当患者NK细胞遇到照射时,照射是否也会使NK-92细胞更容易受到攻击。我们发现,受辐照的NK-92细胞容易受到未受刺激和IL-2 LAK bNK的攻击,而未受辐照的NK-92细胞对杀伤的抵抗力更强(表2)2).这些结果与先前的报告形成对比,先前的报告观察到未辐照的NK-92细胞(与K562相当)被大量杀伤[34,35].技术上的考虑可能导致这些差异:用于维持易感NK-92细胞的IL-2浓度为20 U/ml,而我们使用的IL-2浓度为1000 U/ml。由于NK细胞供体数量有限,我们的结果是初步的,但确实表明,照射后,NK-92细胞可能对循环NK细胞的攻击更加敏感。这种NK介导的攻击可能会被患者发展为NK-92细胞MHC类I蛋白的IgG抗体支持的抗体依赖细胞介导的细胞毒性(ADCC)进一步促进[21].我们建议,当NK-92细胞被基因改造或在过继转移前被处理时,对宿主细胞攻击的敏感性增加应进行监测。
我们的研究仅限于细胞毒性NK细胞系NK-92,这只是几种可用于免疫治疗的细胞系之一(附加文件)1:表S1)。据我们所知,这些其他永生化细胞系和诱导多能NK细胞尚未被定性为连环杀伤和辐射联合Fas结扎的效果。我们的研究还局限于所有的实验都是在体外进行的。尽管如此,我们能够强调连环死亡的重要性,作为一个关键变量,它可能受到预处理(如照射)和体内条件(如肿瘤内Fas配体和bNK攻击)的影响。该研究表明,其他细胞系也应类似地评估其对连环杀人的潜在影响。除了Fas之外,刺激NK抑制受体的肿瘤反配体也可能深刻地影响连环杀人,这种可能性尚待探索。一个广泛的含义是,从基因上分析影响NK系列杀伤的肿瘤环境配体,以选择最佳的NK细胞系进行免疫治疗,可能具有临床价值。
结论
总之,我们在这里指出,未辐照的NK-92细胞在三个方面比辐照的NK-92细胞更有效:增加连环杀伤,抵抗fas -结扎,以及抵抗NK或LAK细胞的攻击。我们的研究结果表明,在小鼠模型中使用未辐照的NK-92细胞进行的研究可能忽略了这三个局限性,并且使用辐照的NK-92细胞可能会出现较小的结果。未来在小鼠中的研究应包括与临床试验中使用的预处理并行的NK-92预处理。我们的数据证明了临床免疫疗法的迫切变化。最重要的是用其他方法替代照射,以防止NK-92肿瘤植入,并潜在地从NK-92细胞中删除Fas。
数据和材料的可用性
支持本研究结果的数据包括在这篇发表的文章及其补充信息文件中。如有合理要求,其他数据可从通讯作者处获得。
缩写
- ADCC:
-
抗体依赖性细胞毒性
- 汽车:
-
嵌合抗原受体
- 艾凡:师:
-
效应器与目标比
- 2:
-
白介素2
- KF:
-
杀死频率
- 腊克语:
-
Lymphokine-activated杀手
- 陆50:
-
裂解单位为杀死50%“目标”细胞所需的细胞数量
- 马伯:
-
单克隆抗体
- NK:
-
自然杀伤,包括bNK作为主要的血液NK细胞
- PBMC:
-
外周血单个核细胞
参考文献
米勒JS,拉尼尔LL。癌症免疫治疗中的自然杀伤细胞。中国癌症杂志,2019;3(1):77-103。
Hodgins JJ, Khan ST, Park MM, Auer RC, Ardolino M.杀手2.0:NK细胞疗法在癌症控制的前沿。中华临床医学杂志,2019;29(9):3499-510。
hepertz EL, Zynda ER, Stav-Noraas TE, Hungler AD, Boucher SE, Kaur N,等。“现成的”异基因NK和CAR-NK细胞治疗的现状。Front Immunol. 2021;1:12。
Isaaz S, Baetz K, Olsen K, Podack E, Griffiths GM.细胞毒性T淋巴细胞的连环杀伤:T细胞受体通过非颗粒途径触发脱颗粒、溶解颗粒的重新填充和溶解蛋白的分泌。中华免疫杂志,1995;25(4):1071-9。
王志强,王志强。人类自然杀伤细胞对肿瘤细胞的连续杀伤作用。PLoS ONE。2007; 2 (3): e326。
Vanherberghen B, Olofsson PE, Forslund E, Sternberg-Simon M, Khorshidi MA, Pacouret S,等。基于迁移行为和细胞毒性反应的人类自然杀伤细胞分类。血。2013;121(8):1326 - 34。
与靶细胞相互作用后自然杀伤细胞毒性活性的失活。中华免疫杂志,2001;26(2):344 - 344。
Romain G, Senyukov V, Rey-Villamizar N, Merouane A, Kelton W, Liadi I,等。抗体Fc工程提高了NK细胞介导的系列杀伤频率,促进了其动力学增强。血。2014;124(22):3241 - 9。
王志强,王志强,王志强,等。CD16的脱落可分解NK细胞免疫突触,并促进目标细胞的连续接合。中国生物医学工程杂志,2018;29(9):366 - 366。
Klingemann H, Boissel L, Toneguzzo F.免疫治疗的自然杀伤细胞- NK-92细胞系相对于血液NK细胞的优势。前沿免疫杂志,2016;14(7):91。
维维耶E, Raulet DH, Moretta A, Caligiuri MA, Zitvogel L, Lanier LL,等。先天免疫还是适应性免疫?自然杀伤细胞的例子。科学。2011;331(6013):44-9。
Gunesch JT, Angelo LS, Mahapatra S, Deering RP, Kowalko JE, Sleiman P,等。人类NK细胞系的全基因组分析和功能分析。中华免疫杂志2019;1(115):64-75。
杨鸿辉,姜春春,金泰,黄毅,金海涛,成玉春,等。发现一种具有独特免疫刺激和增殖潜力的新型自然杀伤细胞系,作为癌症免疫治疗的替代平台。中华免疫杂志,2019;7(1):138。
杨晓东,张晓东,张晓东,等。克服缺氧诱导的NK细胞功能抑制。中华免疫杂志,2020;8(1):e000246。
吸力G, Odendahl M, Nowakowska P, Seidl C, Wels WS, Klingemann HG,等。NK-92:一种“现成的疗法”,用于过继的基于自然杀伤细胞的癌症免疫治疗。中华癌症杂志,2016;65(4):485-92。
Jochems C, Hodge JW, Fantini M, Tsang KY, Vandeveer AJ, Gulley JL,等。ADCC采用NK细胞系(haNK)表达高亲和力CD16等位基因与avelumab,抗pd - l1抗体。中华肿瘤学杂志,2017;29(3):344 - 344。
Fabian KP, Padget MR, Donahue RN, Solocinski K, Robbins Y, Allen CT,等。PD-L1靶向高亲和力NK (t-haNK)细胞诱导直接抗肿瘤作用和靶向抑制MDSC群体。中华免疫杂志,2020;8(1):e000450。
李志强,李志强,李志强,等。晚期肾细胞癌或黑素瘤患者输注异基因细胞系NK-92: I期试验Cytotherapy。2008;10(6):625 - 32。
唐恩,邓文杰,李志强,李志强,等。自然杀伤细胞系NK-92治疗晚期癌症患者。Cytotherapy。2013;15(12):1563 - 70。
颅内注射NK-92/5.28。复发性her2阳性胶质母细胞瘤(CAR2BRAIN)患者的z细胞。标识符NCT03383978。美国国家医学图书馆;2017.
Williams BA, Law AD, Routy B, denHollander N, Gupta V,王晓华,等。NK-92细胞治疗自体造血细胞移植后复发的难治性恶性血液病的I期试验显示了安全性和有效性的证据。Oncotarget。2017;8(51):89256 - 68。
王志强,王志强,王志强。细胞毒性nk细胞系(NK-92)体外清除白血病的研究进展。中华医学杂志1996;2(2):68-75。
细胞毒性,免疫学百科全书的机制。1998; 732 - 4。
McNerney ME, Lee KM, Kumar V. 2B4 (CD244)是一种非mhc结合受体,在自然杀伤细胞和CD8+ T细胞上具有多种功能。中华免疫杂志2005;42:489-94。
progress HF, Maroun JA。用于生物反应调节剂研究的NK细胞测定的标准化。中华免疫杂志,1984;29(1):1 - 5。
科比J,戴R,怀特塞德TL,赫伯曼RB。计算细胞介导的细胞毒性表达的裂解单位。中华免疫杂志,1992;26(1):1 - 3。
Overton弯角。改进的直方图减影技术用于流式细胞术数据分析。血细胞计数。1988;9(6):619 - 26所示。
闫燕,Steinherz P, Klingemann HG, Dennig D, Childs BH, McGuirk J,等。一种自然杀伤细胞系对抗人类白血病的抗白血病活性。临床癌症杂志,1998;4(11):2859-68。
alterg, Malenfant JM, Altfeld M. CD107a作为自然杀伤细胞活性鉴定的功能标记物。中华免疫杂志,2004;29(1):15-22。
蔡普杰,Mitchison TJ。单个自然杀伤细胞连环杀伤的成像爆发动力学和空间协调。美国国家科学研究院。2013; 110(16): 6488 - 93。
徐勇,周松,林耀文,庞文雄。具有连接通道的微孔阵列中自然杀伤细胞的细胞毒性动态。前沿免疫。2017;8:998。
杨晓明,陈晓明,陈晓明。Fas受体介导的细胞凋亡的临床应用?中华病毒学杂志,2002;36(2):344 - 344。
Matsui H, Tsuji S, Nishimura H, Nagasawa S.凋亡Jurkat细胞补体替代通路的激活。中国科学(d辑:自然科学)1994;
Bergman H, Sissala N, Hägerstrand H, Lindqvist C.人NK-92细胞作为人NK细胞的靶细胞- CAR NK-92治疗的意义。抗癌决议2020;40(10):5355-9。
Bergman H, Lindqvist C.人IL-15抑制NK细胞特异性的NK细胞。抗癌决议2021;41(7):3285 - 5。
Ames E, Canter RJ, Grossenbacher SK, Mac S, Smith RC, Monjazeb AM,等。利用辐射和自然杀伤细胞增强干细胞样实体肿瘤细胞的靶向性。OncoImmunology。2015; 4 (9): e1036212。
安娜娜,普拉兹曼,斯巴兹JP。基于液滴的细胞毒性试验:实现自然杀伤细胞抗肿瘤活性的高效筛选。ACS Omega. 2020;5(38): 24674-83。
王志强,王志强,王志强,等。KHYG-1,研究增强自然杀伤细胞细胞毒性的模型。中华血液学杂志,2005;33(10):1160-71。
CF, Ushmorov A, Bird P, Debatin KM。颗粒酶B抑制剂PI-9在儿童急性淋巴细胞白血病的所有主要亚型中均有差异表达。Haematologica。2004;89(11):1314 - 21所示。
Zingoni A, Vulpis E, Loconte L, Santoni A. NKG2D配体脱落对应激的响应:ADAM10的作用。前沿免疫,2020;25:11。
莫菲塔,李志刚,李志刚,李志刚。nkg2d依赖性NK细胞功能的调控:受体内吞作用的阴阳调节。中华分子化学杂志,2017;18(8):1677。
Walcher L, Kistenmacher AK, Sommer C, Böhlen S, Ziemann C, Dehmel S,等。低能电子辐照是一种有效的替代γ辐照灭活(CAR-)NK-92细胞在ATMP制造。Front Immunol. 2021;4:12。
Jochems C, Hodge JW, Fantini M, Fujii R, Maurice Morillon YI, Greiner JW,等。一株NK细胞系(haNK)表达高水平颗粒酶,并被工程用于表达高亲和力CD16等位基因。Oncotarget。2016;7(52):86359 - 73。
高德沃,布兰特,弗斯隆德,欧洛夫森,弗里斯克,欧洛夫森,等。用于NK细胞细胞毒性单细胞评估的芯片筛选平台。Front Immunol. 2016; 7:19 19。
金旭,金洪杰,Doh J.血液肿瘤细胞的单细胞阵列用于淋巴细胞毒性动态、连环杀伤和细胞外分子的评估。实验室芯片。2019;19(11):2009-18。
克里斯科A,拉德曼M.辐射引起的蛋白质损伤和死亡大肠杆菌而且耐辐射球菌.美国国家科学研究院。2010; 107(32): 14373 - 7。
蛋白质损伤,辐射敏感性和衰老。DNA修复,2016;1(44):186-92。
Robertson MJ, Manley TJ, Pichert G, Cameron C, Cochran KJ, Levine H,等。正常和肿瘤造血细胞表达APO-1/fas (CD95)抗原的功能后果。Leuk淋巴瘤,1995;17(1-2):51-61。
Medvedev AE, Johnsen AC, Haux J, Steinkjer B, Egeberg K, Lynch DH,等。细胞因子对NK细胞中Fas和Fas配体表达的调控以及Fas配体参与NK/LAK细胞介导的细胞毒性细胞因子。1997;9(6):394 - 404。
韩瑞,吴文琴,吴小平,刘春春。黄芪种子总黄酮对自然杀伤细胞功能的影响。中华民族药典杂志,2015;173:157-65。
巴恩哈特BC,阿拉帕特EC,彼得ME。CD95 I型/ II型型号。中华免疫杂志2003;15(3):185-93。
坎宁安TD,蒋X,夏皮罗DJ。人蛋白酶抑制剂9的高水平表达阻断穿孔素/颗粒酶和Fas/Fas配体介导的细胞毒性。细胞免疫杂志,2007;45(1):32-41。
王志刚,王志刚,王志刚,等。细胞凋亡检测技术研究进展。历史视角和新进展。科学通报。2012;34(3):255-62。
黄瑞生,史海霞,赖春江,常玉杰,林生。Cas9核糖核蛋白基因工程增强NK-92细胞毒性的研究。前沿免疫。2020;11:1008。
确认
作者感谢William J. Murphy博士的建设性建议,Carl Ware博士关于抗fas效应测量的有益建议,Myung Chul Jo在UNR对细胞进行辐照,Dana E. Reed对细胞系进行支原体检测,David M. White在流式细胞仪方面提供帮助,Matthew Isom提供技术支持。
资金
这项工作得到了内华达州IDeA生物医学研究卓越网络(NIH GM103440)、内华达州本科生研究奖、UNR基金会奖和NIH细胞检测中心P30 (NIH GM110767)的部分资助。
作者信息
作者及隶属关系
贡献
LNG、DH和MG根据VL和RM的有益建议设计了这项研究。LNG、DH、MG和JCA进行了实验并获得了数据。LNG、DH、MG和JSG对数据进行了分析。LNG和DH共同撰写了手稿。所有作者都参与了对手稿的批判性审查和编辑。所有作者都阅读并批准了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
血液淋巴细胞由STEMCELL Technologies (Vancouver, Canada)授权收集,用于从健康献血者身上获取血液。
发表同意书
不适用。
相互竞争的利益
不适用。
额外的信息
出版商的注意
伟德体育在线施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1:表S1。
NK细胞系来源于恶性肿瘤或健康供者的血液NK细胞。NK来源细胞系列表,包括来源、发表年份、中介期和CD16表达。
附加文件2
:图S1。流式细胞术测定外周血单个核细胞内原发性NK细胞的数量。A.门控序列。1.首先,珍珠是由高太平洋橙色信号控制的。2.无碎片的细胞采用正向散射(FSC-A)和侧面散射(SSC-A)进行门控。3.单细胞(不含双染色体)由SSC高度与SSC宽度进行门控。4.太平洋蓝抗cd45对所有细胞进行门控。 5. Live cells were gated by Boolean not gate, taking 7-AAD positive cells as dead cells. 6. T-cells were gated out by Boolean not gate of FITC anti-CD3 positive T-cells. 7. NK cells were gated on as AF647 anti-CD244 positive cells. CD244 is expressed by CD8+ T-cells (gated out with CD3) and all NK cells [24].8.NK细胞BV711抗cd16 /CD56染色。B.静息和IL-2激活(LAK) bNK细胞对CD16A和CD56的表达。浅蓝色为各组未染色的对照细胞。红色样品染色CD16A和/或CD56。1.未受刺激的bNK细胞。2.白细胞介素2激活LAK bNK细胞。
附加文件3:表S2。
NK-92 KFs在E:T 1:16后8小时。NK-92系列杀伤对Raji, Daudi和K562“目标”细胞的实验可变性的记录。
附加文件4
:图S2.通过静息或激活的原发性NK细胞杀死NK-92细胞。研究了NK-92细胞对健康献血者的原代外周血NK细胞攻击的敏感性,使用NK-92细胞进行了未辐照或10 Gy辐照,然后培养1天。原代NK细胞经1000u /ml IL-2培养后静息或活化3 d。用4-h测定细胞毒性51Cr-release化验;水平的灰色虚线反映了正面杀伤的10%阈值。所示的结果代表了多个实验中多个捐赠者的分析。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
Navarrete-Galvan, L., Guglielmo, M., Cruz Amaya, J.。et al。优化NK-92系列杀手:γ照射、CD95/ fas -结扎、NK或LAK攻击限制细胞毒功效。翻译医学杂志20., 151(2022)。https://doi.org/10.1186/s12967-022-03350-6
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12967-022-03350-6
关键字
- nk - 92
- NK
- 辐射
- Fas / CD95
- 连环杀人
- 淋巴因子激活杀手
- 限制
- 过继细胞转移
- 治疗效果